국내산 오갈피꿀과 아카시아꿀의 유기화합물 및 무기질 성분에 관한 연구
초록
국내산 벌꿀 기반의 기능성 식품을 개발하기 위하여 오갈피꿀과 아카시아꿀의 유기화합물 및 무기질성분을 분석하였다. 알콜추출물의 농축 수유율은 오갈피 85.50%, 아카시아꿀 93.06%였으며, GC-MS분석으로 유기용매별 추출한 주요 유기화합물은 오갈피꿀에서 Trichloromethane, Phosphine, Superpalite, Carbon Tetrachloride, Methyclolpropane, Cyclopentane 및 아카시아꿀에서는 Trichloromethan, Hexyl hydride, Propyl carbinol, Acetoxyethane, Acetidin, Hexanaphthene, Methane trichloride 등이 검출되었다. 또한 SPME분석에 의한 주요 향기성분 물질은 오갈피꿀에서 Dibutyl phthalate, Pelargonaldehyde, Cyclopentasiloxane, Hexasiloxane, Pyrrolidine, Dodecanoic acid, Lauros tearic acid, Vulvic acid 및 아카시아꿀에서 Hexyl hydride, Hydrazomethan, Azulene, Cyclotrisiloxane, Hydrazine 등이 검출되었다. 일반성분은 오갈피꿀에서 수분함량 21.22%, 조단백질 0.43%, 조지방 0.36%, 조회분 0.04%, 탄수화물 77.95% 및 아카시아꿀에서 수분함량 18.75%, 조단백질 0.10%, 조지방 0.44%, 조회분 0.06%, 탄수화물 80.65%로 측정되어, 오갈피꿀은 대조군으로 실험한 마누카꿀의 조단백질(0.23%)과 조지방(0.34%) 함량보다 더 높았다. HPLC로 분석한 유리당은 오갈피꿀에서 총당류 57.63%, fructose 32.38%, glucose 25.25% 및 아카시아꿀에서 총당류 72.81%, fructose 48.52%, glucose 24.29%였고, 이는 마누카꿀의 총당류 70.23%, fructose 39.07%, glucose 31.16%값과 비교되며 비타민C는 3종류 벌꿀 모두에서 검출되지 않았다. ICP분석에 의한 무기질 성분은 오갈피꿀에서 총 23종류로 K 14.230ppm > Na 6.234ppm > Si 4.206ppm > B 3.461ppm > Ca 2.235ppm > Mg 0.742ppm 순으로 높게 검출되었고, 아카시아꿀에서는 총 22종류로 Na 4.527ppm > Si 3.420ppm > K 3.091ppm > Zn 1.482ppm순으로 높게 검출되었다. 이는 마누카꿀에서 검출된 K 11.865ppm > Na 5.573ppm > Si 4.487ppm > Ca 2.223ppm 등과 비교되었는데, 특히 K성분의 경우 아카시아꿀보다 오갈피꿀에서 4.6배, 마누카꿀에서 3.84배 높게 나타남으로써 체내에서는 K에 의한 Na배출 작용에 더 효율적으로 고혈압 예방에 유리할 것으로 예측된다.
Abstract
In order to use as a new functional food material, we analyzed the chemical components including the organic compounds, minerals and Vitamin C of acanthopanax and acacia honey which were produced in South Korea. The condensed rate of methanol extraction in honey was 85.5% of acanthopanax honey and it was 93.06% of acacia honey. In the case of acanthopanax honey, main organic compounds that extract by organic solvents in GC-MS analysis were trichloromethane, phosphine, superpalite, carbon tetrachloride, methyclolpropane, cyclopentane etc. and main aromatic compounds that extract by organic solvents in SPME analysis were dibutyl phthalate, pelargonaldehyde, cyclopentasiloxane, hexasiloxane, pyrrolidine, lauros tearic acid, vulvic acid etc. Also, in case of acacia honey, main organic compounds were trichloromethan, acetoxyethane, hexanaphthene, acetidin etc. and main aromatic compounds were hydrazomethan, azulene, cyclotrisiloxane, hydrazine etc. Proximate composition was crude protein 0.43%, crude fat 0.36%, crude ash 0.04% in acanthopanax honey and crude protein 0.10%, crude fat 0.29%, crude ash 0.06% in acacia honey. Free sugar that analyze by HPLC was fructose 32.38%, glucose 25.25%, total sugars 57.63% in acanthopanax honey and fructose 48.52%, glucose 24.29%, total sugars 72.81% in acacia honey. Vitamin C was not detected in two sample honeys. Minerals by ICP analysis were detected total 23 kinds in acanthopanax honey, K 14.230ppm > Na 6.234ppm > Si 4.206ppm > B 3.461ppm > Ca 2.235ppm > Mg 0.742ppm etc. and total 22 kinds in acacia honey, Na 4.527ppm > Si 3.420ppm > K 3.091ppm > Zn 1.482ppm etc.
Keywords:
Acanthopanax honey, Acacia honey, Organic compounds, Minerals, GC-MS, SPME, ICP서 론
소비자의 안전한 농산물 수요에 대한 관심으로 천연 생물 종자원 활용의 필요성이 부각되고 있는 가운데, 양봉사업을 통한 각종 기능성 식품으로써의 가치개발에 대한 중요성도 날로 커져가고 있다. 화밀(花蜜)을 분비하고 화분(花粉)을 공급하여 꿀벌의 생활을 돕는 밀원식물들(Honey Plants)이 다양하게 분포하고 있는 우리나라에서는 삼국시대부터 목밀, 석밀 등을 채취한 기록이 있으며, 예로부터 꿀을 식용 및 약용으로 이용하여 왔고(안 등, 2003; 이 등, 2007; 정 등, 2011), 최근 농가에서는 이들 식물의 벌꿀 수확으로 소득 증대에 도움 될 자원식물에 대한 기대가 높아지고 있는 현실이다.
꿀벌이 만들어 내는 로열젤리, 프로폴리스, 꽃가루, 밀랍, 봉독 등의 다양한 양봉 생성물 가운데 벌꿀(Honey)은 꽃의 밀선에서 빨아내어 벌집에 저장한 후 전화, 숙성시킨 천연감미료이며, 원료가 되는 꽃의 종류 및 일벌에 의해 가공되는 과정을 통하여 일반적인 구조나 맛과 색 등의 성상은 차이가 있게 된다(이 등, 2007). 따라서 체내에서 높은 에너지원(330kcal/100g)으로 작용되는 꿀에는 과당과 포도당이 풍부하고 벌꿀에 함유된 각종 유기산, 항균물질, 페놀계 물질인 플라보노이드 등은 항산화(Ferreres et al., 1991; Sabatier et al., 1992; Chen et al., 2000) 및 항균효과(Blaser, 1990; Willix et al., 1992; Molan, 1992, 2001, 2002; Shin and Ustunol, 2005)와 같은 생리적 기능과 관련이 있고, 각종 비타민과 무기질 외 여러 가지 미확인된 물질들 및 기타 성분들에 의해 여러 가지 약리작용 등이 있는 것으로 알려지고 있는 기능성 식품이다(김 등, 1994). 외국산 벌꿀에 대한 연구는 아미노산, hydroxy methyl furfur(HMF), 무기질 등에 대한 보고가 있으며(Kushnir, 1979; White et al., 1962, 1963, 1967, 1979, 1980; Davies, 1975), 국내산 벌꿀에 관한 연구로는 이 등(1971)이 토종봉밀과 양봉밀 중의 유리아미노산과 유기산 및 당에 대한 보고, 백과 조(1972)가 royal jelly의 유리아미노산에 대한 보고, 정 등(1984)이 한국산 꿀의 HMF, diastatic activity, 유리당, 무기성분에 관한 연구, 한 등(1991)이 유리아미노산, 저장기간에 따른 diastase 활성도 및 HMF 함량 변화에 대한 보고 등이 있다. 또한 꿀벌이 만들어내는 여러 양봉생성물들에 대하여도 이 등(2001)의 국내산 프로폴리스의 화학적 특성에 관한 연구, 정(2005)의 프로폴리스에서 분리한 플라보노이드 화합물의 항산화 활성 및 방사선 방어효과 등이 있으며, 그 외 다양한 연구 및 보고들이 있다(박 등, 1995; 이 등, 2001, 2002; 임 등, 2002; 정 등, 2003; 손, 2003; 윤, 2003; 박 등, 2008; 한 등 2013). 일반적으로 시중에서 유통 판매되는 벌꿀은 수분함량을 줄인 농축꿀임에 반하여, 민간에서는 생꿀의 복용도 이루어지고 있는 현실에서 생꿀에 대한 영양적 성분특성에 대한 보고는 거의 이루어지고 있지 않다. 또한 농촌진흥청에서는 꿀벌을 농업의 블루오션을 창출할 성장동력의 소재로 판단하고, 우수한 품질의 국내산 벌꿀 개발생산과 국산 꿀의 고부가가치 신소재로서의 개발을 추진하며 양봉산업을 고부가가치의 바이오신소재산업으로 확대해 나가고 있다(Rural Development Administrate RDA, 2015).
본 연구는 국내산 벌꿀의 기능성 식품개발을 위한 기초자료를 제공하고자 오갈피(Acanthopanax senticosus)꿀 및 아카시아(Robinia pseudo-acacia)꿀의 유기화합물 및 향기성분 물질을 규명하였고, 수분함량, 조회분, 조지방, 조단백, 탄수화물, 유리당 함량 등의 일반성분과 무기질 및 비타민 분석을 통한 화학적 특성을 알아보고 현재 국제적으로 널리 상품화되어 판매되고 있는 뉴질랜드산 마누카(Leptospermum scoparium)꿀과 비교 분석하였다.
재료 및 방법
실험꿀 재료
본 연구에 사용된 국내산 오갈피 생꿀은 2012년 8월 강원도 동해시에서 채밀 수집 되었고 아카시아 생꿀은 2012년 5월 전라남도 곡성군에서 채밀 수집된 것을 구매하여 실험하였다. 마누카꿀은 뉴질랜드에서 널리 자생하는 관목성 식물인 마누카에서 채취되는 꿀로, 본 실험의 대조군으로는 honeynz회사(www.honeynz.co.nz)의 2013년 시판제품 UMF(Unique Manuka Factor) 15+ 상품을 구매하여 실시하였다.
유기화합물 및 향기 성분 물질분석
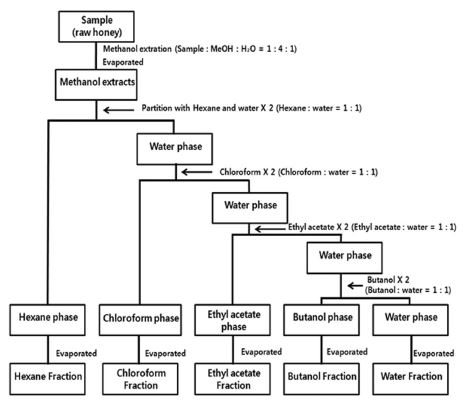
유기화합물 분석을 위한 시료의 물질추출 과정은 각 시료 꿀 100g을 용매500ml(MeOH 4 : H2O 1)에 혼합하여 24시간 이상 방치한 후 회전감압농축기와 중탕기를 이용하여 농축하고 Fig. 1과 같이 각 단계별 Haxane, Chloroform, Ethyl acetate, Butanol 등의 용매를 이용하여 물질을 분리하였다. 추출 용매층별 각 구성 유기화합물과 향기성분(SPME) 유기화합물은 Gas Chromatography SCAN 분석법을 이용하였다(분석기기 모델명: Agilent 6890GC/5973iMSD).
일반성분 분석
식품공전상의 기준 및 규격(식품의약품 안전처 고시 제2013-203호)에 따라 분석하였다. 수분은 105°C 건조 후 항량을 측정하여 산출하였고, 조단백질은 시료의 전처리 및 추출과정을 거쳐서 Kjeltec 8400 Analyzer unit Foss(Denmark) 자동장치를 이용하여 분석하였고, 조지방은 속슬렛추출장치로 FOSS Drive unit 2050(Sweden) 에테르를 순환시켜 검체 중의 지방을 추출하여 측정하였으며, 조회분은 500°C 직접회화법으로 측정하여 산출하였다. 그리고 탄수화물은 검체 100g 중 수분, 조단백질, 조지방, 조회분 함량을 감하여 얻은 양으로 환산하였다.
유리당 및 비타민 C 함량 분석
유리당과 비타민C의 분석조건은 Table 1과 같다. 유리당 5종(fructose, glucose, sucrose, lactose, maltose)에 대한 분석은 표준품으로 시그마(St.Lois, MO, USA) 제품을 사용하여 제조하고 각 생꿀 실험시료를 칭량하여 50% 에탄올로 30분간 초음파 추출 후 3,590×g로 20분간 원심분리(CR-22N, Hitachi, Tokyo, Japan) 후 상층액을 0.2μm membrane filter(Minisart RC, Sartorious)로 여과하였다. 분석기기는 HPLC(Nanospace SI-2, Shiseido, Tokyo, Japan)와 굴절률측정기(RI-201H, Shodex, Tokyo, Japan)를 사용하였다. 분석컬럼은 Imtakt Unison UK-Amino(250×3.0mm, 3μm)로 분석하였고, 컬럼온도는 60°C, 주입량은 10μl, 이동상 용매는 90% 아세토니트릴을 분당 0.4ml를 흘려 40분간 측정하였다. 비타민 C는 시료 1g에 5% 메타인산(Metaphosphoric acid, Wako) 20mL로 시료를 균질화(Ultra-Turrax T25, IKA Labo, Germany)하여 총량 50mL까지 정용 후, refrigerated centrifuge(5804R, Eppendorf, Germany) 12,500×g로 10분간 원심분리한 뒤 상등액을 취하여 여과 후 HPLC(Nanospace SI-2, Shiseido, Tokyo, Japan)로 분석하였다. 분석컬럼은 Shiseido Capcellpak MG 120(250×4.6mm, 5um)를 사용하였고, 이동상은 0.05 M KH2PO4와 acetonitrile을 98:2의 비율로, 측정파장은 254nm에서, 시료주입량은 5μl, 컬럼온도는 40°C, 유속은 0.5ml/min로 분석하였다.
무기질 성분 분석
무기질은 습식분해법(정 등, 2003)에 따라 분해하여 100mL로 정용한 다음 ICP(Inductively coupled plasma) Optical Emission Spectrometer(Model Name: Optima 2000DV, PerkinElmer, USA)로 분석하였으며, 기기분석 조건은 forward RF power; 1,300W, pump flow rate; 1.5ml/min, plasma flow; 15L/min, auxiliary flow; 0.2L/min, nebulizer flow; 0.65L/min였다.
결과 및 고찰
성분물질의 추출과 분리 및 분획량
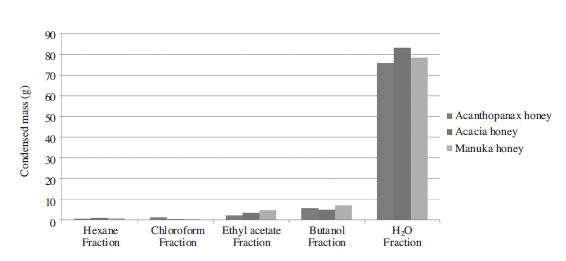
각 시료 꿀 100g을 메탄올(MeOH)로 추출 및 농축하여 얻은 수유율은 오갈피꿀 85.50%, 아카시아꿀 93.06%였으며, 이를 각 용매로 추출 분획하여 얻은 분획량은 H2O층에서 오갈피꿀 75.84g, 아카시아꿀 83.26g으로 가장 많았고, Butanol 용매층의 분획량은 오갈피꿀 5.74g, 아카시아꿀 5.01g이었다. 또한 Hexane 및 Ethyl acetate와 Chloroform 용매층에서 얻은 분획량은 오갈피꿀에서 각각 0.64g, 2.07g, 1.21g이었으며, 아카시아꿀에서는 각각 1.04g, 3.6g. 0.35g이었다. 따라서 꿀을 이루고 있는 성분물질들은 Haxane, Chloroform, Ethyl acetate, Butanol 등의 휘발성 유기물질 용매층 보다는 수용성 H2O용매층에 대량 함유되어 있음을 알 수 있었다. 이는 수유율이 87.02%였던 국내산 대추꿀의 실험결과에서도 H2O용매층에서 77.63g으로 다른 유기용매층 추출의 분획량들 보다 그 값이 가장 높았던 결과와도 일치하였는데(백 등, 2014), 주로 수용성인 과당, 포도당 등의 당류로 이루어진 벌꿀 특유의 감미료 성분들이(Kim and Rhee, 1996) H2O용매층에 대량 함유된 것에서 기인하는 것으로 보인다. 한편 대조군인 외국산 마누카꿀의 경우에는 메탄올(MeOH) 추출물질의 농축 수유율이 91.00%였고, 가장 분획량이 많은 H2O층에서 78.32g이었으며 추출 유기용매인 Butanol, Hexane, Ethyl acetate 및 Chloroform층에서 얻은 분획량은 각각 7.06g, 0.67g, 4.60g 및 0.35g으로 측정되었다(Fig. 2).
유기화합물 및 향기성분 물질분석
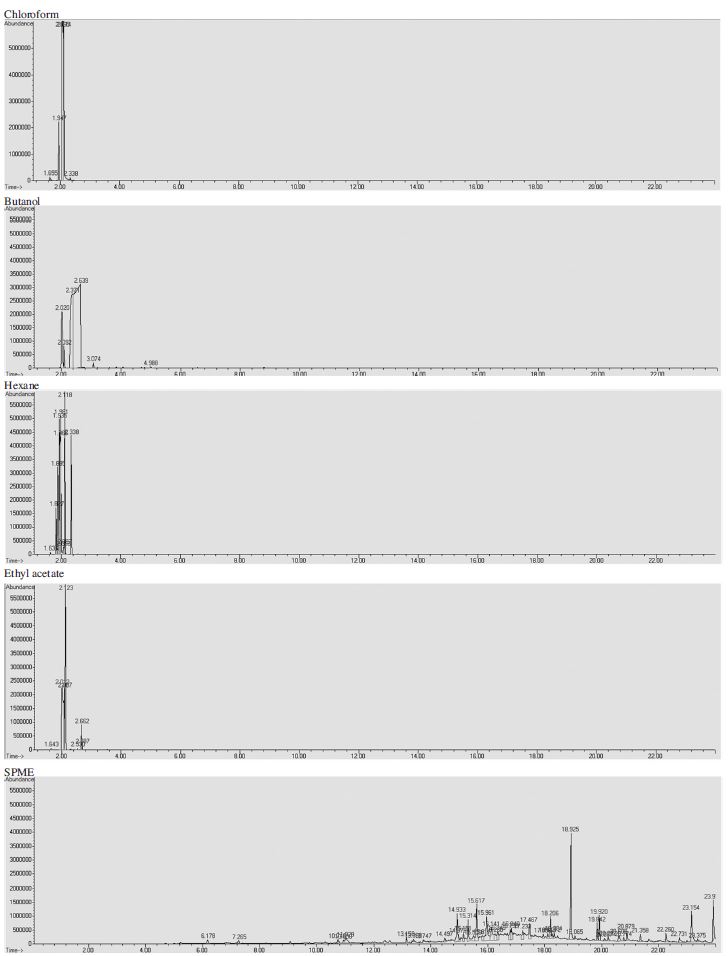
Fig. 3은 오갈피꿀의 추출용매별 주요 성분 및 향기성분을 이루고 있는 유기화합물들이다. GC-MS 분석에 의하여 검출된 주요 유기화합물은 Chloroform 용매층에서 Trichloromethane(peak값 abundance: 5,800,000), Formyl trichloride, Methenyl trichloride, Superpalite, Carbon Tetrachloride 등이, Butanol 용매층에서 Methyclolpropane(peak값: 3,200,000), Acetidin, Acetoxyethane, 2-Propenoic acid, Propylcarbinol, Phosphine 등이, Haxane 용매층에서는 Cyclopentane(peak값: 5,800,000), Trimethylene oxide, 3-Methylpentane, Triptane, Hexyl hydride 등이 그리고 Ethyl acetate 용매층에서는 Trichloromethane(peak값: 5,800,000), Trimethylene oxide, Propanoic acid, 1-Acetoxypropane, 1-Propyl acetate 등이 확인되었다. 또한 SPME분석으로 검출된 오갈피꿀의 주요 향기성분 물질은 Dibutyl phthalate(peak값: 4,000,000) Pelargonaldehyde, Cyclopentasiloxane, Hexasiloxane, Cycloheptasiloxane, Pyrrolidine, Dodecanoic acid, Lauros tearic acid, Vulvic acid, Dodecylic acid 등 다수의 물질이 검출되었다.
Organic compound composition spectra of acanthopanax honey by each solvent (Analyzed by Agilent 6890GC/5973iMSD model).
Fig. 4는 아카시아꿀의 추출용매별 검출된 주요 성분 및 향기성분을 이루는 유기화합물들이다. GC-MS 분석에 의하여 검출된 주요 유기화합물은 Chloroform 용매층에서 Trichloromethane(peak값 abundance: 11,000,000), Hexyl hydride, Gettysolve-B 등이, Butanol 용매층에서 Propyl carbinol(peak값 :5,200,000), Acetoxyethane, Acetidin 등이, Haxane 용매층에서는 Hexanaphthene(peak값: 11,600,000), Cyclohexane 등이 그리고 Ethyl acetate 용매층에서는 Methane trichloride(peak값: 6,000,000), Propanoic acid 등이 확인되었다. 또한 SPME분석으로 검출된 아카시아꿀의 주요 향기성분 물질은 Hexyl hydride(peak값:31,0000), Hydrazomethan, Cyclotrisiloxane, Cyclopentasiloxane, Hydrazine, Cyclotrisiloxane, Azulene, Dioctyl adipate 등 다수의 물질이 검출되었다.

Organic compound composition spectra of acacia honey by each solvent (Analyzed by Agilent 6890GC/5973iMSD model).
백 등(2014)은 국내산 대추꿀에서 GC-MS 분석으로 Formyl trichloride, Methenyl trichloride, Cyclopentane, Ethyl ethanoate, Trichloromethan, Butyl hydroxide, Butyraldehyde, Methylolpropan, Propyl carbinol, Propanoic acid, Acetoxyethane, Triptane 등의 물질들을 확인하였고, SPME분석으로 1,2-Benzenedicarboxylic acid, Benzaldehyde, Octacosane, Hexatriacontane, Cyclopentasiloxane, Pentanoic acid, Naphthalene, Nonanaldehyde, Cyclopentasiloxane, Pelargonaldehyde, Aldehyde, 3-Pyridinecarbonitrile, Nicotinonitrile, Pyrobenzol, Cyclotrisiloxane, Cyclohexatriene 향기성분 물질들이 검출되었음을 보고한 바 있다.
일반성분 분석
시료 꿀들의 일반성분 분석결과는 검체 100g당 오갈피꿀에서 수분함량 21.22%, 조단백질 0.43%, 조지방 0.36%, 조회분 0.04%, 탄수화물 77.95%로 측정되었고, 아카시아꿀에서 수분함량 18.75%, 조단백질 0.10%, 조지방 0.44%, 조회분 0.06%, 탄수화물 80.65%로 측정되었다(Table 2). 오갈피꿀의 조단백질은 백 등(2013)이 측정한 국내산 헤어리베치꿀의 측정값(0.28%)보다 높은 함량이었으나, 조지방은 헤어리베치꿀의 측정값(0.57%)보다 낮은 함량이었다. 한편 아카시아꿀의 조단백질과 조지방함량은 백 등(2013)이 측정한 국내산 헤어리베치꿀의 측정값보다 모두 낮은 값으로 나타났다. 조회분의 경우, 오갈피꿀과 아카시아꿀은 김 등(1994)이 강원도 정선에서 채밀된 잡화꿀의 측정값 0.26%보다 낮게 나타난 결과를 보였다. 또한 양봉생산물 중 국내산 프로폴리스의 일반성분과 비교하면 정 등(2003)이 측정한 값(조단백질 2.71%, 조회분 1.06%, 조지방 86.41%)보다 오갈피꿀과 아카시아꿀의 성분들이 현저히 낮은 함량이었다. 본 실험을 통하여 대조군으로 실험한 마누카꿀은 수분함량 19.79%, 조단백질 0.23%, 조지방 0.34%, 조회분 0.24%, 탄수화물 79.30%로 측정되었다. 따라서 오갈피꿀의 조단백질 함량은 아카시아꿀과 마누카꿀보다 높았으나, 조지방 함량은 아카시아꿀보다 더 낮게 함유되어 있음을 알 수 있었다. 정 등(1984)은 국내산 꿀에 대한 연구에서 아카시아꿀의 조회분 함량이 0.02%로 낮은 반면, 밤꿀 0.57%, 유채꿀 0.10%, 메밀꿀 0.12%, 토끼풀 0.0%로 나타나 벌꿀 중의 회분함량은 종류에 따라 차이가 있었음을 보고한 바 있다. 본 실험의 결과에서도 오갈피꿀의 조회분 함량은 아카시아꿀과 마누카꿀 보다 낮은 값으로 측정되었다.
유리당 및 비타민 C 함량 분석
각 시료 꿀의 유리당 조성과 함량을 HPLC로 분석한 결과는 Table 3과 같다. 유리당은 fructose, glucose가 분리 및 동정되었으며 sucrose, lactose, maltose는 함유되지 않은 것으로 나타났는데, 그 함량은 각각 오갈피꿀에서 총당류 57.63%로 fructose 32.38%, glucose 25.25%였다. 이는 백 등(2013)이 보고한 국내산 헤어리베치꿀의 총당류값(62.27)보다 낮았으며, 과당(35.31%) 및 포도당(26.96%)의 함량보다도 낮게 나타났다. 또한 아카시아꿀에 함유된 유리당 함량의 값은 총당류 72.81%로 각각 fructose 48.52%, glucose 24.29%였으며, 마누카꿀에서는 총당류 70.23%로 fructose 39.07%, glucose 31.16%였다. 이로써 오갈피꿀은 아카시아꿀과 마누카꿀 보다 총당류 및 함유된 과당과 포도당의 값이 낮았음을 알 수 있었으며, 비타민 C는 3종류 벌꿀 모두에서 검출되지 않았다. 또한 정 등(2003)은 양봉생산물 중 국내산 프로폴리스의 유리당 성분이 sucrose 152mg%, glucose 114mg%, fructose 6mg%가 함유되어 있음을 보고한 바 있고, Kim과 Rhee(1996)는 벌꿀의 감미는 과당, 포도당 등의 당류에 기인한다고 하였다.
무기질 성분 분석
ICP분석에 의한 무기질 성분은 오갈피꿀에서 총 23종류로 K 14.230ppm > Na 6.234ppm > Si 4.206ppm > B 3.461ppm > Ca 2.235ppm > Mg 0.742ppm 순으로 높게 검출되었으며, 아카시아꿀에서는 총 22종류로 Na 4.527ppm > Si 3.420ppm > K 3.091ppm > Zn 1.482ppm 순으로 높게 검출되었다(Table 4). 분석결과에서 인체에 필요한 다량무기질(macrominerals) 가운데 Mg, Ca, Na, K이 함유되어 있고, 미량무기질(microminerals) 중 Mo, Zn, Cu 등이 구성성분을 이루고 있음을 볼 때 실험 꿀들은 영양학적으로 가치가 있음을 볼 수 있다. 뉴질랜드산 마누카꿀에서는 K 11.865ppm > Na 5.573ppm > Si 4.487ppm > Ca 2.223ppm 등이 검출되어 비교되었다. 특히 K성분은 아카시아꿀 보다 오갈피꿀이 4.60배, 마누카꿀이 3.84배 높아서 체내에서는 더 효율적인 Na 배출작용으로 고혈압 예방에 도움이 될 것으로 보인다. 정 등(2011)의 연구결과에서도 아카시아꿀은 밤꿀과 잡화꿀 보다 K함량이 낮게 함유된 것으로 보고된 바 있다. 그 외에도 아카시아꿀 보다 Ca은 오갈피꿀에서 7.60배, 마누카꿀에서 7.56배 및 Mg은 오갈피꿀에서 1.50배, 마누카꿀에서 1.23배 높게 측정되어 뼈건강에 유리할 것으로 예측된다. 따라서 오갈피꿀과 마누카꿀은 상대적으로 아카시아꿀 보다 영양 및 건강 기능적 측면에서 더 좋은 무기질 성분을 많이 함유하고 있음을 확인할 수 있었다. 또한 WHO기준 허용치이하로 극미량이지만, 인체에 유해한 중금속으로 분류되고 있는 Cd이 오갈피꿀(0.041ppm), 아카시아꿀(0.058ppm), 마누카꿀(0.040ppm)에서 각각 검출된 점은(WHO기준 허용치: 0.3ppm이하) 밀원식물 군락지의 생육환경 및 벌꿀 채밀과정의 유해 환경요인의 원인들을 분석하여 꿀의 중금속 함량 최소화를 위한 방안도 필요해 보인다. 벌꿀의 무기질 성분은 꿀을 생산하는 벌의 종류에 의한 것이 아닌 주된 밀원이 되는 꽃이 생장하는 토양의 성분에 의해 영향을 받는다는 연구보고가 있다(Rashed and Soltan, 2004).
Acknowledgments
본 연구는 농촌진흥원 국립농업과학원 공동연구 국책기술개발 핵심전략기술개발사업(과제번호: PJ009378)의 지원에 의해 이루어진 것입니다.
References
- 김복남, 김택제, 최홍식, (1994), 강원도산 벌꿀의 무기물, HMF 및 비타민에 관한 연구, 한국영양식량학회지, 23, p675-679.
- 박헌국, 김상범, 심창환, (2008), 수용성 프로폴리스의 항균성, 한국식품영양학회지, 21, p15-21.
- 박호용, 오현우, 박두상, 장영덕, (1995), 한국산 봉교추출물의 항생활성, 한국양봉학회지, 18, p53-56.
- 백광욱, 조부연, (1972), 로열젤리의 free amino acid에 관하여, 강원대학교 연구논문집, 6, p7.
- 백원기, 곽애경, 오영주, 이명렬, 심하식, (2013), 국내산 헤어리베치(털갈퀴덩굴)꿀의 화학적 특성에 관한 연구, 한국양봉학회지, 28, p345-354.
- 백원기, 곽애경, 이명렬, 심하식, (2014), 국내산 대추꿀과 때죽나무꿀의 화학적 특성에 관한 연구, 한국양봉학회지, 29, p125-135.
- 손영록, (2003), 프로폴리스 추출물의 항균 활성에 대한 연구, J. Fd Hyg. Safety, 18, p184-194.
- 안상득, 장병조, 이명선, 권병선, 김무남, 정봉택, (2003), 개정자원식물학개론, 선진문화사, p178-184.
- 윤광로, (2003), 꿀의 건강기능성과 페놀게 물질. 벌꿀, 프로폴리스의 약리 활성 효과, 2003 자연의학 심포지움, 건국대학교 식품개발연구소, p3.
- 이명렬, 김혜경, 이만영, 최용수, 김현복, 정헌관, 김세현, (2007), 우리나라 밤꿀의 항산화와 항균 활성, 한국양봉학회지, 22, p147-152.
- 이성우, 김광수, 김갑랑, 이강자, 김경희, (1971), 각종 식품의 정미 성분에 관한 연구, 한국식품과학회지, 3, p168.
- 이수원, 김희재, 황보 식, (2001), 국내산 프로폴리스의 화학적 특성에 관한 연구, 한국축산식품학회지, 21, p383-388.
- 이수원, 황보 식, 김희재, (2002), 국산 프로폴리스의 항균활성, 한국축산식품학회지, 22, p66-71.
- 임지영, 문유선, 정승희, 이규임, 유수연, 심창섭, 박원봉, (2002), 알로에 베라 및 프로폴리스 혼합 추출물의 구강내 병원균에 대한 항균활성, 한국식품영양과학회지, 31, p899-904.
-
정미애, 김천제, 백현동, 오재욱, 이시경, (2011), 다양한 꿀에 함유된 무기물 조성, Hydroxy Methyl Furfural 함량 및 꿀 단백질의 전기영동 패턴 비교, 한국축산식품학회지, 31, p241-249.
[https://doi.org/10.5851/kosfa.2011.31.2.241]

-
정일윤, (2005), 프로폴리스에서 분리한 플라보노이드 화합물의 항산화 활성 및 방사선 방어효과, 한국식품영양과학회지, 34, p162-166.
[https://doi.org/10.3746/jkfn.2005.34.2.162]

- 정원철, 김만욱, 송기준, 최언호, (1984), 한국산 꿀의 품질 특성, 한국식품과학회지, 16, p17.
-
정창호, 배영일, 이호재, 심기환, (2003), 프로폴리스 및 알콜추출물의 화학성분, 한국식품영양과학회지, 32, p501-504.
[https://doi.org/10.3746/jkfn.2003.32.4.501]

- 한상미, 이광길, 우순옥, 김정민, 조미란, 백하주, (2013), 정제봉독의 물리적 특성 및 중금속에 대한 안전성 분석, 한국양봉학회지, 28, p75-78.
- 한재경, 김관, 김동윤, 김상규, (1991), 벌꿀의 조성과 저장중의 diastase 및 hydroxymethylfurfural 함량 변화, 한국식품과학회지, 17, p155.
-
Blaser, M. J., (1990), Helicobacter pylori and the pathogenesis of gastroduodenal inflammation, J. Infect. Dis., 161, p626-633.
[https://doi.org/10.1093/infdis/161.4.626]

-
Chen, L, A. Mehta, M. Berenbaum, A. R. Zangerl, and N J. Engeseth, (2000), Honeys from different floral sources as inhibitors of enzymatic browning in fruit and vegetable homogenates, J. Agric. Food Chem., 48, p4997-5000.
[https://doi.org/10.1021/jf000373j]

- Davies, A. M. C., (1975), Amino acid analysis of from Eleun Countries, J. Apicultural Res., 4, p29.
-
Ferreres, F. A., Tomas-Barberan, B. I. Gil, and F. Tomas-Lorents, (1991), An HPLC technique for flavonoid analysis in honey, J. Sci. Food Afric., 56, p49-56.
[https://doi.org/10.1002/jsfa.2740560106]

- Kim, E. S., and Rhee, C. O., (1996), Comparison of quality attributes of Korean native bee honey and foreign bee by K/Na ratio, J. Kor. Sic. Food Nutr., 25, p672-679.
- Kushnir, I., (1979), Sugar and sugar products ; Sensitive thin layer chromatographic detection of high fructose corn syrup and other adulterants in honey, J. Assoc. Anal. Chem., 62, p917.
-
Molan, P. C., (1992), The antibacterial activity of honey, Bee world, 73, p5-28.
[https://doi.org/10.1080/0005772x.1992.11099118]

-
Molan, P., (2001), Why honey is effective as a medicine, Bee world, 82, p22-40.
[https://doi.org/10.1080/0005772x.2001.11099498]

- Molan, P., (2002), Not all honeys are the same for wound healing, Bull. Eur. Tissue Rep. Soc., 9, p5-6.
-
Rashed, M. N., and Soltan, M. E., (2004), Major and trace elements in different types of Egyptian mono-floral and non-floral bee honeys, J. Food. Comp. Anal., 17, p725-735.
[https://doi.org/10.1016/j.jfca.2003.10.004]

- Rural Development Administration, (2015), Agricultural Technology Report, http://www.rda.go.kr/board accessed on 30, 9. 2015.
-
Sabatier, S., M. J. Amiot, M. Tacchini, and S. Aubert, (1992), Identification of falvonoids in sunflower honey, J. Food Sci., 57, p773-777.
[https://doi.org/10.1111/j.1365-2621.1992.tb08094.x]

- Shin, H., and Z. Ustunol, (2005), Carbohydrate composition of honey from different floral sources and their influence on growth of selected intestina bacteria, Food Res. Int., 38, p721-728.
- White, J. W. Jr., Riethof, M. L., Subers, M. H., and Kushnir, I., (1962), Composition of American honey, 1261p. Technical Bull., U.S. Dept. Agr., Washington, D.C.
- White, J. W. Jr., (1963), Determination of acidity, nitrogen and ash in honey, J. Assoc. Anal. Chem., 45, p548.
- White, J. W. Jr., and Kushnir, I., (1967), Composition of American honey; Protein, J. Apicultural Res., 4, p29.
- White, J. W. Jr., (1979), Methods for determining carbohydrates, hydroxyfurfural and proline in honey; Collaborative study, J. Assoc. Ana. Chem., 62, p515.
- White, J. W. Jr., (1980), Detection of honey adultration by carbohydrate anylysis, J. Assoc. Anal. Chem., 63, p11.
- Wilix, D. J., P. C. Molan, and C. G. Harfoot, (1992), A comparison of the sensitivity of wound-infecting species of bacteria to the antibacterial activity of manuka honey and other honeys, J. Appl. Bacteriol., 73, p338-394.