왕벚나무와 산벚나무의 화밀분비량, 당 함량 및 아미노산 분석
Abstract
The purpose of this study is to objectively evaluate the value of honey source by analyzing nectar characteristics of Prunus yedoensis Matsum. (Korean flowering cherry, KFC) and P. sargentii Rehder (Sargent’s cherry, SC) such as the volume of secreted nectar, free sugar composition and amino acid content in floral nectar. Both species bloomed for about 10 days, but KFC bloomed about four days earlier than SC. As a result of analyzing the nectar secretion pattern by using 3μL micro-capillary tube, it was the highest on the second day since the flower bloom. In the volume of total secreted nectar and dried nectar per flower during two days, KFC was 7.6±2.8 μL and 0.89±0.40 μL, and SC was 8.5±3.3 μL and 0.95±0.37 μL, respectively. The free sugar content of nectar in KFC and SC show 47.9±13.0μg/μL and 25.5±10.7μg/μL, respectively. The amount of sugar per flower of KFC and SC was 73.7±39.7 μg and 71.4±40.4 μg, and there is no significant difference between two species. But, sucrose/hexose ratio of KFC and SC show 10.3±1.9 and 2.3±0.2, and there is significant difference (t=7.320, p= 0.002). The total free amino acid content of KFC and SC was 55.2±14.6 μg/μL and 25.1±8.2 μg/μL, respectively. Among the amino acids, Proline, Glutamine, Asparagine, Glutamic acid and Arginine accounted for more than 80.0% of the total amino acids. Especially, glutamic acid, glutamine, lysine, proline, serine and tryptophan showed significant differences between two species.
Keywords:
Amino acid, Cherry, Honey tree, Nectar, Sugar content서 론
화밀(Nectar)의 분비 기작은 광합성 작용으로부터 시작되어 체관부 수액이 기원이 되는 것으로 알려져 있다. 광합성에 의해 생성된 당 화합물은 밀선(Nectary) 근처에 존재하는 유세포(Parenchyma cell)에 집적하게 되고, 해당 유세포의 삼투압이 높아짐에 따라 수분요구도가 증가하게 된다. 수분을 흡수한 세포에서 당의 가수분해가 이루어지며 밀선으로 분비되는 것을 화밀이라고 한다. 화밀은 수분이 약 80%를 차지하며, 그 외에 당, 아미노산, 유기산, 단백질, 지방, 비타민, 미네랄 등이 용해되어있다(Pacini et al., 2003). 그 중 화밀 구성의 20%를 차지하고 있는 당은 꿀벌의 섭식과 소화생리를 통하여 추후 인간이 이용할 수 있는 벌꿀 생산에 기인하기 때문에 밀원수 연구에 있어서 당 분석은 필수적이다. 또한, 아미노산은 전체 화밀 구성에 있어 그 함량비가 적음에도 불구하고, 수분매개자에게 화밀의 맛을 결정하는 중요한 요인 중 하나이다(Nicolson et al., 2007).
우리나라의 밀원수에 관한 연구는 밀원식물을 정의하고 주요밀원수종과 보조밀원수종으로 분류하여 총 236종을 소개하면서부터 시작됐다(최, 1973). 이후 많은 사람들이 밀원식물을 연구하여 117종에서 555종에 이르는 밀원식물을 보고하였으나 밀원식물로서의 정량적인 가치를 제시하지 못하였으며, 꿀벌의 방화를 관찰하여 밀원식물로 판별하였다(Kim and Lee, 1989; Ryu and Jang, 2008).밀원가치를 보다 객관적으로 평가하기 위해서는 해당 수종의 화기구조, 개화특성 및 꿀벌방화에 대한 기초연구를 비롯하여 화밀분비량, 화밀 내 당량에 관한 연구가 필요하다. 화밀의 양적인 수집 조사는 1950년대 Beutler(1953)로부터 시작되었으며, Jablonski and Szklanowska (1979)는 아까시나무 꽃 내부의 화밀을 채취하는 방법을 처음 시도하였고, Kearns and Inouye (1993)는 원심분리기를 이용한 화밀채취 방법을 보고하였다. 국내에서는 Chung and Kim (1984)이 한국산 피나무속 수종을 대상으로 Microcapillary tube를 이용하여 화밀을 채취한 바 있다. 최근에는 주요 밀원수종인 헛개나무, 밤나무, 쉬나무 등을 대상으로 개화특성, 꿀벌의 방화와 화밀분비 및 화밀 당량에 관한 연구가 수행되고 있다(Han and Kim, 2008; Kim et al., 2014; Kim et al., 2017b).
벚나무류는 장미과에 속하는 낙엽활엽교목으로서 꽃은 4월초에 백색의 산방화서 또는 산형화서로 달린다. 우리나라에 식재된 가로수 약 770만 본 중 벚나무는 153만 본으로 19.7%에 달하며, 전국적으로 널리 분포하고 있다(산림청, 2018). 우리나라에는 재배종을 포함하여 약 22종의 벚나무류가 있는 것으로 알려진 가운데 왕벚나무(Prunus yedoensis Matsum), 산벚나무(P. sargentii Rehder), 올벚나무[P. pendula f. ascendens (Makino) Kitam.], 개벚나무[P. verecunda (Koidz.) Koehne] 등 4개 수종은 예로부터 밀원수종으로 보고되었다(Kim et al., 1998; Jang, 2008). 이 중 가로수로 많이 식재되어 우리 생활 속에서 비교적 쉽게 볼 수 있는 수종은 왕벚나무이며, 산벚나무는 주로 강원도, 전라북도 등 백두대간 산지에 분포하는 것으로 알려져 있다. 왕벚나무는 잎자루에 털이 있고, 꽃은 산방 또는 산형화서로 발달하며 잎보다 먼저 피고, 암술대와 소화경에 털이 있는 것이 특징이며, 산벚나무는 산형화서로 2~3개씩 달리며, 꽃과 잎이 거의 동시에 피고, 잎자루와 암술대에 털이 없다.
벚나무류는 전국적으로 자생하고, 분포면적이 넓으며, 꽃이 많이 피지 않는 초봄에 개화하여 꿀벌의 월동 이후 먹이자원으로 활용하는 등 밀원수종으로서의 활용이 기대된다. 그러나 아직까지 벚나무류의 개화특성과 화밀특성 등 밀원적 가치를 정량적으로 평가한 연구는 이루어지지 않았다. 따라서 본 연구에서는 왕벚나무와 산벚나무를 대상으로 개화시기, 화밀분비 패턴, 화밀 내 유리당 및 아미노산 함량을 분석하여 밀원가치를 객관적으로 판단하고자 수행하였다.
재료 및 방법
1. 공시재료
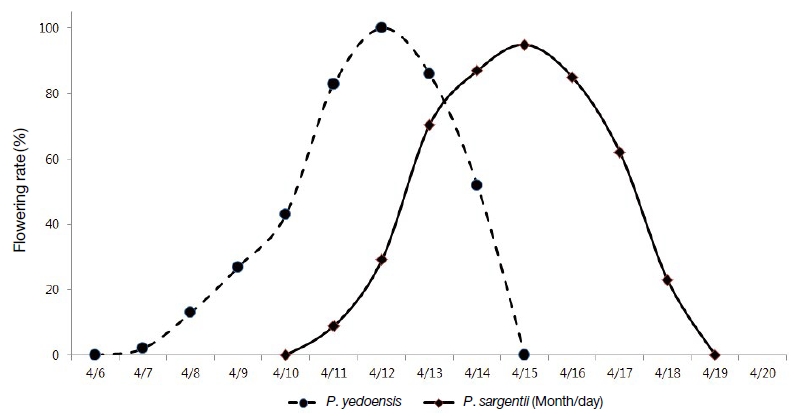
공시수종은 경기도 수원시 소재의 국립산림과학원 시험림에 식재되어 있는 벚나무류로 수고 15 m, 흉고직경 30 cm인 개체를 각각 3본씩 선정하였다. 개화시기 및 개화율 조사는 공시목 3본에서 방위별로 3개의 개화지를 선정하여, 화아발생부터 개화종료까지 육안으로 관찰하였으며 개화한 꽃수를 조사하여 개화율을 구하였다(Fig. 1).
2. 화밀 패턴조사 및 수집
꿀벌 및 방화 곤충에 의한 벚나무 화밀 손실을 방지하기 위해 개화하지 않은 상태의 꽃차례를 미리 선정하고, 교배봉투를 조사목 당 3개씩 씌웠으며, 조사시에만 개방하였다. 화밀분비 패턴은 개화 후 2일 동안 오전 10:00시와 16:00시에 3 μL capillary tube를 이용하여 화밀이 분비되는 양을 정량하였고, 이후 80°C 건조오븐에서 24시간 동안 건조시킨 후 화밀량을 측정하여 수분함량 및 건조화밀량을 산출하였다.
또한, 유리당 및 아미노산 함량분석을 위해 원심분리기(Microfuge 16, Beckman Coulter, USA)를 이용하여 1,000 rpm으로 6분 동안 화밀을 수집하였다. 수집된 화밀은 100 μL microliter syringe (Hamilton, USA)를 이용하여 정량하였으며 휴대용당도계(GMK-703T, Giwonhitech, Korea)를 이용하여 화밀 당도를 측정하였다. 순수 화밀을 수집하기 위해 0.45 μm membrane filter (Whatman, UK)에 필터링한 후, 정제된 화밀을 80% 에탄올로 10배 희석하여 Eppendorf vial에 화밀을 고정하였으며, HPLC 분석 전까지 초저온냉장고(-70°C)에 보관하였다.
3. 유리당 함량 분석
유리당 분석은 HPLC (Dionex ultimate 3000, Dionex, USA)를 이용하여 분석하였다. 이동상으로는 3차 증류수를 사용하였고, 유속은 0.5 mL/min, 온도는 80°C로 설정하였다. Ri-101 detector (Shodex, Japan)로 검출하였으며, Aminex 87P column (Bio-rad, USA)을 사용하였다. 함량은 적분계에 의한 외부표준법으로 계산하였으며, 표준품으로는 Sucrose, Glucose, Fructose, Galactose (Sigma, USA)를 사용하였다.
4. 유리아미노산 분석
수집된 화밀을 O-phthalaldehyd (OPA)-Fluorenylmethyl chloroformate (FMOC) 유도체화하여 아미노산을 분석하였다. Borate buffer, OPA/Mercaptopropionic acid (MPA), FMOC 시약에 시료를 단계적으로 혼합한 다음, HPLC (1200 series, Aglient, USA)를 이용하여 분석하였다. 이동상은 10 mM Na2HPO4, 10 mM Na2B4O7·10H2O가 포함된 A용액(pH 8.2)과 Water : Acetonitrile:Methanol=10 : 45 : 45로 혼합된 B용액에 대하여 A용액 : B용액으로 초기 100 : 0 (v/v,%)에서 26~28분에 55 : 45, 28~30.5분에 0 : 100, 30.5분부터는 100 : 0으로 구배 조건을 설정하였다. 유속은 1.5 mL/min.로 하였고 주입량은 1 mL 설정하였으며 컬럼 온도는 40°C로 설정하여 Inno column C18 (Innopiatech, Korea)을 사용하였다. 검출기는 자외선 검출기와 형광 검출기를 연결시켜, 자외선은 338 nm에서, OPA유도체는 방출 파장은 450 nm, 여기 파장은 340 nm, FMOC유도체의 방출 파장은 305 nm, 여기 파장은 266 nm에서 검출하였다.
5. 통계 분석 방법
조사된 자료는 SPSS program (Statistical Package for Social Science, ver. 18.)을 이용하여 분석하였으며, 각 항목별 두 수종 간 차이를 비교하기 위해 T-test 및 Mann-Whiteny U-test를 실시하였다.
결과 및 고찰
1. 개화시기 및 화밀분비패턴 분석
경기도 수원 지역에서 왕벚나무와 산벚나무의 개화시기를 조사한 결과는 Fig. 2와 같다. 왕벚나무는 4월 6일부터 4월 15일까지 개화하였으며, 11일~13일이 개화최성기로 나타났다. 산벚나무는 4월 10일부터 4월 19일까지 개화하였으며, 15일~17일이 개화최성기를 나타내어 왕벚나무보다 약 4일 정도 늦었으며, 두 수종 모두 약 10일간 개화하는 것으로 조사되었다.
화밀분비패턴을 분석하고자 개화최성기에 3 μL capillary tube를 이용하여 공시대상목의 꽃을 대상으로 이틀 동안 오전 10:00시, 오후 16:00시에 화밀분비 패턴을 조사하였다(Fig. 3, A1~B1). 왕벚나무의 경우, 개화시작 1일차 오전 0.59±0.89 μL, 오후 1.45±1.16 μL를 나타냈고, 개화 2일차 오전에 3.34±1.81 μL로 최대치를 나타낸 후, 오후에 2.18±1.21 μL로 다시 감소하는 경향을 보여 종 모양의 그래프를 나타냈다. 산벚나무는 개화시작 1일차 오전 1.83±1.39 μL, 오후 1.60±0.74 μL를 나타냈고, 개화 2일차 오전에 2.74±1.43 μL로 가장 높게 나타났으며, 오후에는 2.29±1.42 μL로 다소 감소하여, 오후보다 오전에 비교적 많은 화밀이 분비됨을 알 수 있었다. 또한, 두 수종 모두 개화 3일차부터는 대부분의 꽃이 활력을 잃고 떨어지기 시작하였다. 두 수종 간 시간대 별 화밀분비량을 비교하기 위해 T-test를 실시한 결과 개화 1일차 오전은 유의한 차이가 인정되었으며(t= -4.945, p=0.000), 나머지 시간대에서는 화밀분비량에 차이가 없는 것으로 나타났다(p>0.05).우리나라 주요 밀원수종들의 꽃 하나당 평균 화밀분비량은 아까시나무 2.20±1.18 μL, 헛개나무 2.93±0.95 μL, 쉬나무 수꽃 2.73±0.63 μL, 암꽃 0.63±0.49 μL로 보고된 것을 고려할 때, 벚나무류의 화밀분비량은 비교적 많은 것을 알 수 있다(Han and Kim, 2008; Han et al., 2009; Kim et al., 2014).
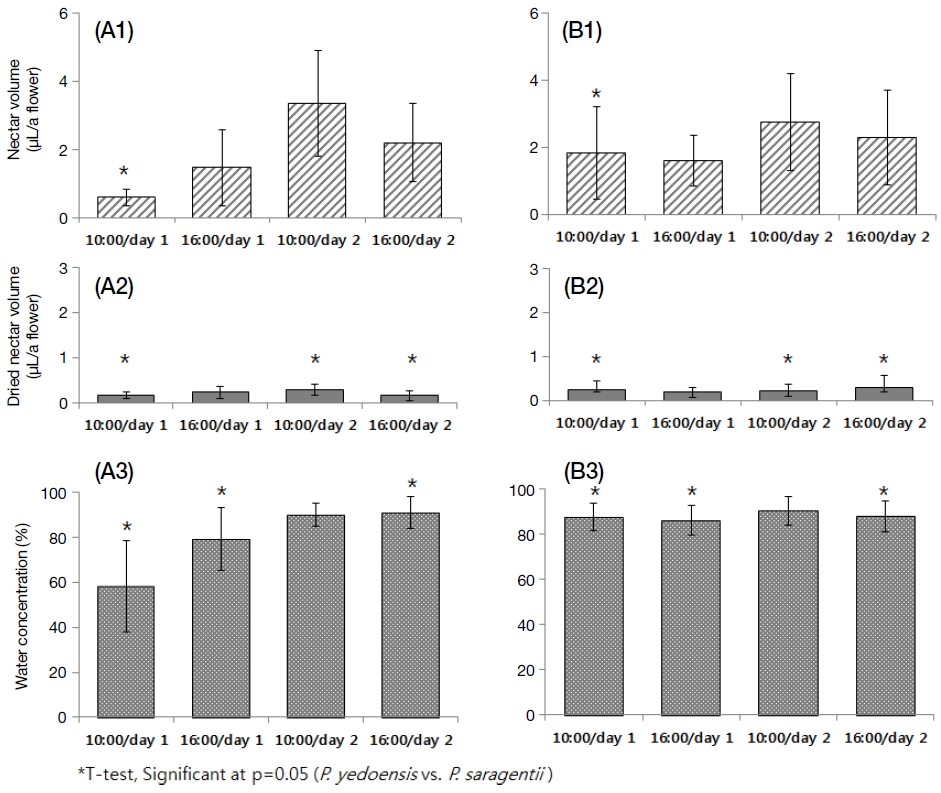
Comparison of nectar volume (A1, B1), dried nectar (A2, B2) and water concentration (A3, B3) between P. yedoensis (A1~A3, n=166) and P. sargentii(B1~B3, n=33). Bars in the graph indicate standard deviation.
그러나 화밀분비량과 당도는 상대습도, 온도 등 환경적인 요인과 식물 자체적인 화밀의 선택적 재흡수에 의해 좌우된다(Kim et al., 2012). 화밀은 상대습도에 의해서 화밀 농도가 유지되는 경향이 있으며, 대부분 낮은 상대습도는 수분 증발을 일으켜서 화밀을 농축시키고, 높은 상대 습도는 화밀을 묽게 하지만 예외적으로 낮은 상대습도에서 높은 당도에 도달하지 못한 경우도 있다(Corbet et al., 1979). 또한 온도는 직·간접적으로 광합성 효율과 관련하여 화밀 생산에 영향을 주며(Burquez and Corbet, 1998), 낮은 온도에서 화밀 분비가 감소하는 것이 일반적이나 높은 온도에서 감소하는 경우도 있다(Jakobsen and Kristjansson, 1994). 따라서 Kim et al. (2012)은 밀원수 개체선발 시 기상인자에 영향을 많이 받는 화밀량보다는 건조화밀량(Dry nectar volume)이나 꽃 하나당 당 함량을 주요 인자로 고려해야 한다고 제언했다.
건조화밀량을 조사한 결과, 왕벚나무는 평균 0.22±0.06 μL로 조사되었으며, 개화시작 1일차 오전에 0.16±0.18 μL, 오후에 0.24±0.18 μL를 나타냈고, 2일차 오전에 0.30±0.16 μL로 가장 높게 나타났으며, 오후에 0.17±0.11 μL로 조사되어 화밀분비량과 동일한 경향을 나타냈다(Fig. 3, A2~B2). 산벚나무는 평균 0.24±0.04 μL로 조사되었으며, 1일차 오전에 0.25±0.19 μL, 오후에 0.20±0.09 μL를 나타냈고, 2일차 오전에 0.22±0.15 μL, 오후에 0.29±0.27 μL로 최대치를 나타냈다. T-test를 이용하여 두 수종 간 건조화밀량을 비교한 결과 1일차 오전, 2일차 오전, 2일차 오후 등 3개의 시간대에서 유의한 차이가 있음을 알 수 있었다(p<0.05).
또한 화밀분비량과 건조화밀량을 이용하여 화밀 내 함수율을 조사한 결과 왕벚나무 81.1±17.5%, 산벚나무 87.9±6.4%로 나타났다(Fig. 3, A3~B3). 왕벚나무는 개화직후 58.2%, 79.3%, 89.9%, 91.0%로 시간이 경과함에 따라 함수율이 높아졌으며, 산벚나무는 84.0~87.7% 범위를 나타내어 함수율이 일정하게 유지되었다. 또한, 두 수종 간 시간대별 함수율은 개화 2일차 오전을 제외한 나머지 3개의 시간대에서 유의한 차이가 인정되었다(T-test, p<0.05).
이를 종합하면 2일 동안 분비된 화밀의 총량은 왕벚나무 7.57±2.81 μL, 산벚나무 8.46±3.30 μL로 조사되었고, 건조화밀량은 왕벚나무 0.89±0.40 μL, 산벚나무 0.95±0.37 μL를 나타냈다. 2일 동안 분비된 총 화밀량과 건조화밀량은 두 수종 간 유의한 차이가 없는 것으로 조사되었으나(T-test, p>0.05), 개화일수 및 시간대에 따른 두 수종별 화밀량, 건조화밀량, 함수율은 부분적으로 유의한 차이가 인정되었다. 본 연구와 동일한 방법으로 2일 동안 화밀분비량을 조사했을 때, 피나무(Kim et al., 2012)는 약 5.2~14.2 μL의 화밀이 분비되며 건조화밀량은 1.8~2.1 μL로 보고한 결과와, 중국 산사나무(Kim et al., 2017)의 화밀은 약 13.8±2.7 μL로 분비된다고 보고된 것보다 다소 낮은 값이며, 섬피나무(Kim et al., 2013)에서 총 화밀량 12.0±4.5 μL, 건조화밀량 1.0±0.4 μL와 비슷한 수준임을 알 수 있었다. 그러나 화밀량은 환경적, 기후적인 요인과 꽃의 형태적 특성에 따라 영향을 받으며, 꽃 하나당 당 함량과 전체 개화량 등이 종합적으로 고려되어야 하므로 타 수종 간 직접적인 비교는 어려울 것으로 판단된다.
2. 유리당 함량 분석
화밀에서의 당은 이당체인 설탕과 6탄당 단당체인 포도당, 자당으로 구성되며, 수분매개자들의 화밀 섭식에 영향을 주는 것으로 알려져 있다(Pacini et al., 2003). 또한 당은 꿀벌의 섭식과 소화생리를 통하여 추후 인간이 이용할 수 있는 벌꿀 생산에 간접적으로 기인하기 때문에 밀원수 연구에 있어서 당 분석은 필수적이다. 원심분리기에 의해 3일 동안 화밀을 수집하고, HPLC를 이용하여 화밀 내 유리당 함량을 분석한 결과는 Table 1과 같다.

Comparison of nectar characteristics in the secreted floral nectar, and estimated free sugar contents of between P. yedoensis and P. sargentii
원심분리기에 의해 수집된 꽃 하나당 화밀분비량은 왕벚나무 1.6±0.9 μL, 산벚나무 2.7±0.4 μL로 조사되었으며, t-test를 실시한 결과 통계적으로 유의한 차이가 인정되었다(t= -2.006, p=0.016). 화밀분비패턴 조사에서 두 수종의 2일간 분비되는 총량은 유의적인 차이가 없었으나, 원심분리기에 의해 조사된 화밀분비량은 차이를 보인 이유는 화분매개자에 의한 화밀손실을 방지하기 위해 교배봉투를 씌우고 꽃의 개화 직후 화밀을 수집하였는데, 개화 1일차에 왕벚나무(2.0±0.6 μL)보다 산벚나무(3.4±0.2 μL)에서 화밀이 더 많이 분비되는 특성 때문인 것으로 판단된다. 화밀 당도는 왕벚나무 42.7±6.4%brix, 산벚나무 21.5±0.5%brix로 왕벚나무가 유의적으로 더 높게 나타났으며(t=4.029, p=0.016), 화밀 내 유리당 함량은 왕벚나무 47.9±13.0 μg/μL, 산벚나무 25.5±0.7 μg/μL로 왕벚나무에서 높았으나 유의한 차이는 없는 것으로 나타났다.
꽃 하나당 화밀량과 단위용량당 당 함량을 이용하여 꽃 하나당 당 함량을 산출한 결과, 왕벚나무 73.7±39.7 μg, 산벚나무 71.4±40.4 μg으로 조사되었으며, T-test를 실시한 결과 차이가 없음을 알 수 있었다(p>0.05). 이러한 결과는 Kim et al. (2017a)이 국내 산사나무와 중국 산사나무 4품종에서 화밀의 유리당 함량을 분석한 결과 단위용량당 당 함량은 유의한 차이를 나타냈으나, 꽃 하나당 당 함량은 차이가 없었다는 보고와 유사한 결과이다.
화밀 내 당 구성비를 나타내는 Sucrose/Hexose 비율은 왕벚나무는 10.3±1.9, 산벚나무 2.3±0.2로 모두 Sucroserich 등급을 나타냈으나, 왕벚나무가 비교적 높게 나타났으며 통계적으로 유의한 차이가 인정되었다(t= -7.320, p=0.002). 이러한 차이는 두 수종 간 Glucose, Fructose 함량에는 차이가 없으나, Sucrose 함량에서 왕벚나무 43.5±11.0 μg/μL, 산벚나무 17.6±6.9 μg/μL로 많은 차이를 나타냈기 때문인 것으로 보인다(t=3.348, p=0.034). 쉬나무(Kim et al., 2014) 수꽃과 암꽃 화밀에서 꽃 하나당 유리당 함량은 각각 48.0 μg과 37.8 μg이며, Sucrose/Hexose 비율은 각각 2.5, 1.2를 나타낸 결과와 국내와 중국 산사나무에서 S/H ratio는 0.4~0.6를 나타냈으며(Kim et al., 2017a), 피나무에서는 0.2~0.7의 범위를 나타낸 결과(Kim et al., 2012)와 비교할 때 왕벚나무의 Sucrose의 비율이 상대적으로 높음을 확인할 수 있었다.
3. 아미노산 함량 분석
HPLC를 통해 분석된 벚나무류 화밀 내 아미노산은 총 20종이 검출되었으며, 각 성분별 함량을 나타낸 결과는 Table 2와 같다.
왕벚나무 화밀 내 아미노산 함량은 55.2±14.6 μg/μL가 검출되었으며, Glutamine, Proline, Asparagine, Glutamic acid, Arginine 순으로 높은 함량을 나타냈으며, 산벚나무는 화밀 내 25.1±8.2 μg/μL의 아미노산이 검출되었고, Proline, Asparagine, Glutamine, Arginine, Glutamic acid 순으로 높게 나타났다. 두 수종 간 함량비의 순서는 다르지만 위의 5개 아미노산이 전체 아미노산의 80%를 차지하여 벚나무류 주요 아미노산임을 알 수 있었으며, 특히 여왕벌의 산란과 곤충의 발달에 필수적이며 꿀벌이 선호하는 것으로 알려진 Proline 성분이 왕벚나무(24.6±3.0%)와 산벚나무(44.3±10.2%) 모두 가장 높게 나타났다.
또한, 두 수종 간 아미노산 구성의 차이를 알아보기 위해 아미노산 함량비에 대해 Mann-Whiteny U-test를 실시한 결과 Glutamic acid, Serine, Glutamine, Tryptophan, Lysine, Proline 등 6개 아미노산이 통계적으로 유의한 차이가 인정되었다. 따라서 6개 아미노산이 왕벚나무와 산벚나무 화밀의 아미노산 구성에 차이를 나타내는 것으로 판단된다. 아미노산은 수분매개자의 종류와 방화를 결정짓는 중요한 요소로서 추후 벚나무류를 비롯한 유망한 밀원수종에 대해 수분매개자 비율 및 방화 횟수에 관한 연구를 지속적으로 수행하여 데이터를 수집하고, 아미노산과 수분매개자의 행동 패턴을 분석하는 연구가 이루어져야 할 것으로 보인다.
적 요
본 연구는 밀원수종으로 알려진 왕벚나무와 산벚나무를 대상으로 정량적인 밀원가치를 평가하기 위해 화밀분비패턴, 유리당 및 유리아미노산 함량을 분석하였다. 개화기간은 왕벚나무가 산벚나무 보다 4일 정도 빨랐으며, 두 수종 모두 약 10일 정도 개화하는 것으로 조사되었다. 3 μL micro-capillary tube를 이용하여 화밀분비 패턴을 조사한 결과 왕벚나무와 산벚나무는 개화 2일차 오전에 각각 3.3±1.8, 2.7±1.4 μL로 가장 많이 분비되었다. 2일 동안 분비된 총 화밀량은 왕벚나무 7.57±2.81 μL, 산벚나무 8.46±3.30 μL로 조사되었으며, 건조화밀량은 왕벚나무 0.89±0.40 μL, 산벚나무 0.95±0.37 μL를 나타내어, 두 수종 간 화밀분비량은 유의한 차이가 인정되지 않았다(T-test, p>0.05). 화밀 내 유리당 함량은 왕벚나무 47.9±13.0 μg/μL, 산벚나무 25.5±10.7 μg/μL로 조사되었으며, 꽃 하나당 당 함량을 산출한 결과, 각각 73.7±39.7 μg/flower, 71.4±40.4 μg/flower로 통계적인 차이는 인정되지 않았다(t=0.071, p=0.947). 그러나 화밀 유리당 구성비(sucrose/hexose)는 왕벚나무 10.3±1.9, 산벚나무 2.3±0.2로 수종 간에 차이가 인정되었다(t=7.320, p=0.002). 아미노산 함량을 분석한 결과, 왕벚나무 55.2±14.6 μg/μL, 산벚나무는 25.1±8.2 μg/μL로 유리아미노산 함량이 분석되었으며, Glutamine, Proline, Asparagine, Glutamic acid, Arginine이 전체 아미노산의 80%를 차지하여 벚나무류의 주요 아미노산임을 알 수 있었다. 특히, 두 수종 간에는 Glutamic acid, Glutamine, Lysine, Proline, Serine, Tryptophan 등 6개 아미노산에서 통계적으로 유의한 차이가 인정되었다. 벚나무류는 전국적으로 자생하고 분포면적이 넓으며, 꽃이 많이 피지 않는 초봄에 개화하는 특성과 종 간 개화기간의 차이 및 화밀 내 유리당 함량 등을 고려할 때 밀원수종으로서의 활용이 가능할 것으로 판단된다.
References
- 최승윤. 1973. 양봉학. 집현사. p. 312.
- 산림청. 2018. 임업통계연보(제 28호). pp. 358.
-
Beutler, R. 1953. Nectar. Bee World. 34: 106-162.
[https://doi.org/10.1080/0005772X.1953.11094812]

- Burquez, A. and S. A. Corbet. 1998. Dynamics of production and exploitation of nectar: lessons from Impatiens glandulifera Royle. In: B. Bahadur (Ed.), Nectary biology pp. 130-152.
- Chung, Y. H. and K. J. Kim. 1984. Flowering process and pollination mechanism of genus Tilia in Korea. Journal of Plant Biology 27: 107-127.
-
Corbet, S. A., P. G. Willmer, J. W. L. Beament, D. M. Unwin and O. E. Prys-Jones. 1979. Post-secretory determinants of sugar concentration in nectar. Plant Cell Environment 2: 293-308.
[https://doi.org/10.1111/j.1365-3040.1979.tb00084.x]

- Han, J. and S. H. Kim. 2008. Flowering and nectar secretion characteristics of honey plant, Hovenia dulcis var. koreana Nakai. Journal of Apiculture 23(3): 199-205.
- Han, J., M. S. Kang, S. H. Kim, G. Y. Lee and E. S. Baik. 2009. Flowering, honeybee visiting and nectar secretion characteristics of Robinia pseudoacacia L. in Suwon, Gyeonggi Province. Journal of Apiculture 24(3): 147-152.
- Jablonski, B. and K. Szklanowska. 1979. Propozycje zmiany metody badanʹ nektarowania roslin [Improved method of investigations on nectar secretion of plants]. Pszczelnicze Zeszyty Naukowe 23: 105-113.
-
Jakobsen, H. B. and K. Kristjansson 1994. Influence of temperature and floret age on nectar secretion in Trifolium repens L. Annals of Botany 74: 327-334.
[https://doi.org/10.1006/anbo.1994.1125]

- Jang, J. W. 2008. A Study on honey plants in Korea (The kind of honey plants in Korea and Around a former Scanning electron microscope form structure of the pollen). Department of Natural Resources, Ph.D. Thesis, Daegu University, p. 134.
- Kearns, C. A. and D. W. Inouye. 1993. Techniques for pollination biologists. Niwot: University Press of Colorado.
-
Kim, C. S., K. Y. Lee, M. O. Moon, H. J. Hyun, B. S. Ihm and M. H. Kim. 1998. Natural habitat of Prunus yedoensis matsumura and its morphological variation, Korean J. Pl. Taxon. 28(2): 117-137.
[https://doi.org/10.11110/kjpt.1998.28.2.117]

- Kim, M. S., S. H. Kim, J. Han and J. S. Kim. 2012. Analysis of secretion quantity and sugar composition of nectar from Tilia amurensis Rupr. Journal of Apiculture 27(1): 79-85.
- Kim, M. S., S. H. Kim, J. H. Song and H. Kim. 2013. Honeybee Visiting and Secreted Nectar Characteristics of Tilia insularis Nakai and Relation with Meteorologic Traits. Journal of Apiculture 28(5): 331-337.
-
Kim, M. S., S. H. Kim, J. H. Song and H. S. Kim. 2014. Analysis of secreted nectar volume, sugar and amino acid content in male and female flower of Evodia daniellii Hemsl. J. Korean For. Soc. 103(1): 43-50.
[https://doi.org/10.14578/jkfs.2014.103.1.43]

-
Kim, S., A. Lee, D. Kang, H. W. Kwon, Y. K. Park and M. S. Kim. 2017a. Analysis of floral nectar characteristics of Korean and Chinses hawthorns (Crataegus pinnatifida Bunge). Journal of Apicultural Research 14: 119-128.
[https://doi.org/10.1080/00218839.2017.1357942]

-
Kim, S. H., A. Lee, H. Y. Kwon, W. Lee and M. S. Kim. 2017b. Analysis of Flowering and Nectar characteristics of major four chestnut cultivars (Castanea spp.). Journal of Apiculture 32(3): 237-246.
[https://doi.org/10.17519/apiculture.2017.09.32.3.237]

- Kim, T. W. and Y. M. Lee. 1989. The state and propagation plans of honey plants in Korea. Journal of Apiculture 4(1): 9-18.
-
Nicolson, S. W., M. Nepi and E. Pacini. 2007. Nectar production and presentation. Nectaries and Nectar pp. 167-214.
[https://doi.org/10.1007/978-1-4020-5937-7_4]

-
Pacini, E., M. Nepi and J. L. Vesprini. 2003. Nectar biodiversity: a short review. Plant Systematics and Evolution 238: 7-21.
[https://doi.org/10.1007/s00606-002-0277-y]

- Ryu, J. and J. Jang. 2008. Newly found honeyplants in Korea. Journal of Apiculture 23(3): 221-228.