토종꿀벌 (Apis cerana F. var. Baekdubeol) 낭충봉아부패병 저항성 품종 백두벌 육성 및 형질 특성 및 벌꿀 생산성 비교
Abstract
Recently, Sacbrood virus (SBV) caused significant colony collapse in Korean Apis cerana. Therefore, the breeding of resistant bees to counter this viral disease is urgently needed. Considering that hygienic behavior in honey bees is genetically based and confers colony-level resistance against brood diseases, we utilized this trait for selecting A. cerana colonies using pin-killed pupae and SBV-killed larvae assays. Also, the brood survival rate was evaluated after colonies were inoculated with SBV. Colonies that exhibited the highest levels of hygienic behavior and brood survival were selected to rear daughter queens and drones for the next generations. Over four selective generations from 2015 to 2018, dead brood removal and brood survivorship in colonies of the hybrid lines (Baekdubeol) was significantly higher than those in the controls (positive control : Hallaboel and negative control : local) (P<0.01, 99.3 vs. 89.9% for removal of pin-killed pupae; P<0.01, 99.0 vs. 63.9% for removal of SBV-killed larvae; and P<0.01, 70.0 vs. 9.2% for brood survivorship). Following SBV-inoculation, colonies of the hybrid line (Baekdubeol) showed an increase in the number of surviving pupae and adults, whereas control colonies collapsed mostly because of SBV infection. Our results confirm the feasibility of selecting SBV-resistant A. cerana based on the improved capability of dead brood removal and brood viability. Comparing honey productivity, a worker of the Baeckdubeol was 27.9 mg respectively.
Keywords:
Apis cerana, Bee-breeding, Sacbrood virus, Brood disease, Honey production서 론
국내에서 사육되고 있는 토종꿀벌인 Apis cerana (Hymenoptera: Apidae)는 고부가가치 벌꿀 생산을 위해 사육되는 가장 중요한 벌종 중 하나이며, 뛰어난 수분 능력으로 인해 아시아 국가들의 식물의 생물 다양성을 유지하는 데 중요한 역할을 하고 있다 (Corlett, 2004). 그러나 최근 몇 년간 국내 토종꿀벌 (A. cerana) 개체수는 크게 감소했으며 중국, 인도, 한국, 태국, 베트남과 같은 아시아 국가에서 거의 멸종 위기에 처한 적이 있다 (Choi et al., 2010; Nguyen and Le, 2013; Theisen-Jones and Bienefeld, 2016). 토종꿀벌인 A. cerana가 봉군 붕괴되는 가장 큰 이유는 SBV (Sacbrood Virus)에 의한 것이라 할 수 있다. SBV는 2009년 국내에서 최초 진단 이후 국내 토종꿀벌의 90% 이상이 폐사한 것으로 추정하고 있다 (Choi et al., 2010; Jung and Cho, 2015). SBV는 IÁavirus속 (Baker and Schroeder, 2008)에 속하는 선형 양성 단일 가닥 RNA 바이러스다. 이 바이러스는 주로 여왕벌이 산란한 유충에서 증식하여 결국 유충이 죽게 된다 (Bailey et al., 1964; Chen et al., 2004). 사회적 곤충으로서 꿀벌은 질병과 싸우기 위한 개별적 또는 사회적인 방어 수단으로서 새로운 생리적, 행동적, 조직적 적응을 진화시켜 왔다. 봉군의 일벌은 개인 및 집단 방어를 모두 수행하여 전체 봉군을 안정적으로 유지한다 (Evans et al., 2006; Cremer et al., 2018). 꿀벌도 대부분의 진핵생물과 마찬가지로 개별 방어는 일반적으로 병원체 발달을 숙주로 제한하는 생리학적 변화 (즉, 면역 체계)와 병원체 감염의 위험을 줄이는 행동에 의존한다 (Evans, 2004; Siva-Jophy et al., 2005; Evans et al., 2006). 예를 들어, 일벌 개체는 바이러스 감염에 대한 방어 기작으로 항균 팹타이드를 합성하여 방출함으로써 항바이러스 효과를 (Xu et al., 2009; Shan et al., 2017) 나타내거나 면역 경로에 관여하는 면역 관련 유전자의 활성화를 통해 바이러스의 성장을 억제한다 (Brutscher et al., 2017). 그러나 이전의 연구는 꿀벌의 선천적 면역과 관련된 유전자가 다른 곤충에서 관찰된 유전자의 3분의 1로 감소한다는 것을 보여주었다 (Evans et al., 2006; Weinstock et al., 2006). 대신 꿀벌은 질병으로부터 방어하기 위해 사회적 면역 (즉, 사회적 행동)에 크게 의존한다 (Cremer et al., 2018). 이 방어 시스템은 병원의 확산을 줄이기 위해 협업적인 집단의 협력을 통해 감염된 개체를 위생적으로 제거하는 방식으로 작동한다 (Simone-Finstrom, 2017; Cremer et al., 2018). 따라서 꿀벌의 경우 개인 및 집단 면역과 관련된 특성이 우수한 봉군을 선발하여 사육하는 것이 효과적일 수 있다. 꿀벌의 집단면역성은 거의 대부분의 사회적 곤충 (Cremer and Sixt, 2009)에 존재하는 위생 행동 (Hygienic behavior)으로써 봉군 내 병원체 확산 위험을 줄이는 데 중요한 역할을 한다 (Rothenbuhler, 1964; Spivak and Gilliam, 1998; Spivak and Reuter, 2001). 꿀벌의 위생 행동은 병들거나 죽은 유충 및 꿀벌응애와 같이 기생충이 기생하는 유충들을 봉군에서 발견하여 제거하는 능력을 말한다. 이러한 위생 행동은 꿀벌의 유전적 행동특성으로 보고되어 있다 (Gilliam et al., 1983; Milne Jr, 1985; Arathi et al., 2000; Palacio et al., 2000; Spivak and Reuter, 2001).
꿀벌은 여왕벌 한 마리가 여러 마리의 수벌과 교미하는 형식인 다중교미로 이를 통해 유전적 다양성을 유지한다 (Tarpy and Nielsen, 2002). 이러한 유전적 다양성은 다음 세대에 질병 내성과 관련된 형질 특성이 유전적으로 고정되어 봉군과 개체 모두 다양한 수준의 면역 반응을 가질 수 있게 한다. 따라서 특정 병원체가 전체 군집 수준의 감염을 일으킬 가능성은 낮다 (Palmer and Oldroyd, 2003; Evans and Pettis, 2005; Evans and Spivak, 2010). 따라서, 질병에 내성이 있는 꿀벌의 육종을 위해서는, 개체별 질병 내성 능력을 평가하는 것이 중요하다. 따라서 본 연구에서는 핀으로 죽인 번데기와 SBV로 죽인 유충에 대해 우수한 위생적 제거 행동 특성을 가진 봉군을 선발하고 이러한 봉군의 발육 특성과 벌꿀 생산성 등을 평가하였다.
재료 및 방법
1. 토종꿀벌 (Apis cerana F.) 봉군
시험에 사용된 토종꿀벌은 농촌진흥청 국립농업과학원에서 2009년부터 2017년까지 선발 육성된 낭충봉아부패병 저항성 신품종인 백두벌과 한라벌을 이용하였으며, 농가에서 구입한 비저항성 품종을 대조구로 사용하였다. 각각의 봉군은 국립농업과학원 실험양봉장에서 사육하면서 외형적 특성 및 형질 특성을 분석하였다.
2. 외부형질 특성 분석 (Morphological analysis)
낭충봉아부패병 저항성 신품종 토종꿀벌인 백두벌과 한라벌의 외형적 특성 분석을 위하여 저항성 신품종과 농가에서 사육 중인 토종꿀벌 각 4봉군에서 각각 60마리의 일벌을 채집하여 95% EtOH에 보관 후 외부형질 부위별로 Leica MZ 16A (Leica application suite)을 이용하여 LAS program으로 측정하였다. 외부형질 특성을 비교를 위하여 Ruttner (1988)에서 설명한 외부형질로 체장 (BL: body length), 배길이 (AL: abdominal length), 몸통 폭 (AW: abdominal width), 머리길이 (HH: head height), 머리 폭 (HW: head width), 안테나 길이 (AL: antennal length), 앞날개 길이 (FWL: forewing length), 앞날개 폭 (FWW: forewing width), 뒷날개 길이 (HWL: hindwing length), 뒷날개 폭 (HWW: hindwing width), 날개 고리 수 (WH: wing-hooks), 허벅지 마디길이 (FL: femur length), 뒷다리 종아리 마디 길이 (TL: tibia length), 화분받이 길이 (BL: basitarsus length), 화분받이 폭 (BW: basitarsus width)을 측정하였다.
3. 청소행동 특성 비교 (Hygenic behavior by Pin kill test)
신규육성 품종의 질병저항성 검증을 위한 방법으로 pin kill test 방법을 사용하였다 (Choi et al., 2020). 시험을 위하여 낭충봉아부패병 저항성 신품종 토종꿀벌 (한라벌, 백두벌)과 농가 관행 사육 토종꿀벌은 각각 3봉군씩 3회 조사하였다. 시험용 봉군은 개량벌통에서 사육하는 토종꿀벌로 먹이장 1매, 산란 소비 3매로 구성된 봉군의 일벌 수를 동일한 수준으로 맞추어 시험하였다. Pin kill test는 100개의 봉개된 번데기 방을 핀으로 찔러서 죽인 후 24시간 경과 후 번데기 방을 완전히 청소한 비율을 측정하였다.
4. 바이러스 인공감염
토종꿀벌 낭충봉아부패병 저항성 신품종 (한라벌, 백두벌)의 낭충봉아부패병에 대한 저항성 시험을 위하여 낭충봉아부패병 바이러스가 감염된 유충을 채집하여 낭충봉아부패병 바이러스 유전자의 정량 분석을 위해 사료는 Trizol을 이용하여 total RNA를 분리하였다. 시료를 액체질소로 동결 마쇄한 후 200 μL chloroform과 Trizol 1 mL을 100 mg의 시료와 섞은 후 15초간 vortex하고 실온에 2∼3분간 반응하였다. 반응 후 시료를 12,000×g, 15분간 4℃ 조건에서 원심분리하고 상층액을 분리하여 500 μL isopropanol과 섞어서 실온에 10분간 반응 후 12,000×g, 15분간 4℃ 조건에서 다시 원심분리한 후 pellet을 80% EtOH로 washing한다. 최종 pellet은 DEPC water에 녹여서 cDNA 합성에 이용하였다. cDNA 합성은 추출한 total RNA를 주형으로 oligo dT primer를 이용하여 PrimeScript II 1st strand cDNA Synthesis kit로 65℃, 5분간 반응 후 얼음에 급냉한 후 42℃, 60분간 cDNA를 합성하였다. 합성된 cDNA는 낭충봉아부패병 바이러스 (SBV) 유전자를 증폭시키기 위하여 주형으로 사용되었으며, Forward primer 5′-GAC CAA GAA GGG AAT CAG-3′, Reverse primer 5′-CAT CTT CTT TAG CAC CAG TAT CCA-3′를 이용하여 낭충봉아부패병 (Sacbrood virus disease) 바이러스 유전자의 발현량을 측정하였고 control 유전자로는 β-actin 유전자를 이용하였다. qPCR은 최종 부피가 25 μL가 되도록 10 pmol 농도의 primer, 1×SYBR Green (Applied Biosystems), 1st strand cDNA 1 μL를 섞어서 반응시켰다. 반응 최종 결과의 Ct 값 분석을 통해 바이러스를 정량 분석하여 (Applied Biosystems, user bulletin #2) 1×106/mL의 농도로 봉군당 50 mL을 벌집에 스프레이하여 인공감염 시험을 하였다.
5. 수밀력 비교 (Honey production)
토종꿀벌 낭충봉아부패병 저항성 신품종 (한라벌, 백두벌)의 수밀력 우수성을 비교하기 위하여 한라벌과 농가에서 관행적으로 사육하고 있는 봉군에서 유밀기 (2019년 5월)에 화밀 (nector)을 수집하기 위하여 나가는 일벌 100마리와 수집 후 들어오는 일벌 100마리를 채집하여 무게 차를 측정하였다.
(들어오는 일벌무게-나가는 일벌무게)÷100=일벌 마리당 수밀력
6. DATA 분석
선발 계통 (R, H, 및 R×H)의 시간경과에 따른 위생 행동 특성 (hygienic behavior, Pin-kill test alc SBV로 죽인 애벌레의 제거 능력)은 유충 및 번데기가 죽은 후 Kaplan-Meier (Mantel-Cox) 방법으로 애벌레 생존력 등을 비교했다. 번데기와 일벌의 수, 벌꿀 저장 면적 및 형태분석 데이터는 일원 분산 분석 테스트에 이어 Fisher의 LSD (Limited Difference Difference)를 사용하여 분석되었다. 모든 검정의 경우, P<0.05에서 그룹 간의 차이는 통계적으로 유의한 것으로 간주되었으며, 모든 데이터는 IBM SPSS 통계 22를 사용하여 분석되었다.
결과 및 고찰
1. 낭충봉아부패병 (SD) 저항성 토종꿀벌 품종 백두벌 육성
토종벌 낭충봉아부패병 저항성을 보유하고 있는 백두벌은 낭충봉아부패병 발생 후 4개 지역 (구미, 이천, 강진, 통영)에서 바이러스 감염 후 생존 봉군 또는 질병이 발생하지 않은 봉군을 수집하여 저항성을 보이는 구미, 이천지역 봉군에서 여왕벌을 생산하고 수벌을 양성하여 교배 시험하여 2016년부터 2017년까지 4세대까지 교미하여 순계를 분리하여 H 계통을 선발하였고 통영과 강진에서 수집한 봉군을 이용하여 순계를 양성하여 R 계통을 선발하였다. R 계통은 한라벌로 명명하여 품종등록 하였으며, R계통에서 여왕벌을 양성하고 H 계통에서 양성된 수벌과 교미한 R (♀)×H (♂) 교배 계통을 백두벌로 명명하여 품종등록하였다 (Fig. 1).
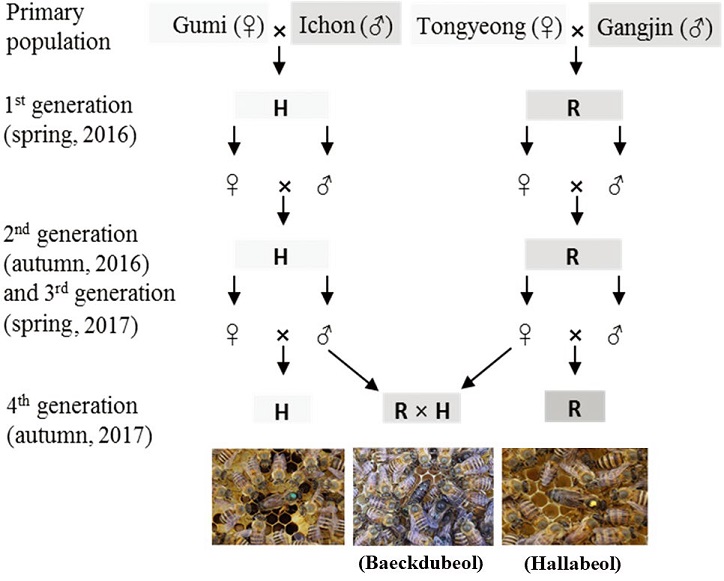
Diagrammatic illustration of breeding procedures. Four generations were propagated from four A. cerana populations collected in Gumi, Ichon, Gangjin, and Tongyeong in South Korea. In each generation, three colonies from six selected colonies were used to rear drones, whereas the other three colonies were used to rear daughter queens.
2. 낭충봉아부패병 (SD) 저항성 품종 (백두벌) 외형적 특성
낭충봉아부패병에 대한 저항성을 보유하고 있는 신품종 토종꿀벌인 백두벌의 외형적 특징을 농가에서 관행적으로 사육하는 토종꿀벌과 비교한 결과, 전체적인 평균 체장 (BL)은 일반 토종꿀벌 (Local) 12.85 mm 대비 저항성 신품종 (백두벌, RH)은 13.49 mm로 상대적으로 길고 모계통인 한라벌 (R) 13.59 mm, 부계통 (H) 13.83 mm와 비슷하고 배 길이 (AL) Local 6.47 mm, R 7.33 mm, H 6.95 mm, RH 6.98 mm, 배 폭 (AW)은 Local 4.04 mm, R 3.91 mm, H 3.91 mm, RH 3.95 mm, 머리길이 (HH) Local 2.79 mm, R 2.82 mm, H 2.87 mm, RH 2.70 mm, 머리 폭 (HW)은 Local 3.55 mm, R 3.58 mm, H 3.66 mm, RH 3.58 mm, 안테나 길이 (ATL) Local 4.17 mm, R 4.08 mm, H 4.10 mm, RH 4.16 mm, 겉날개 길이 (FWL) Local 8.50 mm, R 8.67 mm, H 8.68 mm, RH 8.74 mm, 겉날개 폭 (FWW) Local 2.69 mm, R 2.89 mm, H 2.85 mm, RH 2.89 mm, 속날개 길이 (HWL) Local 5.96 mm, R 6.04 mm, H 6.09 mm, RH 6.13 mm, 속날개 폭 (HWW) Local 1.55 mm, R 1.64 mm, H 1.63 mm, RH 1.64 mm, 날개 훅 수 (WH) Local 18.31개, R 18.49개, H 18.56개, RH 16.82개, 뒷다리 대퇴골 길이 (FL) Local 2.32 mm, R 2.34 mm, H 2.36 mm, RH 2.38 mm, 경골 길이 (TL) Local 2.93 mm, R 2.95 mm, H 2.93 mm, RH 3.06 mm, 발목 길이 (BL) Local 1.89 mm, R 1.84 mm, H 1.86 mm, RH1.93 mm, 발목 폭 (BW) Local 1.04 mm, R 1.03 mm, H 1.06 mm, RH 1.08 mm로 확인되었다 (Fig. 2). 낭충봉아부패병 저항성 모계와 부계는 전체적인 체장, 배길이, 머리 폭, 날개의 길이 및 폭, 대퇴골의 길이가 local 대비 큰 특징을 가지고 있으며, 그러나 상대적으로 안테나의 길이는 짧은 것이 특징이며, 교배종인 백두벌 (RH)은 안테나 길이가 local과 비슷하고 대퇴골 길이는 가장 길고 경골과 발목의 폭과 길이가 유의적으로 가장 큰 특징을 보인다 (Fig. 2).
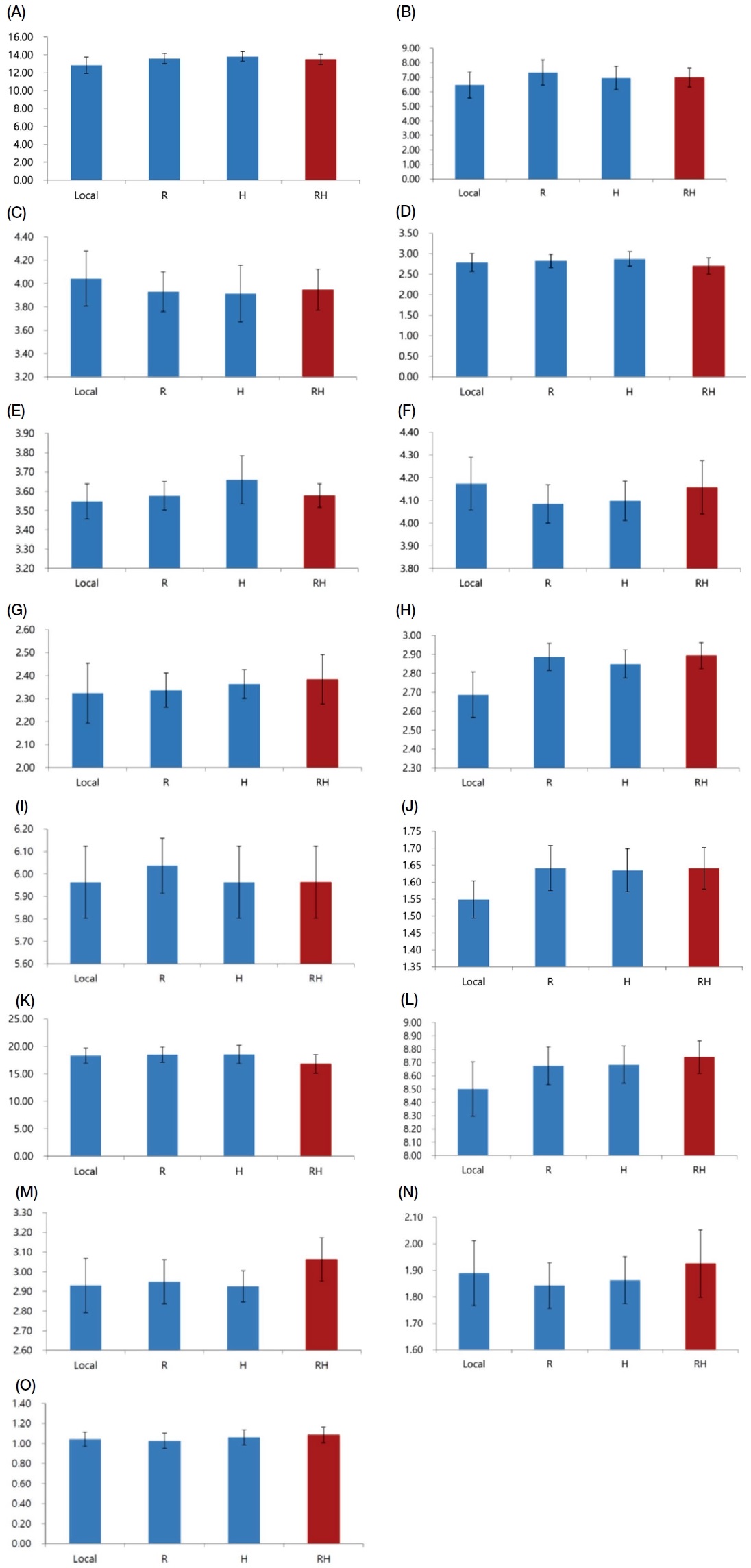
Body parts of worker bees used for measuring morphometric characters. (A) BL: body length, (B) AL: abdominal length, (C) AW: abdominal width, (D) HH: head height, (E) HW: head width, (F) ATL: antennal length, (G) FWL: forewing length, (H) FWW: forewing width, (I) HWL: hindwing length, (J) HWW: hindwing width, (K) WH: wing-hooks, (L) FL: femur length, (M) TL: tibia length, (N) BL: basitarsus length, (O) BW: barsitarsus width. Local: Normal A. cerana from beekeepers, R: hallabeol. RH: Baeckdubeol, Bar is Standard deviation (SD) (ns, no significant difference at the P<0.05).
3. 낭충봉아부패병 (SD) 저항성 신품종 청소행동 특성 (Hygenic behavior)
질병저항성을 확인하기 위해 pin-kill test와 인공적으로 낭충봉아부패병 바이러스를 감염시켜 유충 제거 능력을 비교하였다. Pin kill test 결과, 선발 계통 (R과 H)은 48시간 경과 후 죽인 번데기의 제거비율이 각각 97.3%, 98.9%로 대조군과 비교했을 때 각각 8%와 9%의 차이를 나타내었으며 백두벌 (RH)은 99.3% (P<0.01)로 가장 우수하였다 (Fig. 3). 그리고 낭충봉아부패병 바이러스를 인공적으로 감염한 벌집의 죽은 유충 제거능력은 R 계통과 H 계통에서 SBV로 죽은 유충이 있는 벌집을 넣어준 후 48시간 경과 시 각각 95.7%, 94.3%로 확인되었다. 이는 대조군 (local) 대비 각각 31.8%, 30.4%의 높은 것으로 확인되었다. 특히, 교잡계통 (RH)인 백두벌 전체 실험군 중 SBV감염 유충을 제거하는 능력이 98.6% 가장 우수하였다 (48시간 이내 약 99% 제거) (Fig. 4). 낭충봉아부패병 (SD)은 꿀벌의 유충이 바이러스 증식을 위한 숙주이기 때문에 초기에 감염된 숙주를 신속하게 제거하는 것이 질병저항성의 가장 중요한 특성이다. 따라서 본 연구결과에 따르면, 낭충봉아부패병 저항성 토종꿀벌인 R (한라벌)계통과 H계통은 초기 청소행동 특성이 일반 토종꿀벌 대비 우수하였으며, 두 계통의 교배종 (RH)인 백두벌이 낭충봉아부패병을 비롯한 기타 질병의 확산을 예방하여 봉군이 폐사하는 것을 방지하는 능력이 가장 우수한 것으로 확인하였다. 또한, 낭충봉아부패병 바이러스 (SBV)를 인공감염 시킨 경우에는 R 계통과 H 계통에서의 애벌레 생존 비율은 각각 46.6%, 53.2%로 확인되었다. 백두벌 (RH) 계통은 유충의 생존율이 약 70%로 가장 우수한 것으로 확인되었다 (Fig. 5). 이러한 생존율은 낭충봉아부패병 바이러스 (SBV)에 감염되지 않은 일반 토종꿀벌 (local)의 생존율인 82.5% 큰 차이를 보이지 않아서 바이러스에 대한 저항성도 가장 우수한 것으로 확인되었다.
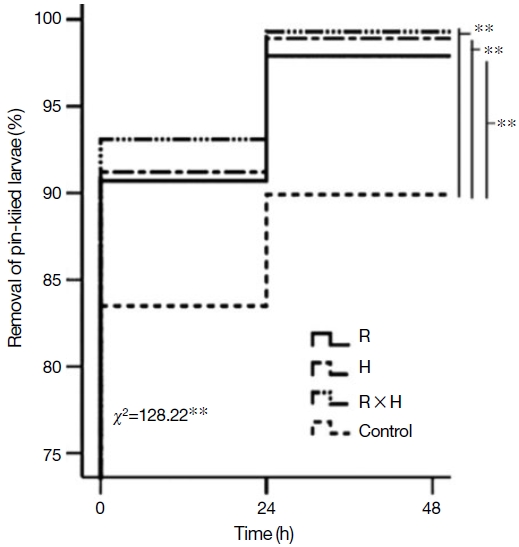
The proportion of pin-killed pupae removed over time from the colonies of breeding lines (R: Hallabeol, H, and R×H: Baekdubeol) and control in the fourth generations. P values were obtained from the log-rank Chi-square (÷2) tests and log-rank post hoc (Mantel-Cox) tests (**, significant difference at the P<0.01 level).
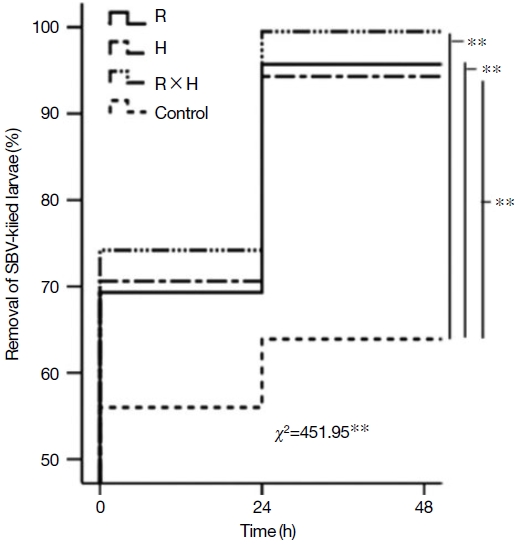
The proportion of SBV-killed larvae removed over time from the colonies of breeding lines (R: Hallabeol, H, and R×H: Baekdubeol) and the control group in the fourth generations. P values were obtained from the log-rank Chi-square (÷2) tests and log-rank post hoc (Mantel-Cox) tests are shown as follows: **, P<0.01 level).
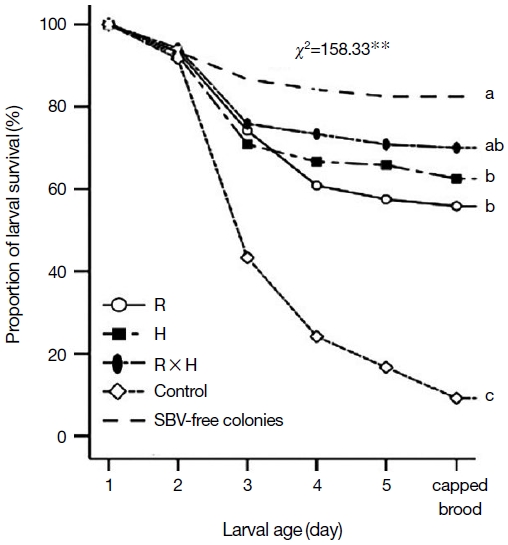
The proportion of larval survivorship in SBV-infected A. cerana colonies (R: Hallabeol, H, and R×H: Baekdubeol) over larval stages in the fourth generations. P values were obtained from the log-rank Chi-square (÷2) test (ns, no significant difference at the P<0.05 level; *, significant difference at the P<0.05 level; and **, significant difference at the P<0.01 level). Different letters in the same graph indicate significant differences at the P<0.05 level (Mantel-Cox tests).
4. 낭충봉아부패병 바이러스 (SBV) 감염 봉군 발육 및 벌꿀 저장능 비교
낭충봉아부패병 저항성 계통한 한라벌 (R), H, 백두벌 (RH)와 대조군 (Local)을 내검을 통해봉군 발육을 비교한 결과, 저항성 계통의 번데기와 일벌 수는 바이러스에 감염되기 전에는 유사하다. SBV를 인공적으로 감염한 후 45일 경과 시 대조군 (local)은 봉군이 붕괴되는 현상을 보였으나 낭충봉아부패병 저항성 계통에서는 봉군 붕괴현상이 발생하지 않았다. 봉개된 일벌방의 수와 출방한 일벌의 수도 대조군 대비 우수하여 저항성 품종의 봉군발육은 낭충봉아부패병에 영향을 받지 않는 것으로 확인하였으며, 특히, 백두벌의 발육이 가장 우수한 것으로 확인되었다 (Figs. 6, 7). 벌꿀 저장능을 비교한 결과, R 계통과 H 계통은 일벌 수 (10,000∼10,500마리) 대비 벌꿀 저장량이 큰 차이를 보이지 않았으나 (3,000∼3,200 cm2) 백두벌의 경우 일벌수가 약 12,000마리로 벌꿀 저장 면적도 약 3,500 cm2로 일벌 수는 10% 이상 증가하여 발육이 우수하였으며, 벌꿀 저장면적은 14% 이상 넓어서 벌꿀 저장능력이 가장 우수한 것으로 확인하였다. 이 유의적인 차이로 우수한 것으로 확인하였다 (Fig. 8). 따라서 토종꿀벌 낭충봉아부패병 (SD)에 저항성을 가지는 신품종 백두벌은 낭충봉아부패병 바이러스에 감염되어 병징을 보이지 않으며, 이로 인한 봉군 폐사는 확인되지 않았다. 또한 봉군당 벌꿀저장능도 우수한 것으로 확인되었다. 지난 2009년 이후 낭충봉아부패병 바이러스의 확산으로 토종꿀벌의 개체수가 약 2년 동안 농가 주장에 의하면 90% 이상, 농식품부 기타가축 통계에 의하면 75% 이상이 급격하게 감소하였으며 이후 농촌진흥청에서 보급한 우수여왕벌 양성 기술 및 개량벌통 사용 농가의 증가로 감소 추세는 줄었으나 지속적인 질병 확산으로 증식된 토종꿀벌 봉군 수와 유사하게 폐사하는 악순환이 연속되고 있는 상황에서 낭충봉아부패병 저항성 품종인 한라벌이 개발되어 점차적으로 토종꿀벌 봉군 수가 증가할 것으로 기대되고 있다 (Choi et al., 2020). 특히, 농가에서 자가 증식한 경우에도 저항성을 보이면서 국내 토종벌이 낭충봉아부패병에 저항성을 획득하고 있는 것으로 추정된다.
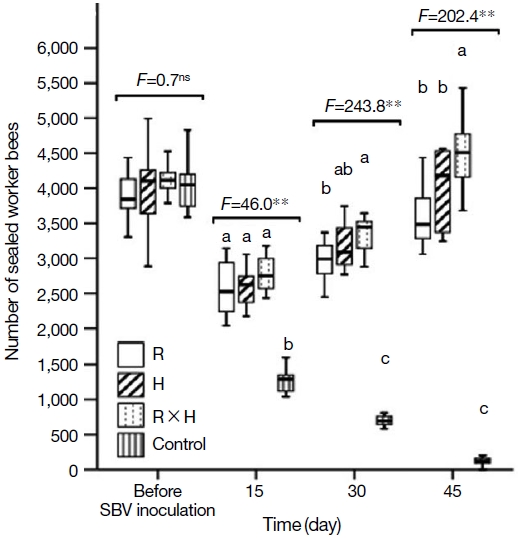
The number of sealed worker broods in SBV-inoculated colonies of breeding lines (R: Hallabeol, H, and R×H: Baekdubeol). Boxplots demonstrate the quartiles (length of box), median (horizontal line inside the box), and whiskers represent 1.5 times the interquartile range. F value obtained from one-way ANOVA tests are shown as follows: **, P<0.01; and ns, no significant difference. Different letters indicate significant differences at the P<0.05 level (Fisher’s LSD tests).
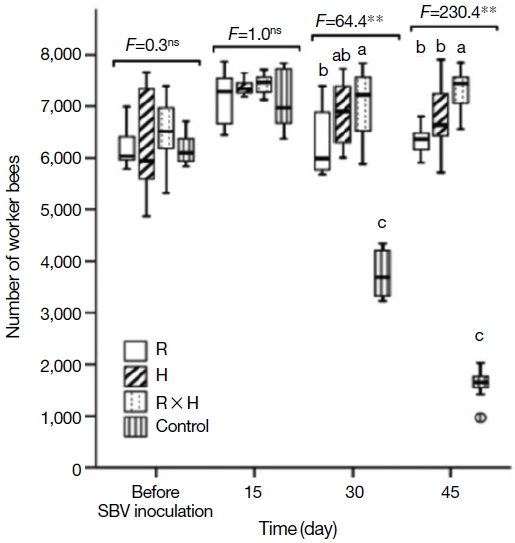
The number of sealed worker broods in SBV-inoculated colonies of breeding lines (R: Hallabeol, H, and R×H: Baekdubeol). Boxplots demonstrate the quartiles (length of the box), median (horizontal line inside the box), and whiskers represent 1.5 times the interquartile range. F value obtained from one-way ANOVA tests are shown as follows: **, P<0.01; and ns, no significant difference. Different letters indicate significant differences at the P<0.05 level (Fisher’s LSD tests).
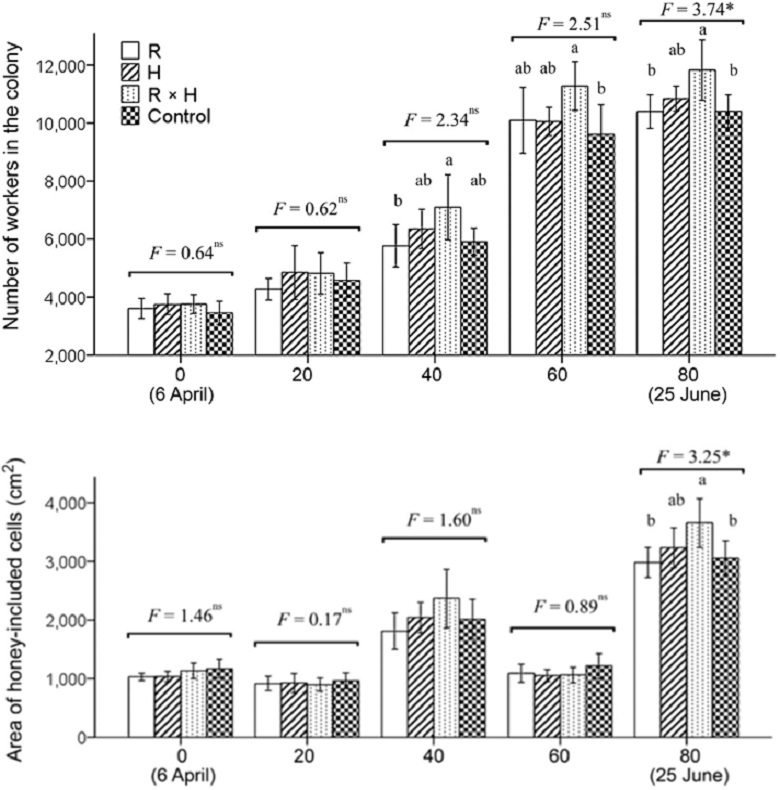
The number of workers and area of honey-included cells in A. cerana colonies of breeding (R: Hallabeol, H, and R×H: Baekdubeol) and the control group from 6 April to 25 June 2018 under SBV-free conditions. Means, standard errors, and results of the one-way ANOVA tests are provided (*, P<0.05; **, P<0.01; and ns, no significant difference). Different letters indicate significant differences at the P<0.05 level based on Fisher’s Least Significant Difference (LSD) post hoc tests.
5. 신품종 토종꿀벌 (A. cerana F. var. Baekdubeol) 백두벌 일벌 개체당 수밀력 검정
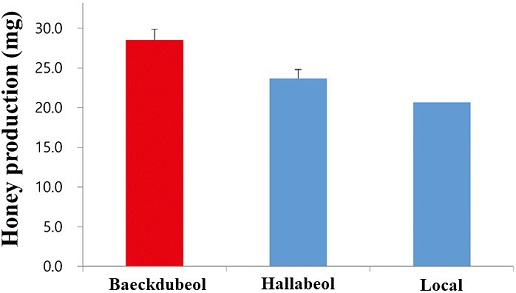
일벌개체당 수밀력 비교는 보급 중인 한라벌 (R)과 신규육성 품종인 백두벌 (RH)와 일반 토종꿀벌인 (Local)을 비교한 결과, 토종꿀벌 농가에서 관행적으로 사육하는 토종꿀벌의 일벌 개체당 벌꿀 수집량이 20.7 mg에 비하여 한라벌 (R)의 경우, 일벌 개체당 벌꿀 수집량이 23.7 mg으로 12.6% 수밀력이 우수한 것으로 확인되었으며, 백두벌 (RH)은 27.9 mg으로 가장 우수한 수밀력을 보이는 것으로 확인되었다 (Fig. 9). 따라서 향후 신품종 백두벌이 보급됨에 따라서 토종꿀벌 사육농가의 벌꿀 생산량 증대를 통해 농가 벌꿀판매 소득도 증대될 것으로 기대된다.
적 요
낭충봉아부패병에 대한 저항성을 보유하고 있는 신품종 토종꿀벌 (백두벌)의 외형적 특징을 기존 육성 신품종 토종꿀벌 (R, H)과 농가에서 관행적으로 사육하는 토종꿀벌과 비교한 결과, 낭충봉아부패병 저항성 신품종 (백두벌)의 모계 (R)와 부계 (H)는 전체적인 체장, 배길이, 머리 폭, 날개의 길이 및 폭, 대퇴골의 길이가 긴 특징을 가지고 있으며, 상대적으로 안테나의 길이는 짧은 것이 특징이다. 그리고 교배종인 백두벌 (RH)은 안테나길이가 기존 토종꿀벌과 비슷하고 대퇴골 길이는 가장 길고 경골과 발목 폭 및 길이가 유의적으로 큰 특징을 가지고 있다. 질병저항성을 판단할 수 있는 청소행동 특성을 비교하기 위하여 pin kill test와 인공적인 SBV 감염을 통한 죽은 번데기 제거능 비교 결과, Pin kill test에서는 48시간 후 모계 (R) 97.3%, 부계 (H) 98.9%로 일반 토종꿀벌보다 8%와 9% 우수하고 백두벌 (RH)은 99.3%로 가장 우수하였다. 그리고 SBV 감염을 통해 죽은 유충 제거능력은 모계 (R) 95.7%, 부계 (H)는 94.3%로 일반 토종꿀벌 대비 31.8%와 30.4% 우수하였으며 백두벌 (RH)은 99%의 제거능력이 확인되었다. 또한 낭충봉아부패병바이럿을 유충에 인공감염시험 결과, 모계 (R)는 46.6%, 부계 (H)는 53.2%가 생존하였고 백두벌은 70%가 생존하였다. 이는 낭충봉아부패병을 감염시키지 않은 일반본군의 생존율 (82.5%)과 큰 차이가 없었다. 낭충봉아부패병 인공감염 시험 봉군의 발육 시험 결과, 약 80일 동안 모계 (R)와 부계 (H)는 각각 10,000∼10,500마리의 일벌 수가 확인되었으며, 백두벌 (RH)은 12,000마리로 가장 우수하였다. 또한 벌꿀 저장능력도 우수하였으며 일벌 개체당 벌꿀 수밀력은 모계 (R)가 23.7 mg, 일반 토종꿀벌이 20.7 mg이었으며 백두벌은 일벌 개체당 벌꿀 수집량이 27.9 mg으로 수밀력이 가장 우수한 것으로 확인되었다. 이와 같이 백두벌은 토종꿀벌 집단 폐사를 유발한 낭충봉아부패병에 강한 저항성을 가지고 있으며 이와 더불어 벌꿀 수집능력도 기존 품종 및 농가관행사육 토종꿀벌 대비 우수한 것으로 확인되었다.
Acknowledgments
본 연구는 농촌진흥청 차세대바이오그린사업 PJ013264032020 과제의 재원으로 연구한 결과입니다.
References
-
Arathi, H. S., I. Burns and M. Spivak. 2000. Ethology of hygienic behaviour in the honey bee Apis mellifera L. (Hymenoptera: Apidae): behavioural repertoire of hygienic bees. Ethology 106: 365-379.
[https://doi.org/10.1046/j.1439-0310.2000.00556.x]

-
Bailey, L., A. J. Gibbs and R. D. Woods. 1964. Sacbrood virus of the larval honey bee (Apis mellifera Linnaeus). Virology 23(3): 425-429.
[https://doi.org/10.1016/0042-6822(64)90266-1]

-
Baker, A. C. and D. C. Schroeder. 2008. The use of RNA-dependent RNA polymerase for the taxonomic assignment of Picorna-like viruses (order Picornavirales) infecting Apis mellifera L. populations. Virol. J. 5: 10.
[https://doi.org/10.1186/1743-422X-5-10]

-
Brutscher, L. M., K. F. Daughenbaugh and M. L. Flenniken. 2017. Virus and dsRNA-triggered transcriptional responses reveal key components of honey bee antiviral defense. Sci. Rep. 7: 6448.
[https://doi.org/10.1038/s41598-017-06623-z]

-
Chen, Y., Y. Zhao, J. Hammond, H. T. Hsu, J. Evans and M. Feldlaufer. 2004. Multiple virus infections in the honey bee and genome divergence of honey bee viruses. J. Invertebr. Pathol. 87: 84-93.
[https://doi.org/10.1016/j.jip.2004.07.005]

-
Choi, Y. S., E. J. Kang, H. G. Park and F. Olga. 2020. Morphological and behavioral characteristics of Hallabeol (Apis cerana F. var. Hallabeol) (Hymenoptera: Apidae) Resistant to Sacbrood Virus Disease. Korean J. Apic. 35: 1-8.
[https://doi.org/10.17519/apiculture.2020.04.35.1.1]

- Choi, Y. S., M. Y. Lee, I. P. Hong, N. S. Kim, H. K. Kim, K. G. Lee and M. L. Lee. 2010. Occurrence of Sacbrood virus in Korean apiaries from Apis cerana (Hymenoptera: Apidae). Korean J. Apic. 25: 187-191.
-
Corlett, R. T. 2004. Flower visitors and pollination in the Oriental (Indomalayan) Region. Biological Reviews 79(3): 497-532.
[https://doi.org/10.1017/S1464793103006341]

-
Cremer, S., C. D. Pull and M. A. Fürst. 2018. Social immunity: Emergence and evolution of colony-level disease protection. Annu. Rev. Entomol. 63: 105-123.
[https://doi.org/10.1146/annurev-ento-020117-043110]

-
Cremer, S. and M. Sixt. 2009. Analogies in the evolution of individual and social immunity. Phil. Trans. R. Soc. B 364: 129-142.
[https://doi.org/10.1098/rstb.2008.0166]

-
Evans, J. D. 2004 Transcriptional immune responses by honey bee larvae during invasion by the bacterial pathogen, Paenibacillus larvae. J. Invertebr. Pathol. 85: 105-111.
[https://doi.org/10.1016/j.jip.2004.02.004]

-
Evans, J. D. and J. S. Pettis. 2005. Colony level impacts of immune responsiveness in honey bees, Apis mellifera. Evolution 59: 2270-2274.
[https://doi.org/10.1111/j.0014-3820.2005.tb00935.x]

-
Evans, J. D. and M. Spivak. 2010. Socialized medicine: individual and communal disease barriers in honey bees. J. Invertebr. Pathol. 103: 62-72.
[https://doi.org/10.1016/j.jip.2009.06.019]

-
Evans, J. D., K. Aronstein, Y. P. Chen, C. Hetru, J. L. Imler, H. Jiang and D. Hultmark. 2006. Immune pathways and defence mechanisms in honey bees Apis mellifera. Insect Mol. Biol. 15: 645-656.
[https://doi.org/10.1111/j.1365-2583.2006.00682.x]

-
Gilliam, M., S. Tarber and G. V. Richardson. 1983. Hygienic behavior of honey bees in relation to Chalkbrood disease. Apidologie 14: 29-39.
[https://doi.org/10.1051/apido:19830103]

-
Jung, C. and S. K. Cho. 2015. Relationship between honeybee population and honey production in Korea. Korean J. Apic. 30: 7-12.
[https://doi.org/10.17519/apiculture.2015.04.30.1.7]

-
Milne Jr, C. P. 1985. Estimates of the heritabilities of and genetic correlation between two components of honey bee (Hymenoptera: Apidae) hygienic behavior: uncapping and removing. Ann. Entomol. Soc. Am. 78: 841-844.
[https://doi.org/10.1093/aesa/78.6.841]

-
Nguyen, N. T. B. and T. H. Le. 2013. Complete genome sequence of sacbrood virus strain SBM2, isolated from the honeybee Apis cerana in Vietnam. Genome Announcements, 1(1).
[https://doi.org/10.1128/genomeA.00076-12]

-
Palacio, M. A., E. E. Figini, S. R. Ruffinengo, E. M. Rodriguez, M. L. del Hoyo and E. L. Bedascarrasbure. 2000. Changes in a population of Apis mellifera L. selected for hygienic behaviour and its relation to brood disease tolerance. Apidologie 31: 471-478.
[https://doi.org/10.1051/apido:2000139]

-
Palmer, K. A. and B. P. Oldroyd. 2003. Evidence for intra-colonial genetic variance in resistance to American foulbrood of honey bees (Apis mellifera): further support for the parasite/pathogen hypothesis for the evolution of polyandry. Naturwissenschaften 90: 265-268.
[https://doi.org/10.1007/s00114-003-0418-3]

-
Rothenbuhler, W. C. 1964. Behavior genetics of nest cleaning in honey bees. IV. Responses of F1 and backcross generations to disease-killedblood. Am. Zool. 4: 111-123.
[https://doi.org/10.1093/icb/4.2.111]

-
Ruttner, F. 1988. Biogeography and taxonomy of honeybees Springer. Springer Science & Business Media, Berlin, Germany.
[https://doi.org/10.1007/978-3-642-72649-1]

-
Shan, L., W. Liuhao, G. Jun, T. Yujie, C. Yanping, W. Jie and L. Jilian. 2017. Chinese Sacbrood virus infection in Asian honey bees (Apis cerana cerana) and host immune responses to the virus infection. J. Invertebr. Pathol. 150: 63-69.
[https://doi.org/10.1016/j.jip.2017.09.006]

-
Simone-Finstrom, M. 2017. Social immunity and the superorganism: Behavioral defenses protecting honey bee colonies from pathogens and parasites. Bee Wld. 94: 21-29.
[https://doi.org/10.1080/0005772X.2017.1307800]

-
Siva-Jothy, M. T., Y. Moret and J. Rolff. 2005. Insect immunity: an evolutionary ecology perspective. Adv. In Insect Phys. 32: 1-48.
[https://doi.org/10.1016/S0065-2806(05)32001-7]

-
Spivak, M. and M. Gilliam. 1998. Hygienic behaviour of honey bees and its application for control of brood diseases and Varroa: Part II. Studies on hygienic behaviour since the Rothenbuhler era. Bee Wld. 79: 169-186.
[https://doi.org/10.1080/0005772X.1998.11099408]

-
Spivak, M. and G. S. Reuter. 2001. Resistance to American foulbrood disease by honey bee colonies Apis mellifera bred for hygienic behavior. Apidologie 32: 555-565.
[https://doi.org/10.1051/apido:2001103]

-
Tarpy, D. R. and D. I. Nielsen. 2002. Sampling error, effective paternity, and estimating the genetic structure of honey bee colonies (Hymenoptera: Apidae). Ann. Entomol. Soc. Am. 95: 513-528.
[https://doi.org/10.1603/0013-8746(2002)095[0513:SEEPAE]2.0.CO;2]

-
Theisen-Jones, H. and K. Bienefeld. 2016. The Asian honey bee (Apis cerana) is significantly in decline. Bee World 93(4): 90-97.
[https://doi.org/10.1080/0005772X.2017.1284973]

-
Weinstock, G. M., G. E. Robinson, R. A. Gibbs, G. M. Weinstock, G. M. Weinstock, G. E. Robinson, K. C. Worley, J. D. Evans, R. Maleszka, H. M. Robertson, D. B. Weaver, M. Beye, P. Bork, C. G. Elsik, K. Hartfelder, G. J. Hunt, E. M. Zdobnov, G. V. Amdam, M. M. G. Bitondi, A. M. Collins, A. S. Cristino, H. M. G. Lattorff and H. Carlos. 2006. Insights into social insects from the genome of the honeybee Apis mellifera. Nature 443: 931-949.
[https://doi.org/10.1038/nature05260]

-
Xu, P., M. Shi and X. X. Chen. 2009. Antimicrobial peptide evolution in the Asiatic honey bee Apis cerana. PLoS One 4: e4239.
[https://doi.org/10.1371/journal.pone.0004239]