서양종 꿀벌 (Apis mellifera L.) 수벌번데기 가수분해 단백질의 특성
Abstract
This study was conducted to confirm the availability of low-molecular proteins produced by hydrolysis of protein from Drone pupa of Apis mellifera, which is highly likely to be used as food for diet or as protein supplements for muscle formation. To hydrolysis the protein in Drone pupa, a proteinase that is available in three types of food, Alcalase, Neutrase and Flavourzyme, was used. The yield of low-molecular proteins hydrolysed by each enzyme was A+N>A+F>A>N>F>C, and overall the yield of the low-molecular protein was improved by 128 to 165% over the control. The level of hydrolysis increased sharply until the first two hours, and the concentration of available amino acid group after 12 to 24 hours of hydrolysis was the highest with 4.15 mg/mL processing of F+N. Protein patterns were confirmed through SDS-PAGE at 14% concentration, and analysis of Branched Chain Amino Acid content was confirmed to have increased rapidly, and the treatment of F+N was particularly high. In conclusion, the low-molecular protein produced by hydrolysis of protein from Drone pupa was found to be highly likely to be used as a protein product consumed for diet purposes, such as food for diet or muscle formation.
Keywords:
Drone pupa, Hydrolysis, Branched Chain Amino Acid (BCAA), Low molecular protein서 론
인간에게 식품으로써 우수한 영양원을 공급해주는 소재들 중 하나로 곤충을 들 수 있으며, 유럽에서는 곤충이 단백질 및 지방산 등의 공급원으로 가장 인기 있는 식품원료들 중 하나이다 (Rumpold and Schlüter, 2013). 이러한 곤충을 식품으로 이용하는 방법으로는 주로 조리 및 가공을 거쳐서 섭취하지만 일부 나라에서는 생식을 하는 경우도 있다 (Lee et al., 2017; Yu et al., 2017; Cho et al., 2019). 국내·외적으로 곤충에 대한 일반적인 인식은 혐오스럽다고 느끼는 경우가 많아서 곤충을 먹는 것은 원시적인 형태로 인식하기도 한다. 이러한 부정적인 인식을 감소시키기 위하여 곤충의 형태를 유지하고 있지 않게 가공하거나 단백질, 지방산, 키틴 등을 분리하여 식품 첨가물로 이용하여 곤충식품 시장을 확대시켜 나가고 있다 (van der Spiegel et al., 2013; Caparros Megido et al., 2016). 또한 곤충을 식용으로 사용할 때 유용 단백질의 섭취가 가능하여 인류의 식품다양성을 확대할 수 있다 (Zielińska et al., 2017). 인류는 지난 세월 동안 인간에게 유익한 항고혈압, 항염증 또는 염증감소 등의 기능성이 있는 성분을 주로 유제품과 유가공 제품, 콩이나 쌀 등과 같은 식물성 식품에 의존하여 왔다 (Gobbetti et al., 2002; Saiga et al., 2003; Torres-Fuentes et al., 2011; Zhang et al., 2012).
서양종 꿀벌 (Apis mellifera L.)의 수벌번데기는 양봉농가의 입장에서는 생산가치가 전혀 없고 생산비를 절감하기 위하여 제거하여야 하는 것으로 여겨지고 있으며, 국내에서 이를 대상으로 한 식품원료로써의 이용가치에 대한 연구는 매우 미흡한 실정이다. 그러나 최근 수벌번데기가 식용가능 곤충으로 대두되면서 국내 연구진들에 의해 수벌번데기의 영양학적 가치에 대한 연구가 수행되었다. 그 결과로 동결건조물의 단백질 함량이 43~47%이고 (Dietz, 1975; Choi et al., 2009), 식품으로써 요구되는 필수 3대영양소를 고르게 가지고 있으며, 환자식으로의 이용 가능성을 보고 하였다 (Hocking and Matsumura, 1960; Dietz, 1975; Burgett, 1990; Thoenes and Schmidt, 1990; Choi et al., 2009; Kim and Jung, 2013; Kim et al., 2016; Kim et al., 2018a). 또한 수벌번데기를 식품원료로 사용하여 가공용 소시지를 제조하고 각종 식품의 원료 및 첨가물로의 이용가치를 구명하기도 하였다 (Kang et al., 2018). 이와 더불어 수벌번데기의 식중독 세균과 곰팡이 독소에 대한 안전성 평가 결과, 각종 유해 미생물이 검출되지 않아 식품원료로의 사용이 가능한 것으로 확인되었으며 (Kim et al., 2018b), 수벌번데기를 식품으로 섭취하여도 알러지가 발생되지 않는다는 장점도 확인되었다 (Hocking and Matsumura, 1960). 한편, 국외에서는 꿀벌을 대상으로 식품원료로의 사용 가능성 검토에 대한 연구가 새로운 분야로 인식되어 봉군의 발육 및 양봉산물의 생산성에 영향을 미치지 않는 범위에서 인간이 이용할 수 있는 수벌유충의 생산, 양양적 가치, 맛 등에 대한 생산·제조방법을 제시하면서 꿀벌의 미래 식량원으로써의 가치를 발표한 사례도 있다 (Jensen et al., 2016).
수벌번데기를 단순한 식품원료로만 사용하는 것을 넘어서 기능성 (생리활성, 고영양, 특수목적식 등)을 기반으로 한 식품원료로의 개발이 필요하다. 이러한 기술들 중 한 예로 효소에 의한 가수분해단백질을 식품의 원료로 사용 가능할 것으로 예상된다. 최근에는 약제를 대신하여 식품으로 질병을 치료 또는 예방하려는 시도가 많이 이루어지고 있다. 그에 따라 각종 식품 펩타이드의 이용에 대한 관심이 증가하고 있으며, 식품에서 가수분해된 단백질이 항균, 항암, 성장 촉진, 항산화 효과 및 고혈압, 당뇨에 효과적이라는 보고도 있다 (Li-Chan, 2015). 곤충에 효소를 작용시켜 가수분해하면 식품 첨가물로 사용이 용이하다는 보고도 있으며, 누에번데기, 목화잎벌레 유충, 메뚜기 등을 효소가수분해 한 경우 모두 우수한 항산화 효과가 있는 것이 확인되었다 (Vercruysse et al., 2009; Tao et al., 2017; Zielińska et al., 2017).
따라서 본 연구에서는 식품원료로써 우수한 가치를 가지고 있는 수벌번데기의 이용 범위를 확대하고자 식품용 단백질 가수분해효소로 가수분해를 하고 그 특성을 조사하고, 기능성 식품원료로의 이용 가능성을 제시하고자 하였다.
재료 및 방법
1. 시험재료
시험에 사용된 서양종 꿀벌 (Apis mellifera L.) 수벌번데기는 전라남도농업기술원 곤충잠업연구소에서 사육중인 서양종 꿀벌 봉군을 이용하여 산란 후 16∼20일령 사이의 수벌번데기를 수벌번데기 생산 전용 벌집 (수벌소초광)을 이용하여 2016년 4월부터 9월초까지 생산하였으며, 생산된 수벌번데기 시료는 초저온 냉동고에 보관한 후 Freeze Dryer (FD8512P, 일신바이오)를 이용하여 동결건조 후 가정용 분쇄기로 분쇄하여 시험분석에 사용하였다. Alcalase, Áavourzyme 및 neutrase 단백질 분해효소는 Novo사 제품을 대종상사 (Seoul, Korea)로부터 구입하였다. 가수분해도 측정을 위해 사용된 2,4,6-trinitrobenzene sulfonic acid (TNBS)는 G-Biosciences Co. (St. Louis, MO, USA)로부터 구입하였으며, 그 밖의 분석용 시약과 유기용매는 Sigma-Aldrich Co. (St. Louis, MO, USA)로부터 구입하여 사용하였다.
2. 수벌번데기 단백질 가수분해물 제조
동결건조한 수벌번데기 동결건조분말을 10 mM sodium phosphate buffer (pH 7.0)에 용해하여 4% (w/v)의 기질용액으로 제조하고 90°C에서 20분 동안 항온수조에서 자가 효소를 불활성화 시켰다. 식품용 단백질 가수분해 효소인 alcalase (Alc), Áavourzyme (Fla), neutrase (Neu) 3종을 각각 단일로 이용하거나 alcase+Áavourzyme (Alc+Fla), alcase+neutrase (Alc+Neu), flavourzyme+neutrase (Fla+Neu)의 조합으로 각각 50 : 50으로 혼합하여 총 6개 처리구로 구성하였으며, 각 효소는 기질용액의 1% (w/w)가 되도록 첨가하여 55°C, 100 rpm에서 0~24시간 동안 가수분해하였고, 가수분해가 종료되면 90°C에서 20분간 가열하여 효소를 불활성화 시켰다. 실온에서 방랭한 후 가수분해물을 13,000×g에서 20분 동안 원심분리하여 상등액을 취하였으며, 얻어진 상등액을 다시 NO. 2 filter paper로 여과한 여액을 시험에 이용하였다. 상등액은 저분자 펩타이드의 분리를 위해서 membrane filter (Amicon Ultra-15, EMD Milipore Corporation, Billerica, MA, USA)를 이용하여 2시간 동안 원심분리 (5,000×g)함으로써 최종적으로 분자량 3 kDa 이하의 단백가수분해물을 얻었다. 이 3 kDa 이하의 단백가수분해물은 동결건조하여 최종 수율을 산출하였다.
3. 가수분해도 측정
TNBS (2,4,6-trinitrobenzene sulfonic acid) 방법 (G-Biosciences Co., New york, USA)을 이용하여 효소처리 시간에 따른 수벌번데기 단백질가수분해물의 가수분해도를 측정하였다. 10 mM sodium bicarbonate (pH 8.5) 990 μL와 1% TNBS 10 μL를 혼합 (v/v)하여 0.01% TNBS를 제조하고, TNBS 50 μL와 경시적으로 취한 반응혼합액 100 μL를 섞어 37°C에서 2시간 반응시킨 후, 반응을 정지시키기 위해 10% sodium dodecylsulfate (10% SDS)와 1 N hydrogen chloride (1 N HCl)를 첨가시켰다. 그 후 micro-plate spectrophotometer (BioTek Instruments Inc., Winooski, VT, USA)를 이용하여 335 nm에서 흡광도를 측정하였다. 표준용액은 L-tyrosin을 0, 0.015, 0.03, 0.06, 0.12, 0.24 mM 농도로 준비하여 표준곡선을 작성하였으며, tyrosine 함량으로 환산한 후 각 시료의 available amino group 농도를 산출하였다.
4. SDS-PAGE
각 효소별 수벌번데기 단백질 가수분해물의 특성을 확인하기 위하여 sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE)를 이용하여 가수분해물의 단백질 패턴을 측정하였다. SDS-PAGE는 14% gel을 사용하였으며, 각 가수분해물은 원심분리 (3,000×g, 4°C, 10분) 후 얻은 상등액을 동결건조하여 분말화 한 것을 50 μL의 PBS로 용해시킨 다음, 각각 10 μL를 gel에 loading하여 80 V에서 5시간 동안 전기영동 한 후, coomassie brilliant blue를 사용하여 염색하고, 10% acetic acid가 함유된 30% methanol을 이용하여 탈색시켰다. 단백질 패턴의 분석은 Digital Gel Documentation System (GDS200D)을 이용하여 polyacrylamide gel을 이미지로 영상화시켰다. 이때 molecular weight marker는 Bio-Rad Laboratories (Carlsbad, CA, USA)의 제품을 이용하였다.
5. 가수분해물 수율
수벌번데기 단백질 수율은 원료량에 대하여 가수분해 후 잔사량의 건조 중량을 뺀 값을 백분율로 나타내었다. 그 계산식은 다음과 같다.
6. 가수분해물의 유리아미노산 분석
분말 상태의 시료 0.5 g에 추출용매 (0.1% trifluoroacetic acid) 9.5 mL를 가하여 1시간 동안 초음파추출을 실시하였다. 1차로 원심분리 (10,000 rpm, 4°C, 3 min)를 실시한 추출액을 0.45 μm syringe filter로 여과하여 분석에 사용하였으며, 함량에 따라 희석이 필요한 경우에는 증류수를 사용하여 적정 비율로 희석하였다. Amino acid 분석에는 LC-30A (Shimadzu, Japan) 액체크로마토그래피와 연동된 LCMS-8050 (Shimadzu, Tokyo, Japan) 삼중사중극자 질량분석기를 사용하였다. Positive electro-spray ionization (+ESI) 장치로 시료를 이온화시킨 후, multiple reaction monitoring (MRM) mode에서 분석을 실시하였다. Column으로 Kinetex C18 (2.1×150 mm, 2.6 μm, Phenomenex)를 사용하였으며, 시료 주입량은 2 μL, column oven은 40°C를 유지시켰다. 이동상으로 5 mM ammonium acetate와 0.1% formic acid가 혼합된 water (A)와 methanol (B)을 사용하여 초기 0% B에서 시작하여 95% B까지 순차적으로 변화시킨 후 다시 0% B로 낮춰서 25분간 분석을 실시하였으며, 유속은 0.2 mL/min으로 유지하였다.
7. 자료의 통계처리
실험에서 얻어진 모든 자료들은 평균과 (준편차로 나타내었으며, SPSS (SPSS Version 20.0 Inc. U.S.A.)를 사용하여 검정하였다. One-way analysis of variance (ANOVA)를 실시 (유의수준: p<0.05)하여 유의성이 관찰되면 control group에 대한 각 시험군 간의 유의성을 확인하기 위해 Duncan̓s multiple range test를 실시하였다 (유의 수준: p<0.05).
결과 및 고찰
1. 수벌번데기 가수분해물의 수율
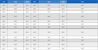
수벌번데기 동결건조분말에 다량 함유되어 있는 단백질을 식품용 단백질 분해효소로 처리하여 24시간 가수분해한 후 각 단백질 가수분해물의 생산효율을 비교하고자 전체 기질의 고형분 함량에 대하여 가수분해 종료 후에 수득한 고형분 무게를 측정하여 그 수율을 조사하였다 (Fig. 1). 그 결과 (Table 1), 효소처리군별 가수분해 단백질 수율 (%)은 Alc+Neu (3.66)>Alc+Fla (3.37)>Alc (3.36)>Neu (3.26)>Fla+Neu (3.18)>Fla (3.13)>control (1.38) 순이었고, 3 kDa 이하의 저분자단백질의 수율 (%)은 Alc (6.52)>Fla+Neu (5.59)>Alc+Fla (5.00)>Alc+Neu (4.83)>Neu (4.73)>Fla (4.71)>control (2.30) 순이었으며, 수벌번데기 동결건조분말은 가수분해를 했을 때 대조구에 비해 전반적으로 단백질 가수분해물의 수율이 128~165% 향상되는 것으로 조사되었다.

Freeze-dried powder of drone pupa hydrolyzed by enzymes. Control, Con; alcalase, Alc; neutrase, Neu; flavourzyme, Fla; alcalase+neutrase, Alc+Neu; alcalase+flavourzyme, Alc+Fla; and flavourzyme+neutrase, Fla+Neu.
2. 가수분해도
TNBS assay를 통한 각 효소 처리구별 수벌번데기의 경시적 단백질 가수분해도를 Fig. 2에 나타내었다. TNBS를 이용하는 방법은 유리형 amine기를 정량하여 유리아미노산의 함량을 측정하며, TNBS와 시료의 1차 amine기 간의 반응에 의해 발색이 유도되는 원리를 이용하여 그 흡광도를 측정함으로써 유리아미노산을 정량한다. 수벌번데기의 경시적인 단백질 가수분해도는 초기 2시간 경과시까지 급격하게 증가되었고, 8~12시간 경과 후 가수분해가 대부분 완료된 것으로 판단되었다. 또한 수벌번데기 단백질 가수분해도를 tyrosine 함량으로 환산한 결과, available amino group 농도 (mg/mL)는 Fla+Neu 처리군에서 4.15, Alc+Fla 처리군에서 3.76, Fla 처리군에서 3.68, Alc+Neu 처리군에서 3.21, Alc 처리군에서 3.11, 그리고 Neu 처리군에서 2.57로 측정되어 본 실험에서 설정한 처리군들 중 Fla+Neu 처리군에서 가장 높았다. Alcalase는 Bacillus licheniformis의 발효에 의해 생산된 효소이고, 펩티드 결합에 대해 넓은 특이성을 갖는 단백질을 가수분해 할 수 있으며, 하전되지 않은 큰 잔류물을 선호하는 endopeptidase인 반면, Áavourzyme은 아미노산 및 펩티드 둘 다를 생산할 수 있는 endo- 및 exopeptidase 혼합물이다 (Hrčková et al., 2002). 또한 neutrase는 Bacillus amyloliquefaciens에서 생산된 중성의 zinc metallo endopeptidase (Clapés et al., 1997; Zhou et al., 2013)이며, 내부 펩티드 결합을 무작위로 가수분해하고, 공촉매로서 아연금속과 역단백 분해반응에 의해 oligopeptide의 효소합성을 촉진한다. 쌀겨와 대두단백질에서 alcalase는 papain, trypsin, aminopeptidase, proteinsase 등과 가수분해 효과 비교시험에서 가장 우수한 결과를 보인 효소이고 (Ahmadifard et al., 2016), 염소젖 유단백질의 가수분해 효과가 가장 낮은 것으로 보고되어진 Áavourzyme (Shu et al., 2015)은, 쌀 단백질과 같은 식물단백질에서는 우수한 것으로 알려져 있다 (Gouveia et al., 2020). 그리고 neutrase는 명태의 단백질을 가수분해하는 효과가 우수하고, 가수분해산물의 항산화 효과를 향상시킨다는 보고도 있다 (Chuyi et al., 2018). 또한 이들 단백질 가수분해효소의 가수분해 정도가 높을수록 항산화 효과 등의 기능성이 우수한 것으로 알려져 있다 (Shu et al., 2015). 최근 식용곤충에 대한 혐오감을 극복하기 위해 곤충 단백질을 가공하여 식품에 이용하고자 식용곤충인 갈색거저리, 흰점박이꽃무지 및 쌍별귀뚜라미의 단백질을 효소처리하여 가수분해한 연구결과들이 보고된 바 있는데 (Lee et al., 2017; Yu et al., 2017; Cho et al., 2019), 이들 곤충단백질 가수분해시 alcalase, neutrase 및 Áavourzyme 효소를 처리했을 때 공통적으로 가수분해가 가장 활발히 진행되었다. 수벌번데기에서도 동일한 경향을 나타내었으며, 특히 Áavourzyme과 neutrase를 혼합처리하였을 때 가수분해가 가장 활발히 진행되는 것이 확인되었다. 그러나 기존에 식용곤충들을 대상으로 행해진 결과에 비해 수벌번데기의 효소처리 가수분해물의 농도가 다소 낮았는데, 이는 원료 자체의 단백질 함량의 차이로부터 기인된 것으로 사료된다.
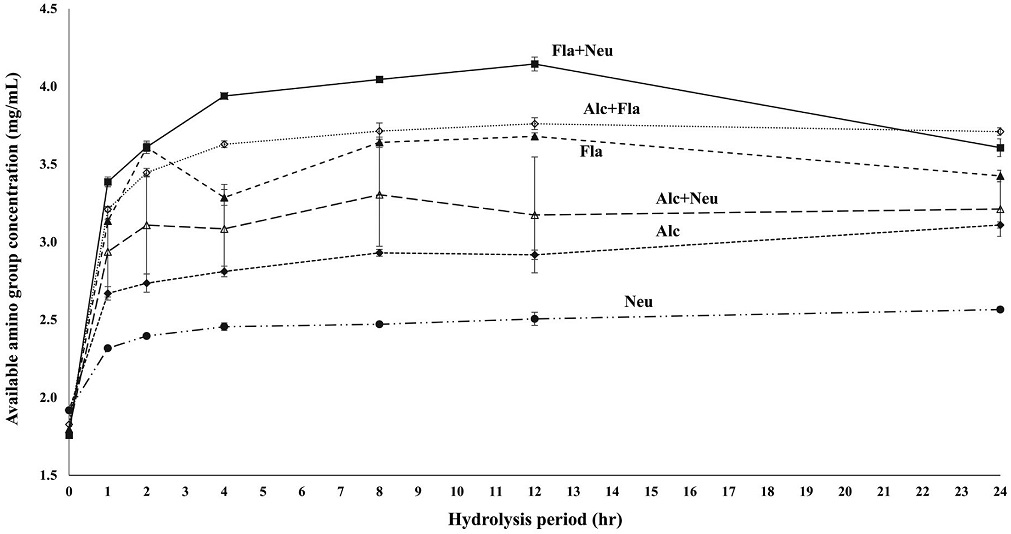
Value of hydrolyzed protein from drone pupa by proteinases treatment. Hydrolysis was carried out by enzymes such as alcalase (Alc), flavourzyme (Fla), neutrase (Neu), alcalase+flavourzyme (Alc+Fla), alcalase+neutrase (Alc+Neu), and flavourzyme+neutrase (Fla+Neu). Values represent mean observations of three replicates±standard deviations. Trials that do not share letters are significantly different (p<0.05).
3. SDS-PAGE
수벌번데기 단백질의 가수분해에 의해 저분자화 된 정도를 확인하기 위하여 14% SDS-PAGE 분석을 행하였다. 그 결과 (Fig. 3), 각각의 시료는 무처리군 (control)과 비교하여 Alc, Fla 및 Fla+Neu 처리군에서 고분자량의 밴드가 감소 또는 소실된 것으로 관찰되어 이 세 처리군에서 가수분해가 양호하게 진행되었음을 확인할 수 있었고, 상대적으로 Neu를 처리한 경우에는 가수분해도가 매우 낮았으며, Alc+Fla 처리군과 Alc+Neu 처리군의 경우에는 일부 단백질만이 가수분해 되는 것을 확인할 수 있었다.
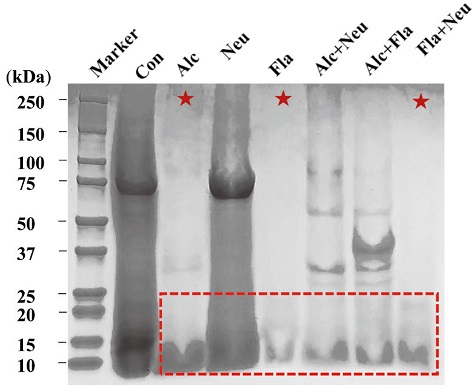
SDS-PAGE profiles of drone pupa protein hydrolysates by proteinase. Con lane, DPE without enzyme treatment; Alc lane, alcalase treated DPE; Neu, neutreated DPE; Fla, flavourzyme treated DPE; Alc+Neu, alcalase and neutrase treated DPE; Alc+Fla, alcalase and flavourzyme treated DPE and Fla+Neu, flavourzyme and neutrase treated DPE. All enzyme treated DPEs were incubated with each enzyme for for 24 hr at 55℃.
4. 수벌번데기 가수분해물의 유리아미노산
효소 처리별 수벌번데기 가수분해물을 대상으로 성분별 유리아미노산의 함량을 분석하였다 (Table 2). 분석된 총 유리아미노산 함량은 효소 무처리군 (control)과 비교했을 때, 본 연구에서 행한 여섯 군의 모든 효소처리군에서 2.78~4.68배 높았으며, 특히 Fla+Neu 처리군이 470.83 mg/g으로 가장 높았다. 수벌번데기를 가수분해했을 때, 유리아미노산들 중 특히 asparagine의 함량이 급격히 증가하였고, 특히 Fla와 Fla+Neu 처리군에서 각각 212.82 및 214.71 mg/g으로 asparagine의 함량이 가장 높았으며, 필수아미노산의 함량 또한 두 처리군이 127.88 및 129.79 mg/g으로 가장 높았고 (Fig. 4), 총 유리아미노산 함량의 약 27%를 차지하였다. 또한 필수지방산이면서 근육생성과 관련된 분지쇄아미노산인 leucine, isoleucine 및 valine의 함량이 급격히 증가되는 것을 확인할 수 있었으며 (Fig. 5), 특히 Fla와 Fla+Neu 처리군에서 그들의 함량이 가장 높았다. 이와 함께 지방연소 관련 아미노산인 alanine과 arginine 함량 (Fig. 6), 그리고 체력향상에 도움이 되는 아미노산으로 알려진 glutamine, isoleucine, arginine 및 valine의 함량 (Fig. 7) 모두가 두 처리군에서 각각 38.27, 42.75 mg/g과, 58.41, 60.53 mg/g으로 가장 높게 분석되었다. 이와 같은 결과는 수벌번데기 단백질 가수분해물이 운동을 목적으로 하는 헬스 및 다이어트용 식품개발 소재로 이용 가능성이 높음을 시사한다.
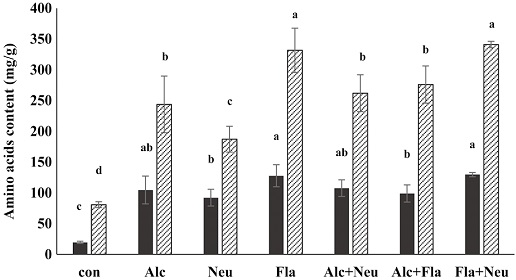
Amino acids [ (essential amino acids (■) and non-essential amino acids (▨)] concentration (mg/g) of drone pupa protein hydrolysates by proteinase. Con, DPE without enzyme treatment; Alc lane, alcalase treated DPE; Neu, neutreated DPE; Fla, flavourzyme treated DPE; Alc+Neu, alcalase and neutrase treated DPE; Alc+Fla, alcalase and flavourzyme treated DPE and Fla+Neu, flavourzyme and neutrase treated DPE. All enzyme treated DPEs were incubated with each enzyme for for 24 hr at 55℃. Values with different letters are significantly different at p<0.05 by Duncan's multiple range test.
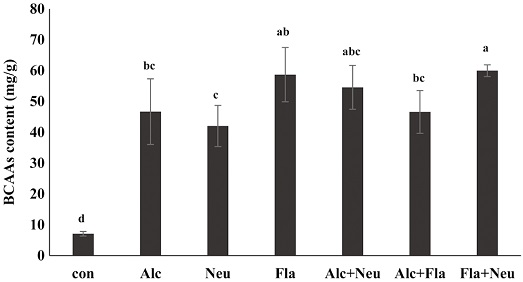
Branched-chain amino acid (BCAA) concentration (mg/g) of drone pupa protein hydrolysates by proteinase. Con, DPE without enzyme treatment; Alc, alcalase treated DPE; Neu, neutreated DPE; Fla, flavourzyme treated DPE; Alc+Neu, alcalase and neutrase treated DPE; Alc+Fla, alcalase and flavourzyme treated DPE and Fla+Neu, flavourzyme and neutrase treated DPE. All enzyme treated DPEs were incubated with each enzyme for for 24 hr at 55℃. Values with different letters are significantly different at p<0.05 by Duncan's multiple range test.
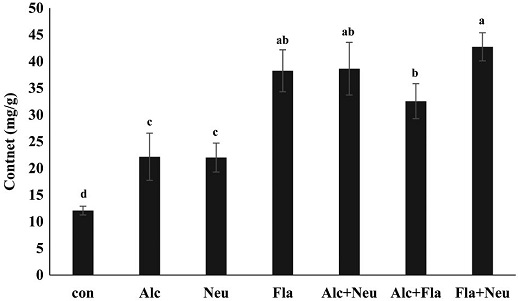
Fat-burning potential amino acid (alanine and arginine) concentration (mg/g) of drone pupa protein hydrolysates by proteinase. Con, DPE without enzyme treatment; Alc, alcalase treated DPE; Neu, neutreated DPE; Fla, flavourzyme treated DPE; Alc+Neu, alcalase and neutrase treated DPE; Alc+Fla, alcalase and flavourzyme treated DPE and Fla+Neu, flavourzyme and neutrase treated DPE. All enzyme treated DPEs were incubated with each enzyme for for 24 hr at 55℃. Values with different letters are significantly different at p<0.05 by Duncan's multiple range test.
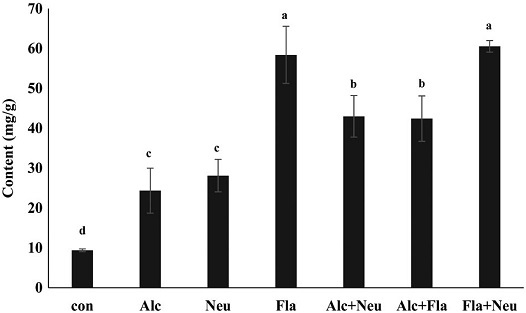
Physical improvement potential amino acid (glutamine, isoleucine, arginine, and valine) concentration (mg/g) of drone pupa protein hydrolysates by proteinase. Con, DPE without enzyme treatment; Alc, alcalase treated DPE; Neu, neutreated DPE; Fla, flavourzyme treated DPE; Alc+Neu, alcalase and neutrase treated DPE; Alc+Fla, alcalase and flavourzyme treated DPE and Fla+Neu, flavourzyme and neutrase treated DPE. All enzyme treated DPEs were incubated with each enzyme for for 24 hr at 55℃. Values with different letters are significantly different at p<0.05 by Duncan's multiple range test.
적 요
본 연구에서는 신규 양봉산물을 개발하여 벌꿀생산성 감소에 의한 양봉농가의 소득불안정을 해소하고 농가의 벌꿀 의존도를 분산시키기 위하여 수행되었다. 수벌번데기를 식품용 단백질 가수분해 효소를 이용한 가공을 통해, 수벌번데기를 양봉산물로써의 가치평가와 다양한 식품원료로의 이용 가능성을 검토하였다. 식품용 단백질 분해 효소인 alcalase (Alc), neutrase (Neu) 및 flavourzyme (Fla)을 이용하여 가수분해를 하지 않은 대조구를 포함하여 Alc, Neu, Fla, Alc+Neu (1 : 1), Alc+Fla (1 : 1) 및 Fla+Neu (1 : 1) 등 총 7개처리구를 설정하였으며, 0~24시간 동안 경시적으로 가수분해도를 조사한 결과, Fla+Neu (1 : 1)에 의한 가수분해도가 가장 높았으며, 시간에 따른 가수분해도를 tyrosine 함량 (mg/mL)으로 환산한 결과, available amino group 농도는 Fla+Neu 4.15, Alc+Fla 3.76, Fla 3.68로 측정되었다. 또한 효소처리별 수벌번데기 단백질 가수분해물 (Hydrolysate from Drone Pupa Protein, HDPP)의 유리아미노산을 분석한 결과, 근육생성과 관련된 BCAA (Branched chain amino acid)인 leucine, isoleucine 및 valine의 함량이 급격히 증가되는 것을 확인하였다. 수벌번데기는 높은 단백질 농도, 우수한 아미노산 및 지방산 등의 조성을 갖추고 있어 건강식을 비롯한 각종 식품원료로써 매우 중요하게 이용될 수 있을 것으로 생각되며, 식용곤충의 단백질 가공기술 적용으로 새로운 특수목적의 영양식 및 기능성식품 소재로써의 활용성을 기대할 만한 기초자료가 확보되었다고 판단된다. 이러한 수벌번데기를 특정 기능을 요구하는 여러 분야에서 각각의 기능성을 구명하고, 이를 기능성식품 원료로 이용하게 된다면 양봉농가의 소득향상에 기여할 수 있는 새로운 중요한 양봉산물로 자리매김할 수 있을 것으로 기대된다.
References
-
Ahmadifard, N., J. H. C. Murueta, A. Abedian-Kenari, A. Motamedzadegan and H. Jamali. 2016. Comparison the effect of three commercial enzymes for enzymatic hydrolysis of two substrates (rice bran protein concentrate and soy-been protein) with SDS-PAGE. J. Food Sci. Technol. 53: 1279-1284.
[https://doi.org/10.1007/s13197-015-2087-6]

- Burgett, M. 1990. Bakuti-a nepalese culinary preparation of giant honey bee brood. The Food Insect Newsletter 3: 1-2.
-
Caparros Megido, R., C. Gierts, C. Blecker, Y. Brostaux, É., Alabi, T. Haubruge and F. Francis. 2016. Consumer acceptance of insect-based alternative meat products in Western countries. Food Qual. Prefer. 52: 237-243.
[https://doi.org/10.1016/j.foodqual.2016.05.004]

- Cho, H. R., Y. J. Lee, J. E. Hong and S. O. Lee. 2019. Enzymatic preparation and antioxidant activities of protein hydrolysates from Gryllus bimaculatus. Korean J. Food Sci. Technol. 51: 473-479.
- Choi, Y. S., M. L. Lee, M. Y. Lee, H. K. Kim, K. G. Lee, J. H. Yeo and S. O. Woo. 2009. Management for high quality drone products. 한국양봉학회 학술대회 자료집, 23-23.
-
Clapés, P., E. Pera and J. L. Torres. 1997. Peptide bond formation by the industrial protease, neutrase, in organic media. Biotechnol. Lett. 19: 1023-1026.
[https://doi.org/10.1023/A:1018407619672]

- Dietz, A. 1975. Nutrition of the adult honey bee. The hive and the honey bee, 125-156.
-
Gobbetti, M., L. Stepaniak, M. De Angelis, A. Corsetti and R. Di Cagno. 2002. Latent bioactive peptides in milk proteins: proteolytic activation and significance in dairy processing. Crit. Rev. Food Sci. Nutr. 42: 223-239.
[https://doi.org/10.1080/10408690290825538]

-
Gouveia Gomes, M. H. and L. E. Kurozawa. 2020. Improvement of the functional and antioxidant properties of rice protein by enzymatic hydrolysis for the microencapsulation of linseed oil. J. Food Eng. 267: 1-10.
[https://doi.org/10.1016/j.jfoodeng.2019.109761]

-
Hocking, B. and F. Matsumura. 1960. Bee brood as food. Bee World 41: 113-120.
[https://doi.org/10.1080/0005772X.1960.11096777]

-
Hrčková, M., M. Rusńáková and J. Zemanovič. 2002. Enzymatic hydrolysis of defatted soy flour by three different proteases and their effect on the functional properties of resulting protein hydrolysates. Czech J. Food Sci. 20: 7-14.
[https://doi.org/10.17221/3503-CJFS]

-
Jensen, A. B., J. Evans, A. Jonas-Levi, O. Benjamin, I. Martinez, B. Dahle, N. Roos, A. Lecocq and K. Foley. 2016. Standard methods for Apis mellifera brood as human food. J. Apicult. Res. 58: 1-28.
[https://doi.org/10.1080/00218839.2016.1226606]

- Kang, S. M., A. R. Maeng, P. N. Seong, J. H. Kim, S. Cho, Y. Kim and Y. S. Choi. 2018. Effect of drone pupa meal added as replacement of sodium nitrite and vitamin C on physico-chemical quality characteristics of emulsion-type sausage. Korean J. Food & Nutr. 31: 802-810.
- Kim, H. and C. Jung. 2013. Nutritional characteristics of edible insects as potential food materials. Korean J. Apiculture 28: 1-8.
- Kim, J., S. Kim, S. Kang and Y. Kim. 2016. Physico-chemical characteristics of done pupa and major pollens. Paper presented at the The 31st Conferences of the Apicultural Society of Korea and Symposium.
-
Kim, S. G., S. O. Woo, K. W. Bang, H. R. Jang and S. M. Han. 2018a. Chemical composition of drone pupa of Apis mellifera and its nutritional evaluation. J. Apic. 33: 17-23.
[https://doi.org/10.17519/apiculture.2018.04.33.1.17]

-
Kim, S. G., S. O. Woo, H. R. Jang, H. M. Choi, H. J. Moon and S. M. Han. 2018b. Safety investigation on foodborne pathogens and mycotoxins in honeybee drone pupas. J. Food Hyg. Saf. 33: 399-403.
[https://doi.org/10.13103/JFHS.2018.33.5.399]

- Lee, H. S., R. H. Jeong, H. J. Song and S. O. Lee. 2017. Enzymatic preparation and antioxidant activities of protein hydrolysates from Protaetia brevitarsis Larvae. J. Korean Soc. Food Sci. Nutr. 46: 1164-1170.
-
Li-Chan, E. C. Y. 2015. Bioactive peptides and protein hydrolysates: research trends and challenges for application as nutraceuticals and functional food ingredients. Curr. Opin. Food Sci. 1: 28-37.
[https://doi.org/10.1016/j.cofs.2014.09.005]

-
Rumpold, B. A. and O. K. Schlüter. 2013. Nutritional composition and safety aspects of edible insects. Mo. Nutr. Food Res. 57: 802-823.
[https://doi.org/10.1002/mnfr.201200735]

-
Saiga, A., S. Tanabe and T. Nishimura. 2003. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment. J. Agric. Food Chem. 51: 3661-3667.
[https://doi.org/10.1021/jf021156g]

-
Shu, G., Q. Zhang, H. Chen, H. Wan and H. Li. 2015. Effect of five proteases including alcalase, flavourzyme, papain, proteinase K and trypsin on antioxidative activities of casein hydrolysate from goat milk. Acta Universitatis Cibiniensis. Series E: Food Technol. 19: 64-74.
[https://doi.org/10.1515/aucft-2015-0015]

-
Tao, M., C. Wang, D. Liao, H. Liu, Z. Zhao and Z. Zhao. 2017. Purification, modification and inhibition mechanism of angiotensin I-converting enzyme inhibitory peptide from silkworm pupa (Bombyx mori) protein hydrolysate. Process Biochem. 54: 172-179.
[https://doi.org/10.1016/j.procbio.2016.12.022]

- Thoenes, S. and J. Schmidt. 1990. A rapid, effective method of non-destructively removing honeybee larvae from combs. Am. Bee J. 130: 817.
-
Torres-Fuentes, C., M. Alaiz and J. Vioque. 2011. Affinity purification and characterisation of chelating peptides from chickpea protein hydrolysates. Food Chem. 129: 485-490.
[https://doi.org/10.1016/j.foodchem.2011.04.103]

-
van der Spiegel, M., M. Y. Noordam and H. J. van der Fels-Klerx. 2013. Safety of novel protein sources (insects, microalgae, seaweed, duckweed, and rapeseed) and legislative aspects for their application in food and feed production. Compr. Rev. Food Sci. Food Saf. 12: 662-678.
[https://doi.org/10.1111/1541-4337.12032]

-
Vercruysse, L., G. Smagghe, T. Beckers and J. V. Camp. 2009. Antioxidative and ACE inhibitory activities in enzymatic hydrolysates of the cotton leafworm, Spodoptera littoralis. Food Chem. 114: 38-43.
[https://doi.org/10.1016/j.foodchem.2008.09.011]

-
Yu, M. H., H. S. Lee, H. R. Cho and S. O. Lee. 2017. Enzymatic preparation and antioxidant activities of Protein hydrolysates from Tenebrio molitor larvae (Mealworm). J. Korean Soc. Food Sci. Nutr. 46: 435-441.
[https://doi.org/10.3746/jkfn.2017.46.4.435]

-
Zhang, M., T. H. Mu, Y. B. Wang and M. J. Sun. 2012. Evaluation of free radical-scavenging activities of sweet potato protein and its hydrolysates as affected by single and combination of enzyme systems. Int. J. Cood Sci. Tech. 47: 696-702.
[https://doi.org/10.1111/j.1365-2621.2011.02895.x]

-
Zhou, C., H. Ma, Q. Ding, L. Lin, x. Yu, L. Luo, C. Dai and A. E. G. A. Yagoub. 2013. Ultrasonic pretreatment of corn gluten meal proteins andneutrase: Effect on protein conformation and preparation ofACE (angiotensin converting enzyme) inhibitory peptides. Food and Bioproducts Processing 91: 665-671.
[https://doi.org/10.1016/j.fbp.2013.06.003]

-
Zieliñska, E., M. Kara and A. Jakubczyk. 2017. Antioxidant activity of predigested protein obtained from a range of farmed edibleinsects. Int. J. Cood Sci. Tech. 52: 306-312.
[https://doi.org/10.1111/ijfs.13282]