국산 아카시아꿀로부터 분리된 robinin의 UPLC 분석법 개발
Abstract
Robinia honey is known as the most popular honey among many different honeys produced in Korea, and has anti-oxidant, anti-inflammatory, and anti-microbial effects. However, in Korean food code, a marker compound and analytical method for quality control of Robinia honey have not been established. In this study, marker compound (robinin) was isolated from Robinia honey by chromatographic technique. Its UPLC (ultra performance liquid chromatography) method for quality control of Robinia honey was optimized using C18 column and isocratic elution of 14% MeCN/0.1%H3PO4 at 345 nm. The method was also validated by specificity, linearity, precision and accuracy tests. Base on the developed method, robinin in eight different honey types was quantified, and robinin content (0.6 mg/kg) was six times higher than that of other samples. These results were expected to be helpful for quality control of Robinia honey distributed in Korea.
Keywords:
Robinia honey, Robinin, RP-UPLC, Validation서 론
벌꿀 (honey)은 꿀벌이 꽃꿀, 수액 등 자연물을 채집하여 산, 효소 포함된 타액과 함께 벌집에 저장한 물질로 (식품의약품안전처, 2020; Burlando and Cornara, 2013), 프로폴리스 (propolis), 로열젤리 (royal jelly), 봉독 (bee venom), 밀랍 (bee wax), 벌화분 (bee pollen) 등이 포함된 국내 양봉산물 총 생산액에서 50% 이상 (2017년) 차지하는 양봉농가의 주요 소득원으로 알려져 있다 (정 등, 2019). 특히, 아까시나무 (Robinia pseudoacacia)의 화밀 (nectar)에서 유래된 아카시아꿀은 국내 벌꿀 총 생산량의 59.3% (2017년)를 차지하는 주요 벌꿀로, 맛과 향이 우수하여 소비자의 선호도가 높으며, 포도당, 과당과 같은 탄수화물을 비롯하여 칼륨, 마그네슘, 인 등과 같은 무기질, 프롤린, 트레오닌, 세린 등과 같은 아미노산이 함유되어 있다 (김 등, 2017; 정 등, 2019). 또한, 식물에서 유래된 항산화, 항염 활성을 가지는 페놀성 화합물과 강력한 헬리코박터균 (Helicobacter pylori) 억제물질인 terpene류 화합물 abscisic acid을 포함하고 있다 (Chang et al., 1988; Can et al., 2015; Kim et al., 2017). 아카시아꿀은 우리나라뿐만 아니라 중국, 헝가리 등에서 생산되고 있으며 수많은 벌꿀 중에서 아카시아꿀의 판별을 위하여 chlorogenic acid, ellagic acid, abscisic acid와 같은 식물유래 성분을 분석한 성분연구가 진행되고 있다 (Wang et al., 2014; Ciulu et al., 2016; Kim et al., 2017).
현재 우리나라는 국제식품규격위원회 (CODEX)와 유사한 벌꿀의 규격 기준으로 전화당 함량, 자당 함량, HMF (hydroxymethylfurfural) 등 10가지 항목에 대하여 식품공전에 고시되어 있다 (식품의약품안전처, 2020). 하지만 단일 밀원 벌꿀에 대한 규격 기준 및 지표물질은 고시되어 있지 않다. 이에 본 연구에서는 국내 주요 벌꿀이면서 소비자 기호도가 가장 높은 아카시아꿀에 대하여 밀원 유래 특이 물질을 분리하여 지표물질로 설정한 후 품질평가를 위한 분석법을 개발하고자 하였다.
재료 및 방법
1. 실험재료
실험에 사용한 아카시아꿀, 밤꿀, 피나무꿀, 때죽나무꿀, 옻나무꿀, 밀감나무꿀, 헛개나무꿀, 잡화꿀은 한국양봉농협 (Anseong, Korea) 및 온라인 마켓에서 식품공전의 벌꿀의 규격기준에 적합한 제품을 구입하였다.
2. 시약 및 기기
성분 분석에 사용한 methanol 및 methylene chloride는 SK chemicals (Seongnam, Korea)사, HPLC 등급의 acetonitrile은 Honeywell (Morris plains, NJ, USA)사, TLC plate (layer thickness 0.25 mm, 20×20 cm, Art. No. 5715) 및 silica gel (40~63 μm, Art. No. 9385)은 Merck (Darmstadt, Hessen, Germany)사, MCI gel은 Mitsubishi chemical (Tokyo, Japan)사에서 구입하였다. NMR (nuclear magnetic resonance) spectrometer는 JEOL (Tokyo, Japan)사의 JNM-ECZ500R을 사용하였고, NMR용 methanol-d4는 Cambridge Isotope Laboratories (Tewksbury, MA, USA)에서 구입하였다.
3. 지표성분 분리
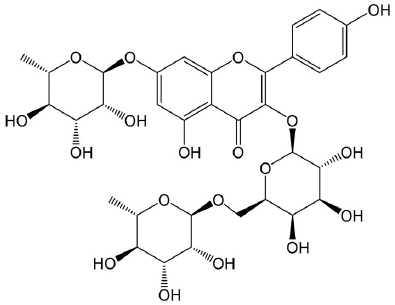
국산 아카시아꿀 15 kg을 증류수 45 L에 희석한 다음 MCI gel로 충진시킨 유리 컬럼 (10×60 cm)에 넣고 감압하에 시료를 용출시키고 증류수 5 L를 넣어 레진에 흡착된 당을 제거한 후, MeOH 20, 40, 60, 80, 100%를 각각 4 L씩 넣어 5개의 소분획 (AHF1-5)을 얻었다. AHF3에 대하여 이동상 CH2Cl2 : MeOH : H2O=7 : 3 : 1 (상층)로 silica gel 컬럼 (3×60 cm) 크로마토그래피를 실시한 다음 TLC로 확인하여 특이성분을 포함하는 AHF34분획에 대하여 MeOH : H2O=40 : 60로 ODS (octadecyl silane) 컬럼 (2×60 cm) 크로마토그래피를 실시하여 화합물 (robinin) 5 mg을 분리하였다.
Robinin – light yellow powder, 1H-NMR (500 MHz, CD3OD): δ 8.13 (2H, d, J=8.9 Hz, H-2′, 6′), 6.90 (2H, d, J=8.9 Hz, H-3′, 5′), 6.76 (1H, d, J=2.0 Hz, H-8), 6.49 (1H, d, J=2.0 Hz, H-6), 5.58 (1H, d, J=1.2 Hz, H-1′′′′), 5.12 (1H, d, J=7.7 Hz, H-1′′), 4.53 (1H, d, J=0.9 Hz, H-1′′′), 4.04 (1H, J=1.2 Hz, H-2′′′′), 3.74 (1H, dd, J=10.2, 6.9 Hz, H-6′′a), 3.41 (1H, dd, J=10.2, 6.9 Hz, H-6′′b), 3.28-3.85 (11H, m), 1.27 (3H, J=6.0 Hz, H-6′′′′), 1.19 (3H, J=6.3 Hz, H-6′′′); 13C-NMR (125 MHz, CD3OD): δ 180.0 (C-4), 163.9 (C-7), 163.0 (C-5), 162.1 (C-4′), 160.0 (C-2), 158.2 (C-9), 136.0 (C-3), 132.7 (C-2′, 6′), 122.5 (C-1′), 116.4 (C-3′, 5′), 107.4 (C-10), 105.3 (C-1′′), 102.1 (C-1′′′), 100.8 (C-6), 100.1 (C-1′′′′), 95.9 (C-8), 75.6 (C-5′′), 75.2 (C-3′′), 74.0 (C-4′′′), 73.8 (C-4′′′′), 73.1 (C-2′′), 72.4 (C-3′′′), 72.2 (C-4′′, 3′′′′), 71.8 (C-2′′′), 71.5 (C-2′′′′), 70.3 (C-5′′′′), 70.0 (C-5′′′), 67.5 (C-6′′), 18.2 (C-6′′′′), 18.1 (C-6′′′)
4. 분석시료 전처리
분석시료 전처리는 고체상추출 (solid phase extraction)법을 이용하였다. 벌꿀 10 g을 증류수 20 mL에 섞은 후 strong anion exchanger 레진 1 g이 충진된 컬럼 (Macherey-Nagel, Dueren, North rhine-Westphalia, Germany)에 넣고 감압하여 용출시킨 다음 증류수 10 mL로 세척하였다. 레진에 흡착된 성분은 MeOH 3 mL로 용출시켜 분석에 사용하였다.
5. UPLC (ultra performance liquid chromatography) 분석조건
성분분석은 photodiode array detector, binary pump, auto sampler가 장착된 Waters (Minneapolis, MN, USA) ACQUITY UPLC I-Class를 사용하였으며 UPLC 분석조건은 Table 1과 같다.
6. 분석법 밸리데이션
아카시아꿀의 robinin 분석법은 특이성 (specificity), 직선성 (linearity), 검출한계 (limit of detection, LOD), 정량한계 (limit of quantification, LOQ), 정밀성 (precision) 및 정확성 (accuracy)을 평가하여 검증하였다. 특이성은 robinin의 표준품과 시료 내 동일한 머무름 시간에 검출되는 피크의 UV 스펙트럼 일치여부로 확인하였다. 직선성은 robinin의 0.5~20 μg/mL 구간에서 상관계수 R2≥0.9에서 평가하였다. 검출한계와 정량한계는 신호 (signal)대 잡음 (noise)비가 각각 3:1과 10:1일 때의 농도로 산출하였다. 정밀성은 표준품의 일내 (intra-day) 및 일간 (inter-day) 농도 변화에 대하여 상대표준편차 (relative standard deviation, RSD)±10% 이내에서 평가하였다. 정확성은 분석시료에 3가지 농도의 표준품을 희석하여 회수율 (recovery)로 ±15% 범위에서 평가하였다.
결과 및 고찰
1. 지표성분에 대한 UPLC 분석법 개발
아카시아꿀로부터 지표성분을 분리하기 위하여 아카시아꿀을 증류수로 희석하여 MCI, silica, ODS gel 컬럼 크로마토그래피를 실시하였다. 그 결과, 연한 노란색의 화합물을 얻었으며 1H-NMR과 13C-NMR을 측정하여 문헌치 (Veitch et al., 2010)와 비교하여 robinin으로 동정하였다 (Fig. 1). Robinin은 aglycone인 kaempferol에 1개의 galactose와 2개의 rhamnose가 결합된 flavonol 배당체로 아까시나무 화밀뿐만 아니라 이탈리아 및 슬로바키아에서 생산된 아카시아꿀에 존재하는 물질로 Truchado et al. (2008)이 질량분석기 (tandem mass spectrometry)로 분석하여 보고하였으며 항산화 효과, 항염 효과를 가지는 것으로 알려져 있다 (Husain et al., 1987; Janeesh et al., 2014).
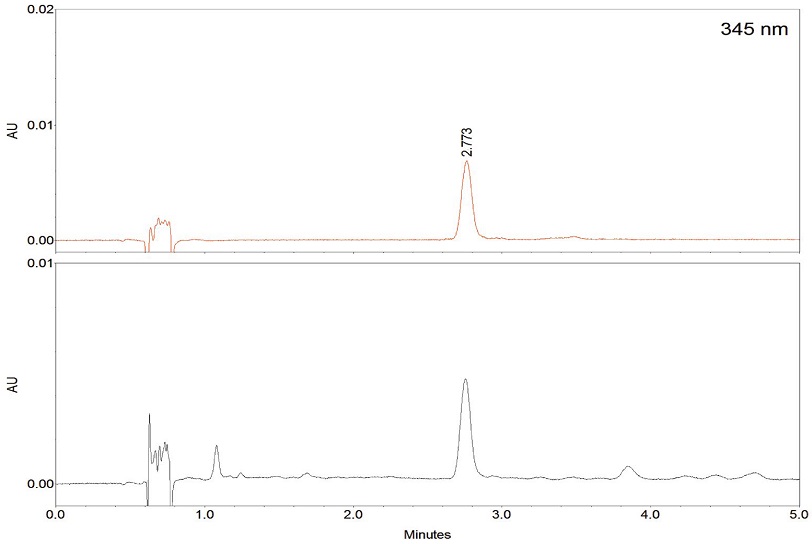
아카시아꿀의 품질관리를 위한 robinin 분석은 UPLC에 C18 컬럼을 장착한 다음 robinin peak의 분리도를 높이기 위하여 컬럼 온도변화 (30~50℃)와 acetonitrile, methanol 및 pH 변화를 준 완충액을 사용하여 조건을 탐색하였다 (data 미제시). 그 결과, Halo C18 (2.0 μm, 2.1×100 mm) 컬럼에 컬럼 온도 40℃, 0.1% 인산이 함유된 14% acetonitrile 등용매로 용출시켰을 때, 검출파장 345 nm에서 robinin peak를 양호하게 분리할 수 있었으며 3분 이내에 기존의 분석방법 (Truchado et al., 2008; Tsiklauri et al., 2011)보다 빠르게 검출할 수 있었다. 또한, 표준품과 동일한 시간에 검출되는 peak의 UV 스펙트럼 (200~400 nm)을 추출하여 비교하였을 때 동일한 UV 흡수를 나타내어 본 분석방법은 특이성을 가지는 것으로 확인되었다 (Fig. 2). 다음으로 최적화된 robinin 분석법의 타당성을 검증 (validation)하기 위하여 직선성 (linearity), 정밀성 (precision), 정확성 (accuracy) 평가를 실시하여 정량분석법을 확립하였다. Robinin의 5가지 농도 (0.5, 1, 5, 10, 20 μg/mL) 대하여 본 분석방법을 적용하였을 때, 상관계수 (R2)가 0.9998로 우수한 직선성을 나타내었고 robinin을 정량할 수 있는 회귀방정식 (Y=6993.2x-52.8)이 산출되었으며 검출한계와 정량한계는 각각 0.02, 0.07 μg/mL로 아카시아꿀에 robinin이 미량 함유되어 있어도 검출 및 정량이 가능하였다 (Table 2). 정밀성 평가는 1, 5, 10 μg/mL에 대하여 일간 및 일내 3회씩 반복 측정하여 실시하였으며 모든 농도에서 4% 이하의 상대표준편차를 나타내어 분석방법의 정밀성은 양호한 것으로 확인되었다 (Table 3). 정확성을 평가하는 회수율 (recovery)은 정밀성에서 사용했던 동일한 3가지 농도에 대하여 분석시료에 첨가하여 확인한 결과 102.1~108.3%로 양호한 정확성을 나타내었다 (Table 4).
2. 벌꿀 내 robinin의 함량 분석
확립된 분석법을 이용하여 국내 유통되는 아카시아꿀, 밤꿀, 피나무꿀, 때죽나무꿀, 옻나무꿀, 밀감나무꿀, 헛개나무꿀, 잡화꿀에 대하여 robinin의 정량분석 결과를 Table 5에 나타내었다. 아카시아꿀 (Robinia honey)에는 robinin이 0.6 mg/kg로 가장 높게 함유되어 있었으며 그 다음으로 때죽나무꿀 (Styrax honey)에 0.1 mg/kg의 함유량을 보였지만 밤꿀 (Castanea honey) 등 6종의 벌꿀에서는 검출되지 않았다. 때죽나무꿀에 robinin이 미량으로 검출된 것은 때죽나무꿀의 밀원식물인 때죽나무 (Styrax japoniccus Siebold & Zucc)의 개화기 (5~6월)가 아까시나무의 개화기 (5~6월)와 유사하여 꿀벌에 의해 아카시아꿀에 유입된 것으로 판단되며 추후 아까시나무 개화기와 유사한 밀원식물에 대한 성분연구가 진행되어야 할 것으로 생각된다.
현재 식품공전에 고시된 벌꿀의 규격기준만으로는 아카시아꿀과 같은 단일 밀원에 대한 판별을 할 수 없는 실정이며 국내 유통되는 아카시아꿀의 품질등급은 색상, 맛, 향기 등의 방법으로 이루어지고 있다. 본 연구의 결과 robinin은 특이적으로 타밀원 벌꿀에 비해 아카시아꿀에 6배 높게 함유된 것으로 확인되었으며 아카시아꿀의 품질평가 지표물질로 설정 가능함을 알 수 있었다. 또한 개발된 분석법은 아카시아꿀뿐만 아니라 타밀원 벌꿀에 대하여 robinin 분석이 가능한 것으로 평가되었다.
적 요
국내 주요 벌꿀인 아카시아꿀의 품질관리를 위하여 아카시아꿀로부터 robinin을 컬럼 크로마토그래피를 실시하여 분리 및 동정하였다. Robinin은 아카시아꿀의 밀원식물인 아까시나무 유래 특이물질로 UPLC를 이용하여 C18컬럼과 0.1% 인산이 함유된 14% acetonitrile 등용매 조건으로 검출파장 345 nm에서 robinin 분석법을 최적화하였다. 또한, 직선성, 검출한계, 정량한계, 정밀성, 정확성 평가를 통하여 분석법을 검증하였다. 개발된 분석법을 시중에 유통되는 아카시아꿀을 포함한 밀원별 벌꿀에 적용하여 분석한 결과, robinin 정량분석이 가능하였으며 아카시아꿀에 0.6 mg/kg로 타밀원 벌꿀보다 6배 높게 검출되어 가장 높은 함유량을 나타냈으며 지표성분으로 충분히 설정 가능함을 알 수 있었다. 본 연구결과를 통하여 개발된 분석방법은 국내 유통되는 국산 및 수입산 벌꿀의 품질관리를 위한 기초자료로 사용할 수 있을 것으로 판단되며 아카시아꿀의 품질관리 및 판별을 위한 분석법으로 적용할 수 있을 것으로 생각된다.
Acknowledgments
본 연구는 농촌진흥청 공동연구사업 (과제번호:PJ01408001)의 지원에 의해 수행된 결과입니다.
References
- 김세건, 홍인표, 우순옥, 장혜리, 장재선, 한상미. 2017. 천연꿀과 사양꿀의 성분분석. 한국식품영양학회지 30: 112-119.
- 식품의약품안전처. 2020. 식품공전. 식품의약품안전처. 청주, 대한민국. p. 263.
- 정민국, 허덕, 이용건, 이정민, 김태련. 2019. 양봉산업 실태조사연구. 한국농촌경제연구원. pp. 9-13.
-
Burlando, B. and L. Cornara. 2013. Honey in dermatology and skin care: a review. J. Cosmet. Dermatol. 12: 306-313.
[https://doi.org/10.1111/jocd.12058]

-
Can, Z., O. Yildiz, H. Sahin, E. Akyuz Turumtay, S. Silici and S. Kolayli. 2015. An investigation of Turkish honeys: Their physico-chemical properties, antioxidant capacities and phenolic profiles. Food Chem. 180: 133-141.
[https://doi.org/10.1016/j.foodchem.2015.02.024]

- Chang, H. G., M. K. Han and J. G. Kim. 1988. The chemical composition of Korean honey. Korean J. Food Sci. Technol. 20: 631-636.
-
Ciulu, M., N. Spano, M. I. Pilo and G. Sanna. 2016. Recent advances in the analysis of phenolic compounds in unifloral honeys. Molecules 21(4): 451.
[https://doi.org/10.3390/molecules21040451]

-
Husain, S. R., J. Cillard and P. Cillard. 1987. Hydroxyl radical scavenging activity of flavonoids. Phytochemistry 26: 2489-2491.
[https://doi.org/10.1016/S0031-9422(00)83860-1]

-
Janeesh, P. A., V. Sasikala, C. R. Dhanya and A. Abraham. 2014. Robinin modulates TLR/NF-κB signaling pathway in oxidized LDL induced human peripheral blood mononuclear cells. Int. Immunopharmacol. 18: 191-197.
[https://doi.org/10.1016/j.intimp.2013.11.023]

-
Kim, S. G., I. P. Hong, S. O. Woo, H. R. Jang, S. C. Pak and S. M. Han. 2017. Isolation of abscisic acid from Korean acacia honey with anti-Helicobacter pylori activity. Pharmacogn. Mag. 13: S170-S173.
[https://doi.org/10.4103/0973-1296.210166]

-
Truchado, P., F. Ferreres, L. Bortolotti, A. G. Sabatini and F. A. Tomás-Barberán. 2008. Nectar Flavonol rhamnosides are floral markers of acacia (Robinia pseudacacia) honey. J. Agric. Food Chem. 56: 8815-8824.
[https://doi.org/10.1021/jf801625t]

-
Tsiklauri, L., G. An, D. M. Ruszaj, M. Alaniya, E. Kemertelidze and M. E. Morris. 2011. Simultaneous determination of the flavonoids robinin and kaempferol in human breast cancer cells by liquid chromatography-tandem mass spectrometry. J. Pharm. Biomed. Anal. 55: 109-113.
[https://doi.org/10.1016/j.jpba.2010.12.021]

-
Veitch, N. C., P. C. Elliott, G. C. Kite and G. P. Lewis. 2010. Flavonoid glycosides of the black locust tree, Robinia pseudoacacia (Leguminosae). Phytochemistry 71: 479-86.
[https://doi.org/10.1016/j.phytochem.2009.10.024]

-
Wang, J., X. Xue, X. Du, N. Cheng, L. Chen, J. Zhao, J. Zheng and W. Cao. 2014. Identification of Acacia Honey Adulteration with Rape Honey Using Liquid Chromatography-Electrochemical Detection and Chemometrics. Food Anal. Methods 7: 2003-2012.
[https://doi.org/10.1007/s12161-014-9833-7]