봉독으로부터 Phospholipase A2 성분 분리
Abstract
PLA2 is the second highest content of bee venom components next to the melittin. However, unlike melittin has various pharmacological effects, PLA2 has been known as an allergen and thus most researches on PLA2 were focused on removing it or inhibiting its activity. Recently, PLA2 is effective in the treatment of liver damage and cancer cell suppression. PLA2 is in the spotlight as an active ingredient of pharmaceuticals. In this study, we developed a method for effective isolation of PLA2 from bee venom. Sep-pak cartridge column was used to separate pure PLA2 from the TFA / MeCN mobile phase after 6 steps including column stabilization and bee venom injection. The purity was 99.7±0.03% and the yield was 37.5±3.6%, proving that PLA2 of high purity can be effectively separated by this method. Purified PLA2 activity, as well as standard PLA2 activity had the growth inhibitions against hepatocellular carcinoma cells. This study will be useful for the research on physiological activity of PLA2 and the development of various pharmaceuticals containing PLA2.
Keywords:
Apis mellifera, Phospholipase A2, UPLC, Purity, Percent yield서 론
고대부터 봉독은 순수 천연물질이면서 강력한 항균, 항염증 효과를 갖고 있으며 부작용과 잔류에 대한 위험성이 적어 봉침요법으로 민간과 한방에서 관절염, 통풍 등의 질환에 사용되어 오고 있다(김 등, 2002; Kim et al., 2003). 서양종꿀벌(Apis mellifera L.) 일벌의 독인 봉독은 다양한 성분이 복합적으로 구성되어 있으며, 주 성분인 멜리틴(Melittin)은 펩타이드 성분으로 염증과 항균작용, 강력한 진통작용, 면역증강 등의 역할을 한다고 알려져 있다(Habermann and Reiz, 1965; Fennell et al., 1967; Piek, 1986; Liu et al., 2016). 건조 중량의 40% 이상을 차지하는 멜리틴 이외에도 히스타민(Histamin), 도파민(Dopamine)과 같은 활성아민, 히알루니다아제(Hyaluronidase), 포스포리파아제(Phospholipase A2: PLA2) 등의 효소성분 그리고 지질 등이 미량으로 존재한다(Piek, 1986). 우리나라에서는 봉독채집장치가 개발되기 전까지는 살아있는 벌을 이용하는 봉침요법으로 사람이나 가축에 직접 벌의 침을 쏘기 때문에 피부에 벌침이 박혀 내장이 분리되어 봉침요법에 사용했던 꿀벌은 죽게 되고, 무엇보다도 봉독의 정량·정성 분석이 불가능하기 때문에 효능과 안정성이 임상적으로 입증 되었음에도 불구하고 산업화 되지 못했다. 2005년 본 연구팀에서 봉독채집장치를 개발함에 따라 국내에서도 봉독 채집이 가능하게 되었으며, 채집과정에서 혼입된 흙이나 먼지 등과 같은 이물질을 제거한 순수 정제봉독이 시판 판매됨으로써 다양한 실용화 소재로서 사용하게 되었다. 2010년「축산법 시행규칙」개정을 통해 축산물의 종류에 봉독을 포함하였으며, 국내는 물론 외국에서도 봉독의 다양한 기능성 탐색뿐 만 아니라 기전 구명에 대한 연구가 활발히 이루어지고 있다. 봉독 내 10-12% 가량 함유되어 있는 PLA2는 인지질을 가수분해하는 효소로서 레시티나아제(Lecithinase)라고도 한다(Pie et al., 2017). PLA2는 인지질을 분해하는 위치에 따라 A2, A2, B, C, D 로 분류되며, 포스포리파아제 중 PLA2 성분은 세포막 구성 지질인 포스포리피드(Phospholipids)의 글리세린(Glycerin)의 BDP(Bisphenol A bis(Diphenyl Phosphate) 결합하는 지방산을 유리시켜 리조포스파티드(Risophosphatide)로 만들기 때문에 세포조직의 파괴, 용혈작용 및 촉매 작용 등을 일으키는 것으로 알려져 있다(Diaz et al., 2001; Caforio and Driessen, 2016). PLA2성분이 체내 면역력을 조절하는 T-세포의 기능을 증강시켜 간 손상 치료제로써 활용될 수 있다는 보여주고 있으며, 또한, PLA2의 암세포에 대한 세포독성 작용을 통해 항암치료에도 활용될 수 있다고 보고된 바 있다(Cheung et al., 2016; Tagami et al., 2017). 그러나 봉독으로부터 PLA2 성분을 의약품이나 시약용으로 활용하기 위하여 고순도로 정제하기 위해서는 많은 비용과 시간이 소비 될 뿐더러 경제적이고 안전한 기술이 필요하다. 따라서 본 연구에서는 멜리틴 뿐만 아니라PLA2 성분에 대한 생리활성 연구가 활발히 진행됨에 따라 봉독으로부터 고순도의 PLA2 성분을 분리할 수 있는 최적 분석 조건을 확립하고자 하였다. 또한 분리 정제한 PLA2 성분에 대한 생리활성을 검정하였다.
재료 및 방법
공시 시료
공시 시료로는 한국정제봉독협동조합(안산, 한국)으로부터 2016년에 채취하여 정제한 정제봉독을 시험에 사용하였다.
시약 및 기기
정제봉독으로부터 PLA2의 단일성분 분리에 사용한 trifluoroacetic acid(TFA)와 acetonitrile(MeCN)은 Burdik & Jackson(MI, USA)사를 사용하였다. PLA2 표준품은 시그마사(Sigma-Aldrich., MO, USA)로부터 구입하여 사용하였다. 증류수 등 시험에 사용한 모든 시약은 모두HPLC급으로 사용하였다.
PLA2 단일성분 분리
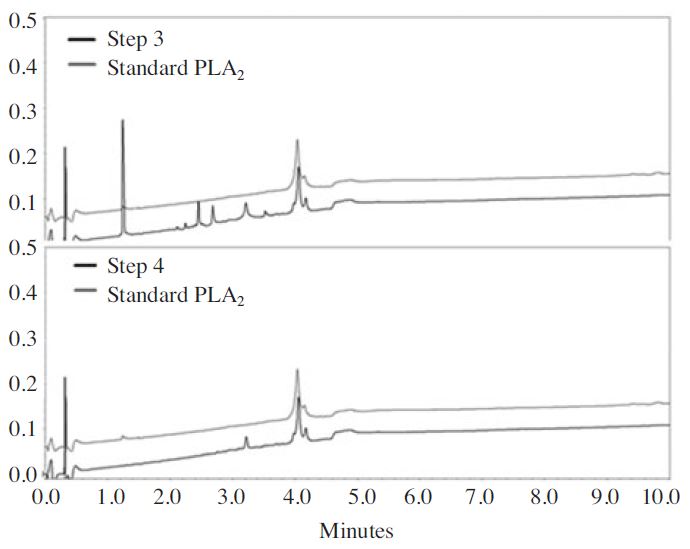
옥타데실실란(ODS) 10g이 충진된 Sep-Pak(WAT043345, Waters, MA, USA) 카트리지 컬럼을 진공 매니폴드(730150, Macherey-Nagel, Duren, Germany)에 장착하고 (A)20 mM trifluoroacetic acid(TFA)/acetonitrile(MeCN)과 (B)20 mM TFA/H2O를 이동상으로 사용하였다. 먼저 100%(B) 용액 100mL로 컬럼을 안정화 시킨 다음(1단계), 봉독 300mg을 증류수2mL에 녹여 컬럼에 주입하였다(2단계). 80% (B) 용액 100mL를 추가하여 용액을 배출시킨 다음(3단계), 65% (B) 용액 20mL를 컬럼에 주입하여 3단계와 동일하게 배출시켰다(4단계) (Fig. 1). 65% (B) 용액20mL를 컬럼에 재 주입한 후 용출액 20mL를 취하고(5단계), 5단계 분취 용액에 증류수 80mL를 추가하여 동결건조 후 PLA2를 수득하고(6단계), PLA2의 수율을 구하였다.
PLA2 단일성분 및 순도 확인
봉독으로부터 분리한 PLA2가 단일성분 확인에 사용된 기기는Waters사의 PDA(photo diode array)검출기가 장착된 Acquity UPLC I-Class를 사용하였다. Waters사의 BEH C18(50×2.1mm, 1.7um) 컬럼을 사용하여 Table 1과 같은 조건으로 분석하였다. 순도는 아래와 같은 식으로 구하였다.
분리한 PLA2의 암세포 성장 억제 효과 측정
PLA2 표준품과 분리한PLA2에 대한 암세포 성장 억제 효과를 확인하고자 하였다. 실험에 사용한 암세포는 인체의 간암 HepG2 세포를 한국세포주은행(서울, 한국)에서 구입하여 사용하였다. 5% FBS (fetal bovine serum, Hyclone, USA) 및 항생제 혼합액을 첨가한 DMEM (Dulbecco's modified Eagle's medium, GIBCO, NY, USA) 배양액을 사용하여 CO2 배양기에서 배양하였다. 간암세포에 대한 암세포 성장 억제 효과를 측정하기 위해 MTT[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide] assay를 실시하였다. HepG2 세포를 96 well plate에 1×105 cells/well이 되게 300μL씩 분주하여 24시간 후 시료를 일정한 농도로 제조하여 10μL 첨가한 후 37°C, 5% CO2 배양기에서 72시간 배양하였다. 여기에 PBS(phosphate- buffered saline)에 5mg/mL의 농도로 제조한 MTT용액 20μL를 첨가하고 동일한 배양 조건에서 4시간을 배양하였다. 배양액을 제거하고 각 well당 DMSO(dimethyl sulfoxide) 300μL를 가하여 ELISA reader(Molecular Devices, CA, USA)로 517nm에서 흡광도를 측정하여 inhibition rate(%)를 구하였다.
결과 및 고찰
봉독의 주성분은 펩타이드인 멜리틴으로 50% 이상 차지하고 있으며, 그 다음으로 많은 함량을 차지하고 있는 PLA2는 분자량이 19,000인 효소 성분으로 10∼12% 가량 함유되어 있다(Piek, 1986). 봉독의 항균 및 항염 효과는 멜리틴에서 기인하는 것으로 보고 되어 있으나, PLA2는 체내 면역력을 조절하는 T-세포의 기능을 과도하게 증강시킴으로써 봉독의 알러지 반응을 유발하는 물질로 알려져 있어 봉침요법으로 사용할 경우PLA2 성분을 제거하고 사용하는 경우도 있다(조와 권. 2011; Hossen et al., 2016). 그러나 최근 PLA2 성분이 간 손상 치료제와 암세포 사멸에 효과가 있어 항암 치료제로서 가능성이 높다는 연구가 이루어지고있다(Shariati et al., 2016).
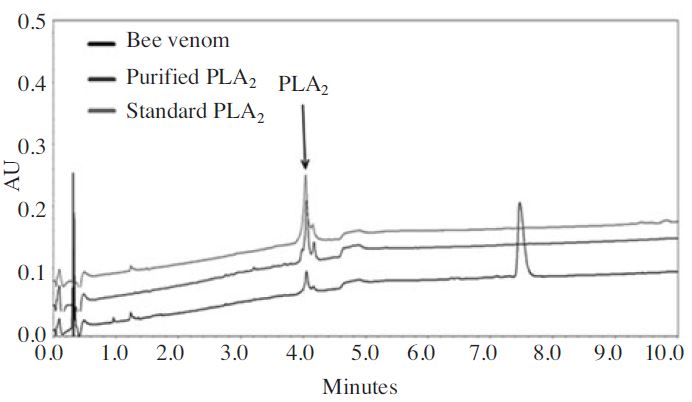
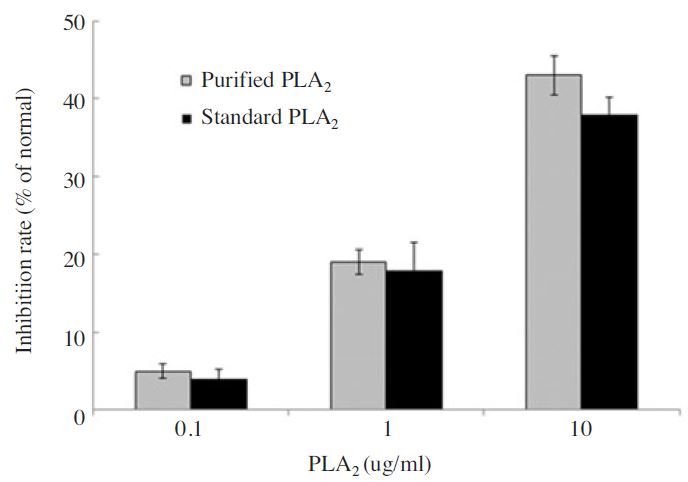
본 연구에서는 봉독으로부터 PLA2 성분만을 분리 정제할 수 있는 정제법을 개발하고자 하였다. 봉독으로부터 6단계의 과정을 거쳐 PLA2만을 순수하게 분리 정제할 수 있었다. Fig. 2에서 보는 바와 같이 크로마토그래피 그래프가 표준품으로 사용한 PLA2와 동일함을 확인할 수 있다. 수율에 있어서도 일반적으로 봉독 내 PLA2의 함량은 10~12% 이나 본 연구에서는 3.5% 수준으로 37.5±3.6%로 비교적 안정된 수득률을 보였다. 또한 Fig. 2의 크로마토그래피에서 분리한 PLA2는 1∼4분대에 피크가 나타나지 않는 것을 볼 수 있으며, 표준품과의 계산식을 통해 불순물의 존재가 거의 없는 것으로 확인되었다(Table 2). 또한 분리한 PLA2는 성분과 표준품과의 간암세포에 대한 성장 억제효과를 비교하고자 하였다. 그 결과 분리한 PLA2는 성분과 표준품의 HepG2 세포 억제 효과에 대한 차이는 확인되지 않았다(Fig. 3). Fig. 3에서 보는 바와 같이 분리한 PLA2와 표준품 모두 HepG2 세포 억제 효과를 확인 할 수 있었으며 농도 의존적이였다. 40여 가지 이상의 다양한 성분으로 혼합물로 이루어진 봉독으로부터 약학적 효능을 가지는 특성 성분인PLA2를 고순도의 단일 성분으로 분리하는 기술이 확보됨에 따라 PLA2에 대한 생리활성 및 약리 효능 구명을 통해 PLA2를 유효성분으로 하는 의약품, 화장품 등의 개발에게 유용하게 사용될수있을것으로기대한다.
적 요
PLA2는 혼합물로 이루어진 봉독 성분 중에서 멜리틴에 이어 두 번째로 많은 함량을 갖고 있는 물질이다. 그러나, 다양한 약리효능을 갖는 멜리틴과는 달리 알러지를 유발하는 물질로 알려져 PLA2를 제거하거나 활성을 억제하는 연구가 주로 이루어졌었다. 최근 PLA2가 간 손상 치료와 암세포 억제 효능이 밝혀짐에 따라 PLA2를 유효성분으로 하는 의학조성물에 대한 연구가 활발히 진행되고 있다. 따라서 본 연구에서는 봉독으로부터 효과적으로 PLA2를 분리하는 방법을 개발하고자 하였다. Sep-pak 카트리지 컬럼을 사용하여 TFA/MeCN을 이동상으로, 컬럼의 안정화 단계, 봉독 주입 등 6단계를 거친후 순수한 PLA2를 분리할 수 있었다. 순도는 99.7±0.03%, 수득률은 37.5±3.6%로 고순도의 PLA2를 효과적으로 분리하였으며, 분리한 PLA2의 간암세포 억제 효과를 확인하였다. 이러한 연구를 통해PLA2에 대한 다양한 생리활성 구명과 이를 원료로 하는 다양한 의약품 개발이 가능 할 것으로 사료된다.
Acknowledgments
본 연구는 농촌진흥청 차세대바이오그린21사업(과제번호: PJ01188201)에 의하여 수행되었습니다.
인 용 문 헌
- 김민정, 박상동, 이아람, 김경호, 장준혁, 김갑성, (2002), 쥐의 Collagen 유발 관절염의 활액에서 단백분해효소의 활성 및 유리기 손상에 미치는 봉독약침의 억제효과, 대한침구학회지, 19, p161-175.
- 조병군, 권기록, (2011), 기니픽을 이용한 Sweet Bee Venom의 항원성 평가, J Pharmacopunct, 14, p23-32.
- Caforio, A., A. J. Driessen,, (2016), Archaeal phospholipids: Structural properties and biosynthesis, Biochim Biophys Acta, 20, pS1388-1981.
-
Cheung, K. L., R. Jarrett, S. Subramaniam, M. Salimi, D. Gutowska-Owsiak, Y. L. Chen, C. Hardmanm, L. Xuem, V. Cerundolo, G. Ogg, (2016), Psoriatic T cells recognize neolipid antigens generated by mast cell phospholipase delivered by exosomes and presented by CD1a, J. Exp. Med, 213(11), p2399-2412.
[https://doi.org/10.1084/jem.20160258]

- Díaz, C., G. León, A. Rucavado, N. Rojas, A. J. Schroit, J. M. Gutiérrez, (2001), Modulation of the susceptibility of human erythrocytes to snake venom myotoxic phospholipases A(2): role of negatively charged phospholipids as potential membrane binding sites, Arch Biochem Biophys, 391(1), p56-64.
- Fennell, J. F., Shipman, W. H., and Cole, L. J., (1967), Antibacterial action of a bee venom fraction(melittin) against a penicillin- resistant Staphylococcus and other microorganisms, Res. Dev. Tech. Rep, 5, p1-13.
- Habermann, E., and K. G. Reiz, (1965), On the biochemistry of bee venom pep-tides, melittin and apamin, Biochemistry, 343, p192-203.
-
Hossen, M. S., Shapla, U. M., Gan, S. H., Khalil, M. I., (2016), Impact of Bee Venom Enzymes on Diseases and Immune Responses, Molecules, 22, p25.
[https://doi.org/10.3390/molecules22010025]

-
Kim, H. W., Kwon, Y. B., Ham, T. W., Roh, D. H., Yoon, S. Y., Lee, H. J., Han, H. J., Yang, I. S., Beitz, A. J., and Lee, J. J., (2003), Acupoint stimulation using bee venom attenuates formalin-induced pain behavior and spinal cord fos expression in rats, J. Vet. Med. Sci, 65, p349-355.
[https://doi.org/10.1292/jvms.65.349]

-
Liu, C. C., Hao, D..J., Zhang, Q., An, J. 1., Zhao, J. J., Chen, B., Zhang, L. L., Yang, H., (2016), Application of bee venom and its main constituent melittin for cancer treatment, Cancer Chemother. Pharmacol, 78(6), p1113-1130.
[https://doi.org/10.1007/s00280-016-3160-1]

- Pie, M. S., Peters, G. H., Brask, J., (2017), Chemoenzymatic synthesis of fluorogenic phospholipids and evaluation in assays of phospholipases A, C and D, Chem Phys Lipids, 202, p49-54.
- Piek, T., (1986), Venoms of the Hymenoptera, London, Academic Press.
- Shariati, M., Aghaei, M., Movahedian, A., Somi, M. H., Dolatkhah, H., Aghazade, A. M., (2016), The effect of ω -fatty acids on the expression of phospholipase A2 group 2A in human gastric cancer patients, J. Res. Med. Sci, 21, p10.
-
Tagami, T., Ando, Y., Ozeki, T., (2017), Fabrication of liposomal doxorubicin exhibiting ultrasensitivity against phospholipase A2 for efficient pulmonary drug delivery to lung cancers, Int. J. Pharm, 517(1-2), p35-41.
[https://doi.org/10.1016/j.ijpharm.2016.11.039]