
아까시나무(Robinia pseudoacacia L.) 꽃의 개화 단계별 향기성분 조성 비교
Abstract
Floral scent emitted from many plants is the critical factors for pollinator attraction and defense for adaptation in environments. The fragrance components of flowers are different in composition by geographical origins, climate factors and the development stages of flowers. In the present study, we investigated the volatile-floral compounds in flowers of Robinia pseudoacacia L. and defined the chemical contribution for flowering periods. The volatile compounds analysis was performed by gas chromatography with mass selective detector after solid phase microextraction (SPME). We reported different compositional features of fragrance compounds according to flowering periods. The abundant compounds identified in stage 1 were α-pinene (66.80%) and β-pinene (26.53%). Those of the stage 2 were (Z)-β-ocimene (37.57%), α-pinene (15.16%), benzaldehyde (16.63%), linalool (12.13%). The volatiles of stage 3 comprised an abundance of (Z)-β-ocimene (64.94%), α-pinene (9.84%), linalool (8.92%), benzaldehyde (1.71%). Leaf volatiles were distinct from those in the reproductive plant parts by their high relative amount of (E)-β-ocimene (23.50%) and (Z)-3- Hexenyl acetate (27.87%). Differences in flower scents of the different stages and leaves are discussed in light of biochemical constraints on volatile chemical synthesis and of the role of flower scent in evolutionary ecology of R. pseudoacacia.
Keywords:
Robinia pseudoacacia L., Fragrance, Flowering periods, (Z)-β-ocimene, Linalool, Benzaldehyde서 론
아까시나무(Robinia psedoacacia L.)는 콩과에 속하는 낙엽교목으로 원산지는 북아메리카이지만 환경 적응성이 매우 뛰어나 조경수 등의 용도로 전세계적으로 분포하고 있는 수종이다. 우리나라에서는 연료림 조성과 사방조림 등 다목적 수종으로 식재된 이후 밀원자원으로 각광받아 우리나라 양봉 생산량의 70%를 차지하는 주요 수종으로 인식되어 있다(Lee et al., 2004). 이러한 경제적 중요성으로 인해 아까시나무와 꽃의 생리적 특성에 관한 많은 연구가 지속적으로 이루어져 왔지만 아까시나무의 경우 황화현상 및 잎혹파리 등의 피해로 인해 벌꿀 생산량이 감소하여 아까시나무를 대체할 수 있는 밀원수종에 대한 연구가 활발히 진행 중에 있다(국립산림과학원, 2006; 한 등, 2009). 또한 아까시나무 꽃의 화기구조, 개화특성, 및 화밀 분비에 관한 연구가 꾸준히 진행되어 왔다(김과 김, 1987; 손 등, 1999; 한 등, 2009).
우리나라에서 아까시나무 꽃의 개화는 평균적으로 5월초부터 중순까지이며 개화기간은 약 10일 정도이다. 아까시나무 꽃은 흰색이고, 꽃이 여러 개가 모여 꽃대에 자라는데 이 길이는 8~20cm이다. 아까시나무 꽃에는 특유의 강하고 향기로운 냄새성분을 함유하고 있으며 이러한 향기성분은 아까시 꿀 특유의 독특한 풍미를 부여하는데 크게 기여하고 있다. 또한 아까시나무 꽃은 항 염증, 지혈, 혈액순환 개선, 경련 억제제 등의 한약재로 이용하기도 하는데(Strzelecka and Kowalski, 2000) 이는 꽃이 함유하고 있는 Robinin, birobin, rhamnorobin, acaciin, coumarin 등의 비활발성 flavonoid성분들이 다양한 생리활성 효과를 나타내기 때문인 것으로 알려져 있다(Tian and McLaughlin).
아까시나무꽃의 휘발성 향기성분에 대한 연구는 여러 국가에서 자생하고 있는 아까시나무 꽃을 대상으로 수행하였다(Aronne et al., 2014). 아시아에서는 다양한 추출법으로 성분을 동정하였는데 동시증류추출(Simultaneous Distillation and Extraction, SDE) 장치를 이용한 아까시나무 꽃 오일의 주 성분은 linalool, phenyl ethylacohol, methyl anthranilate, 1-hexanol, 및 3-Methyl pyridine으로 보고되었다(Bhalla and Bajpai, 2017). 또한 고체상 추출법(Solid-phase microextraction, SPME)을 이용한 아까시나무 꽃 향기성분으로는 주로 linalool, β-ocimene, α-bergamotene, formanilide가 검출되었다(Xie et al., 2006). 이란에서의 아까시나무 꽃의 주요 향기성분으로는ethyl hexanoate, heptadecane, virdiflorol인 반면 미국에서는δ-3-carene, linalool, anthranilic aldehyde가 주로 수집되었다(Kamdem et al., 1994; Kicel et al., 2015). 이러한 연구결과는 아까시나무 꽃의 휘발성 향기성분은 아까시나무 자생지역의 기후와 추출방식에 따라 향기성분의 차이가 있음을 시사한다. 또한 아까시나무 꽃과 잎 등의 조직에 따라 차이가 있음이 밝혀짐에 따라(Kicel et al., 2015), 아까시 나무 꽃은 개화단계에 따라서도 향기성분의 종류와 조성이 다를 것으로 추측된다. 따라서 본 연구는 국내 자생하고 있는 아까시나무 꽃의 개화단계에 따른 휘발성 향기성분을 각각 동정하고 조성 차이를 비교분석하기 위해 실시하였다.
재료 및 방법
시료
본 실험에 사용한 아까시나무 꽃은 2017년 5월에 인천광역시 남동구에 자생하는 아까시나무를 대상으로 가슴높이지름 20cm이상인 15~20년생 개체 10본을 공시목으로 선정하여 화아가 발생하기 시작한 5월 10일부터 꽃잎이 탈락하여 개화가 완전히 종료된 5월 31일까지 시료를 채집하였다. 채집 후 줄기를 제거한 꽃을 다른 처리 없이 바로 GC분석을 진행하였다. 아까시나무 꽃의 개화는 기존의 연구결과를 인용하여(한 등, 2006), 3단계로 구분 후 각 단계에 해당하는 시료를 3회 이상 채집하였다. 개화 1단계는 화아에서 나온 꽃잎이 한 덩어리로 생장하는 시기이며, 개화 2단계는 꽃잎이 벌어지기 시작하여 외형적으로 아까시나무 꽃의 형태를 식별할 수 있는 시기이다. 끝으로 개화 3단계는 꽃잎이 벌어지면서 밀선이 개방되고 꿀벌의 채밀이 가능한 시기로 정의하였다.
Solid phase microextraction (SPME)법에 의한 휘발성 향기성분 분석
아까시나무 꽃의 휘발성 향기성분은 SPME법으로 추출하였다. 향기성분의 흡착은 SPME Holder (SupelcoTM Solid Phase Microextraction Fiber Holder, Supelco, Inc., Bellofonte, PA, USA)에 Polydimethylsiloxane (PDMS) fiber (100μm coating thickness)를 고정하여 사용하였다. SPME용 20mL, headspace crimp vial (Agilent Technologies, Inc., CA, USA)에 각각의 시료 2g씩 계량하여 넣고 , 50°C hot plate에서 30분 방치하여 수분을 제거한 후 Crimp cap(20mm HS AL Crimp, Agilent Technologies, Inc.)을 이용하여 밀봉하였다. SPME fiber를 휘발성 향기성분에 노출시키기 전, 먼저 SPME fiber를 250°C GC injection port에서 10분 동안 활성화 하였다. 활성화 된 SPME fiber의 needle을 vial의 headspace상에 삽입하여 60분 동안 노출시켜 휘발성분을 흡착시켰다. 흡착된 fiber는 즉시 GC-MS injector에 넣고 10분간 탈착시킨 후 분석을 시작하였다. 본 실험은 아까시나무 꽃의 단계별 시료에 대해 3회 반복실험을 수행하였다.
Gas chromatography analysis
휘발성 물질은 7890B gas chromatography(Agilent Technologies Inc.)를 이용하여 분리하였다. 이동상 기체는 헬륨가스를 사용하였고, 고정상(Column)으로는 HP-5MS, 30m×250μm×0.25μm을 사용하였다. 컬럼의 온도는 40°C 에서 5분간 유지시킨 후 250°C까지 6°C/min의 속도로 승온 하였다. 유속은 1ml/min으로 조정하였다. GC-MS분석 장치는 7890B와 5977B mass selective detector 가 연결된 것을 사용하였으며 분석조건은 다음과 같다. GC 주입구 온도는 250°C, mass range는 50-550 m/z, linear velocity는 36.262 cm/sec, ionization voltage는 90.6 eV로 설정하고, 운반기체는 헬륨가스를 사용하였다. 그 외 컬럼 온도를 비롯한 분석 조건은 GC의 분석 조건과 동일하게 설정하였다. 휘발성 성분의 동정은 Agilent Chemstation(Agilent Technologies, Inc.)을 운영하여 분석하였고mass spectral library data 검색으로 물질을 추정하였고, 표준물질의 머무름 시간 일치에 따라 정성분석 하였다.
결과 및 고찰
SPME-GC/MS는 꽃의 향기성분을 조사하기 위해 널리 사용하는 실험 방법으로(Barták et al., 2003; Flamini et al., 2003), 본 연구는 아까시나무 꽃의 개화단계에 따른 향기성분을 동정하고 조성 변화를 분석하기 위해 SPME-GC/MS를 수행하였다. 아까시나무 꽃의 개화를 3단계로 나누었고 화아로 부터 꽃잎이 생성하기 전의 잎을 비교대상군으로 채집, 분석하였다(Fig. 1).
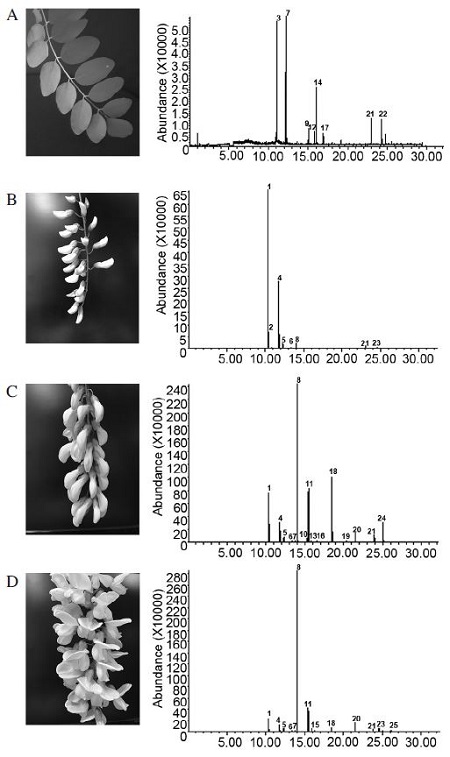
Divided flowing period of Robinia pseudoacacia L. by 3 stages (Left pannel: A. Leaves, B. Stage 1; Period when five petals are growing for a lump. C. Stage 2; Period when form into complete flower. D. Stage 3; Period when appear a stamen and pistil) and SPME-GC/MS traces of volatile fraction of Robinia pseudoacacia flowers (Right panel: A. Leaves, B. Stage 1, C. Stage 2, D. Stage 3).
분석 결과 Table 1에서 볼 수 있듯이 SPME분석법으로4종류의 시료에서 총 25가지의 휘발성분을 동정하였고 본 실험에서 사용한 PDMS fiber에 흡착된 전체 휘발성분 중 평균적으로 90%이상 동정하였다. 기존 SPME를 이용한 아까시나무 꽃에서 동정한 휘발성분은 약 35~40가지이지만(Aronne et al., 2014; Xie et al., 2006), 본 연구결과에서 휘발성분 수가 적은 것은 함량 0.1% 이하 물질을 제외했기 때문이다. 아까시나무 꽃의 주요 휘발성분은 monoterpene을 비롯한 terpenoids 계열이며, 각 단계마다 동정된 주요 향기물질의 종류가 다른 것으로 나타났다. 이는 PDMS fiber가 비극성 성분들을 주로 흡착하기 때문이며, PDMS coating의 terpene 계열 선호성은 이미 보고 되었다(Xie et al., 2006).

Chemical composition of the aroma identified by SPME-GC/MS from headspace samples of different flower stages and leaves of Robinia pseudoacacia
잎에서는 8개의 휘발성분이 검출되었고, 동정된 휘발성분은 잎의 전체 휘발성분 중 90.73%를 차지하였다. 동정된 휘발성분 중에서monoterpene계열인 (E)-β-ocimene (28.50%)과 지방산 유도체 ester계열인 (Z)-3-hexenyl acetate (27.87%)가 50% 이상의 함량으로 주요성분을 차지하였다. 잎의 휘발성분에는 꽃에 함유되지 않는 휘발성분이 있었는데 특히 지방족 알코올 계열의 3-hexen-1-ol의 ester 유도체 물질인 (Z)-3-hexenyl acetate (27.87%), (Z)-3-hexenyl butyrate (2.66%), (Z)-3-hexenyl 2-methylbutanoate (2.54%), (Z)-3-hexenyl benzoate (6.35%)는 전체 함량의 39.42%에 해당한다. 이 계열의 물질은 주로malonic acid 경로를 거친 지방산에서 유래하는 지방족 화합물로 분류할 수 있다. Kicel 등에 따르면 아까시나무 잎의 오일성분에서는 주로 지방족 알코올 계열 물질과 ester유도체가 검출되었다(Kicel et al., 2015).
아까시나무 꽃에서는 개화의 3단계 모든 시료 잎에서 동정된 성분과는 전혀 다른 종류의 휘발성분이 검출되었다(Fig. 1). 다른 꽃들과 같이 아까시나무 꽃의 향기성분은 작은 분자량을 가지면서도 높은 휘발성을 가지고 있는 다양한 유기 화합물의 혼합형태를 보여 주었다(Pichersky et al., 2006). 개화의 모든 단계에서 함량이 가장 높은 휘발성분 계열은 monoterpene과 sesquiterpene 을 포함한 terpenoid계열로 나타났다. 이는 꽃잎이 발달함에 따라 식물 2차 대사과정이 활발하게 일어나면서, 아까시나무 꽃의 특이한 terpenoids 성분의 생합성 과정이 증가한다고 유추할 수 있다. 각 단계별 향기성분의 프로파일을 살펴보면, 먼저 개화 1단계 시료에서는 8종류의 휘발성분이 전체 휘발성분 중 98.44%의 비율로 검출되었다. 8종의 모든 휘발성분은 terpenoid계열이며 이성질체인 α-pinene (66.80%)과 β-pinene (26.53%)이 93.33%를 차지하였다. 기타 terpenenoid물질로 Camphene (0.62%), β-myrcene (1.62%), limonene (0.43%), (Z)-β-ocimene (1.82%), farnesene (0.32%), caryphylene (0.30%)이 동정되었다(Table 1). 개화 1단계는 화아와 꽃잎이 한 덩어리로 발달하는 시기이므로 아까시나무 꽃 특유의 향기성분이 검출되지 않고 pinene이 주로 동정되었다. 특이한 점은 잎의 주요 휘발물질 중 하나였던 (E)-β-ocimene은 검출되지 않았고, (Z)-β-ocimene가 검출되기 시작하였다. 선행 연구에 따르면 아까시나무 꽃이 만개하였을 때 검출되는 ocimene은 (Z)-β-ocimene이며 (Aronne et al., 2014; Xie et al., 2006), (E)-β-ocimene의 함량은 1% 미만으로 알려졌다. 본 연구결과를 통해 (E)-β-ocimene은 개화단계가 시작되는 시점에서부터 휘발되는 함량이 낮음을 알 수 있다.
개화 2단계는 꽃잎이 벌어지기 시작하면서 외형적으로 아까시나무 꽃의 형태를 갖추고 있다(Fig. 1). 이 단계에서 동정된 휘발성분은 15개이며, 전체 휘발성분 중 99.51%에 해당하는 수치이다. 총15개의 휘발성분 중 terpenoid계열물질은 9개 (α-pinene, β-pinene, β-myrcene, limonene, (Z)-β-ocimene, (E)-β-ocimene, linalool, farnesene, (E)-α-bergamonene)이며 81.12%를 차지한다. 또한 benzenoids계열의 휘발성분이 동정되었는데 methyl benzoate (1.02%), benzaldehyde (16.63%), methyl anthranilate (2.25%)가 그것이다. 기타물질로는 phenylethyl alcohol (0.31%), methyl nicotinate (0.29%), indole (0.24%)가 동정되었다. 아까시나무 꽃 향기가 강하게 풍기기 시작하는 개화 2단계에 동정된 휘발성분의 특징은 크게 두 가지로 볼 수 있다. 첫 번째는 개화 1단계에 비해 달라진 monoterpene물질 함량비의 변화이다. 개화 1단계에서 전체 휘발성분 중 93.33%를 차지하였던 α-pinene, β-pinene의 비율이 개화2단계에서는 20.86%로 휘발성분의 상대적인 함량비가 감소하였다. 반면 (Z)-β-ocimene (37.57%), linalool (12.31%), farnesene (1.90%), (E)-α-Bergamonene (4.45%)는 새롭게 생성 혹은 함량비가 증가하여 2단계에서 주요 휘발성분으로 확인되었다. Monoterpene은 식물의 2차대사산물 생성과정 중 2-C-methyl-d-erythritol 4-phosphate (MEP) 경로를 거쳐 생합성 되는데 (Eisenreich et al., 1997), 중간대사 산물인 geranyl diphosphate (GPP) 가 monoterpene synthase의 작용으로 촉매되어 (Z)-β-ocimene (ocimene synthase, OCS), linalool (linalool synthase, LIS) 등으로 구조적인 변화를 하게 된다(Lange et al., 2000). 이를 통해 개화 1, 2단계의 결과를 비교해 볼 때, 아까시나무 꽃의 개화 단계마다 함량이 높은 주요 monoterpene종류가 달라지는 것은 꽃의 발달 과정에서 각각의 monoterpene합성효소인monoterpene synthase들의 활성화가 다르기 때문으로 해석할 수 있다. 또한 1단계에 비해 2단계에서 함량비가 높은 monoterpene profiles이 실제 아까시나무 꽃 특유의 강한 향을 발산하는 휘발성분 조성비에 적합함을 유추할 수 있다. 개화 2단계에 동정된 휘발물질의 두 번째 특징은 식물의 방향성분 생합성 과정 중에서 shikimic acid 경로를 시작으로 생산되는 benzenoids계열(Methyl benzoate, benzaldehyde, indole, methyl anthranilate) 과phenylpropanoids계열 phenylethyl alcohol의 화합물질(Dudareva et al., 2006)이 검출되었다는 점이다. 이 두 계열의 휘발성분 생합성은 1) 식물색소를 구성하는데 필수적이고, 2) 식물의 형태를 지지하는 구조성분의 합성을 위한 중간물질로서 생성되며 아미노산인 phenylalanine으로부터 유도되는 식물의 방향물질로 보고된 바 있다(Boatright et al., 2011). 따라서 두 계열의 휘발성분들은 아까시나무 꽃이 성숙단계로 발달하는 과정에서 필수적으로 생성되는 화합물이며, 이러한 생합성 과정을 통해 아까시나무 꽃은 특유의 향기 조성을 구성하여 발산하는 것으로 생각할 수 있다. 특히 benzenoids의 주요 성분으로 알려진benzaldehyde는 burnt sugar향을 가지는 성분으로 아몬드(almond)에서 최초로 분리된 향기성분으로 향역시 아몬드 특유의 향을 나타낸다(Xiao et al., 2014). 이 휘발성분은 매화나 라일락 꽃 등 여러 꽃의 주요 향기 성분으로 보고된 연구결과가 있다(김과 이, 2004; 이와 김, 2002).
아까시나무 꽃의 최성기에 해당하는 3단계는 13종류의 휘발물질이 검출되었는데 전체 성분의 98.56%를 차지한다. 이중 terpenoids 계열의 물질은 α-pinene (9.84%), β-pinene (4.49%), β-myrcene (1.66%), limonene (0.66%), (E)-β-ocimene (0.53%), (Z)-β-ocimene (0.53%), linalool (8.92%), cosmene (0.39%), farnesene (0.33%), caryophyllene (1.31%), nerolidol (0.46%) 로 총11가지가 동정되었다. Benzenoids계열의 물질인 benzaldehyde (1.71%), methyl anthranilate (3.32%)는 나머지 두 종류의 물질에 해당한다. 개화 2단계에 비해 향기성분의 종류는 benzenoids 계열의 수가 감소한 반면, sesquiterpene에 해당하는 성분수는 증가하였다. 개화 3단계에서는 (Z)-β-ocimene의 구성비율이 약 65%에 이를 정도로 높은 비율을 나타낸다. (Z)-β-ocimene의 구성비 증가현상은 개화단계 전반에 걸쳐 나타나게 되는데 아까시나무 꽃이 성숙단계에 이르면 (Z)-β-ocimene이 가장 높은 상태로 유지됨을 확인할 수 있었다. Xie 등이 발표한 연구결과에 따르면 아까시나무 꽃이 성숙기일 때 (Z)-β-ocimene과linalool의 검출량이 50% 이상 차지하는데 특히 (Z)-β-ocimene의 검출량이 높은 것으로 나타나 본 연구와 유사한 결과를 보여주었다(Xie et al., 2006). β-ocimene은 라일락 꽃을 비롯한 여러 꽃에서 발생하는 방향물질로 알려져 있는데(김과 이, 2004; Suchet et al., 2010), 흥미로운 점은 꽃의 종류에 따라서 β-ocimene의 주성분이 (E)- 혹은 (Z)-형태일 수 있다는 것이다. 아까시나무 꽃의 주요 ocimene이 (Z)형태인 반면, 금어초라 부르는 Antirrhinum majus의 꽃에서 생성되는 ocimene은 (E)-형태가 주로 검출되었다(Suchet et al., 2010). 향후 꽃의 종류와 색소 구성 등의 특정조건에 따른 β-ocimene의 주요 형태를 분류하고 생합성 경로를 밝히는 연구가 필요할 것으로 보인다. 한편, β-ocimene은 꿀벌의 사회성 행동을 촉진하는 휘발물질로 알려졌다(He et al., 2016; McAfee et al., 2016). 즉, β-ocimene은 꿀벌의 유충페로몬이면서 꿀벌의 청소행동을 유발하는 냄새성분의 기능을 가지고 있다는 것이다. 먹이가 부족한 섭식제한 상태에 놓인 2령 유충은 내역봉의 원활한 먹이 공급을 위해 β-ocimene을 방출한다고 알려져 있다(He et al., 2016). 또한 질병이나 급격한 환경변화에 노출된 유충 및 번데기 사체에서 β-ocimene이 방출되어 내역봉의 청소행동을 유발시키기도 한다(McAfee et al., 2016). 이러한 연구결과는 식물과 꿀벌에서 β-ocimene의 생합성 경로가 존재하며 특정단계와 상황에 따라 β-ocimene의 생합성 과정이 유도되거나 차단됨을 의미한다. 향후 꽃과 꿀벌이 생성하는 고유한 형태의 β-ocimene 생합성 과정에 대한 심층적인 연구가 필요할 것으로 보인다.
아까시나무 꽃의 향기 성분은 필연적으로 꿀벌 방화행동의 비율과 관련이 있다. 꽃에 대한 꿀벌 방화행동의 특성은 일반적으로 개화기간 동안 개화율과 꿀벌방화 빈도가 일치하는 경향을 나타낸다(류와 장 등, 2003). 즉, 꽃잎이 벌어지면서 밀선이 개방되고 꿀벌의 채밀이 가능한 개화 최성기에 꿀벌의 방화률도 가장 높게 나타나는데 이는 아까시나무 꽃의 향기 성분 조성비의 변화가 꿀벌의 방화행동 유도에 중요한 역할을 할 것으로 추측된다. 본 연구는 이러한 가설을 일부 설명 할 수 있다. 아까시나무 꽃은 성숙단계에 진입하면서 특유의 향기성분을 발산하며 본 연구 결과는 각 단계마다 주요 향기성분의 종류와 향기 성분조성비에 변화가 있음을 확인하였다. 즉, 개화 1단계에서는 90% 이상의 함유량을 보이던 pinene은 2단계에서는 20%로 감소한 반면 (Z)-β-ocimene, linalool, benzaldehyde가 60% 이상 차지하였다. 개화 최성기에 도달한 3단계에서는 (Z)-β-ocimene, linalool, benzaldehyde의 함유량이 70% 이상 되지만 각 물질에 대한 구성비는 확연한 차이를 보이는데 (Z)-β-ocimene의 함유량이 압도적으로 증가하는 것을 확인했다. 개화가 진행될 수로 꿀벌의 방화활동이 활발해지는 것은 꿀벌이 개화 2, 3단계에서 휘발되는 향기성분의 프로파일을 인지할 수 있음을 의미한다. 실제로 꿀벌은 (Z)-β-ocimene, linalool, benzaldehyde와 같은 향기성분을 후각기관인 더듬이에서 인지하는 것으로 알려졌다(Jung et al., 2014). 향후 향기성분에 대한 꿀벌의 선호도를 포함한 선택적 행동반응을 통해 아까시나무의 향기성분과 꿀벌의 방화행동에 대한 상호작용 연구가 필요할 것으로 생각된다.
적 요
식물의 향기성분에 대한 프로파일은 기본적으로 추출법의 효율성에 기반한다. 본 연구에 사용된 SPME 방식은 한 개체의 식물로부터 반복적인 시료의 채취가 가능하고, 사용하는 fiber의 종류에 따라 극성과 비극성 성분 모두 가질 수 있기 때문에 사용범위가 넓고 재현성이 강하다. 본 연구는 아까시나무 꽃으로부터 발산되는 휘발성 성분을 SPME법으로 추출하여 GC/MS를 통해 분석을 시도하였다. 선행연구에서 관찰한 결과(Aronne et al., 2014; Xie et al., 2006) 아까시나무 꽃의 향기성분은 대다수 terpenoids와 benzenoids 화합물로 밝혀졌다. Pinene, (Z)-β-ocimene, linalool, benzaldehyde가 대표적인 아까시나무 꽃의 주요 향기성분으로 검출되었다. 또한 β-myrcene, limonene, farnesene, methyl benzonate, indole, methyl anthranilate, phenylethyl alcohol 등은 아까시나무 꽃 특유의 강한 향을 구성하는데 중요한 휘발성분으로 생각된다. 또한 본 연구는 개화의 단계별로 발산하는 향기성분과 그 구성비율이 확연하게 차이가 있음을알수있었다. 이러한 결과를 통해 꽃이 생합성 하는 향기성분의 조성은 정적인 비율로 구성하는 것이 아니라 꽃잎의 발달과 함께 동적인 비율로 구성한다는 것을 알게 되었다. 앞으로 아까시나무 꽃의 향기성분 생산에 미치는 환경적인 요인, 향기성분 발산의 주기성, 꽃의 노화와 수분 후(post-pollination)의 향기 발산, 화색과 향기성분과의 연관성에 대해 심층적인 연구가 수행되어야 할 것으로 보인다.
Acknowledgments
본 성과물은 농촌진흥청 연구사업(PJ012285042017)의 지원에 의해 이루어진 것입니다.
인 용 문 헌
- 국립산림과학원, (2006), 아까시나무 황화피해 원인 규명 및 관리방안, 국립산림과학원, 서울, p31.
- 김남선, 이동선, (2004), GC-MS에 의한 라일락 꽃 향기 분석, 분석과학, 17(1), p85-89.
- 김태욱, 김기중, (1987), 아까시나무의 화밀생산과 수분기작, 한국양봉학회지, 2, p82-92.
- 류장발, 장정원, (2003), 산수유와 매실나무에 대한 꿀벌의 방화활동에 관한 연구, 한국양봉학회지, 18(1), p1-4.
- 손재형, 김재길, 오경규, 지일훈, 박성치, (1999), 아까시나무의 개화기 예측및 우량 화밀 개체선발, 농림부, p95.
- 우종호, (1994), 아까시나무 임분의 자원화에 관한 연구, 경북대학교, 박사학위 논문, p113.
- 이동선, 김남선, (2002), 기체크로마토그래피-다중 질량분석법에 의한 매화나무 [Prunus mume] 꽃 향기 성분 분석, 한국냄새환경학회지, 1(1), p59-67.
- 한진규, 강문수, 김세현, 이갑연, 백을선, (2009), 경기도 수원지역 아까시나무의 개화, 꿀벌방화 및 화밀분비 특성, 한국양봉학회지, 24(3), p147-152.
- Aronne, G., M. Giovanetti, R. Sacchi, and V. De Micco, (2014), From flower to honey bouquet: Possible markers for the botanical origin of Robinia Honey, The Scientific World Journal, 12, p7.
- Barták, P., P. Bednár, L. Cáp, L. Ondráková, and Z. Stránsk´y, (2003), SPME - a valuable tool for investigation of flower scent, Journal of Separation Science, 26(8), p715-721.
-
Bhalla, P., and V.K. Bajpai, (2017), Chemical Composition and Antibacterial Action of Robinia pseudoacacia L. Flower Essential Oil on Membrane Permeability of Foodborne Pathogens, Journal of Essential Oil Bearing Plants, 20(3), p632-645.
[https://doi.org/10.1080/0972060x.2017.1329670]

- Boatright, J., F. Negre, X. Chen, C.M. Kish, B. Wood, G. Peel, I. Orlova, D. Gang, D. Rhodes, and N. Dudareva, (2011), Understanding in vivo benzenoid metabolism in petunia petal tissue, Plant Physiology, 135, p1993-2011.
-
Dudareva, N., F. Negre, D.A. Nagegowda, and I. Orlova, (2006), Plant Volatiles: Recent Advances and Future Perspectives, Critical Reviews in Plant Sciences, 25(5), p417-440.
[https://doi.org/10.1080/07352680600899973]

-
Eisenreich, W., S. Sagner, M.H. Zenk, and A. Bacher, (1997), Monoterpenoid essential oils are not of mevalonoid origin, Tetrahedron Letters, 38, p3889-3892.
[https://doi.org/10.1016/s0040-4039(97)00761-2]

-
Flamini, G., P.L. Cioni, and I. Morelli, (2003), Use of solid-phase micro-extraction as a sampling technique in the determination of volatiles emitted by flowers, isolated flower parts and pollen, Journal of Chromatography a, 998(1), p229-233.
[https://doi.org/10.1016/s0021-9673(03)00641-1]

-
He, X.J., X.C. Zhang, W.J. Jiang, A.B. Barron, J.H. Zhang, and Z.J. Zeng, (2016), Starving honey bee (Apis mellifera) larvae signal pheromonally to worker bees, Scientific Reports 6, p22359.
[https://doi.org/10.1038/srep22359]

-
Jung, J.W., K.W. Park, H.W. Oh, and H.W. Kwon, (2014), Structural and functional differences in the antennal olfactory system of worker honey bees of Apis mellifera and Apis cerana, Journal of Asia-Pacific entomology, 17(3), p639-646.
[https://doi.org/10.1016/j.aspen.2014.01.012]

-
Kamdem, D.P., K. Gruber, T. Barkman, and D.A. Gage, (1994), Characterizaion of black locust floral fragrance, Journal of Essential Oil Research, 6, p199.
[https://doi.org/10.1080/10412905.1994.9698356]

- Kicel, A., M.A. Olszewska, A. Owczarek, and M. Wolbis, (2015), Preliminary study on the composition of volatile fraction of fresh flowers and leaves of Robinia psedoacacia L. growing Poland, Acta Poloniac Pharmaccutica-Drug research, 72(6), p1217-1222.
-
Lange, B.M., T. Rujan, W. Martin, and R. Croteau, (2000), Isoprenoid biosynthesis: The evolution of two ancient and distinct pathways across genomes, Proceedings of the National Academy of Sciences of the United States of America, 97, p13172-13177.
[https://doi.org/10.1073/pnas.240454797]

-
Lee, C.S., H.J. Cho, and H.B. Yi, (2004), Stand dynamics of introduced black locust (Robinia pseudoacacia L.) plantation under different disturbance regimes in Korea, Forest Ecology and Management, 189(1-3), p281-293.
[https://doi.org/10.1016/j.foreco.2003.08.012]

-
McAfee, A., T.F. Collins, L.L. Madilao, and L.J. Foster, (2017), Odorant cues linked to social immunity induce lateralized antenna stimulation in honey bees (Apis mellifera L.), Scientific reports 7.
[https://doi.org/10.1038/srep46171]

-
Pichersky, E., J.P. Noel, and N. Dudareva, (2006), Biosynthesis of plant volatiles: Nature’s diversity and ingenuity, Science, 311, p808-811.
[https://doi.org/10.1126/science.1118510]

-
Suchet, C., L. Dormont, B. Schatz, M. Giurfa, V. Simon, C. Raynaud, and J. Chave, (2010), Floral scent variation in two Antirrhinum majus subspecies influences the choice of naïve bumblebees, Behavioral Ecology and Sociobiology, 65(5), p1015-1027.
[https://doi.org/10.1007/s00265-010-1106-x]

- Strzelecka, H., and J. Kowalski, (2000), The Encyclopedia of Herbs and Herbalism [in Polish], p477, PWN, Warsazawa.
- Tian, F., and J.L. McLaughlin, (2000), Bioactive Flavonoids from the Black Locust Tree, Robinia Pseudoacacia, Pharmaceutical Biology, 38, p229.
- Veitch, N.C., P.C. Elliott, G.C. Kite, and G.P. Lewis, (2010), Flavonoid glycosides of the black locust tree, Robinia pseudoacacia L., Phytochemistry, 71(4), p479-486.
-
Xiao, L., J. Lee, G. Zhang, S.E. Ebeler, N. Wickramasinghe, J. Seiber, and A.E. Mitchell, (2014), HS-SPME GC/MS characterization of volatiles in raw and dry-roasted almonds (Prunus dulcis), Food Chemistry, 151, p31-39.
[https://doi.org/10.1016/j.foodchem.2013.11.052]

-
Xie, J., B. Sun, and M. Yu, (2006), Constituents of top fragrance from fresh flowers of Robinia Pseudoacacia L. occurring in China, Flavour and Fragrance Journal, 21, p798-800.
[https://doi.org/10.1002/ffj.1720]
