꿀벌 계통별 로얄제리 생산성 평가 및 특성 분석
Abstract
This research was carried out to evaluate the royal jelly production in Apis mellifera through the selection of superior honeybee lines. For the study, two inbred honeybee lines A and C were evaluated for the production of royal jelly by their workers, royal jelly production per colony (g), and the acceptance percentage of grafted larvae (%). The results showed that, the average royal jelly production per colony was highest (33.7±7.41g) in the inbred line C in comparison to other lines and the percentage of larvae acceptance (87.8±7.5%) was also highest in the inbred line C in comparison to other liens. The royal jelly produced by the three honeybee lines was analyzed for their trans-10-hydroxy-2-decenoic acid (10-HDA) content using a column liquid chromatography technique. Chromatographic results showed that the royal jelly produced by the inbred honeybee line C had the maximum amount of 10-HDA. We also observed age-dependent alterations of the major royal jelly proteins (MRJPs), which were differentially expressed in the two inbred lines and the commercial line, using quantitative real time-PCR (qRT-PCR).
Keywords:
Honey bee, Apis mellifera, Royal jelly, Production, Larvae acceptance, 10-HDA, MRJPs서 론
로얄제리는 양봉산물 중 벌꿀 다음으로 중요한 생산물 중 하나로 항노화, 항염증, 항균, 항산화 등 다양한 기능성을 보유하고 있는 것으로 알려져 있다(Viuda-Martos et al., 2008; Cavusoglu et al., 2009; Nakajima et al., 2009). 로얄제리는 어린 일벌 유충 및 여왕벌 유충 먹이로 사용되며, 5~15일령 일벌 머리의 하인두선(hypopharyngeal glands)과 큰턱샘(mandibular)에서 분비되는 유백색의 물질로 독특한 향과 맛을 지니고 있다(Haydak,1970). 하인두선은 일벌 머리 앞쪽에 복잡하게 나선모양으로 이루어져 있는 한 쌍의 외분비선으로, 일벌령에 따라 단계적으로 구조가 바뀌는 특징을 지닌다. 즉, 15일령 이전의 일벌(육아벌)은 하인두선이 발달하여 로얄제리를 분비하지만, 그 이후에는 하인두선이 수축하면서 로얄제리 대신 Rglucosidase, glucose oxidase, galactosidase 등의 효소를 분비한다(Drapeau et al., 2006; Knecht and Kaatz, 1990; Klaudiny et al., 1994; Ohashi et al., 1997).
로얄제리는 물(67%)과 단백질 및 아미노산(12.5%), 단당류(11%), 지방(5%) 등으로 이루어져 있다(Liu et al., 2013). 로얄제리 내에 존재하는 특이적 물질로는 지방산 중 하나인 (E)-10-hydroxydec-2-enoic acid (10-HDA)으로, 로얄제리의 신선도나 품질을 평가하는 지표물질로 알려져 있다(Antinelli et al., 2003). 또한 로얄제리 단백질의 82~90%를 차지하는 major royal jelly proteins (MRJPs)이 있으며, 이는 서양종꿀벌(Apis mellifera) 11번 chromosome의 60 kb 유전자 상에서 9개의 MRJP 유전자가 gene family를 이루고 있는 것으로 알려져 있다(Albert et al., 1999a; Albert et al., 1999b; Albert et al., 2004; Drapeau et al., 2006). 최근 Jianke 등 (2010)은 로얄제리 생산성이 우수한 계통에서 MRJP의 발현량이 높아진다는 연구 결과를 보고한바 있어, MRJP 발현량과 로얄제리 생산성간에는 높은 인과관계가 있을 것이라 확인되고 있다.
일반적으로 로얄제리 생산성은 꿀벌 계통의 양적형질과 깊은 관련이 있다(Li et al., 2003). 앞선 연구에 의하면, 서양종꿀벌 카니올란 계통은 유충 접수율(larvae acceptance) 및 로얄제리 생산성이 우수한 것으로 확인되어(Mouro and Toledo, 2004) 로얄제리 생산성에 따른 꿀벌계통의 중요성이 강조된 바 있다. Cao 등(2016)은 로얄제리 생산성 우수 품종 육성 결과를 보고하여, 로얄제리 생산성에 따른 계통 육성의 가능성을 보여주었으며, Jianke 등(2010)은 로얄제리 생산성 우수계통의 하이두선샘의 크기 및 MRJP 전사체 발현량 등을 비교하여 꿀벌 계통에 따른 로얄제리 생산특성을 비교한 바 있다.
최근 국내에서는 꿀벌 특성별 우수 꿀벌계통 육성을 위한 연구가 활발히 이루어지고 있다. Kim 등(2015)은 국내 육성 6개 꿀벌 계통에 대한 유전적 다양성을 보고한 바 있으며, 이 등(2014)은 수밀력 우수 꿀벌 계통을 육성하기도 하였다. 본 연구에서는 국내 고유 꿀벌 육성 연구의 일환으로 로얄제리 생산성 우수계통을 선발하고자 하였으며, 이를 위해 농촌진흥청 국립농업과학원과 예천곤충연구소에서 공동으로 보존·육성중인 서양종꿀벌 기본종계통에 대해 로얄제리 생산성 우수 계통을 선발하였다. 시험을 통해 선발된 계통은 로얄제리 생산성 평가 및 10-HDA 함량, MRJP 발현량 평가를 수행하였다.
재료 및 방법
서양종꿀벌 계통평가
로알젤리 생산성 우수 꿀벌 계통 선발을 위해 본 연구에서는 농촌진흥청 국립농업과학원에서 보유 중인 서양종꿀벌(Apis mellifera L.) A, C 계통에 대한 로얄제리 생산성 평가를 수행 하였다. 계통 A와 C는 2005년부터 인공수정을 통해 순계로 유지되어 오던 계통으로(이 등, 2016), 시험을 위해 2016년 새롭게 여왕벌을 양성한 후 봉군을 형성하여 시험에 사용하였다. 각각의 시험 봉군은 계통 당 10봉군 내외로 준비하여 활성이 우수한 봉군 3개씩을 선발하여 조사를 수행하였으며, 대조구는 양봉농가로부터 구입한 봉군을 사용하였다.
서양종꿀벌 계통별 로얄제리 생산성 평가 및 접수율 조사
꿀벌 계통에 대한 로얄제리 생산성 평가는 Doolittle(1899) 방법에 따라 이루어 졌다. 먼저 서양종 꿀벌A와 C, 대조구 계통을 각각 3봉군씩 8매 벌로 양성하였으며, 육아벌은 동일하게 계량하고, 봉세를 일정하게 유지하도록 보정하여 주었다. 시험봉군 양성이 끝나면 로얄제리 생산틀을 준비해 부화한지 24시간 이내의 유충을 로얄제리 생산 틀 내 왕안(cup)에 이충하였다. 이때 1봉군 당 66개의 왕안을 이충침을 이용하여 이충하고, 72시간 이후 생산된 로얄제리를 채취하여 무게를 계측하였다. 접수율 조사는 여왕 벌방에 로얄제리가 정상적으로 분비된 방을 계수하는 방법으로 이루어 졌으며, 각각의 조사는 3반복 수행하였다.
10-HDA 함량 분석
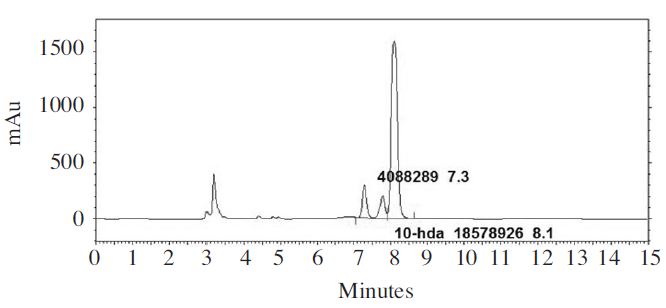
계통별로 생산된 로알젤리는 용량플라스크에 넣은 후 메탄올을 사용하여 100mg/mL의 농도가 되도록 희석하고 40°C에서 30분간 초음파 추출기를 사용하여 진탕 추출한 후 0.45μm 필터를 사용하여 여과하였다. 표준물질 10-HDA(Nacalai tesque, JAPAN)는 메탄올을 이용하여 0.1mg/mL의 농도가 되도록 희석하여 사용하였다. 시료 및 표준용액은 실험 전까지 4°C 냉장고에 보관하였으며, 건강기능식품공전 분석법에 따라 HPLC (Shiseido Co., Ltd., Tokyo, Japan)를 이용하여 정량 분석하였다(Fig. 3). 컬럼은 C18(Shiseido Capcellpak C18 MG 4.6mm×250mm)를 사용하였고, 이동상 용매는 0.02M(NH4)2HPO4가 첨가된 물(water, A)과 MeOH(B)를 6:4의 비율로 사용하였다. 용매의 유속은 1mL/min, 컬럼 온도는 40°C, 파장조건은 210nm, 시료는 5μl를 주입하였다.
qRT-PCR을 이용한 MRJP 유전자 발현량 조사
꿀벌 계통에 대한 MRJP 유전자 발현량을 조사하기 위해 각각의 꿀벌 계통에서 갓 태어난 유봉의 등(thorax)을 마킹펜을 이용해 마킹하는 방법을 통해 1일, 5일, 10일 15일째 일벌을 채집한 뒤 머리만 분리하여 Total RNA를 추출하였다. Total RNA는 각각의 시료를 액체질소로 동결시킨 상태에서 마쇄한 후 RNeasy mini kit (Qiagen)의 방법에 따라 분리하였으며, 최종적으로 50μL RNase-free water에 elution 하였다. Total RNA 농도는 260nm/280nm 흡광도 값의 비율로 결정하였으며, 분리한 RNA는 amfiRivert cDNA systhesis Master Mix(GenDEPOT)에 의한 역전사 효소반응(RTPCR)을 통해 First-Strand cDNA를 합성하였다. First-Strand cDNA는 MRJP 특이적 primer를 이용한 PCR 반응에 사용하였으며, control primer로는 β-actin(Accession No. AB02305)을 이용하였다(Table 1). qPCR 증폭반응은 Exicycler™96 (Bioneer)를 사용하였다. qPCR 증폭반응을 위한 각각의 reaction volume 은 25μl로, 1μl의 cDNA와 10 pmol primer, 12.5μL SYBR Green Supermix (Bioneer)를 반응에 사용하여 Pre-denaturation 94°C 5분 후 94°C 30초, 52°C 30초, 72°C 30초로 40 cycle을 반복한 후 65°C에서 94°C의 melting단계를 수행하였다.
통계처리
각 실험결과에 대한 통계분석은 SPSS program(Ver. 22.0, IBM, USA)을 이용하였다. 로얄젤리 생산성, 접수율, 10-HDA 함량 분석결과는 일원배치분산분석(one-way ANOVA)법을 이용하여 비교하였으며, 각 실험 군간의 유의적 차이는 Duncan’s multiful range test(p<0.05)로 검증하였다. MRJP 유전자 발현량에 대한 통계분석은T-test 분석법을 이용하였다.
결과 및 고찰
꿀벌 계통별 로얄제리 생산성 평가
서양종꿀벌 계통에 따른 로얄제리 생산성 평가는 농촌진흥청 국립농업과학원에서 보유 중인 서양종 꿀벌 계통 A, C 계통에 대해 이루어졌으며, 대조군으로는 양봉농가로부터 구매한 서양종꿀벌 계통을 사용하였다. 로얄제리 생산량 조사 결과, 계통 A, C와, 대조구의 로얄제리 생산량은 각각 27.95±3.04g/hive, 33.70±7.41g/hive, 22.31±13.71g/hive로, 계통 C의로얄 제리 생산량이 가장 높은 것으로 확인되었으나(Fig. 1), 통계적인 유의성은 없었다(Oneway AONOVA test: F(2,6)=1.156, p=0.376). 이때 로얄제리 생산에 따른 접수율은 계통 A, C와, 대조구에서 각각 68.6%, 87.8%, 78.4%로 조사되어 역시 계통 C가 가장 높은 것으로 확인되었으나(Fig. 2), 통계적인 유의성은 없는 것으로 확인되었다(Oneway AONOVA test: F(2,6)=2.243, p=0.187).
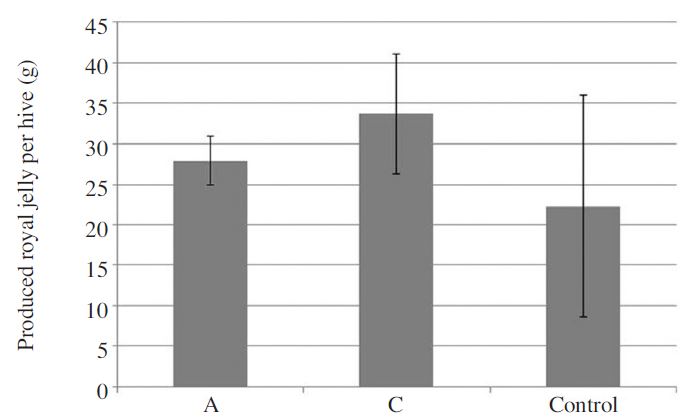
Average royal jelly production (g) per hive in different honeybee lines and the unselected commercial lines that was used as control. Bars indicate the standard deviation in replications.
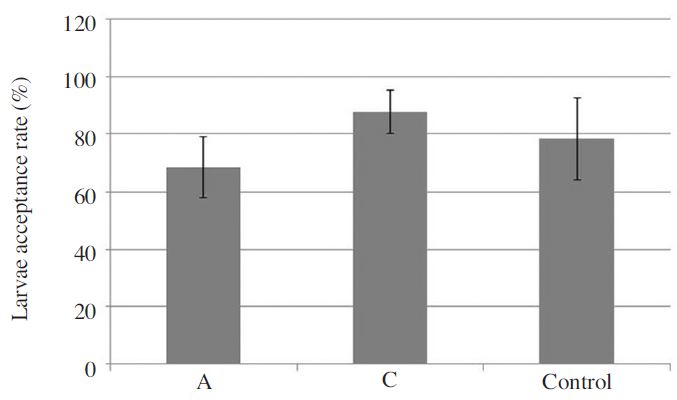
The average larvae acceptance rate (%) in different honeybee lines and the unselected commercial line that was used as control. Bars indicate the standard deviation in replications.
로얄제리 생산성에 영항을 미치는 요인들은 꿀벌 계통에 따른 유전적인 요인인 내부요인과 영양상태, 기후, 온도, 습도 등의 외부요인으로 나눌 수 있는데, 로얄제리 생산성의 경우 유전적 요인보다는 환경적 요인 및 기술적 요인과 같은 외부요인이 주요하게 작용할 수 있다(이 등, 2007; Albarracín et al., 2006; Chang, 1977; Faquinello et al., 2011; Ostrovski-Tomporoski et al., 2016). 그러나 여전히 많은 연구자들에 의해 로얄제리 및 기타 양봉산물의 생산량을 높일 수 있는 꿀벌 육종연구가 수행되고 있다. Jianke 등(2010)은 로얄제리 생산성이 월등히 우수한 계통을 육종한 바 있는데, 이들은 이탈리안 계통의 로얄제리 생산량은 35.28g에 그치는 것에 반해 로얄제리 생산 우수계통의 로얄제리 생산량은 151.92g으로 일반계통에 비해 로얄제리 생산량이 월등히 우수하다고(5배) 보고한 바 있다 . 이 결과는 본 연구 결과와 비교해 보아서도 로얄제리 생산량이 월등히 우수한 것으로 확인되었다. 그러나 앞서 기술한바와 같이 로얄제리 생산량은 봉군의 발육 상황, 배치, 온도, 생산기술 등 외부요인에 큰 영향을 받을 수 있어 단순 생산량만을 놓고 비교 하는 것은 적절하지 않지만 지속적인 육종 연구를 통한 우수 계통 선발 노력은 더욱 필요할 것으로 여겨진다.
10-HDA 함량 분석
10-HDA((E)-10-hydroxydec-2-enoic acid)는 로얄제리의 품질 및 신선도와 관련 있는 것으로 알려진 물질로, 본 연구에서는 꿀벌 계통에 따른 10-HDA 함량 차이를 비교 하고자 계통 A, C, 대조군에 대한 10-HDA 함량 분석을 수행하였다(Fig. 4). 분석 결과, 계통 C의 10-HDA 함량은 4.28%(±0.3)로 가장 높았으며, 계통 A는 4.18%(±0.2), 대조군은 4.02%(±0.3)로 C 계통에 비해 다소 낮은 것으로 확인 되었으나(Fig. 5), 통계적인 유의성은 관찰 되지 않았다(Oneway AONOVA test: F(2,6)=0.659, p=0.551). 본 연구결과에 따르면 10-HDA 함량이 가장 높은 계통 C는 봉군당 로얄제리 생산성 또한 가장 우수한 것으로 확인되었다. 현재까지 로얄제리 생산성과 10-HDA 함량간의 상관관계는 알려진 바가 없다. 하지만 본 연구결과에 비추어 볼 때 꿀벌계통에 따른 10-HDA 함량 차이는 발생 할 수 있을 것이라 여겨지며, 추후 관련 연구를 확대할 필요가 있을 것으로 기대하고 있다.
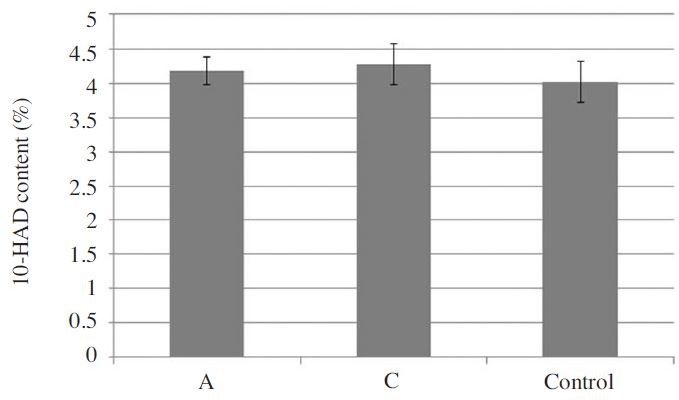
Total amount of 10-HDA in royal jelly produced by the two honeybee lines and the unselected commercial line that was used as control. Bars indicate the standard deviation in replications.
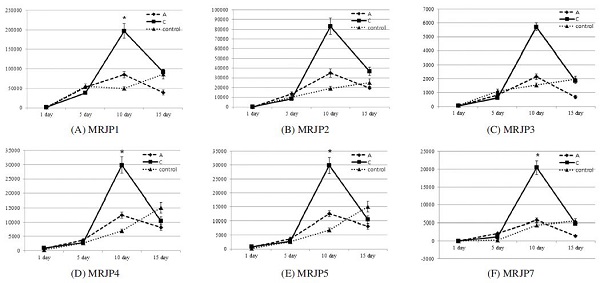
Quantitative real-time PCR analysis of major royal jelly protein (MRJP1) (A), MRJP2 (B), MRJP3 (C), MRJP4 (D), MRJP5, (E) and MRJP7 (F). Transcript alterations of MRJP1, MRJP2, MRJP3, MRJP4, MRJP5, and MRJP7. The total RNA of hypopharyngeal gland were extracted and samples were normalized with actin gene as the control housekeeping gene. Asterisks indicate statistically significant differences of the transcription level between the honeybee lines at each development stage (p<0.05).
한 등(2012)의 연구결과에서는 농가로부터 수집한 로얄제리 10-HDA 초기 함량이 2.9%이며, 이는 보관온도에 따라 크게 달라질 수 있다고 밝힌 바 있으며, Antinelli 등(2003) 또한 로얄제리 10-HDA 초기 함량이 프랑스 샘플의 경우 2.5%, 태국 샘플의 경우 1.7%이며, 한 등(2012)의 결과와 마찬가지로 보관 온도 및 기간에 따라 함량이 줄어들 수 있다고 밝혔다. 본 연구결과와 비교해 보면, 국내 육성 계통의 10-HDA함량은 기존 문헌에 알려져 있는 10-HDA함량에 비해 이월등히 높은 것으로 확인되어 국내 육성 로얄제리 생산 계통의 로얄제리는 품질 면에서 우수한 것으로 평가 될 수 있을 것이다.
MRJP 유전자 발현량 평가
본 연구에서는 국내 육성 꿀벌 계통에 대한 일령(1일, 5일, 10일, 15일)별 MRJP(major royal jelly proteins) 전사체 발현량을 qRT-PCR을 통해 분석하였다. 본 연구에서 사용된 MRJP 유전자는 MRJP1, MRJP2, MRJP3, MRJP4, MRJP5, MRJP7 유전자이며, 사용된 primer 정보는 Table 1과 같다. 결과에 따르면 MRJP 전사체 발현량은 꿀벌 계통A와 계통 C 모두 1일령에서 10일령까지 꾸준히 발현량이 증가하다, 15일령 이후 감소하는 것을 확인 할 수 있었다. Jianke 등(2010)의 결과에 따르면, 서양종 꿀벌 MRJP1, MRJP2, MRJP3 전사체 발현량은 로얄제리 생산량이 많은 12일령까지 꾸준히 증가하는 경향을 보이다 12 일령을 기점으로 감소하였는데, 이는 꿀벌 하인두선의 소포(acini) 직경의 크기 변화와 직접적인 관련이 있다고 밝히기도 하였다.
각각의 일령에 따른 MRJP 발현량의 차이를 보면, 5일령 일벌의 경우 계통A와 대조구는 C 계통에 비해 약간 높은 경향을 보이고 있었으나, 통계적으로 유의하지 않은 수준의 차이를 보이고 있었다. 10일령 일벌의 MRJP 발현량은 계통 A 및 대조구의 일벌과 비교했을 때 계통C에서 큰 폭으로 발현량이 증가 한 것을 확인 할 수 있었으며, 특히 MRJP1, MRJP4, MRJP5, MRJP7 유전자의 발현량은 통계적으로 유의미한 차이를 보이는 것을 확인할 수 있었다. 이 시기의 꿀벌은 로얄제리 생산을 가장 활발하게 하는 시기로, 계통C의 로얄젤리 생산성은 MRJP 유전자의 발현량과 큰 상관관계가 있을 것으로 보여 진다. 15일령의 일벌은 10일령과 마찬가지로 C 계통의 MRJP 발현량이 A 계통에 비해 높지만, 대조구의 경우 계통 C와 비슷하거나 오히려 약간 높은 경향을 보였다. 하지만 통계적으로 유의미한 수준은 아니었던 것으로 확인 되었다. Jianke 등(2010)의 결과에서는 로얄제리 생산성 우수꿀벌계통은 그렇지 않은 계통에 비해 MRJP1, MRJP2, MRJP3 전사체 발현량이 유의적으로 높은 것을 확인할 수 있었고, 이러한 결과를 종합해 볼 때 서양종 꿀벌 계통별 로얄제리 생산성과 MRJP 전사체 발현량과는 높은 상관관계가 있다고 볼 수 있다.
서두에 밝힌 바와 같이 현재 국내에서는 품목에 따른 서양종꿀벌 선발 및 육성연구가 활발히 이루어지고 있으나, 로얄제리 생산성에 특화 된 계통 육성에 관한 연구는 이번이 처음이다. 꿀벌 계통 육성 연구는 양봉산업 발전을 위해 필수적으로 선행 되어야 하는 연구임에도 불구하고 짧은 시간에 이루어 질 수 없는 어려움을 지니고 있다. 이에 본 연구에서는 국내 최초로 로얄제리 생산을 목적으로 하는 계통을 선발하였으며, 추후 이를 바탕으로 로얄제리 생산성이 우수한 계통을 지속적으로 육성할 수 있는 기반을 마련하고자 한다.
적 요
로얄제리 생산성 우수계통 선발을 위해 국내 육성서양종꿀벌 원종 계통인 A와 C에 대한 로얄제리 생산성 및 접수율 평가를 수행하였다. 그 결과 꿀벌 계통C의 로얄제리 생산량은 33.7±7.41g로 A 계통에 비해 높은 것으로 드러났으며, 접수율 또한 87.8±7.5%로 A 계통에 비해 높은 것으로 확인되었다. 이들 계통으로부터 생산된 로얄제리 trans-10-hydroxy-2-decenoic acid (10-HDA) 함량을 분석한 결과 꿀벌 계통C는 4.28%(±0.3)으로, A 계통에 비해 높은 것으로 나타났다. 일령에 따른 major royal jelly proteins(MRJPs) 전사체 발현량을 비교한 결과 10일령의 일벌의 경우 C 계통이 A 계통에 비해 MRJP 발현량이 큰 폭으로 증가했음을 확인 할 수 있었으며, 15일령의 일벌의 MRJP 발현량 또한C계통이 A 계통에 비해 높은 것을 확인할 수 있었다. 이러한 결과를 통해 본 연구에서는 국내 육성 서양종꿀벌 기본종 계통 중 로얄제리 생산성이 가장 우수한 계통은 C 계통인 것으로 평가 되었으며, 향후 로얄제리 생산성 우수 계통 선발을 위한 기초 자료로 제공 될 수 있을 것이라 기대하고 있다.
Acknowledgments
본 연구는 농촌진흥청 시험연구사업(PJ01203601)의 연구비로 수행된 결과이며 이에 깊은 감사를 드립니다.
인 용 문 헌
- 이만영, 이명렬, 김영수, 이광길, 조상균, Ge Fengchen, (2007), 이충 및 봉군 벌집배열에 따른 로얄제리 생산량, 한국양봉학회지, 22(2), p153-157.
- 이명렬, 이만영, 심하식, 최용수, 김혜경, 변규호, 김인석, 권천락, (2014), 우수 삼원교배종 꿀벌(Apis mellifera L.)의 형질 특성, Journal of Apiculture, 29(4), p257-262.
- 한상미, 우순옥, 홍인표, 최용수, 김정민, 조윤희, (2012), 저장방법에 따른 로얄제리의 주요성분 및 생리활성 변화, 한국양봉학회지, 27(2), p143-148.
- Albarracín, VN, S.R.C. Funari, E.M.R. Arouco, and R.O. Orsi, (2006), Acceptance percentage of larvae from different genetic groups of Apis mellifera in queen bee production, Archivos Latinoamericanos de Producci?n Animal, 14, p33-41.
- Albert, S., D. Bhattacharya, Klaudiny, J., Schmitzova, J., and Simuth, J., (1999a), The family of major royal jelly proteins and its evolution, J. Mol. Evol., 49, p290-297.
- Albert, S., Klaudiny, J., and Simuth, J., (1999b), Molecular characterization of MRJP3, highly polymorphic protein of honeybee (Apis mellifera) royal jelly, Insect Biochem. Mol. Biol., 29, p427-434.
-
Albert, S., and J. Klaudiny, (2004), The MRJP/YELLOW protein family of Apis mellifera: Identification of new members in the EST library, J. Insect Physiol, 50, p51-59.
[https://doi.org/10.1016/j.jinsphys.2003.09.008]

-
Antinelli, J. F., S. Zeggane, R. Davico, C. Rognone, J. P. Faucon, and L. Lizzani, (2003), Evaluation of (E)-10-hydroxydec-2-enoic acid as a freshness parameter for royal jelly, Food chemistry, 80(1), p85-89.
[https://doi.org/10.1016/s0308-8146(02)00243-1]

-
Cao, L. F., H. Q. Zheng, C. W. Pirk, F. L. Hu, and Z. W. Xu, (2016), High Royal Jelly-Producing Honeybees (Apis mellifera ligustica) (Hymenoptera: Apidae) in China, Journal of economic entomology, 109(2), p510-514.
[https://doi.org/10.1093/jee/tow013]

- Cavusog˘lu, K., K. Yapar, and E. Yalcin, (2009), Royal jelly (honey bee) is a potential antioxidant against cadmiuminduced genotoxicity and oxidative stress in albino mice, J. Med. Food, 12, p1286-1292.
- Chang, S. Y., (1977), Effects of size and type of queen cup on the production of royal jelly and acceptance by nurse bees, Thesis (Master Science), National Chang Hsing University, Thaichung, Taiwan.
- Doolittle, G. M., (1899), Mr. Doolittle´s queen rearing methods, American Bee Journal, 39, p435-436.
-
Drapeau, M. D., S. Albert, R. Kucharski, C Prusko, and R. Maleszka, (2006), Evolution of the Yellow/Major Royal Jelly Protein family and the emergence of social behavior in honey bees, Genome Research, 16(11), p1385-1394.
[https://doi.org/10.1101/gr.5012006]

- Faquinello, P., V.A.A. Toledo, E.N. Martins, C.A.L. Oliveira, M.J. Sereia, F.M. Costa-Maia, and M.C.C. Ruvolo- Takasusuki, (2011), Parameters for royal jelly production in Africanized honeybees, Sociobiology, 57, p495-509.
- Haydak, M. H., (1970), Honey bee nutrition, Annual review of entomology, 15(1), p143-156.
-
Jianke, L., F. Mao, D. Begna, F. Yu, and Z. Aijuan, (2010), Proteome comparison of hypopharyngeal gland development between Italian and royal jelly producing worker honeybees (Apis mellifera L.), Journal of proteome research, 9(12), p6578-6594.
[https://doi.org/10.1021/pr100768t]

-
Kim, H. K., M. L. Lee, Y. S. Choi, and B. R. Jin, (2015), Microsatellite markers developed by next-generation sequencing differentiate inbred lines of Apis mellifera, Journal of Asia-Pacific Entomology, 18, p801-805.
[https://doi.org/10.1016/j.aspen.2015.10.003]

-
Klaudiny, J., J. Kulifajova, K. Crailsheim, and J. Simuth, (1994), New approach to the study of division of labour in the honeybee colony (Apis mellifera L.), Apidologie (Celle), 25, p596-600.
[https://doi.org/10.1051/apido:19940610]

-
Knecht, D., and H. H. Kaatz, (1990), Patterns of larval food production by hypopharyngeal glands in adult worker honey bees, Apidologie, 21(5), p457-468.
[https://doi.org/10.1051/apido:19900507]

- Liu, Z., T. Ji, L. Yin, J. Shen, F. Shen, and G. Chen, (2013), Transcriptome sequencing analysis reveals the regulation of the hypopharyngeal glands in the honey bee, Apis mellifera carnica Pollmann, PloS one, 12, pe81001.
-
Mouro, G. F., and V. D. A. A. D. Toledo, (2004), Evaluation of Apis mellifera Carniolan and Africanized honey bees in royal jelly production, Brazilian Archives of Biology and Technology, 47(3), p469-476.
[https://doi.org/10.1590/s1516-89132004000300018]

-
Nakajima, Y., K. Tsuruma, M. Shimazawa, S. Mishima, and H. Hara, (2009), Comparison of bee products based on assays of antioxidant capacities, BMC Complement. Altern. Med., 9, p4.
[https://doi.org/10.1186/1472-6882-9-4]

-
Ohashi, K., S. Natori, and T. Kubo, (1997), Change in the Mode of Gene Expression of the Hypopharyngeal Gland Cells with an Age-dependent Role Change of the Worker Honeybee Apis mellifera L., European journal of biochemistry, 249(3), p797-802.
[https://doi.org/10.1111/j.1432-1033.1997.t01-1-00797.x]

- Ostrovski-Tomporoski, K., P. Faquinello, F. M. Costa-Maia, M. C. Ruvolo-Takasusuki, P. da Rosa Santos, and V. A. de Toledo, (2016), Breeding Program Design Principles for Royal Jelly, In Beekeeping and Bee Conservation-Advances in Research, In Tech.
-
Viuda-Martos, M., Y. Ruiz-Navajas, J. Fernandez-Lopez, and J. A. Perez-Alvarez, (2008), Functional properties of honey, propolis, and royal jelly, J. Food Sci., 73, pR117-R124.
[https://doi.org/10.1111/j.1750-3841.2008.00966.x]