초고속 유전자 증폭법을 이용한 서양뒤영벌 의심병원체 Lysinibacillus fusiformis의 신속 검출법
Abstract
Lysinibacillus fusiformis has been suspected to be a pathogen of Bombus terrestris in Korea since 2008. In this study, we developed the rapid detection method for the L. fusiformis by utilizing the Ultra-rapid PCR. After optimizing of L. fusiformis-specific Ultra-rapid PCR, it can detect the existence of 1.0×108 L. fusiformis-specific DNA molecules in 4 minute and 22 seconds. Even, only 10 molecules could be detected quantitatively using this method. In addition, for the first time, in our knowledge, L. fusiformis was detected using proposed method from bumblebee produced commercially in Korea. Not only in the laboratory but also in the field, L. fusiformis-specific Ultra-rapid PCR would be applied and might be expected as convenient tools at production of bumblebee or inspection for the import and export of bumblebee.
Keywords:
Lysinibacillus fusiformis, Bumblebee, Bombus terrestris, Ultra-rapid PCR, Rapid detection서 론
Lysinibacillus fusiformis는 비운동성 그람양성 간균으로, 1901년 처음 발견되었다. L. fusiformis는 2007년까지 Bacillus fusiformis라 알려졌으나, Bacillus 속이 세분화 되면서 세포벽에 L-lysine을 포함한다는 이유 등으로 Lysinibacillus 속이 독립되었으며, 새롭게 L. fusiformis로 분류되었다(Ahmed et al., 2007). 또한, L. fusiformis는 일명 복어독으로 알려진 중추신경계를 마비시키는 신경독인Tetrodotoxin의 생성균주로 알려져 다른 의미에서 주목 받은 바가 있었다(Wang et al., 2010).
뒤영벌에 감염 또는 기생하는 생물체는 바이러스, 세균, 응애류 등을 포함하여 100종이 넘는 것으로 보고되고 있다. 수입된 서양뒤영벌(Bombus terrestris)에서 기생성 응애가 발견되고 그 심각성이 보고된 바 있으며(Schmid-Hempel, 2001), 국내에서는 실내사육 중인 호박벌(Bombus ignitus)의 유충에서 석고병균(Aspergillus flavus Link)이 분리된 바가 있었다(남 등, 2003). 또한 최 등(2009)과 최 등(2010)에서는 꿀벌의 바이러스가 뒤영벌류에 교차 감염되는지 여부를 확인하였으며 그 결과 국내의 서양뒤영벌에서 7종의 바이러스가 교차 감염되는 것을 처음으로 확인하였다.
L. fusiformis가 뒤영벌의 병원체로써 의심되기 시작된 것은 화분매개 곤충으로 사육된 서양뒤영벌의 급작스러운 폐사에서, 이 원인을 규명하고자 사충에서 병원성 세균들을 분리 동정하였고, 이 연구에서 L. fusiformis가 동정된 이후이다(김 등, 2008). 하지만 이는 L. fusiformis가 초기 감염세균으로 뒤영벌에 감염되어 뒤영벌을 치사시킨 것인지, 또는 사체가 된 후에 이차 침입 세균으로 사체에서 단순 성장된 것인지 현재로써 판단하기는 어려운 것이 현실이다.
현재까지 L. fusiformis 검출에 대한 연구는 뒤영벌의 다양한 병원체들에 대한 실시간 다중 PCR법(민 등, 2017)에서 처음 제시된 바 있었으나, L. fusiformis의 검출을 위한 보다 현장 적용성이 있고, 신속한 방법은 개발된 바가 없었다. 또한, 국내의 뒤영벌에서 L. fusiformis를 검출한 연구는, 앞서 언급한 김 등(2008)의 분리 동정 연구 외에 찾아볼 수 없었으며, 국내 뒤영벌에서 이들의 감염 현황을 파악하는 것은 유관된 자료조차 찾기 어려웠다.
한편, 초고속 PCR (Ultra-Rapid PCR)은 특이 유전자를 10분 이내 증폭해 낼 수 있는 PCR기법을 말하며(Han et al., 2008), 근래 더욱 발전되어 SHB (Small Hive Beetle)의 특이 유전자 검출, 꿀벌 병원체들의 초신속 검출 등에 적용되어, 수 분내 목적한 특이유전자를 증폭하여 이의 존재를 정량적으로 증명할 수 있음을 보여주었다(김 등, 2017; 임 등, 2017).
따라서, 본 연구에서는 초고속 PCR법을 적용하여 서양뒤영벌의 병원체로 의심되는 L. fusiformis의 가장 빠른 검출 조건을 수립하여, 이를 통해 L. fusiformis의 뒤영벌 병원체 여부를 판단하는 연구에 앞서 이를 정량적으로 검출하는 방법을 제시하고자 하였다. 또한, 국내에서 판매되고있는 화분매개용 뒤영벌 사체에서 병원체의 존재여부를 확인하고자 하였다.
재료 및 방법
Lysinibacillus fusiformis 표준균주 및 배양
Lysinibacillus fusiformis 표준균주인 ATCC 7055를 KCTC에서 분양 받았으며, L. fusiformis 및 관련 재조합 균주들은 표준 LB배지(Biobasic, Korea)에서 37°C, 16시간을 기준으로 배양하여 사용하였다.
뒤영벌 시료 확보 및 genomic DNA의 추출
뒤영벌 시료는 2016년 8월 경기도 수원, 전라도 보성, 경상남도 창원, 경상북도 청송에서 구입된 서양뒤영벌(Bombus terrestris)을 사용하였다.
뒤영벌 genomic DNA (gDNA)의 분리를 위하여, 먼저 시료를 분쇄하였으며, 이는 뒤영벌 성충 1마리를 2.0ml tube에 넣고 glass bead (pore size: 1mm, Germany)와 혼합 후, MagNa Lyser (Roche, Switzerland)에 넣고, 6,000 rpm으로 분쇄하는 것이었다. 분쇄액은 DNeasy®Blood & Tissue Kit (Qiagen, Germany)의 방법을 따라 gDNA를 분리하였으며, 추출된 Total gDNA는 spectrophotometer로 260 nm에서 흡광도로 정량하고, -70°C에 보관하며 이후 실험에 사용하였다.
L. fusiformis의 gDNA 분리 또한 DNeasy® Blood & Tissue Kit (Qiagen, Germany)의 방법을 따랐으나, L. fusiformis가 gram-positive인 점을 감안하여 침전시킨 세균을 99°C에서 5분간 끓여준 뒤, 상기 kit의 gDNA 분리 방법을 적용하였다. 추출된 Total gDNA를 spectrophotometer로 정량하고, -70°C에 보관하며 이 후 실험에 사용하였다.
L. fusiformis 특이 유전자의 재조합 DNA 제작 및 Primer 선별
L. fusiformis 특이 유전자 재조합 DNA (pLF-159)는, 경기대학교 생명과학과 분자생물학 연구실에 확보된 것을 사용하였으며(민 등, 2017), 이는 GenBank CP010820.1 (L. fusiformis full genome)를 탑재하고 있다. pLF-159는 L. fusiformis 초고속 검출법의 최적화를 위한 표준으로 사용되었으며 추후 실제 뒤영벌에서의 병원체 검출의 표준 DNA로써 검출여부 판단에 사용되었다. L. fusiformis의 Glutamyl tRNA amidotransferase 유전자를 증폭하는 L. fusiformis 특이 프라이머 한 쌍을 사용하였다(Table 1).
L. fusiformis 특이 유전자 초고속 검출을 위한 PCR 조건 최적화
초고속 PCR의 최적화를 위하여, 주형으로 재조합 DNA pLF-159를 사용하였으며, OD260 (Optical Density 260nm)으로 정량한 후, 1.0×106 분자를 기준으로 초고속 PCR에 사용하였다. 초고속 PCR 기기는 GENECHECKER (Gene System Co., Korea)를 사용하였으며, 초고속 PCR의 온도 및 시간 조건은 95°C 초기변성 15초 후, 95°C 변성 3초, 혼성 3초, 72°C 중합 3초를 기준으로 하였고, 총 50 회전을 진행하였다. 최적 annealing 온도는 55~65°C 범위에서 구하였으며, 최적의 primer 농도는 10μM, 8μM, 4μM, 2μM, 1μM, 0.5μM, 0.25μM에서 각기 CT (Threshold Cycles)값과 최대 형광값을 고려하여 조정하였다. 이후, 초고속 PCR의 온도 및 시간 조건은 상기의 기준조건부터 최적 혼성온도와 시간을 CT 값과 최대 형광값을 기준으로 재조정하였다.
L. fusiformis 특이 유전자의 최소 검출 시간에 따른 검출 한계 초기주형량 측정
L. fusiformis 특이 초고속PCR의 최소 검출 시간에서 특이 검출의 한계를 측정하기 위하여 초고속 PCR의 각 회전 중 혼성, 중합의 시간을 각각 3초에서 1초까지 감소시켜 각 온도와 시간 조건에 따른 CT 값과 CT 값이 측정되는 시간(CT time)을 측정하였다. 이 측정에서는 재조합 DNA인 pLF-159를 1.0×108 분자부터 1.0×100 분자까지 연속 희석하여, 초고속 PCR의 주형으로 사용하였으며, 초고속 PCR의 각 단계에서 시간 및 온도 조건도 가감하여, L. fusiformis 특이 초고속 PCR이 최소 검출 시간 내에 검출 가능한 최소 초기기질의 한계주형량을 도출하였다.
L. fusiformis gDNA를 이용한 L. fusiformis 특이 초고속 PCR 정량
L. fusiformis 특이 초고속 PCR에 적합한 L. fusiformis gDNA 사용량을 정하기 위하여, 또한 재조합 DNA pLF-159를 사용하여 구한 정량식의 보정을 위하여, L. fusiformis 에서 추출한 gDNA을 주형으로, 다양한 초기주형량에 대한 L. fusiformis 특이 유전자의 증폭을 측정하였다.
PCR 반응은 5μl의 2×Rapi master mix와 1μl씩의 L.fusi detection F2/R2(최종 농도 4μM) 프라이머에 L. fusiformis gDNA(최고 50ng에서 최저 1ng까지 희석)을 첨가하여 총 10μl로 조성하여 수행하였으며, 이때의 positive control로써 1.0×106 분자의 L. fusiformis 유전자를 포함하는 재조합 DNA를 사용하여 L. fusiformis PCR 산물의 합성 유무와 특이 Tm (Temperature of midpoint)값을 비교하였다. 초고속 PCR의 각 단계에서 시간 및 온도 조건은 앞서 실험에서 최적화한 조건을 사용하여 95°C 초기 변성 15초 후, 95°C 변성 1초, 57°C 혼성 2초, 72°C 중합 2초를 표준으로 하였고, 총 50 회전을 진행하였다.
국내 뒤영벌에서 L. fusiformis 특이 초고속 PCR을 적용한 검출
국내에 판매되고 있는 서양뒤영벌의 L. fusiformis 감염여부를 판단하기 위하여, 경기도 수원, 전라도 보성, 경상남도 창원, 경상북도 청송에서 생산된 뒤영벌 각 1마리에 대하여 gDNA를 분리하였다. gDNA는 각 50ng을 사용하여 뒤영벌에 대하여 L. fusiformis 특이 초고속 PCR을 수행하였다. PCR 반응은 5μl의 2×Rapi master mix와 1μl씩의 L.fusi detection F2/R2(최종농도 4μM) 프라이머로 총 10μl로 조성하여 수행하였다. L. fusiformis 특이 초고속 PCR은 GENECHECKER(Gene System Co., Korea)를 사용하였으며, PCR 조건은 95°C, 15초 초기 변성 후, 95°C, 1초 변성, 57°C, 2초 혼성, 72°C, 2초 중합의 조건으로 50 회전을 진행하였다.
결과 및 고찰
L. fusiformis 특이 유전자 초고속 검출을 위한 PCR 조건 최적화
L. fusiformis 특이 초고속PCR에서 최적의 혼성 온도를 파악하고자 재조합 DNA 1.0×106 분자의 pLF-159를 사용하였으며, 초고속 PCR의 온도 및 시간 조건은 95°C 초기 변성 15초 후, 95°C 변성 3초, 55~65°C 혼성 3초, 72°C 중합 3초를 표준으로 총 50 회전 진행하였다.
가장 빠른 CT는 혼성 온도 57°C일 때 23.28 회전으로 측정되었으며, 이에 이르기까지 소요된 PCR 진행시간(CT time)은 10분 44초이었다. 따라서 L. fusiformis 특이 초고속 PCR에서 최적 혼성 온도는 CT 값(23.28 회전), 최종 형광값(증폭량, F=221) 모두에서 우수한 결과를 보인 57°C로 결정하였다(Fig. 1).
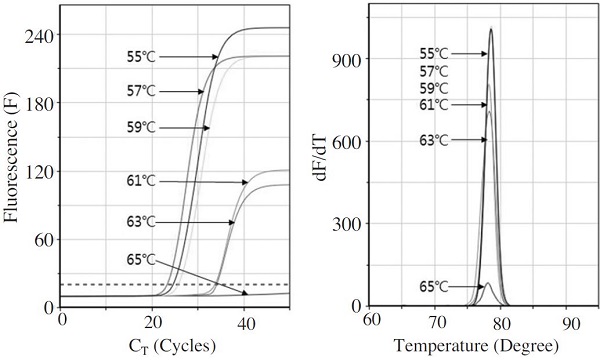
Optimization of annealing temperature using L. fusiformis-specific Ultra-rapid PCR. The optimal annealing temperature for the Ultra-rapid real-time PCR was tested in the range from 55°C to 65°C, the lowest CT of 23.28 cycles and the fastest CT time of 10 minutes 44 seconds was measured on 57°C, annealing temperature.
또한, 초고속 PCR에서 L. fusiformis 특이 primer의 최적 농도를 구하기 위하여 각 10μM, 8μM, 4μM, 2μM, 1μM, 0.5μM, 0.25μM의 농도의 primer를 각각 사용하여 실험하였다. 특이 primer의 최적 농도는 가장 빠른 CT 값과 최종 형광값을 기준으로 판단하였으며, 최종 농도 4μM에서 초고속 PCR은 가장 빠른 20.28 회전의 CT 값을 보였으며, 최종 형광값 또한 가장 높게 측정되었다. 따라서 L. fusiformis 특이 초고속 PCR에서 최적 primer의 농도는 CT (20.28±0.08 회전)와 CT time (7분 56초)에서 가장 빠른 검출시간을 보였으며, 최종 형광값(223±17.67) 모두에서 가장 우수한 결과를 보인 4μM을 최적 프라이머 농도로 결정하였다(Fig. 2).
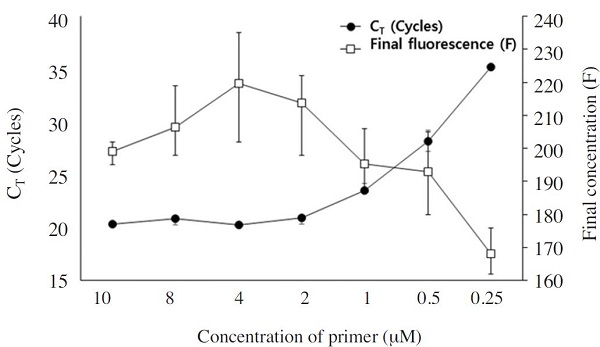
Optimization of primer concentration using L. fusiformis-specific Ultra-rapid PCR. Using various concentration of primers, optimal concentration of L. fusiformis-specific primer were selected for Ultra-rapid PCRs. Using each 4μM primers, CT was estimated the lowest cycles than others. Also, CT time was estimated the fastest time than others. Based on this reasons, optimal concentration of primer was selected as 4μM (CT=20.28±0.08, CT time=7min 56sec, F=223±17.67).
L. fusiformis 특이 유전자의 최소 검출 시간에 따른 검출 한계 초기주형량 측정
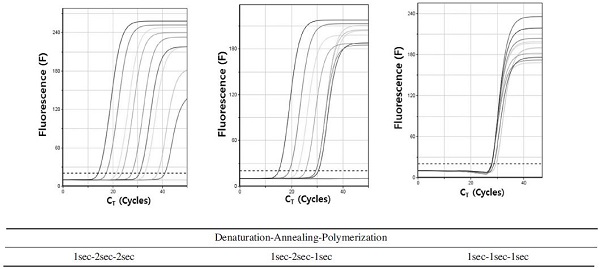
PCR의 각 단계의 시간 단축은 초고속 검출에 있어서 전체 검사 시간을 줄일 수 있는 가장 중요한 요소로써 작용한다. L. fusiformis 유전자의 최단 검출 시간을 위해, PCR 각 단계(혼성, 중합)의 시간을 3초에서 1초까지 조절하여 초고속 PCR을 시행하였고 변성시간은 1초로 고정하여 실험을 수행하였다.
1.0×103 pLF-159 분자를 기질로 사용한 초고속 PCR에서 각 회전의 혼성 시간을 3초로 조정한 결과, CT 값은 28.77 회전으로 감소되었으며, CT time은 9분 40초만에 L. fusiformis 특이 유전자의 증폭을 확인할 수 있었다. 같은 조건에서 각 혼성시간만 2초, 1초로 감소시킨 초고속 PCR은 해당 CT 값이 혼성시간이 짧아질수록 증가하는 결과를 보여주었으며, 해당 CT time은 다소 증감하는 양상을 보였지만 혼성단계를 2초로 주었을 경우 분명한 감소세를 보여주었다.
PCR 반응에서 중합 시간 또한 3초, 2초, 1초로 감소시킨 결과, 1초의 중합시간을 준 초고속 PCR에서 CT time은 8분 29초로 중합시간이 3초였을 때와 비교해보면, 1분 이상의 차이로 크게 감소한 것이 측정되었다. 이는 L. fusiformis 특이 초고속 PCR의 각 변성, 혼성, 중합 시간을 1초로 설정하여도 특이 증폭이 가능함을 보여준 것이다(Fig. 3).
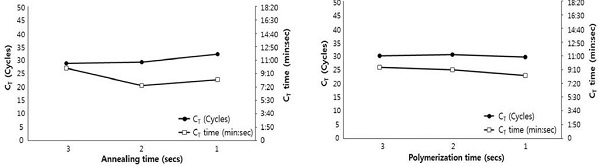
Minimum time of annealing and/or polymerization in L. fusiformis-specific Ultra-rapid PCR. The annealing time and polymerization time were shortened to set the minimum detection time in L. fusiformis-specific Ultra-rapid PCR. Denaturation step was fixed at 1 sec in each cycle of PCR and the times of annealing step and/or polymerization step were shortened from 3 sec to 1 sec.
한편, 변성, 혼성, 중합시간을 각 1초, 2초, 1초로 단축한 결과, DNA 증폭을 나타내는 형광곡선은 초기주형량에 따라 비교적 정상적인 증가를 보여주었으나 1.0×103 분자 이하의 초기 주형 DNA의 증폭에서 크게 왜곡됨이 빈번하게 나타났다. 또한 변성, 혼성, 중합시간을 각 1초, 1초, 1초로 단축한 최단 시간 조건은 DNA 증폭을 나타내는 형광곡선이 1.0×108 분자부터 1.0×100 분자까지 동일한 CT 값에서 동시에 증폭됨을 볼 수 있어 정량적 측정이 불가능하다고 판단하였다(Fig. S1).
따라서 L. fusiformis 특이 초고속 PCR은 PCR 시스템의 안정성 또한 고려하여 각 회전의 변성, 혼성, 중합시간을 각 1초, 2초, 2초로 수행하였다.
또한, L. fusiformis 특이 초고속 PCR에서 L. fusiformis 유전자의 특이 증폭을 위한 최소 검출 시간을 측정하였다. 1.0×108 pLF-159 분자를 주형으로 사용하였으며, 최적화된 L. fusiformis 특이 초고속 PCR의 조성으로, 최적화된 온도조건하에 각 변성, 혼성, 중합 시간을 각 1초, 2초, 2초로 설정하고 50 회전을 수행하였다. 초기 변성 15초 후, 13.59 회전만에 CT line에 도달하였으며, CT time은 4분 8초였다. 38 회전(CT time은 11분 34초)전후에 최대 형광값을 보여주었으며, 50 회전의 초고속 PCR은 16분 47초에 종료되었다(Table S1).
L. fusiformis 특이 초고속 PCR의 검출한계 및 정량 범위
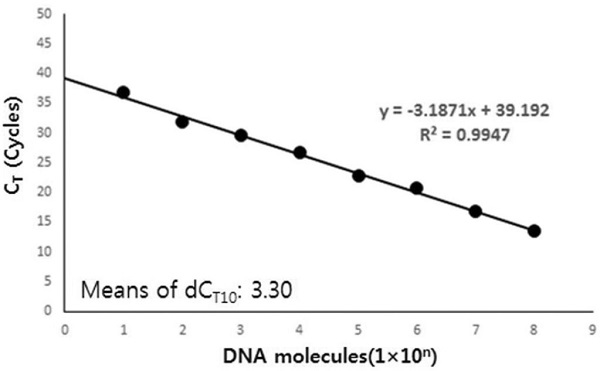
L. fusiformis 특이 초고속 PCR의 안정적 시간 조건(각 회전 중 변성, 혼성, 중합시간 각 1초, 2초, 2초)에서 L. fusiformis 유전자의 최소 검출한계를 확인하였다. L. fusiformis 특이 유전자 재조합 DNA 1.0×108를 연속 희석하여, 1.0×100 분자까지 초고속 PCR의 주형으로 사용하여 검출한계를 측정하였다(Fig. 4).
상기 조건에서 L. fusiformis 유전자는 1.0×101 분자의 초기 주형에서도 성공적으로 증폭이 가능함을 보여 우수한 민감도를 확인하였다. 10-1씩 감소시킨 초기분자량 간의 CT 값 차이를 dCT라 하며, 1.0×108 분자에서 1.0×101 분자까지의 평균 dCT 값은 약 3.30회 전이었고, 1.0×101 분자의 초기 주형에서도 평균 CT 값은 36.74 회전이었고, 평균 CT time은 11분 11초이었고, Tm값 또한 78.47°C로 L. fusiformis의 유효범위에 포함되었다. 따라서 안정적인 검출에 필요한 주형의 양은 1.0×101 분자 이상이라 판단되었다.
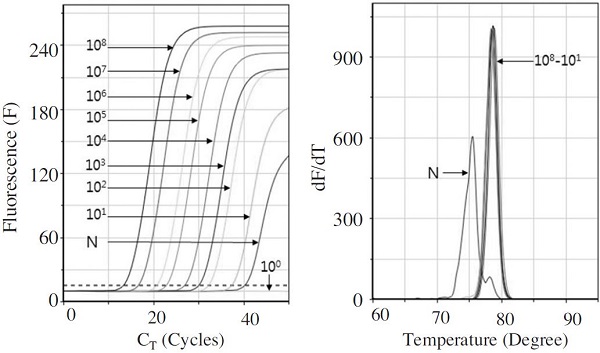
Detection limit of L. fusiformis-specific Ultra-rapid real-time PCR with serial diluted specific DNAs. The detection limit of L. fusiformis gene was estimated using L. fusiformis-specific Ultra-rapid real-time PCR under the minimum times of thermocycling (1 sec of denaturation step, 2 sec of annealing step, 2 sec of polymerization step). 1.0×101 molecules of pLF-159 was also amplified. Tms of all PCR products were measured as 78.55±0.73°C, except 1.0×100 molecule and PCR product using non template.
L. fusiformis 특이 유전자 대신 증류수를 넣어준 L. fusiformis 특이 초고속 PCR (N; non-template, Fig. 4)은 40 회전 부근에서 CT line을 넘는 증폭이 관찰되었으나, 이 Tm값은 L. fusiformis 유효범위의 Tm과 3.99°C 수준의 차이를 보이는 74.56°C로 측정되어 특이적 증폭이 아님을 쉽게 확인할 수 있었다.
한편, 재조합 DNA인 pLF-159를 사용한 초고속 PCR에서 연속 희석된 주형 DNA의 양에 따라 각 CT 값이 측정되었으며, 이에 따른 회귀식(Regression equation)은 y=-3.1871x+39.192 (y=초기 L. fusiformis의 분자수)로, 이 때 회귀 상수(Regression coefficient)는 R2=0.9947이었다.
또한, 정확한 정량을 위한 정량 가능 범위는 주형 DNA가 1.0×101 분자 이상 1.0×108 분자까지라 판단하였으며, 이를 정량가능범위로 정하였다(Fig. 5).
L. fusiformis gDNA를 이용한 L. fusiformis 특이 초고속 PCR 정량
재조합 DNA pLF-159를 사용하여 구한 정량식(Fig. 5)의 보정을 위하여, L. fusiformis 에서 추출한gDNA을 주형으로, 다양한 초기주형량에 대한 L. fusiformis 특이 유전자의 증폭을 측정하였다. L. fusiformis의 1ml 배양액으로부터 gDNA를 순수분리하여, 이 중 50ng, 25ng, 10ng, 1ng을 L. fusiformis-특이 초고속 PCR에 각각 초기 주형으로 사용하였다.
L. fusiformis-특이 초고속 PCR에서 L. fusiformis gDNA는 주형으로 정량적 증폭의 패턴을 보였으며, CT 값은 50ng에서 20.93 회전(CT time= 6분 22초), 25ng에서 23.45 회전(CT time=7분 8초), 10ng에서 26.64 회전(CT time=8분 7초), 1ng에서 28.18 회전(CT time=8분 35초)으로 측정되었다. 한편, 1.0×106 분자의 pLF-159를 사용한 초고속 PCR은 22회전의 CT 를 나타내어, L. fusiformis gDNA양에 따른 목적 유전자의 수 또는 L. fusiformis gDNA의 분자수를 계산할 수 있게 하였다(Fig. 6).
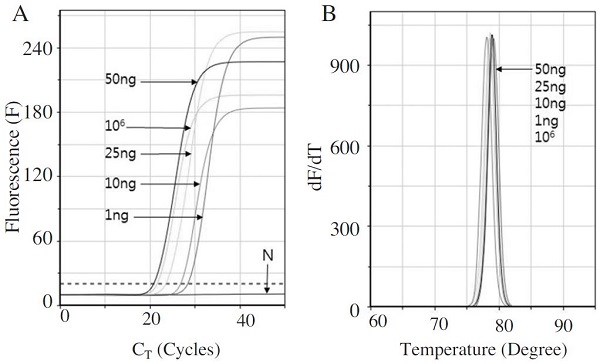
The comparison between gDNA of L. fusiformis and target gene on pLF-159. The Ultra-rapid PCR of L. fusiformis-specific gene was performed using 50ng-1ng gDNA of L. fusiformis and 1.0×106 molecules of pLF-159. Panel A is the fluorescent graph of amplification according to initial gDNA. Panel B is peak graph of Tm value.
국내 판매되는 뒤영벌에서 L. fusiformis 특이 초고속 PCR을 이용한 L. fusiformis 검출
L. fusiformis 특이 초고속 PCR의 유효성을 평가하기 위하여, 국내에서 판매되고 있는 뒤영벌을 수집하여 각 뒤영벌 시료로부터 gDNA를 분리하였으며, 분리된 각 gDNA 50ng을 사용하여 L. fusiformis 특이 초고속 PCR을 진행하였다. 사용된 뒤영벌 시료, 즉 수원, 보성, 창원, 청송 각 1개체에서 모두 L. fusiformis가 검출되었으며, 특히 창원의 시료의 경우 3곳의 시료에 비해 1,000배 이상 많은 L. fusiformis가 존재하는 것으로 정량적 계산이 가능하였다(Fig. 7).
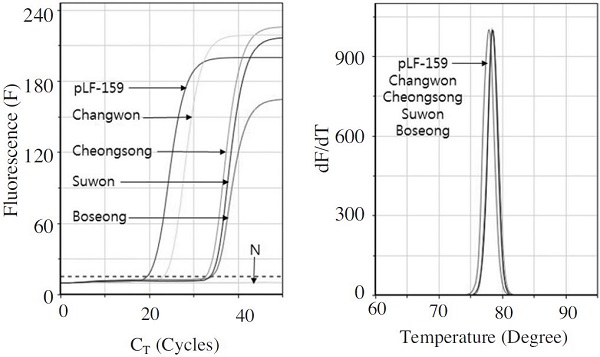
L. fusiformis-specific UR-PCR for the detection with commercial bumblebee samples. UR-PCR was performed with 50ng gDNA from dead bumblebee as inital templates. The PCR condition was 95°C, 15 sec of pre-denaturation, 95°C, 1 sec of denaturation, 57°C, 2 sec of annealing, 72°C, 2 sec of polymerization in each cycle for 50 cycles. L. fusiformis specific gene were amplified with commercial bumblebee from Suwon, Boseong, Changwon and 240 Cheongsong.
L. fusiformis 특이 초고속 PCR 결과, 모든 시료에서 L. fusiformis 특이 유전자 증폭이 관찰되었으며, 각 산물의 융점분석에서 L. fusiformis 특이 유전자의 증폭임을 인정할 수 있었다. 측정된 L. fusiformis의 Tm 값은 수원(Suwon), 보성(Boseong), 창원(Changwon), 청송(Cheongsong) 각각 78.47°C, 77.82°C, 78.47°C, 78.47°C로, L. fusiformis 의 양성 증폭의 유효범위(78.55±0.73°C) 안에 해당함으로 L. fusiformis 유전자의 증폭임을 판정할 수 있었다(Table 2).
이 검출 결과는 L. fusiformis가 국내 판매되고 있는 뒤영벌에 실제로 존재함을 보여주는 것으로, 국내 최초의 보고가 될 것이다. 본 검출에서 사용된 시료는 각 봉군 중 사체를 수집하여 사용하였으며, 평균 무게 70mg의 뒤영벌 성체로 부터 평균 7.27μg gDNA를 추출하였고, 그 중 50ng의 gDNA를 초기 주형으로 L. fusiformis 특이 초고속 PCR을 수행한 것이다.
L. fusiformis가 초기 감염세균으로 뒤영벌에 감염되어 뒤영벌을 치사시킨 것인지, 또는 사체가 된 후에 이차 침입 세균으로 사체에서 단순 성장된 것인지 현재로써 판단하기는 어려울 것이다. 각 사체에 포함되어 있는 L. fusiformis 양은 창원, 수원, 보성, 청송의 순서대로 각 1.05×108 분자/마리, 7.61×104 분자/마리, 5.39×104 분자/마리, 1.55×105 분자/마리로 계산되었으며, 특히 창원 시료의 경우 L. fusiformis 수가 다른 시료에 비하여 1,000배 이상으로 나타나 그 원인이 주목되고 있다. 추후, 본 정량법을 사용하여 L. fusiformis의 뒤영벌에 대한 병원체 여부를 증명하는 연구가 요구된다 할 실험인 것이다.
본 L. fusiformis 특이 초고속 PCR법을 뒤영벌 사육현장에서 보다 쉽게 적용하고, 생산과정에서의 L. fusiformis 증감을 모니터링하기 위하여, 성봉 또는 유충으로부터 보다 간소화된 핵산 추출법의 개발이 요구되고 있으며, 이러한 간편 핵산 분리법과 본 초고속 PCR법이 연합될 수 있다면, 바로 현장에서 유전자 검사를 빠르게 수행하여 L. fusiformis의 감염여부를 수분 내에 판정할 수 있을 것이다. 더 나아가 L. fusiformis 특이 초고속 PCR법이 뒤영벌의 다른 병원체에 대하여 현장성을 보안한 신속한 검출법 개발로 연구가 확장될 것으로 기대하며, 또한 뒤영벌 수출입을 위한 검역 기준으로 사용되어 L. fusiformis 방역에 기여할 것으로 기대하는 바이다.
적 요
2008년 서양뒤영벌의 급작스런 폐사로 인하여 뒤영벌에 대한 병원체로 그 가능성이 제기된 Lysinibacillus fusiformis는 현재까지도 뒤영벌 병원체로써 의심되고 있다. 본 연구에서는 가장 빠르고 간편한 L. fusiformis 검출방법을 고안한 것으로, L. fusiformis 특이 초고속 PCR를 개발하여, 뒤영벌 성충으로부터 L. fusiformis 검출에 소요되는 시간을 최소화한 것이다. 최적화된 L. fusiformis 특이 유전자 초고속 PCR을 적용하였을 때, L. fusiformis의 감염여부는 1.0×108 분자수를 기준으로 4분 22초만에 판정할 수 있었으며, 최소 1.0×101 분자의 재조합 DNA까지 정량적으로 측정할 수 있었다. 또한, L. fusiformis 특이 유전자 초고속 PCR을 이용하여 국내에서 상업적으로 생산된 뒤영벌을 검사하였으며, 4개 지역에서 각 1개체씩 실험한 결과, L. fusiformis가 검출됨에 따라, 국내 최초로 뒤영벌에서 L. fusiformis의 존재를 확인할 수 있었다. L. fusiformis 특이 유전자 초고속 PCR법은 실험실 내에서 뿐만 아니라 현장에서 정량적 검출을 하기에 유용한 방법이 될 것이며 더 나아가 뒤영벌 수출입을 위한 검역 기준으로 사용되기를 기대한다.
Acknowledgments
본 연구는 농림축산식품부의 재원으로 농림수산식품기술기획평가원의 수출전략기술개발사업(과제번호 115067-02), 첨단생산기술개발사업(과제번호 115058-02, 과제번호 115102-03), 농생명산업기술개발사업(과제번호 312027-03)과 2017학년도 경기대학교 대학원 연구원장학생 장학금 지원에 의하여 수행되었습니다.
인 용 문 헌
- 김원태, 최지영, 김종길, 황석조, 최영철, 한상미, 김미애, 이대원, 윤형주, (2008), 서양뒤영벌(Bombus terrestris)과 호박벌(B. ignitus)에 대한 병원성 세균 분리, Journal of Apiculture, 23, p13-20.
- 김정민, 임수진, Truong A Tai, 홍기정, 윤병수, (2017), 초고속 유전자 증폭법을 이용한 벌집꼬마밑빠진벌레(Aethina tumida)의 신속한 검출 기법 개발, Journal of Apiculture, 32, p119-131.
- 남성희, 윤형주, 김삼은, (2003), 호박벌(Bombus ignitus)에서 분리된 석고병균, Aspergillus flavus Link의 형태학적 특성, Journal of Apiculture, 18, p43-48.
- 민상현, 김정민, 임수진, 김병희, 이칠우, 윤병수, (2017), 뒤영벌 병원체 11종에 대한 실시간 중합효소 연쇄반응 검출법 개발, Journal of Apiculture, 32, p99-109.
- 임수진, 김정민, 이칠우, 윤병수, (2017), 꿀벌 6종 주요 병원체에 대한 초고속 다중 PCR 검출법의 개발, Journal of Apiculture, 32, p27-39.
- 최용수, 이만영, 홍인표, 김남숙, 김혜경, 변규호, 윤형주, (2010), 뒤영벌류(Bombus terrestris와 Bombus ignitus) 에서 꿀벌바이러스 진단, Journal of Apiculture, 25, p259-266.
- 최용수, 이명렬, 이만영, 김혜경, 이광길, 이경용, 윤형주, (2009), 국내 최초 서양뒤영벌(Bombus terrestris)에서의 Deformed Wing Virus (DWV) 진단, Journal of Apiculture, 24, p23-30.
-
Ahmed, I., A. Yokota, A. Yamazoe, T. Fujiwara, (2007), Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov., Int J Syst Evol Microbiol, 57, p1117-1125.
[https://doi.org/10.1099/ijs.0.63867-0]

-
Han, S. H., D. B. Lee, D. W. Lee, E. H. Kim, and B. S. Yoon, (2008), Ultra-rapid real-time PCR for the detection of Paenibacillus larvae, the causative agent of American Foulbrood (AFB), J. Invertebr. Pathol., 99, p8-13.
[https://doi.org/10.1016/j.jip.2008.04.010]

-
Priest, F. G., M. Goodfellow, and C. Todd, (1988), A numerical classification of the genus Bacillus, Microbiology, 134, p1847-1882.
[https://doi.org/10.1099/00221287-134-7-1847]

-
Schmid-Hempel, P., (2001), On the evolutionary ecology of host-parasite interactions: addressing the question with regard to bumblebees and their parasites, Naturwissenschaften, 88, p147-158.
[https://doi.org/10.1007/s001140100222]

- Smith, E. C., (1993), Inoculation Experiments with Bacillus fusiformis isolated from Tropical Ulcer with Observations on the Bacillus, Epidemiology and infection, 33, p95-102.
-
Wang, J., Y. Fan, and Z. Yao, (2010), Isolation of a Lysinibacillus fusiformis strain with tetrodotoxin-producing ability from puffer fish Fugu obscurus and the characterization of this strain, Toxicon, 56, p640-643.
[https://doi.org/10.1016/j.toxicon.2010.05.011]