
지역별 국산 프로폴리스의 항균활성 및 Pinocembrin의 UPLC 분석
Abstract
Propolis, natural antibacterial agent, which has been used traditional medicine across the globe, is resinous mixture to include abundant bioactive substances. In present study, we investigated antimicrobial activity according to quality characteristics of propolis collected from 9 different regions in Korea. Antimicrobial activity was evaluated by measuring growth inhibition zone using agar well diffusion method against Streptococcus mutans. Constituents analysis of propolis samples were measured through total phenolic contents, total flavonoid contents and quantitative analysis of major compound (pinocembrin) by ultra performance liquid chromatography. As a result, 9 different propolis (10mg/mL) and pinocembrin (1mg/mL) showed antimicrobial activity that has growth inhibition zone more than 11.9mm on S. mutans. The total flavonoid contents of 8 different propolis excluding Jeju island were in compliance with standard of health functional food in Korea and were found to affect antimicrobial activity on S. mutans when contained over 10mg/g. In addition, when content of pinocembrin in propolis was ranged from 12mg/g to 32mg/g, each propolis excluding Jeju island exhibited antimicrobial activity alike. These results indicate that pinocembrin plays a important role for antimicrobial activity of propolis collected from 8 different regions in Korea, and that it can be used as basic data for standardization of Korean propolis.
Keywords:
Propolis, Streptococcus mutans, Antimicrobial activity, UPLC, Pinocembrin서 론
천연 항생제로 불리는 프로폴리스는 벌이 생산하는 양봉산물의 하나로 외부의 침입이나 벌집을 보호하는 목적으로 포플러 속 식물, 소나무, 참나무 등의 수피나 꽃봉오리에서 자신의 타액을 섞어 만든 점착성 물질이다(Marcucci, 1995). 프로폴리스는 예로부터 우리나라뿐만 아니라 전 세계적으로 민간에서 의약품으로 사용하여 왔으며, 항균 효과, 항암 효과, 항산화효과, 항돌연변이 효과 등 다양한 생리활성을 나타내어 이를 이용한 화장품, 비누, 치약 등 인간에게 유익한 천연물 소재로 사용되고 있다(Khalil, 2006). 프로폴리스의 구성성분으로는 주로 페놀성 화합물이 차지하는데, 그 중에서도 플라보노이드가 다량으로 함유되어 있으며 이외에도 terpenes, steroids 등이 존재한다(Havsteen, 1983). 프로폴리스의 성분은 생산국에 따라 다르게 나타나는데, 그린프로폴리스라 불리는 브라질산 프로폴리스는 cinnammic acid의 유도체인 artepillin C가 주성분으로 알려져 있고, 중국, 유럽 및 국산 프로폴리스에는 flavone 및 flavanone 계열의 물질이 주성분으로 밝혀져 있으며, 생산지에 따라 수목의 다양성 때문에 구성성분들의 차이는 있지만 항균활성과 항산화 활성은 대표적인 약리작용이다(Grange and Davey, 1990; Kumazawa et al., 2004). 항산화 활성과 더불어 항균 활성이 뛰어난 프로폴리스는 우리나라에서 1995년 식품위생법에 의거 ‘건강보조식품’으로 출발하여 2004년 이후로는 ‘건강기능식품’으로 관리되고 있으며, 특히 Streptococcus mutans, Porphyromonas gingivalis, Prevotella intermedia 등의 충치 유발균에 의하여 발생되는 치주질환에 효과적인 활성을 가진다(Topcuoglu et al., 2012) 충치유발균 중 우식 위험도의 지표로 사용되는 S. mutans는 입속의 음식물을 부패하게 하여 산을 발생시키고 치아의 석회 성분을 파괴하는 동시에 glucosyltransferase(GTase) 효소를 생성하여 비수용성 글루칸을 형성한다. 비수용성 글루칸은 기타 세균들과 치아에 부착하여 치아우식증 발생시키는데, 프로폴리스는GTase의 활성을 억제하여 비수용성 글루칸의 생성을 막아 구강에서 항균작용을 나타낸다(Rolla, 1989). 현재까지 외국산 프로폴리스, 액상제품, 국산 일부지역프로폴리스 추출물 등을 이용하여 충치유발균에 대한 항균활성 연구는 보고되었지만(Park et al., 1998; Bertolini et al., 2012), 지역별 국산 프로폴리스에 대한 항균활성 검증은 미비한 상태이다. 따라서 본 연구에서는 경기도, 강원도, 충청북도, 충청남도, 경상북도, 경상남도, 전라남도, 전라북도, 제주도로부터 수집한 9종의 국산 프로폴리스 원괴 추출물과 구성성분에 대하여 치아우식증의 원인균인 동시에 지표로 사용되는 S. mutans에 대한 항균활성을 평가하고 프로폴리스에 존재하는 플라보노이드, 페놀성 화합물의 함량 및 주요성분의 UPLC 분석을 통하여 항균활성과의 관계를 확인하고자 하였다.
재료 및 방법
실험재료
본 실험에 사용한 프로폴리스는 경기도, 강원도, 충청북도, 충청남도, 전라북도, 전라남도, 경상북도, 경상남도 및 제주도의 양봉농가로부터 2017년도에 수집한 원괴를 구입하여 사용하였으며, 시료명은 Table 1에 나타내었다.
시약
성분추출 및 성분분석에 사용한 ethanol, methanol, acetonitrile은 Thermo fisher scientific(Waltham, MA, USA)사의 제품을 사용하였고, 항균실험에 사용한 brain heart infusion(BHI) broth는 BD(Franklin Lakes NJ, USA)사, p-coumaric acid와 trans-cinnamic acid는 Sigma-Aldrich(St.Louis, MO, USA)사의 제품을 사용하였다. 총 페놀성 화합물 함량 및 플라보노이드 함량측정에 사용한 Folin-Ciocalteu reagent, quercetin, gallic acid, diethylene glycol은 Sigma-Aldrich사의 분석용 시약을 사용하였고, UPLC분석에 사용한 표준품은 이전의 연구(Kim et al., 2017)에서 국산 프로폴리스로부터 분리한 pinocembrin을 사용하였다.
프로폴리스의 항균활성 측정
충치유발균 S. mutans(KCCM 40105)는 한국미생물보존센터로부터 분양받아 사용하였다. S. mutans는 BHI broth를 사용하여 37°C에서 호기조건으로 균전용 배양기(DS-310C1L, Dasol scientific, Hwaseong, Korea)에서 24시간동안 배양하였으며, 항균활성의 측정은 agar well diffusion 방법을 사용하였다. 즉, BHI agar를 121°C에서 15분간 멸균한 후, 45°C 항온수조에서 방냉하여 반고형 상태의 배지에 S. mutans의 개체수가 1×106 CFU/mL이 되도록 균을 접종하였다. 접종된 배지는 square dish(11125, SPL life sciences, Pocheon, Korea)에 60mL씩 옮겨 상온에서 굳힌 후, 멸균된 4mm 콜크보러를 사용하여 배지에 well을 만들고 10mg/mL 농도의 프로폴리스 80% ethanol 추출물 9종과 1mg/mL 농도의 화합물 4종(p-coumaric acid, trans-cinnamic acid, chrysin, pinocembrin)을 40μL씩 well에 처리하여 37°C에서 24시간 배양 후에 생육저지원의 지름(mm)을 측정하여 항균활성을 평가하였다.
총 페놀성 화합물 함량
프로폴리스 내 존재하는 총 페놀성 화합물의 함량은 Singleton과 Rossi의 방법(1965)을 변형하여 평가하였다. 즉, 유리 시험관에 시료(1mg/mL) 1mL, 3차 증류수 5mL, Folin-Ciocalteu’s phenol reagent(1N) 1mL을 넣고 혼합하여 5분간 실온에 방치한 후, 10% sodium carbonate 1mL을 첨가하여 1분간 vortex하였다. 각 시료의 반응액은 96 well plate에 200μL씩 옮겨 microplate reader(SpectraMax M2, Molecular Devices, Sunnyvale, CA, USA)를 이용하여 725nm에서 흡광도를 측정하였으며, 표준물질 gallic acid의 검량선으로부터 산출된 회귀방정식을 이용하여 시료 내 총 페놀성 화합물의 함량은 mg gallic acid equivalent(mg GAE/g)으로 나타내었다.
총 플라보노이드 함량
총 플라보노이드 함량은 Jia 등(1999)의 방법을 변형한 비색법을 이용하였다. 즉, 유리 시험관에 시료(1mg/mL) 1mL, diethylene glycol 2mL, 1N-NaOH 200μL를 넣고 30초간 vortex한 후 37°C에서 1시간동안 방치하였다. 반응액은 96 well plate에 200μL씩 옮겨 microplate reader를 이용하여 420nm에서 흡광도를 측정하였으며, 표준물질 quercetin을 이용하여 검량선을 작성한 후 시료의 플라보노이드 함량은 mg quercetin equivalent(mg QE/g)로 나타내었다.
Pinocembrin의 UPLC 분석
Kim 등(2016)의 방법에 따라 80% ethanol을 추출용매로 사용하여 9종의 지역별 프로폴리스 원괴를 초음파 추출한 후 0.2μm PTFE 멤브레인 필터로 여과하였다. UPLC분석은 Kim 등(2017)의 방법에 따라 binary pump, autosampler, PDA(photodiode array) detector가 장착된 Waters(Minneapolis, MN, USA) ACQUITY I-class를 사용하여Waters BEH C18(2.1×50mm, 1.7μm)컬럼, 흐름속도 0.5mL/min, 주입량 1μL, 검출파장 280nm, 이동상 용매 (A)acetonitrile, (B)0.1% phosphoric acid; (A)24-25%, 0-5 min; (A)25-36%, 5-15 min의 분석조건으로 pinocembrin의 정량분석을 실시하였다.
통계처리
모든 실험데이터는 3회 반복실험의 평균±표준편차로 나타냈으며, SPSS statistics 18(IBM, Armonk, NY, USA) 프로그램을 사용하여 analysis of variance(ANOVA)의 Duncan’s multiple range test로 p<0.05에서 통계적 유의성을 검증하였다.
결과 및 고찰
S. mutans에 대한 프로폴리스의 항균효과
지역별 9종의 프로폴리스 80% ethanol 추출물과 구성성분에 대한 항균활성은 충치유발균인 S. mutans를 사용하여 agar well diffusion assay를 실시하였으며, 그 결과를 Fig. 1과 Table 2에 나타내었다. 10mg/mL의 농도로 처리한 모든 프로폴리스 추출물에서 항균활성이 관찰되었고 clear zone의 지름은 11.9±2.0mm에서 17.3±0.9mm로 충북지역에서 생산한 프로폴리스에서 가장 높게 나타났다. 이는 프로폴리스의 밀원이 되는 식물이 지역별로 다르게 분포하여 구성성분의 차이로 인한 결과라 생각한다. 프로폴리스의 활성물질로 알려진 p-coumaric acid와 trans-cinnamic acid는 1mg/mL로 처리하였을 때 항균활성이 관찰되지 않았으며, 국산 프로폴리스의 주요성분인 chrysin과 pinocembrin을 1mg/mL로 처리한 경우, pinocembrin에서만 17±1.7mm의 clear zone을 형성하였다. 우리나라 건강기능식품 공전에 의하면 p-coumaric acid와 trans-cinnamic acid는 항산화 활성물질로 규정되었지만 S. mutans에 대한 항균활성은 관찰되지 않았으며, 이는 Koo 등(2002)이 발표한 S. mutans에서 생성되는 GTase 효소의 비수용성 글루칸 생성억제 실험과 동일한 결과를 나타내었다. 충치유발균의 항균활성은 주로 프로폴리스에 포함되어 있는 apigenin(flavone 계열)과 quercetin(flavonol 계열)이 생리활성 물질로 알려져 있는데, 본 연구를 통하여 flavanone 계열의 물질인 pinocembrin도 우수한 항균활성을 가지는 것으로 확인되었다. Pinocembrin은 국산 프로폴리스의 주성분으로 알려져 있을 뿐만 아니라 항산화, 항염, 항암 효과 등의 다양한 생리활성을 가지는 물질로(Rasul et al., 2013), 국산 프로폴리스의 생리활성 지표물질 또는 품질평가 기준물질로 설정 가능함을 시사한다. 앞으로 국산 프로폴리스의 우수성을 알리기 위하여 지역별 국산 프로폴리스의 성분연구 및 항균활성 물질로 확인된 pinocembrin의 메커니즘 연구가 진행되어야 할 것이다.
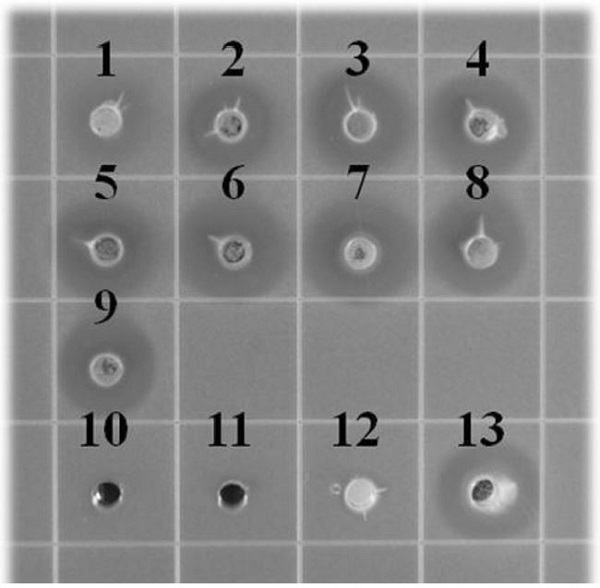
Antimicrobial activity of propolis samples and compounds on Streptococcus mutans: 1, JJP; 2, GWP; 3, GGP; 4, GBP; 5, GNP; 6, CBP; 7, CNP; 8, JBP; 9, JNP; 10, p-coumaric acid; 11, trans-cinnamic acid; 12, chrysin; 13, pinocembrin.
총 페놀성 화합물 함량 및 총 플라보노이드 함량
9종의 지역별 프로폴리스 에탄올 추출물의 총 페놀성 화합물 함량 및 총 플라보노이드 함량은 Table 3에 나타내었다. 프로폴리스의 주요 물질이면서 항산화활성의 간접적인 지표로 사용되는 총 페놀성 화합물 함량은 17.4±0.5에서 98.2±3.3mg/g로 충청북도(CBP)와 충청남도산(CNP) 프로폴리스에서 80mg/g이상 높은 함량을 나타내었다. 총 플라보노이드 함량은 제주산 프로폴리스(JJP)를 제외한 모든 지역에서 수집한 프로폴리스에서 10mg/g이상으로 프로폴리스 건강기능식품 기준 및 규격에 적합하였다. 특히, 충청북도(CBP)와 충청남도(CNP)에서 수집한 프로폴리스는 35mg/g로 많은 함유량을 나타내었다. 총 페놀성 화합물의 함량은 지역별로 유의적인 차이가 나타났지만 항균활성에서는 유의적인 차이는 나타나지 않았다. 총 플라보노이드 함량이 19mg/g이상인 경우 S. mutans의 생장을 크게 억제하는 것으로 확인되었으나, 플라보노이드의 함량이 가장 적은 강원도 프로폴리스에서도 항균활성이 관찰되어 플라보노이드의 함량에 따른 항균활성과의 상관관계를 확인해야 할 것으로 판단되었다. 플라보노이드가 검출되지 않은 제주산 프로폴리스(JJP)는 jejuchalcone A와 같은 trans-chalcone계 물질이 존재하는데(Shimomura et al., 2013), 특히 trans-chalcone계 물질은 S. mutans에 대한 항균활성을 가진다고 알려져 있어(Wallock-Richards et al., 2015) 플라보노이드 계열 물질보다는 chalcone과 같은 페놀류 또는 기타 성분들에 의한 것으로 판단되며 추가적인 성분연구가 필요할 것이다.
Pinocembrin의 정량분석
Pinocembrin은 국산 프로폴리스의 주요성분이자 항균활성을 나타내는 물질로 본 연구를 통하여 확인되었다. 이에 각 지역별 프로폴리스 내 pinocembrin의 함유량에 따라 항균활성 관계를 알아보고자, UPLC를 이용하여 정량분석을 실시하였다(Fig. 2, Table 4). 그 결과, 제주산 프로폴리스를 제외한 8개 지역으로부터 수집한 프로폴리스 내 pinocembrin은 함량은 7.9±0.1에서 32.0±0.2mg/g로 지역별로 유의한 차이를 보였지만, 12mg/g 이상 32mg/g 이하의 농도에서는 유사한 항균활성을 나타내어 pinocembrin이 12mg/g이상일 경우 우수한 항균활성을 가지는 것으로 확인되었으며 농도별로 추가적인 실험이 진행되어야 할 것이다. 본 연구에서는 9개 지역으로부터 수집한 프로폴리스에 대한 결과를 나타냈지만, 국산 프로폴리스의 표준화와 생리활성 지표물질을 설정하기 위하여 모든 양봉농가로부터 시료를 채취하여 성분분석이 이루어져야 할 것으로 판단된다.
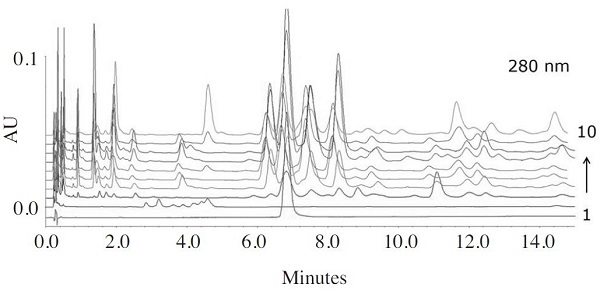
UPLC chromatogram of pinocembrin in Korean propolis. 1, pinocembrin; 2, JJP; 3, GWP; 4, GGP; 5, GBP; 6, GNP; 7, CBP; 8, CNP; 9, JBP; 10, JNP.
적 요
충치발생의 주요 원인균으로 알려진 S. mutans를 이용하여 건강기능식품으로 사용되는 프로폴리스를 9개 지역으로부터 수집한 후 생리활성 물질 탐색과 주요성분 함량에 따라 활성차이를 조사하였다. S. mutans에 대한 항균활성은 제주도, 경상북도, 경상남도, 충청북도, 충청남도, 전라북도, 전라남도, 경기도, 강원도 프로폴리스 및 pinocembrin에서 모두 관찰되었다. 제주도를 제외한 모든 프로폴리스에서 총 플라보노이드 함량이 10mg/g 이상으로 건강기능식품 기준 및 규격에 적합하였고, 19mg/g 이상일 경우 우수한 항균활성을 유사하게 나타내었다. 국산 프로폴리스의 주요성분으로 알려진 pinocembrin의 UPLC 정량분석에서는 제주도산 프로폴리스를 제외한 모든 시료에서 주성분으로 검출되었고 12mg/g 이상일 경우 항균활성에 큰 영향을 주는 것으로 확인되었다.
Acknowledgments
본 연구는 농촌진흥청 어젠다연구사업(과제번호:PJ01091202)에 의하여 수행되었으므로 감사를 드립니다.
인 용 문 헌
-
Bertolini, P. F., O. Biondi Filho, A. Pomilio, S. L. Pinheiro, and M. S. Carvalho, (2012), Antimicrobial capacity of Aloe vera and propolis dentifrice against Streptococcus mutans strains in toothbrushes: an in vitro study, J. Appl. Oral Sci., 20, p32-37.
[https://doi.org/10.1590/s1678-77572012000100007]

- Grange, J. M., and R. W. Davey, (1990), Antibacterial properties of propolis (bee glue), J. R. Soc. Med., 83, p159-160.
-
Havsteen, B., (1983), Flavonoids, a class of natural products of high pharmacological potency, Biochem. Pharmacol., 32, p1141-1148.
[https://doi.org/10.1016/0006-2952(83)90262-9]

- Jia, Z., M. Tang, and J. Wu, (1999), The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals, Food Chem., 64, p555-559.
- Khalil, M. L., (2006), Biological activity of bee propolis in health and disease, Asian Pac. J. Cancer Prev., 7, p22-31.
-
Kim, S. G., I. P. Hong, S. O. Woo, H. R. Jang, and S. M. Han, (2016), Quantitative analysis of pinocembrin isolated from Korean propolis, Journal of apiculture, 31, p103-111.
[https://doi.org/10.17519/apiculture.2016.09.31.3.227]

- Kim, S. G., I. P. Hong, S. O. Woo, H. R. Jang, and S. M. Han, (2017), Quantitative analysis of chrysin and pinocembrin in Korean propolis, Kor. J. Pharmacogn., 48, p88-92.
-
Koo, H., P. L. Rosalen, J. A. Cury, Y. K. Park, and W. H. Bowen, (2002), Effects of compounds found in propolis on Streptococcus mutans growth and on glucosyltransferase activity, Antimicrob. Agents Chemother., 46, p1302-1309.
[https://doi.org/10.1128/aac.46.5.1302-1309.2002]

-
Kumazawa, S., T. Hamasaka, and T. Nakayama, (2004), Antioxidant activity of propolis of various geographic origins, Food Chem., 84, p329-339.
[https://doi.org/10.1016/s0308-8146(03)00216-4]

-
Marcucci, M. C., (1995), Propolis: chemical composition, biological properties and therapeutic activity, Apodologie, 26, p83-99.
[https://doi.org/10.1051/apido:19950202]

-
Park, Y. K., M. H. Koo, J. A. Abreu, M. Ikegaki, J. A. Cury, and P. L. Rosalen, (1998), Antimicrobial activity of propolis on oral microorganisms, Curr. Microbiol., 36, p24-28.
[https://doi.org/10.1007/s002849900274]

-
Rasul, A., F. M. Millimouno, W. Ali Eltayb, M. Ali, J. Li, and X. Li, (2013), Pinocembrin: a novel natural compound with versatile pharmacological and biological activities, Biomed. Res. Int., 2013, p379850.
[https://doi.org/10.1155/2013/379850]

- Rolla, G., (1989), Why is sucrose so cariogenic? The role of glucosyltransferase and polysaccharides, Scand. J. Dent. Res., 97, p115-119.
-
Shimomura, K., Y. Sugiyama, J. Nakamura, M. R. Ahn, and S. Kumazawa, (2013), Component analysis of propolis collected on Jeju Island, Korea, Phytochemistry, 93, p222-229.
[https://doi.org/10.1016/j.phytochem.2012.02.018]

- Singleton, V. L., and J. A. Rossi, (1965), Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents, Am. J. Enol. Viticult., 16, p144-158.
- Topcuoglu, N., F. Ozan, M. Ozyurt, and G. Kulekci, (2012), In vitro antibacterial effects of glass-ionomer cement containing ethanolic extract of propolis on Streptococcus mutans, Eur. J. Dent., 6, p428-433.
-
Wallock-Richards, D. J., J. Marles-Wright, D. J. Clarke, A. Maitra, M. Dodds, B. Hanley, and D. J. Campopiano, (2015), Molecular basis of Streptococcus mutans sortase A inhibition by the flavonoid natural product trans-chalcone, Chem. Commun. (Camb), 51, p10483-10485.
[https://doi.org/10.1039/c5cc01816a]

