
울금 추출물에 의한 미국 부저병 방제효과
초록
꿀벌의 주요 질병 중 하나인 미국부저병은 P. larvae에 의한 세균성 질병으로, 꿀벌 유충에 광범위하고 빈번하게 발생하는 것으로 잘 알려져 있다. 본 연구에서는 미국 부저병 방제 효과를 지니는 천연물을 선발하고자 울금 추출물에 의한 미국부저병 방제효과를 검정하였다. 미국 부저병 방제 효과 검정을 위해 미국 부저병 원인균주 P. larvae에 대한 항균 활성을 Agar well diffusion assay 및 최소성장억제농도(Minimum Inhibitory Concentration, MIC) 측정법을 통해 검정하였다. 항균활성 검정 결과 Agar well diffusion assay에 의한 울금추출액 생장억제환(IDZ)의 크기는 10mg/ml의 농도에서 15mm~20mm이며, MIC 값(24시간)은 20μg/ml로 높은 항균 활성을 지니는 것으로 확인 되었다. 이와 더불어 미국 부저병 방제 효과 in vivo 검정을 위해 꿀벌 유충 실내사육시험을 통한 방제 효과를 검정 하였다. 그 결과 미국 부저병을 유발시킨 처리구에 울금을 급이한 시험구는 울금을 급이 하지 않은 시험구에 비해 생존율이 12.5% 높은 것으로 확인되었다. 본 연구결과는 울금 추출물이 꿀벌 부저병에 대해 강력한 방제 효과를 지닌다는 것을 보여줄 수 있으며, 향후 천연물을 이용한 부저병 방제제 개발에 이용될 수 있을 것으로 기대하고 있다.
Abstract
American foulbrood (AFB), caused by the spore forming bacterium Paenibacillus larvae, is the most series brood disease affecting bees. This study was conducted to evaluate the growth inhibitory effect of turmeric (Curcuma longa L.) extract against P. larvae in honey bee larvae. We investigated this with an agar well diffusion assay and determined minimum inhibitory concentration (MIC) of turmeric extract against P. larvae growth, and also conducted honey bee larval bioassays on to determine AFB infection frequency. Results showed that 10mg/ml of turmeric extract possessed strong antibacterial effects in the range of 15mm~20mm. An MIC value of 30μg/ml of turmeric extract against P. larvae was obtained. In honey bee larval bioassays, adding the turmeric mixture to larval food significantly reduced the mortality rates of AFB infected larvae, while the turmeric extract was non-toxic to adult bees at concentrations as high as 500μg peer bee. Our study identified a highly potent natural product turmeric that is effective against AFB both in vitro and in vivo, but has low toxicity to adult honey bees.
Keywords:
American foulbrood (AFB), Paenibacillus larvae, Turmeric, Minimum inhibitory concentration (MIC)서 론
미국부저병(American foulbrood, AFB)은 그람 양성세균인 Paenibacillus larvae에 의한 꿀벌 유충질병으로, 꿀벌에 발생하는 세균성 질병 중 가장 심각하고 위험한 것으로 잘 알려져 있다(Genersch et al., 2006). P. larvae는 감염성을 지닌 포자를 형성하는데, 이때 형성되는 포자는 고온이나 항생제에 강한 내성을 지니고 있어 방제가 쉽지 않을 뿐만 아니라 높은 전염성을 지녀 봉군에 큰 피해를 양산한다(Matheson and Reid, 1992; Kochansky et al., 2001). 지금까지 밝혀진 바에 의하면 P. larvae는 2개의 아종 즉, P. larvae larvae와 P. larvae pulvifaciens로 분류되며, 이는 다시 conserved motifs인 ERIC 영역에 따라 ERIC I에서 IV까지 4개의 genotype으로 분류할 수 있다(Genersch, 2006; Ashiralieva and Genersch, 2006). 이들에 의하면, ERIC type에 의해 분류된 균주는 포자형태 및 콜로니 색깔, 영양성분, 저온 활성, 병원성 등에 따라 다양한 특성들을 보유하고 있어, 원인 균주에 따른 다양한 방제대책에 수립되어야 할 것으로 여겨진다(Genersch, 2006).
지금까지 알려진 미국부저병 방제는 비 화학적 방법에 의한 방제와 화학적 방법에 의한 방제로 나눌 수 있다. 그중 비 화학적 방법에 의한 방제는 부저병 발생 봉군을 격리시키거나 소각처리 하는 것으로, 질병의 확산방지 혹은 비 감염 봉군에 대한 예방 차원에서 사용될 수 있는 방법이다. 반면, 화학적 방법에 의한 방제는 옥시테트라사이클린 등과 같은 항생제를 처리하는 것으로, 이는 비교적 간단하게 사용할 수 있는 방법이지만 내생포자에 대한 방제효과는 없어 사용상에 한계가 있을 수 있다. 뿐만 아니라 잦은 항생제 사용은 양봉 산물 내 항생제 잔류(Mutinelli, 2003; Kochansky et al., 2001; Piccini and Zunino, 2001) 및 꿀벌 생리장애 유발(Genersch, 2010), 내성 균주의 확산(Eguaras et al., 2005) 등의 문제를 야기할 수 있어 이를 대체 할 수 있는 천연물 약제의 개발이 시급한 실정이다(Aronstein and Hayes, 2004).
미국부저병 방제 기술 개발에 있어 기존의 항생제 처리를 대체하기 위한 연구는 주로 미국부저병 원인균인 P. larvae에 대한 항균활성 효과검증을 통한 물질 선발에 초점이 맞추어져 있다. 지금까지 연구된 것 중 P. larvae에 대해 높은 항균활성을 갖는 것으로 확인된 물질은 allicin(Aronstein and Hayes, 2004), thymol(Fuselli et al., 2006). 동충하초(Kim et al., 2016), citrus(Fuselli et al., 2008), geraniol(Gochnauer et al., 1979), 지방산(Feldlaufer et al., 1993), 에센스오일(Alippi et al., 1996; Floris and Carta, 1990; Fuselli et al., 2006) 등이 있으나 이들 물질에 대한 in vivo 검정은 수반되지 않아 실제로 봉군에 적용될 가능성이 있는지 여부는 확인되고 있지 않다. 그러나 최근 Forsgren 등(2010)은 Lactic acid균에 의한 미국부저병 방제효과를 유충 급이에 의한 in vivo 검정을 통해 확인 한 바가 있어, 이러한 방법을 통한 생물검정법이 향후 미국 부저병 방제물질의 선발 및 검정에 활용 가능할 것으로 기대된다.
본 연구에서는 미국부저병 방제를 위한 천연물 방제제 개발을 위해 울금(turmeric, Curcuma longa L.) 추출물의 부저병 방제 효과를 검정하고자 하였다. 울금은 생강과(Zingiberaceae)에 속하는 다년생 초본 식물로 한약재, 향신료 및 식용으로 사용되어 왔으며, 다양한 생리활성을 가지는 물질로 잘 알려져 있다(김 등 2013, Oh et al., 2010). 최근 김 등(2016)은 울금이 꿀벌 노제마병 방제에 효과를 지닌다고 밝힌바가 있어 향후 꿀벌 질병 방제 약제로 활용 가능성이 높을 것으로 기대 되고 있다. 이에 본 연구에서는 울금의 미국부저병 방제효과를 추가로 검정하여 꿀벌 질병에 대한 종합적 방제제로서 울금의 사용 가능성을 제시하고자 하였다.
재료 및 방법
균주 분리
미국부저병 원인균주인 Paenibacillus larvae를 분리하기 위하여 미국부저병 감염 의심 병원체(유충)를 완주군 농촌진흥청 국립농업과학원 내 시험양봉장에서 2차례에 걸쳐 수거하였다. 수거한 병원체는 1.5ml 튜브에 phosphate buffered saline(PBS)용액에 넣고 페슬을 이용해 분쇄한 다음 block heater 내에서 65°C, 20분간 열처리를 하였다. 열처리는 포자를 형성하지 않는 기타 균주에 의한 오염을 방지하고 발아(germination)를 촉진하기 위해 수행되었다. 열처리를 거친 혼탁액은 PBS를 이용해 10-9까지 순차적으로 희석한 다음 MYPGP agar 배지(10g Mueller-Hinton broth(Oxoid CM0405), 15g yeast extract, 3g K2HPO4, 1g Na-pyruvate, 20g agar, 20ml 10% glucose(autoclaved separately) per litre)에 도말하여 배양하였다(Nordstr?m and Fries, 1995). 균주 배양은 37°C에서 48시간 이상 이루어 졌으며, 배양시 5% CO2를 주입시켜 포자발아를 향상시킬 수 있도록 유도하였다. 배양 균주는 평판 배지 상에 colony를 형성하면 배양을 중단하고 백금이를 이용해 단일 colony를 MYPGP 배지 5ml에 접종하여 37°C, 48시간 혼탁배양 한 후PCR을 통해 동정하여 사용하였다.
미국부저병 균주 동정
미국부저병 감염 유충으로부터 분리한 균주는 16S rRNA 유전자를 이용한 PCR 분석을 통해 동정하였다. PCR 진단을 위해 배양된 균주는 DNA를 추출하여 사용 하였으며, 이는 DNA extraction Kit(Promega)의 방법에 따라 수행되었다. 추출된 DNA는 P. larvae rRNA primer (F: 5’-GCAGCAAATCGTATCAG-3’, R: 5’-GGTCCTTTGTAACGATTG-3) 를 이용하여 PCR 하였으며, 증폭반응은 Applied Biosystems 2720 Thermal Cycler(Thermo Fisher Scientific, USA)을 사용하였다. 반응을 위하여 20mM Tris-HCl, pH 8.4, 2.0mM MgCl2, 100μM dNTP와 0.1μM의 forward와 reverse primer를 PCR tube에 넣었으며, 25ng의 genomic DNA와 0.6 U Takara Ex Taq(Takara Biomedical, Japan)을 추가적으로 넣고 PCR 증폭반응을 실시하였다. 반응 시간은 Predenaturation 95°C 5분, 94°C 30초 52°C 30초 72°C 45초로 35cycle을 반복하고 72°C에서 5분간 final extension을 수행하였다. PCR 산물은 UV-light를 통해 확인한 후 정제하여 염기서열을 분석 하였으며, 염기서열 분석결과 분리된 균주가 Paenibacillus larvae 임을 확인한 후 시험에 사용하였다.
추출물 제조
울금(Turmeric, Curcuma longa L.)은 한약재시장(www.hanyakjae.net)에서 건조 상태의 것을 구입하여 분쇄기(대성파워 믹서/분쇄기 DA-280G, Seoul, Korea)로 분쇄한 다음 추출하여 사용 하였다. 추출방법은 다음과 같다. 먼저 건조 울금 시료 500g에 10배(w/v)의 Methanol(Mallinckrodt Baker Inc., Philipsburg, MT, USA)을 첨가하여 24시간 동안 정치시킨 다음(3회 반복) 여과지(Whatman No. 3, Whatman Internatinal Ltd., Maidstone, England)를 이용해 여과 하였다. 여과액은 rotary evaporator(UT-1000, EYELA, Tokyo, Japan)로 55°C에서 농축하여 칭량한 후(58.8g), -20°C 냉동 보관하여 사용하였다.
Agar well diffusion assay에 의한 항균활성 검증
Paenibacillus larvae에 대한 울금 추출물의 항균활성 효과 검증은 Lehrer 등(1991)의 방법을 변형한 Agar well diffusion assay를 통해 수행되었다. 먼저, -70°C에 보관중인 P. larvae 균주를 MYPGP 배지 50ml에 접종한 후 35°C에서 24시간 200rpm으로 진탕 배양하였다. 이후 새로운MYPGP 배지 50ml에 배양액 50μl를접종하고 35°C, 2.5시간 진탕 배양한 후, 4°C, 3000rpm에서 10분간 원심 분리하였다. 원심 분리한 침전물은 차갑게 보관된 10ml의 10mM sodium phosphate buffer(SPB, pH 7.4)로 2번 세척한 후 최종적으로 5ml SPB에 resuspension 하였다. resuspension 용액은 620nm에서 흡광도를 측정한 후 4×106 CFU를 항온수조(42°C)에 보관되어 있는 underlay agar에 vortex 하여 잘 섞어 준 다음, square petri dish(10×10×1.5cm)에 분주하였다. underlay agar는 10mM sodium phosphate buffer(pH 7.4)와 1%(w/v) low-electroendosmosis-type agarose(Sigma), 0.03% MYPGP 배양배지를 이용해 만들었다. 분주한 underlay agar가 굳으면 직경 10mm의 구멍을 뚫어 울금 추출액 1mg/ml과 10mg/ml를 각각 10μl씩 넣고 3시간 동안 시료가 확산되도록 정치시킨다. 이후 6% TSB와 1%(w/v) agarose가 포함되어 있는 overlay gel을 추가로 분주하고 배지가 굳기를 기다렸다가 배지가 굳으면 37°C에서 24시간 균주를 배양한다. 이후 울금 추출물의 항균작용에 의한 생장억제환(IDZ; inhibition zone distance)이 발생하는지 여부를 육안으로 관찰하였다.
최소성장억제농도(Minimum Inhibitory Concentration, MIC)
최소성장억제농도는에 의한 P. larvae 항균활성 검증은 Norrell과 Messley(1997) 방법에 의해 수행 되었다. 먼저 MYPGP 배지에 P. larvae 균주 4×106 CFU를 접종한 후 10mg에서 40mg까지 단계적으로 희석한 울금 추출물을 각각 분주하여 37°C에서 혐기 배양하였다. 처리 24시간 및 48시간 배양한 P. larvae 배양액은 흡수파장 600nm에서 흡광도를 측정하여 최소성장억제농도를 결정하였다. 이때 양성대조군으로는 테트라사이클린(10μg/ml), 음성대조군으로는 에탄올(1%, v/v)을 사용하였다.
꿀벌 급성 급이 독성 평가
꿀벌급성섭식독성시험은 오 등(2013)의 방법에 따라 수행하였다. 한 벌통에서 생산된 건강하고 활동성이 좋은 일벌을 시험구 당 10마리씩 케이지에 넣어 준비한 후 울금 추출액을 일벌 한 마리당 100μg에서 500μg까지 농도별로 급이 하였다. 이때 사용한 울금 추출액은 농도별로 준비하여 50% 자당용액과 섞어 벌 한 마리당 20μl씩 급이 하였으며, 급이 방법은 집단섭식법을 이용하였다. 시료 급이는 준비된 추출물이 모두 소비될 때 까지 이루어 졌으며, 시험용액 급이가 먼저 끝난 시험구에 대해서는 추가로 50% 자당용액을 공급하였다. 급이 시험은 상온(22~24°C)에서 이루어 졌으며, 급이 24시간 및 48시간 후 시험개체에 대한 치사 및 행동이상 등을 관찰한 후 이에 대한 LD50값과 95% 신뢰 한계를 산출하였다.
꿀벌 유충 실내 사육을 통한 생물검정
꿀벌 유충 실내사육은 Aupinel 등(2005)의 방법을 따랐다. 먼저 2일령의 일벌 유충을 48-well tissue culture plates의 각 well에 이충한 다음 1% yeast extract, 6% glucose, 6% D-fructose를 함유한 수용액에 50% royal jelly(v/v)를 섞어 먹이로 공급하였다. 유충 사육에 필요한 먹이양은 유충이 하루에 섭취 가능한 양만 공급 되었으며, 사육 온도는 35°C, 습도는96%를유지시켜 주었다. 시험구는 P. larvae 포자를 감염시키지않고 울금 추출액을 급이 하지 않은 것(1)과 울금 추출액을 급이 한 것(2), P. larvae 포자를 감염시키고 울금 추출액을 급이 하지 않은 것(3)과 울금 추출액을 급이 한 것(4)으로 나누어 처리 하였으며, P. larvae 포자 감염은 P. larvae 포자가 4×106 CFU 함유되어 있는 유충 먹이를 24시간 급이 하는 방법을 통해 이루어 졌다. 유충의 먹이 공급은 7일 동안 이루어지고, 이후 번데기 단계에서는 먹이공급을 중단하였으며(35°C, 습도 80%), 시험 14일 경과 후 시험을 종료하고 유충 생존율을 조사하였다. 한번의 시험에 사용된 유충은 48마리이며, 각각의 실험은 3회 반복 수행되었다.
통계처리
모든 실험 결과는 3회 반복 수행된 평균값이며, 각 실험결과에 대한 통계분석은 SPSS program(Ver. 18.0, Chicago, IL, USA)을 이용하였으며, 각 실험군 간의 유의적 차이는 일원배치분산분석(one-way ANOVA)후 Duncan’s multiful range test (p<0.05)로 검증하였다.
결과 및 고찰
울금에 의한 Paenibacillus larva 항균활성 검증
울금 추출물에 대한 P. larvae 항균활성 효과는 Agar well diffusion assay 및 최소성장억제농도(Minimum Inhibitory Concentration, MIC)를 통해 검정하였다. Agar well diffusion assay에 의한 울금추출액 생장억제환(IDZ)의 크기는 1mg/ml의 농도에서 5mm~10mm였으나, 10mg/ml의 농도에서는 15mm~20mm로 관찰되어 높은 항균 활성을 지니는 것으로 확인되었다(Table 1). 이와 더불어 최소성장억제농도(MIC)를 결정한 결과 24시간의 MIC 값은 20μg/ml, 48시간의 MIC 값은 30μg/ml로 이 역시 높은 항균활성을 보이는 것으로 확인되었다(Fig. 1). P. larvae에 대한 울금의 항균활성 검정은 Flesar 등(2010)의 연구 결과에서 찾아 볼 수 있다. 이들에 의하면 다양한 식물추출물 및 단일성분 중 울금 추출물의 MIC 값은 30μg/ml 로 본 연구결과와 유사한 값을 보였다. Flesar 등(2010)에 의하면 울금은 다른 식물추출물 및 단일성분에 비해 P. larvae에 대한 항균활성은 우수하다고 밝혔으며, 이러한 결과를 종합해 볼 때 울금의 미국부저병 방제제 활용 가능성은 충분한 것으로 여겨진다.
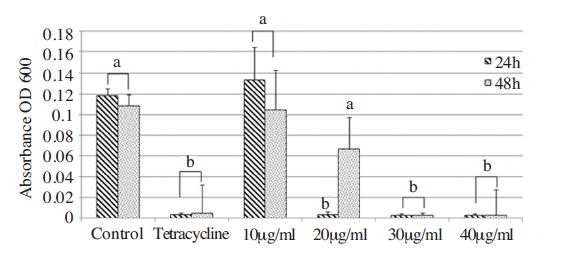
Minimum inhibitory concentrations (MIC) of turmeric extract (Curcuma longa L.) extract against Paenibacillus larvae by direct measurements of the optical density of bacterial cultures at 600nm (OD600). The solution of ethanol (1%, v/v) was assayed as the negative control and antibiotics (tetracycline) was used as the positive control. The same small letter indicates significant difference (p<0.05). Bars indicate standard deviation of replications.
미국부저병 방제에 있어서 기존의 항생제를 대체하기 위한 천연물 선발에 관한 연구는 미국부저병 원인균인 P. larvae에 대한 항균활성 검정이 주를 이루고 있다. 그 중 Fuselli 등(2008)은 감귤류로부터 추출한 에센스 오일로부터 P. larvae에 대한 항균활성 효과를 검정한바 있으며, Bilikova 등(2013)은 프로폴리스 ethyl acetate 층으로부터 분리한 극성의 신규화합물이 부저병 균주에 대해 우수한 항균활성 효과를 갖는다고 보고하기도 하였다. 뿐만 아니라 본 연구진에 의해서는 동충하초 배지 추출물의 P. larvae 항균활성 검증을 수행함으로써, 동충하초 추출물의 미국부저병 방제제 활용 가능성에 대한 기대감을 내비치기도 하였다(김 등, 2016). 그러나 이들의 연구결과는 유효물질에 대한 in vivo 검정이 이루어지지 않아 실제로 봉군에 적용가능한지 여부는 확인하지 못한 것이 한계로 지적되어, 이에 대한 후속 연구가 필요할 것으로 여겨진다.
꿀벌급성섭식독성
미국부저병 원인균주에 대해 항균활성을 가지는 울금 추출물이 꿀벌에 독성을 가지는지 여부를 확인하기 위하여 본 연구에서는 꿀벌 급성섭식독성 검정을 수행하였다(Fig. 2). 본 연구에서는 울금 추출물 100μg/bee, 200μg/bee, 300μg/bee, 400μg/bee, 500μg/bee 농도에서 24시간 및 48시간 일벌의 치사개체수 측정 및 행동 이상 등을 관찰하였다. 그 결과 100μg/bee, 200μg/bee 농도의 울금을 급이한 시험구의 치사 개체수는 24시간에서 각각 3.3%, 0%, 48시간에서는 각각 6.7%, 10%로, 음성 대조구(당액 급이)인 3.33%, 13.33%에 비해 오히려 치사 개체수가 낮은 것으로 확인되었다. 반면 300μg/bee, 400μg/bee, 500μg/bee 농도의 울금을 급이한 시험구의 치사 개체수는 24시간에서 각각 23.3%, 26.7%, 20.0%, 48시간에서는 각각 33.3%, 33.3%, 36.7%로, 울금 농도가 증가함에 따라 치사개체수가 함께 증가하였지만 반수치사량(LD50)에는 미치지 못하는 것으로 평가되어, 울금의 꿀벌급성 섭식결과는 500μg/bee 이상인 것으로 드러났다. 오 등(2016)은 국내 유기농업자재로 사용되고 있는 식물 추출물에 대한 꿀벌 독성평가를 위해 꿀벌급성섭식 독성 평가를 수행 한 바 있다. 이들에 따르면, 식물추출물의 반수치사량(LD50)이 24시간 및 48시간에 100μg/bee 이상이면 섭식독성이 낮은 것으로 평가 하였는데, 본 연구 결과와 비교해 보면 울금의 반수치사량(LD50)은 500μg/bee 이상인 것으로 보아 울금에 의한 꿀벌의 섭식독성은 현저히 낮은 것으로 평가할 수 있을 것이다.
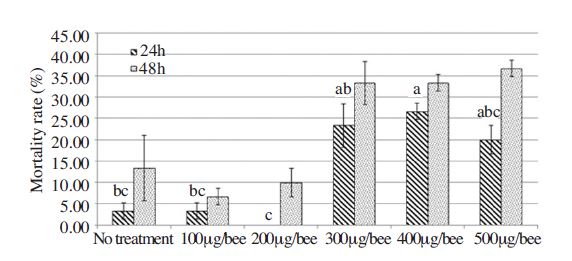
Acute oral toxicity of tested Curcuma longa L. extract to adult worker honey bees. The same small letter indicates significant difference (p<0.05). Bars indicate standard deviation of replications.
꿀벌의 급성섭식독성 평가는 꿀벌의 질병 방제 약제 개발에 있어 매우 중요한 요소가 될 수 있다. 특히 꿀벌이 직접적으로 섭취하는 약제의 경우 벌꿀, 로얄젤리 등의 생산물에 잔류 될 수도 있고, 유충 양육을 위한 먹이로 제공 될 수도 있기 때문에 각별한 주의를 기울일 필요가 있어 질병 방제 후보 물질에 대해 이러한 섭식독성을 통한 평가는 반드시 수반되어 할 것으로 여겨진다.
꿀벌 유충 실내 사육을 통한 생물검정
본 연구에서는 울금에 의한 미국부저병 방제효과를 in vivo 검정을 통해 확인하기 위해 꿀벌 유충 실내사육을 통한 생물검정을 수행하였다. 이를 위해 Aupinel 등(2005)의 방법에 따라 유충 실내사육을 수행하였으며, 울금 추출물을 미국부저병 감염유충과 감염시키지 않은 유충에 급이한 후 유충생존율을 조사하는 방법을 통해 검정을 수행하였다. 본 연구에서는 P. larvae 포자를 감염시키지 않고 울금 추출액을 급이 하지 않은 것(1)과 급이 한 것(2), P. larvae 포자를 감염시키고 울금 추출액을 급이 하지 않은 것(3)과 급이 한 것(4)으로 나누어 처리 하였다. 그 결과 미국부저병을 감염시키지 않고 울금 추출물을 급이 하지 않은 시험구(1)의 유충 및 번데기의 생존율은 77.08%(P=0.0001, Table 2)인 반면, 울금을 급이한 시험구(2)의 유충 및 번데기 생존율은 81.25%(P=0.0001, Table 2)로 확인 되어, 울금을 급이하지 않은 시험구는 급이한 시험구에 비해 유충 및 번데기 생존율이 4.17% 낮은 것으로 드러나 미국부저병을 감염시키지 않은 처리구에서도 울금은 유충 성장에 긍정적인 영향을 미치는 것으로 판단되었다. 미국부저병을 감염시킨 시험구의 경우 울금 추출물을 급이 하지 않은 시험구(3)의 생존율은 58.33%, 울금을 급이한 시험구(4)의 생존율은 70.83%로 확인되었다. 그 결과 미국부저병을 감염시킨 유충에 울금을 급이 한 시험구는 급이하지 않은 시험구에 비해 유충 및 번데기 생존율이 12.5% 높은 것으로 확인되어 울금이 미국부저병에 의한 사충률을 감소시키는 것으로 드러났다. 이에 대한 chi square test 결과에서도 유충 생존율(x2=339.000, df=9) 및 우화율(x2=600.000, df=9)의P값은 0.0001로통계적 유의성이 있는 것으로 확인되었다.

Proportional mortality of honey bee larvae from in vivo experiments calculated based on the total number infected after 14 days. The difference between groups was significant (P=0.001)
앞선 연구에서 Forsgren 등(2010)은 Lactic acid 균에 대한 P. larvae 방제효과 검증을 위해 유충실내 사육을 통한 in vivo 검정을 수행한 바 있다. 이들에 따르면, 미국부저병 균주를 감염시킨 유충에 Lactic acid 세균 배양액을 급이한 경우가 그렇지 않은 경우에 비해 유충사충률이 17% 낮아 졌다고 밝힌바 있는데, 이는본연구결과와 유사한 경향을 보여 울금 추출물 또한 꿀벌부저병 방제효과가 있는 것으로 평가 할 수 있었다. Al-Ghamdi 등(2017)은 꿀벌 장내에서 분리한 균주에 의한 미국부저병 방제효과를 본 연구와 같이 유충사육을 통한 in vivo 검정으로 수행한바 있다. 이들에 의하면 꿀벌 장내에서 분리한 Lactobacillus kunkeei 균주를 유충에 급이한 경우 유충의 사충률은 56.6%로 양성 대조구(미국부저병 감염 유충)에 비해 30% 가량 낮아지는 효과를 보인다고 밝혔다. 하지만 미국 부저병을 감염시키지 않은 음성 대조군(26.7%)에 비해서는 여전히 높은 사충률을 보이는 것으로 판단되어 이에 대한 효과검증에 대해서는 추가적인 연구가 필요할 것으로 여겨진다.
앞서 밝힌바와 같이 지금까지 미국 부저병 방제를 위한 천연물 선발에 관한 연구는 주로 P. larvae에 대한 항균 활성 검정을 통한 활성여부에 주목한 경우가 적지 않았다. 그러나 이는 꿀벌에 적용이 가능한지 여부가 확인되지 않아 관련 연구의 확대가 절실한 상황이다. 본 연구에서는 미국부저병 방제 물질 선발에 있어 단순히 P. larvae 항균 활성 확인을 통한 검정에서 벗어나 꿀벌 유충에 대한 in vivo 검정을 통한 부저병방제 효과를 확인하였으며, 이를 통해 울금이 미국 부저병 방제제로 활용 가능성이 크다는 것을 제시할 수 있었다. 이는 서두에 밝힌 바와 같이, 꿀벌 노제마병 방제와 함께 복합적으로 사용될 수 있는 소재라 여겨지며, 향후 꿀벌 주요 질병에 대한 종합적 방제제로 울금의 사용 가치는 매우 높아질 것이라 기대한다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(PJ01326404)의 지원에 의해 수행된 결과이며 이에 깊은 감사를 드립니다.
References
-
김민선, 전성식, 최정화, (2013), 울금(Curcuma longa L.)이 고지방·고콜레스테롤 식이 흰쥐의 항산화계 및 산화적 손상에 미치는 영향, 한국식품영양과학회지, 42(4), p570-576.
[https://doi.org/10.3746/jkfn.2013.42.4.570]

-
김혜경, 강아랑, 이명렬, 이만영, 강은진, 최용수, (2016), 동충하초 폐배지 추출물을 이용한 Paenibacillus larvae 항균활성 검정, Journal of Apiculture, 31(3), p211-218.
[https://doi.org/10.17519/apiculture.2016.09.31.3.211]

-
김혜경, 변규호, 강은진, 이명렬, 최용수, (2016), 울금 추출물을 이용한 꿀벌 노제마병 방제, Journal of Apiculture, 31(4), p359-365.
[https://doi.org/10.17519/apiculture.2016.11.31.4.359]

-
오진아, 최진희, 최미선, 김진효, 백민경, 박경훈, 홍순성, 이제봉, 김두호, (2013), 식물추출 유기농업자재 3종(님, 고삼, 데리스 추출물)의 꿀벌에 대한 독성평가, 농약과학회지, 17(4), p473-477.
[https://doi.org/10.7585/kjps.2013.17.4.473]

-
Al-Ghamdi, A., K. A. Khan, M. J. Ansari, S.B. Almasaudi, and S. Al-Kahtani, (2017), Effect of gut bacterial isolates from Apis mellifera jemenitica on Paenibacillus larvae infected bee larvae, Saudi Journal of Biological Sciences, 25, p383-387.
[https://doi.org/10.1016/j.sjbs.2017.07.005]

- Alippi, A., (1996), Characterization of isolates of Paenibacillus larvae with biochemical type and oxytetracycline resistance, Rev. Argent. Microbiol, 28, p197-203.
-
Aronstein, K. A., and G.W. Hayes, (2004), Antimicrobial activity of allicin against honey bee pathogens, Journal of apicultural research, 43(2), p57-59.
[https://doi.org/10.1080/00218839.2004.11101111]

-
Ashiralieva, A., and E. Genersch, (2006), Reclassification, genotypes and virulence of Paenibacillus larvae, the etiological agent of American foulbrood in honeybees-a review, Apidologie, 37, p411-420.
[https://doi.org/10.1051/apido:2006028]

- Aupinel, P., D. Fortini, H. Dufour, J. N. Tasei, B. Michaud, J. F. Odoux, and M. H. Pham-Delegue, (2005), Improvement of artificial feeding in a standard in vitro method for rearing Apis mellifera larvae, Bull. Insectol, 58, p107-111.
-
Bilikova, K., M. Popova, B. Trusheva, and V. Bankova, (2013), New anti-Paenibacillus larvae substances purified from propolis, Apidologie, 44(3), p278-285.
[https://doi.org/10.1007/s13592-012-0178-1]

-
Eguaras, M. J., S. Fuselli, L. Gende, R. Fritz, S.R. Ruffinengo, G. Clement, A. Gonzalez, P. N. Bailac, and M. I. Ponzi, (2005), An in vitro evaluation of Tagetes minuta essential oil for the control of the honeybee pathogens Paenibacillus larvae and Ascosphaera apis, and the parasitic mite Varroa destructor, J. Essent. Oil Res, 17, p336-340.
[https://doi.org/10.1080/10412905.2005.9698924]

-
Feldlaufer, M. F., D. A. Knox, W. R. Lusby, and H. Shimanuki, (1993), Antimicrobial activity of fatty acids against Bacillus larvae, the causative agent of American foulbrood disease, Apidologie, 24, p95-99.
[https://doi.org/10.1051/apido:19930202]

-
Flesar, J., J. Havlik, P. Kloucek, V. Rada, D. Titera, M. Bednar, M. Stropnicky, and L. Kokoska, (2010), In vitro growth-inhibitory effect of plant-derived extracts and compounds against Paenibacillus larvae and their acute oral toxicity to adult honey bees, Veterinary microbiology, 145(1), p129-133.
[https://doi.org/10.1016/j.vetmic.2010.03.018]

- Floris, I., and C. Carta, (1990), In vivo activity of Cinnamomum zeylanicum Nees essential oil against Bacillus larvae White, Apicoltura, 6, p57-61.
-
Forsgren, E., T. C. Olofsson, A. V?squez, and I. Fries, (2010), Novel lactic acid bacteria inhibiting Paenibacillus larvae in honey bee larvae, Apidologie, 41(1), p99-108.
[https://doi.org/10.1051/apido/2009065]

-
Fuselli, S. R., S.B.G. de la Rosa, L. B. Gende, M.J. Eguaras, and R. Fritz, (2006), Antimicrobial activity of some Argentinean wild plant essential oils against Paenibacillus larvae larvae, causal agent of American foulbrood (AFB), J. Apicult. Res, 45, p2-7.
[https://doi.org/10.1080/00218839.2006.11101304]

-
Fuselli, S. R., S.B.G. de la Rosa, M. J. Eguaras, and R. Fritz, (2008), Chemical composition and antimicrobial activity of Citrus essences on honeybee bacterial pathogen Paenibacillus larvae, the causal agent of American foulbrood, World Journal of Microbiology and Biotechnology, 24(10), p2067-2072.
[https://doi.org/10.1007/s11274-008-9711-9]

-
Genersch, E., E. Forsgren, J. Pentikäinen, A. Ashiralieva, S. Rauch, J. Kilwinski, and I. Fries, (2006), Reclassification of Paenibacillus larvae subsp. pulvifaciens and Paenibacillus larvae subsp. larvae as Paenibacillus larvae without subspecies differentiation, International Journal of Systematic and Evolutionary Microbiology, 56(3), p501-511.
[https://doi.org/10.1099/ijs.0.63928-0]

-
Genersch, E., (2010), American Foulbrood in honeybees and its causative agent, Paenibacillus larvae, Journal of invertebrate pathology, 103, pS10-S19.
[https://doi.org/10.1016/j.jip.2009.06.015]

-
Gochnauer, T.A., R. Boch, and V.J. Margetts, (1979), Inhibition of Ascosphaera apis by citral and geraniol, J. Invertebr. Pathol, 34, p57-61.
[https://doi.org/10.1016/0022-2011(79)90053-3]

-
Kochansky, J., D. Knox, M. Feldlaufer, and J. Pettis, (2001), Screening alternative antibiotics against oxytetracyclinesusceptible and-resistant Paenibacillus larvae, Apidologie, 32(3), p215-222.
[https://doi.org/10.1051/apido:2001123]

-
Lehrer, R. I., M. Rosenman, S. S. Harwig, R. Jackson, and P. Eisenhauer, (1991), Ultrasensitive assays for endogenous antimicrobial polypeptides, Journal of immunological methods, 137(2), p167-173.
[https://doi.org/10.1016/0022-1759(91)90021-7]

- Matheson, A., and M. Reid, (1992), Strategies for the prevention and control of American foulbrood. II, American bee journal, 132, p399-402.
- Mutinelli, F., (2003), European legislation governing the authorisation of veterinary medical products with particular reference to the use of drugs for the control of honey bee diseases, Apiacta, 38, p156-168.
-
Nordström, S., and I. Fries, (1995), A comparison of media and cultural conditions for identification of Bacillus larvae in honey, J. Apicult. Res, 34, p97-103.
[https://doi.org/10.1080/00218839.1995.11100894]

- Norrell, S. A., and K. E. Messley, (1997), Microbiology laboratory manual: principles and applications, Prentice-Hall.
-
Oh, H., Park, H., Ju, M. S., Jung, S. Y., and M. S. Oh, (2010), Comparative study of anti-oxidant and anti-inflammatory activities between Curcumae longae Radix and Curcumae longae Rhizoma, Kor J Herbology, 25, p83-91.
[https://doi.org/10.6116/kjh.2010.25.1.083]

-
Piccini, C., and P. Zunino, (2001), American foulbrood in Uruguay: isolation of Paenibacillus larvae larvae from larvae with clinical symptoms and adult honeybees and susceptibility to oxytretracycline, Journal of Invertebrate Pathology, 78, p176-177.
[https://doi.org/10.1006/jipa.2001.5055]
