5종 화분의 항산화, 항균 및 항당뇨 활성
Abstract
The pollen of acorn [PA], darae [PD], mixed flower [PM], pine tree [PP] and cattail [PC] were collected, and their physicochemical properties and useful bio-activities, such as anti-oxidant, anti-microbial and anti-diabetic activity, of extracts were evaluated. The size of pollen are 25~35 μm and each pollen has particular characteristics in tiny bump, crease, irregular small dent and wings for anemophily pollination. The PA has the highest acidity (0.7), brix (52) and color differences (55.70±0.04) determined by colorimeter among the 5 different pollen. Extraction yields for hot water and ethanol were the highest in PM and followed by PD, PA, PC and PP. The content of total polyphenol (TP) and total flavonoids (TF) in hot water extract of PC showed 29.1 and 19.6 mg/g, whereas the content of TP and TF in ethanol extract of PD were 21.5 and 14.0 mg/g, respectively. Therefore, strong anti-oxidant activities determined by radical scavenging of DPPH, ABTS, nitrite and reducing power were observed in the water extract of PC and the ethanol extracts of PD and PM. The water and ethanol extracts of PC, PD and PM did not showed anti-bacterial and anti-fungal activities at 0.5 mg/disc, but the ethanol extracts of PC and PP showed specific anti-bacterial activities against gram positive bacteria. In anti-diabetic activity assay, the PC and PA extracts inhibited α-glucosidase, whereas the hot water extract of PM and ethanol extracts of PC and PP inhibited β-amylase. Our results suggest that the pollen have high potential as noble resources of anti-oxidant, anti-bacterial and anti-diabetic. These results could be utilized for development of high-value added product of pollen.
Keywords:
Pollen, Anti-oxidant, Anti-microbial, Anti-diabetic서 론
지구상의 가장 많은 양을 차지하는 생명체는 식물이며, 가장 많은 종류를 차지하는 생명체는 곤충이다. 식물과 곤충은 화분 매개 방식을 통해 조화롭게 공생하여 왔으며, 이는 지구 생태계 유지 및 인류 생존에 필수적이다 (최 등, 1995). 화분 (Pollen)은 종자를 만드는 유관속 식물의 생식 기관으로 수컷 배우체를 보호하기 위해 carotenoid 중합체인 sporopollenin의 견고한 껍질로 둘러싸여 있으며 (이 등, 1997), 곤충, 바람, 물 등에 의해 운반되어 암컷 배우체에 도달하여 수정한 후 종자를 형성한다. 꿀벌 등의 곤충은 화분을 수집하여 타액, 꿀 등이 혼합된 덩어리 형태로 만들고, 이를 유충 및 성충의 먹이로 이용한다 (홍 등, 2014). 인류는 화분을 오래전부터 식용 및 전통 의약품으로 이용하였으며 (김 등, 1984; 김 등, 2010), 미국에서는 dietary supplement (Kroyer et al., 2001)로, 국내에서는 영양보조식품으로 이용되고 있다 (최, 2007).
화분은 기원 식물 및 회수, 가공 방법에 따라 차이가 있으나 통상 조단백 20~25%, 조지질 7~15%, 조회분 2~5%, 조탄수화물 20~50%, 수분 10~15%를 포함하고 있어, 균형 잡힌 영양식품으로 인정하고 있다. 그러나, 화분은 두꺼운 층으로 구성된 외피 (extine)와 내피 (intine)로 구성되어 있어 그 자체로는 소화, 흡수가 되지 않아 생체 이용률은 10~15%로 낮다는 문제점이 있으며 (최 등, 2017), 다양한 식물로부터 기인하여 미생물학적 오염이 나타날 수 있으며 수분함량이 높아 쉽게 부패하는 단점도 있다. 따라서 기존의 화분 연구는 영양학적 특성 평가 (이 등, 1997; 최 등, 2007; 홍 등, 2014; 홍 등, 2016)와 소화흡수를 증진시키기 위한 물리적, 화학적, 생물학적 추출조건, 전처리 방법 개발에 주로 집중되어 있다 (최와 정, 2004; 홍 등, 2013a; 홍 등, 2015; Fang et al., 2008; Xu et al., 2009).
화분은 영양적 특성 이외에도 다양한 유용 생리활성을 나타내며, 최근 노화 억제, 항산화 (심 등, 2004; 홍 등, 2014), 항균 (최 등, 2007; Abouda et al., 2011), 혈관신생 억제활성 (방 등, 2019), 면역증강 활성 (Li et al., 2009), 전립선염 개선 (Fang et al., 2008), 항당뇨 및 남성 성기능 개선 효과 (Mohamed et al., 2018) 등이 보고되고 있다. 그러나 현재까지 화분을 이용한 제품은 단순 건조된 영양보조식품이 대부분인 실정이다.
본 연구에서는 화분의 고부가가치화를 위한 기초자료 확보를 위해 국내에서 식용 및 약용으로 판매되고 있는 5종 화분 (도토리화분, 다래화분, 잡화분, 송화분, 부들화분)의 열수 및 에탄올 추출물을 조제하여 이들의 항산화, 항균 및 항당뇨 활성을 비교 평가한 결과를 보고하고자한다.
재료 및 방법
1. 화분 시료 및 재료
분석에 사용된 5종 화분 (도토리화분, 다래화분, 잡화분, 송화분, 부들화분)은 2019년 봄에 강원도 지역에서 채취한 화분을 구입하여 -20℃에서 냉동보관하면서 사용하였다. 기타 시약은 Sigma Co. (St. Louis, MO, USA)의 시약급 이상의 제품을 구입하여 사용하였다. 실험에 사용한 화분은 안동대학교 식품영양학과에서 보관하고 있다 (voucher specimen 2019-P1~5).
2. 화분의 이화학적 특성
화분의 pH, brix 및 산도는 5% 화분 용액을 100℃에서 30분간 열처리한 상등액을 이용하여 측정하였으며, pH 측정은 320 pH meter (Mettler Toledo InLabR 413, UK)로, brix 측정은 refractometer (Atago N-1E, Japan)을 이용하였다. 화분의 색차는 색차계 (Super color SP-80 Colormeter, Tokyo Denshoku Co., Japan)를 이용하여 명도 (lightness, L), 적색도 (redness, a), 황색도 (yellowness, b)를 측정하였다. 표준 백색판은 L값 92.39, a값 -0.08, b값 1.39이었으며, 시료당 3회 측정하여 평균값을 구하여 나타내었고 색차 (△E)는 다음의 식을 이용하여 계산하였다 (정과 손, 2014).
3. 화분의 세포 관찰
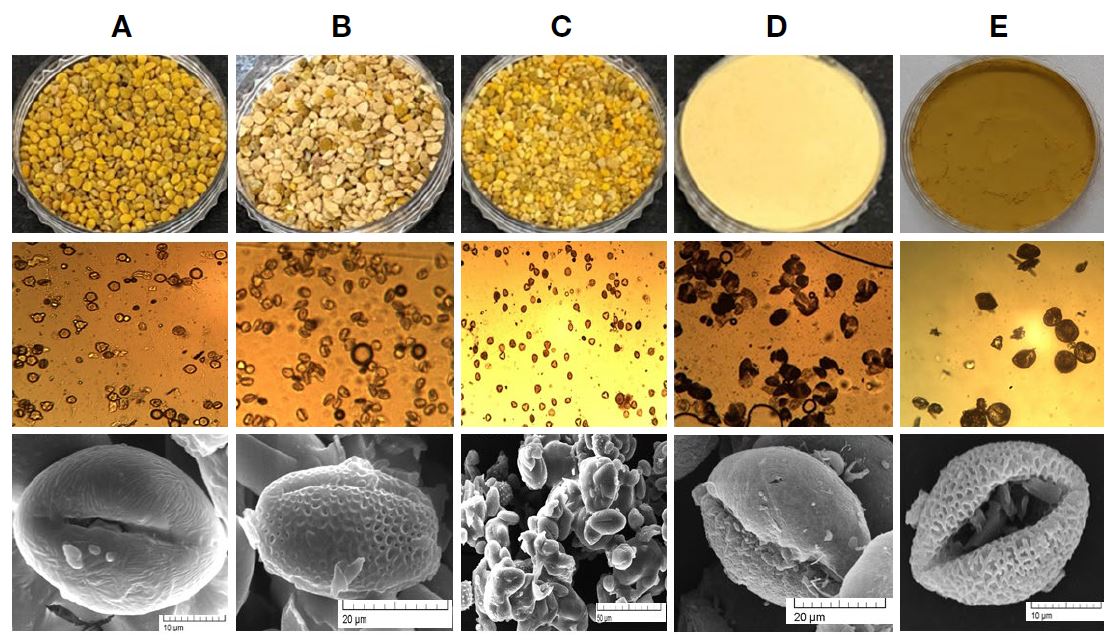
화분은 외관은 광학현미경 (Olympus CH-2, Olympus Optical Co., LTD, Japan, ×200)으로 확인하였으며 (Fig. 1), 상세 구조는 각각의 화분을 gold-palladium으로 진공상태에서 120초간 코팅시킨 다음 주사전자현미경 (Tescan, VEGA II LMU, Czech Republic)을 이용하여 확인하였다. 잡화분의 경우 1,500배, 기타 화분의 경우 2,400~5,000배 확대하였으며, 각각의 크기는 사진의 scale bar로 나타내었다 (Fig. 1).
4. 화분의 열수 및 에탄올 추출물 조제
화분 열수 추출물은, 화분 중량의 20배의 증류수를 가한 후, 100℃에서 1시간 추출한 후 추출액을 filter paper (Whatsman No. 2)로 거른 후 감압 농축 (Eyela Rotary evaporator N-1000, Tokyo Rikakikai Co., Ltd. Japan)한 후 동결건조 (Freeze dryer, FD5508, Ilshin Lab Co., Ltd, Korea)하여 분말로 조제하였다 (Kim et al., 2016). 화분의 ethanol 추출물은, 화분 중량에 대해 10배의 95% ethanol (Daejung Chemicals & Metals Co., Ltd. Korea)을 가한 후 상온에서 3회 추출한 후 상기와 동일하게 분말로 조제하였다. 분말시료들은 DMSO에 적당한 농도로 녹여, 성분 분석 및 생리활성 평가에 사용하였다.
5. 항산화 활성
5종 화분 추출물의 항산화 활성은 DPPH (1,1-diphenyl-2-picryl hydrazyl) 음이온 소거능, ABTS [2,2-azobis (3-ethylbenzothiazoline-6-sulfonate)] 양이온 소거능, nitrite 소거능 및 환원력 측정으로 평가하였다. 활성 평가는 기존의 방법 (김 등, 2017)과 동일하게 사용하였으며, 대조구로는 Vitamin C (Sigma Co., St. Louis, MO, USA)를 사용하였으며, 용매 대조구로는 DMSO를 사용하였다. DPPH 음이온 소거능, ABTS 양이온 소거능 및 환원력의 비교 평가 시 화분 추출물의 최종농도는 0.5 mg/mL로 조정하였으며, nitrite 소거능의 경우 0.2 mg/mL로 조정하였다. 각각의 활성 평가는 각각 3회 반복한 실험의 평균과 편차로 표시하였다.
6. 항균 활성
5종 화분 추출물의 항균 활성은 기존의 보고된 방법과 동일하게 disc-diffusion법으로 평가하였다 (성 등, 2019a). 항세균 활성 평가를 위한 그람 양성세균으로는 Listeria monocytogenes KACC 10550, Staphylococcus epidermidis ATCC 12228, Staphylococcus aureus KCTC 1916, Bacillus subtilis KCTC 1924를 사용하였으며, 그람 음성세균으로는 Escherichia coli KCTC 1682, Pseudomonas aeruginosa KACC 10186, Salmonella typhimurium KCTC 1926, Proteus vulgaris KCTC 2433를 사용하였고, 항진균 활성 평가를 위해서는 Candida albicans KCTC 1940 및 Saccharomyces cerevisiae IF0 0233를 사용하였다. 항세균 활성 평가의 경우, Nutrient broth (Difco Co., USA)에 각각의 세균을 접종하여 37℃에서 24시간 동안 배양한 후, 각 균주를 OD600 0.1로 조정하여 Nutrient agar (Difco Co., USA, Culture media ISO 6579) 배지를 포함하는 멸균 petri dish (90×15 mm, Green Cross Co., Ltd. Korea)에 100 μL 도말하고, 각각의 시료 5 μL를 포함하는 멸균 disc-paper (지름 6.5 mm, Whatsman No. 2)를, 상기 도말된 배지 위에 올린 후 37℃에서 48시간 동안 배양하였으며, 진균의 경우에는 Sabouraud dextrose agar (Difco Co., USA, Culture media USP 24) 배지를 이용하여 동일한 방법으로 30℃에서 24시간 동안 배양 후, 생육저지환의 크기를 측정하여 항균활성을 평가하였다. 대조구로는 항세균제인 ampicillin과 항진균제인 miconazole (Sigma Co., St. Louis, MO, USA)을 각각 1 μg/disc의 농도로 사용하였으며, 생육저지환의 크기는 육안으로 생육이 나타나지 않는 부분의 지름을 mm 단위로 측정하였고, 3회 이상 평가 후 대표 결과로 나타내었다.
7. 항당뇨 활성
5종 화분 추출물의 항당뇨 활성은 β-amylase 및 α-glucosidase 저해 활성을 평가하여 나타내었다. β-amylase 활성은 화분 추출물 시료 2.5 μL와 50 mM phosphate buffer (pH 6.8)로 희석한 β-amylase (0.25 U/mL) 25 μL를 혼합하여 37℃에서 10분간 preincubation한 후, 0.5% soluble starch (Samchun Chemicals Co., Korea) 25 μL를 가하여 37℃에서 10분간 반응하였다. 이후 100℃에서 5분간 가열하여 반응을 정지시켰으며, 반응액에 150 μL의 DNS (3,5-dinitrosalicylic acid) 용액을 첨가하여 100℃에서 5분간 가열, 발색한 후 상온에서 냉각하였다. 발색액은 96 well microplate reader (Tecan Co., USA)를 이용하여 540 nm에서 흡광도를 측정하였으며, 각각의 실험은 3회 반복한 후 평균값을 구하여 아래의 식으로 저해율을 계산하였다 (성 등, 2019b). 한편 α-glucosidase 저해 활성은, 화분 추출물 시료 2.5 μL와 50 mM sodium acetate buffer (pH 5.6)로 희석한 α-glucosidase (0.25 U/mL) 25 μL를 혼합하여 37℃에서 10분간 반응하고 1 mM p-nitrophenol glucoside 용액 25 μL를 가하여 60℃에서 10분간 반응하였다 (Tanase et al., 2019). 이후 1 M NaOH 25 μL를 첨가하여 반응을 정지시키고, 405 nm에서 흡광도를 측정하여 저해율을 계산하였다 (성 등, 2019b).
8. 기타 분석 및 통계처리
Total polyphenol (TP) 및 Total flavonoid (TF) 함량 측정은 기존의 보고된 방법 (Singleton et al., 1999)에 따라 측정하였으며, 각각 rutin과 tannic acid를 표준시약으로 사용하였다. 총당 정량의 경우에는 phenol-sulfuric acid법을, 환원당 정량의 경우에는 DNS 변법을 이용하였다 (Pancham et al., 2016). 각각의 분석결과는 3회 반복한 실험의 평균과 편차로 나타내었다. 실험 결과는 SPSS 23.0 버전을 사용하여 mean±SD 로 나타내었으며, 각 군 간의 차이는 ANOVA로 분석하였으며 유의수준은 p<0.05로 하였다.
결과 및 고찰
1. 5종 화분의 형태 및 이화학적 특성
시판 도토리화분 (A), 다래화분 (B), 잡화분 (C), 송화분 (D) 및 부들화분 (E)의 형태적 특성과 이화학적 특성은 Fig. 1 및 Table 1에 나타내었다. 먼저 도토리 화분은 기존의 보고 (홍 등, 2013b)와 유사하게 단립의 장구형 (prolate)으로 극면상은 원형이며, 표면은 미세한 돌기와 주름들이 확인되었다. 다래화분은 단립의 아장구형 (subprolate)으로 표면에 보리의 할맥 구조와 같은 구분선이 있으며 (홍 등, 2013b), 분화구와 같은 미세 함몰이 전체적으로 확인되었다. 송화분의 경우 작은 타원구형으로, 양쪽에 타원형의 그물 무늬가 있는 날개가 붙어 있어 쉽게 비산할 수 있는 구조로 확인되었다. 부들화분은 단립의 구형으로, 표면은 과립상으로 도토리 화분과 유사하였으며, 그물무늬 날개구조가 없어 대표적인 풍매화분인 송화분과도 차별화되었다. 잡화분의 경우 미세돌기를 가진 화분, 도토리화분, 다래화분 등 다양한 형태의 화분이 포함되어 있었으며 전자현미경 실측 결과 5종 화분은 25~35 μm의 크기를 보였다.
5종 화분의 색차 분석결과, 명도는 풍매화분인 송화분, 부들화분이 높게 나타났으며, 도토리화분, 다래화분, 잡화분은 상대적으로 낮게 나타났다 반면 적색도는 충매화분에서 높게 나타났으며, 황색도는 부들화분에서 가장 높게 나타났으며, 송화분 및 잡화분은 유사하였다. 전체적인 색차는 도토리화분>잡화분>다래화분>부들화분>송화분 순으로 나타났다. 이러한 화분 색차는 지역, 시기에 따라 차이가 있을 수 있으나 화분매개 방식과 곤충 선호도와도 연계되리라 추측된다. 한편 가수분해한 화분의 pH, brix, 산도를 특정한 결과, 도토리화분이 가장 높은 산도 (0.70)와 brix (52)를 나타내었으며 송화분이 가장 낮은 산도 (0.08)와 brix (0.2)를 나타내었다. 이는 도토리화분, 다래화분, 잡화분이 풍매화분인 송화분, 부들화분보다 다양한 성분을 포함하고 있음을 의미하고 있다.
2. 5종 화분 추출물의 성분 분석
5종 화분의 열수 및 에탄올 추출물의 유용성분 분석을 위해 총 폴리페놀, 총 플라노이드, 총당 및 환원당 함량을 평가하였다. 먼저 추출효율은 열수 추출이 에탄올 추출보다 1.1배 (잡화분)~2.4배 (부들화분) 높게 나타났으며, 열수 및 에탄올 추출물 모두에서 잡화분>다래화분>도토리화분>부들화분>송화분 순으로 나타났다 (Table 2). 총 폴리페놀 함량은 열수 추출물 중에서는 부들화분에서 29.1 mg/g으로 가장 높았으며, 도토리화분은 가장 낮은 4.7 mg/g을 나타내었다. 그러나, 에탄올 추출물의 경우 잡화분, 다래화분 송화분에서 21.5~25.4 mg/g의 높은 함량을 나타내었다. 이러한 현상은 총 플라보노이드 함량 분석에서도 유사하게 나타났으며 열수 추출물 중에서는 부들화분에서 19.6 mg/g으로 가장 높았으며, 도토리화분 및 송화분은 2.0~2.5 mg/g을 나타내었다. 에탄올 추출물의 경우 부들화분이 가장 높은 18.4 mg/g을 나타내었다. 한편 총당 및 환원당 분석의 경우 충매화분이 풍매화분보다 열수 추출물에서는 7~10배 이상, 에탄올 추출물에서는 평균 15배 이상 높은 함량을 보였다. 따라서 도토리화분, 다래화분 등의 충매화분은 풍매화분보다 상당량의 당류를 포함하고 있음을 확인하였다.
3. 5종 화분 추출물의 항산화 활성
5종 화분의 열수 및 에탄올 추출물의 항산화 활성을 평가한 결과는 Table 3 및 4에 나타내었다. DPPH 음이온 소거능 평가에서는 잡화분 및 다래화분의 에탄올 추출물에서 가장 높은 소거능을 나타내었으며, 기존 보고 (홍 등, 2014)와 유사하게 전체적으로 에탄올 추출물이 열수 추출물보다 우수한 활성을 나타내었다. ABTS 양이온 소거능 역시 잡화분 및 다래화분의 에탄올 추출물에서 가장 높은 소거능을 나타내었으며, 충매화분의 경우 에탄올 추출물이 열수 추출물보다 우수한 활성을 나타내었다. 그러나 송화분 및 부들화분의 경우 열수 추출물에서 에탄올 추출물보다 1.6배 이상 우수한 소거능을 나타내었다. 환원력 평가에서도 잡화분 및 다래화분의 에탄올 추출물에서 가장 높은 환원력이 나타났으며, ABTS 양이온 소거능과 유사한 활성 패턴을 나타내었다. 따라서 5종 화분 중 다래화분 및 잡화분의 경우 에탄올 추출물에서, 송화분 및 부들화분의 경우 열수 추출물에서 우수한 항산화 활성이 나타남을 확인하였다. 또한 5종 화분의 경우 DPPH 음이온 소거능보다 ABTS 양이온 소거능이 더욱 우수함을 알 수 있었다. 한편 발암억제와 관련된 nitrite 소거능 평가에서는 부들화분의 열수 및 에탄올 추출물에서 47.9~55.0%의 강력한 소거능을 확인하였으며, 송화분의 열수 추출물 및 도토리화분, 다래화분, 잡화분의 에탄올 추출물에서 우수한 소거능을 확인하였다 (Table 3). 다양한 농도에서 반복된 항산화 활성 평가 결과를 이용하여 활성이온의 50% 소거에 필요한 농도 (RC50)를 결정하였으며, 그 결과 Vitamin C에 비해서는 상대적으로 미약하나 다래화분, 잡화분, 부들화분의 실제적 이용 가능성을 확인하였다 (Table 4). 상기의 결과는 화분의 종류에 따라 지용성 및 수용성 항산화 물질 종류와 함량에 큰 차이가 있음을 제시하고 있다.
4. 5종 화분 추출물의 항균 활성
5종 화분의 열수 및 에탄올 추출물의 항세균 및 항진균 활성을 평가한 결과는 Table 5에 나타내었다. 먼저 대조구로 사용된 ampicillin은 강력한 항세균 활성을, miconazole은 강력한 항진균 활성을 나타냄을 확인하였다. 5종 화분의 열수 추출물에서는 모두 항균 활성이 나타나지 않았다 (Table 5). 그러나 에탄올 추출물에서는 송화분 및 부들화분 추출물에서 L. monocytogenes, S. epidermidis, S. aureus 및 B. subtilis의 그람 양성세균 특이적인 항균 활성이 나타났다. 이러한 결과는 향후 송화분 및 부들화분을 이용한 항세균제 개발이 가능함을 제시하고 있다.
5. 5종 화분 추출물의 항당뇨 활성
5종 화분의 열수 및 에탄올 추출물의 항당뇨 활성 평가를 위해 α-glucosidase 및 β-amylase 저해활성을 평가하였다. 먼저 임상에서 항당뇨제로 사용되고 있는 acarbose는 0.5 mg/mL 농도에서 각각 75.3% 및 59.0%의 저해를 나타내어 우수한 활성을 확인하였다 (Table 6). 5종 화분 중에서는 부들화분의 에탄올 추출물 및 열수 추출물에서 우수한 α-glucosidase 저해활성이 나타났으며, 도토리 화분에서도 유의적인 저해활성이 확인되었다. 기존 도토리와 도토리잎에서 α-glucosidase 저해활성이 보고 (Xu et al., 2018)된 바 있으나 도토리화분의 α-glucosidase 저해활성은 현재까지 알려진 바 없다. 반면 β-amylase 저해활성 평가에서는 송화분, 부들화분의 에탄올 추출물과 잡화분의 열수 추출물에서 매우 우수한 저해 활성이 나타났다. 따라서, 잡화분의 특정 성분과 β-amylase 저해활성의 연관성에 대한 추가적인 연구가 필요하며, 국내 다양한 화분에 대한 항당뇨 활성 평가가 필요하다고 판단된다 (Chen et al., 2018). 상기 결과는 뽕잎 등의 약용식물을 대치할 수 있는 송화분, 부들화분, 도토리 화분을 이용한 항당뇨제 개발이 가능함을 제시하고 있다.
적 요
화분의 고부가가치화를 위해, 국내 시판되는 도토리화분, 다래화분, 잡화분, 송화분 및 부들화분의 이화학적 특성을 평가하고 열수 추출물 및 에탄올 추출물을 조제하여 이들의 항산화, 항균 및 항당뇨 활성을 평가하였다. 5종 화분은 25~35 μm 크기로 미세한 돌기, 주름, 함몰구조, 비산을 위한 날개 등의 특유의 형태를 가지고 있었으며, 전체적인 색차는 도토리화분>잡화분>다래화분>부들화분>송화분 순으로 나타났으며, 도토리화분에서 가장 높은 산도와 brix를 나타내었다. 열수 및 에탄올 추출효율은 잡화분>다래화분>도토리화분>부들화분>송화분 순으로 나타났으며, 총 폴리페놀 및 총 플라보노이드 함량은 부들화분의 열수 추출물에서 29.1 mg/g 및 19.6 mg/g으로 가장 높았으며, 다래 화분에서도 높은 함량을 보였다. 따라서 총 폴리페놀 함량이 상대적으로 높은 부들화분 및 다래화분의 열수 추출물, 잡화분 에탄올 추출물에서 우수한 활성 라디컬 소거능과 환원력이 나타났다. 송화분 및 부들화분의 에탄올 추출물은 0.5 mg/disc 농도에서 그람 양성세균에 대한 특이적인 항균력을 나타낸 반면, 다른 화분 추출물은 항균활성이 인정되지 않았다. 향후 송화분 및 부들화분의 항균 활성 물질의 분리 및 기전 연구가 필요하다고 판단된다. 항당뇨 활성의 경우 부들화분과 도토리화분에서 α-glucosidase 저해활성이 나타났으며, 잡화분의 열수 추출물과 송화분, 부들화분의 에탄올 추출물에서 우수한 β-amylase 저해활성이 확인되었다. 이상의 결과는 화분이 항산화, 항균, 항당뇨 활성의 새로운 생물자원으로 이용가능함을 제시하고 있다.
Acknowledgments
본 연구는 한국연구재단 중점연구소 지원사업 (NRF-2018R1A6A1A03024862)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
- 김미선, 성화정, 박종이, 손호용. 2017. 오미자 열매, 씨, 착즙후 박의 항산화, 항균 및 항혈전 활성 평가. 생명과학회지 27: 131-138.
- 김애정, 한명륜, 김명환, 이수정. 2010. 화분 분말을 첨가한 현미 다식의 품질 특성. 한국식품영양학회지 23: 212-217.
- 김정우, 신상철, 김병각. 1984. 건강식품으로서의 화분제재에 관한 연구. 생약학회지 15: 147-149.
- 방호정, 안목련. 2019. 국내산 화분 (Bee pollen)의 항산화 및 혈관신생 억제 활성. 한국양봉학회 34: 87-97.
- 성화정, 최옥자, 박종이, 손호용. 2019a. 쪽잎의 생리활성 평가. 생명과학회지 29: 52-59.
- 성화정, 표수진, 박종이, 손호용. 2019b. 표고버섯 수확후 배지의 유용생리활성 평가. 생명과학회지 29: 164-172.
- 심태흠, 김영선, 사재훈, 신인철, 허성일, 왕명현. 2004. 도토리가루의 성분 분석과 항산화능 평가. 한국식품과학회지 36: 800-803.
- 이길란, 안목련. 2019. 국내산 화분 (Bee pollen)의 특성 및 영양성분 분석에 관한 연구. 한국양봉학회 34: 73-86.
- 이부용, 최희돈, 황진봉. 1997. 국내산 화분 및 화분 추출물의 성분 분석. 한국식품과학회지 29: 869-875.
- 정인창, 손호용. 2014. 흑마늘의 항산화, 항균 및 항혈전 활성, 한국미생물생명공학회지 42: 285-292.
- 최수정, 정윤화. 2004. 화분에서의 조단백질 및 환원당 추출시 단백질 분해효소가 미치는 영향. 한국식품영양과학회지 33: 1353-1358.
- 최승윤. 1995. 신제양봉학. 집현사. 서울.
- 최준혁, 임가영, 장세영, 정용진. 2007. 도토리 화분의 발아 조건에 따른 식품유해균 억제효과. 한국식품저장유통학회지 14: 87-93.
- 홍인표, 우순옥, 한상미, 김세건, 장혜리, 이만영, 최용수, 김혜경, 이명렬. 2016. 벼화분의 영양학적 가치 및 항산화 활성. 한국양봉학회지 31: 219-225.
- 홍인표, 우순옥, 한상미, 여주홍, 조미란, 주완택, 심하식, 최용수, 김혜경, 이명렬, 이만영. 2014. 도토리화분과 다래화분의 형태 및 항산화 활성. 한국양봉학회지 29: 137-142.
- 홍인표, 이만영, 우순옥, 심하식, 최용수, 한상미, 김혜경, 변규호, 이명렬, 김정봉. 2013b. 도토리화분과 다래화분의 일반성분, 지방산 분석 및 형태 관찰. 한국잠사곤충학회지 51: 119-122.
- 홍인표, 이만영, 우순옥, 심하식, 최용수, 한상미, 김혜경, 변규호, 이명렬, 하남규. 2013a. 도토리 화분 (꽃가루)의 물리적 처리에 의한 성분 변화. 한국양봉학회지 28: 217-221.
-
Abouda, Z., I. Zerdani, I. Kalalou, M. Faid and M. T. Ahami. 2011. The antibacterial activity of Moroccan bee bread and bee-pollen (fresh and dried) against pathogenic bacteria. Res. J. Microbiol. 6: 376-384.
[https://doi.org/10.3923/jm.2011.376.384]

-
Chen, Z., X. Du, Y. Yang, X. Cui, Z. Zhang and Y. Li. 2018. Comparative study of chemical composition and active components against α-glucosidase of various medicinal parts of Morus alba L. Biomed. Chromatogr. 32: e4328.
[https://doi.org/10.1002/bmc.4328]

-
Fang, K., Y. N. Wang, T. Q. Yu, L. Y. Zhang, F. Baluska, J. Samaj and J. X. Lin. 2008. Isolation of de-exined pollen and cytological studies of the pollen intines of Pinus bungeana Zucc. Ex Endl. and Picea wilsonii Mast. Flora 203: 332-340.
[https://doi.org/10.1016/j.flora.2007.04.007]

-
Hong, I. P., S. O. Woo, S. M. Han, S. G. Kim, H. R. Jang, M. Y. Lee, Y. S. Choi, H. K. Kim and M. L. Lee. 2015. Evaluation of total polyphenol, flavonoid and vitamin content from the crushed pollens of acorn and actinidia. Korean J. Apiculture 30: 225-229.
[https://doi.org/10.17519/apiculture.2015.09.30.3.225]

-
Kim, M. S., W. C. Shin, D. K. Kang and H. Y. Sohn. 2016. Anti-thrombosis activity of sinapic acid isolated from the lees of bokbunja wine. J. Microbiol. Biotechnol. 26: 61-65.
[https://doi.org/10.4014/jmb.1508.08095]

-
Kroyer, F. and N. Hegedus. 2001. Evaluation of bioactive properties of pollen extracts as functional dietary food supplement. Innov. Food Sci. Emerg. Technol. 2: 171-174.
[https://doi.org/10.1016/S1466-8564(01)00039-X]

-
Li, F., Q. P. Yuan and F. Rashid. 2009. Isolation, purification and immunobiological activity of a new water-soluble bee pollen polysaccharide from Crataegus pinnatifida Bge. Carbohydrate Polymers 78: 80-88.
[https://doi.org/10.1016/j.carbpol.2009.04.005]

-
Mohamed, N. A., O. M. Ahmed, W. G. Hozayen and M. A. Ahmed. 2018. Ameliorative effects of bee pollen and date palm pollen on the glycemic state and male sexual dysfunctions in streptozotocin-induced diabetic wistar rats. Biomed. Pharmcol. 97: 9-18.
[https://doi.org/10.1016/j.biopha.2017.10.117]

- Pancham, A., S. L. Godara and M. A. K. Bilma. 2016. Study of biochemical changes viz., total sugars (reducing and non-reducing), proteins and phenols in dry root infected groundnut plant. Annal. Biol. 32: 188-192.
-
Rashidian. G., S. Bahrami Gorji, M. N. Farsani, M. D. Prokić and C. Faggio. 2018. The oak (Quercus brantii) acorn as a growth promoter for rainbow trout (Oncorhynchus mykiss): growth performance, body composition, liver enzymes activity and blood biochemical parameters. Nat. Prod. Res. 23: 1-11.
[https://doi.org/10.1080/14786419.2018.1538994]

-
Singleton, V. L., R. Orthofer and R. M. Lamuela-Raventos. 1999. Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent. Methods Enzymol. 299: 152-178.
[https://doi.org/10.1016/S0076-6879(99)99017-1]

-
Sweeney, J. D., L. A. Hoerning, A. N. Behrens, E. Novak and R. T. Swank. 1990. Thrombocytopenia after desmopressin but absence of in-vitro hypersensitivity to ristocetin. Amer. J. Clin. Path. 93: 522-525.
[https://doi.org/10.1093/ajcp/93.4.522]

-
Tanase. C., A. Mocan, S. Coşarcă, A. Gavan, A. Nicolescu, A. M. Gheldiu, D. C. Vodnar, D. L. Muntean and O. Crişan. 2019. Biological and chemical insights of beech (Fagus sylvatica L.) bark: A source of bioactive compounds with functional properties. Antioxidants 8: E417.
[https://doi.org/10.3390/antiox8090417]

-
Xu. J., X. Wang, J. Yue, Y. Sun, X. Zhang and Y. Zhao. 2018. Polyphenols from acorn leaves (Quercus liaotungensis) protect pancreatic beta cells and their inhibitory activity against α-glucosidase and protein tyrosine phosphatase 1B. Molecules 23: E2167.
[https://doi.org/10.3390/molecules23092167]

-
Xu, X., L. P. Sun, J. Dong and H. C. Zhang. 2009. Breaking the cells of rape bee pollen and consecutive extraction of functional oil with supercritical carbon dioxide. Inno. Food Sci. Emer. Technol. 10: 42-46.
[https://doi.org/10.1016/j.ifset.2008.08.004]