
화밀 수집 방법에 따른 화밀분비량 및 유리당 함량 비교: Capillary tube 방법과 원심분리 방법을 중심으로
Abstract
This study compared the difference in the nectar volume (μL/flower), free sugar content (μg/μL) and nectar sugar content per flower (mg/flower) between the capillary tube and centrifuge method, which are most suitable for evaluating the value of honey plants among various nectar collecting methods. A method of repeatedly collecting nectar using a capillary tube and a method of collecting accumulated nectar using a centrifuge method were compared in Hovenia dulcis, Tetradium daniellii, and Zanthoxylum ailanthoides. As a results, there was a statistically significant difference in the nectar volume and free sugar content, but there was no difference in nectar sugar content per flower (T-test, p=0.05). In other words, as the free sugar content dose increased when the nectar volume decreased, the nectar sugar content per flower was maintained constant as a complementary characteristic (negative correlation). This result means that the nectar sugar content per flower should be considered the main factor in evaluating the value of the honey plants because the nectar volume is variable depending on environmental factors. In addition, it is judged that nectar collection by centrifuge is possible for honey plants that cannot collect nectar using capillary tube due to the narrow corolla structure.
Keywords:
Capillary tube, Centrifuge, Nectar sampling, Nectar secretion, Nectar sugar content서 론
화밀 (Nectar)은 식물의 광합성 작용으로 생성된 당 화합물이 밀선 (Nectary) 근처에 존재하는 유세포 (Parenchyma cell)에 집적되었다가, 삼투압 현상에 의해 수분을 흡수한 뒤 가수분해되면서 분비된다 (Heil, 2011). 화밀에는 수분과 당 성분이 주로 포함되어 있고 그 외에 아미노산, 미네랄, 2차 대사산물이 일부 포함되어 있다 (Adler, 2000; Nepi et al., 2012; Afik et al., 2014). 화밀 내 수분 (water)은 꿀벌의 섭식과 저장 과정 중에 대부분 증발되는 반면, 유리당 함량은 꿀 생산량에 직접적으로 기인하는 요소이기 때문에 밀원수종의 가치를 평가하는 연구에서 화밀 내 유리당 함량 분석은 매우 중요하다 (Kim et al., 2018). 한편, 분비되는 화밀의 양과 패턴, 유리당 함량과 구성은 수종마다 각기 다르기 때문에, 유망한 밀원수종들을 대상으로 화밀분비 특성과 유리당 및 아미노산 함량을 분석하는 연구가 활발히 수행되고 있다 (Wolff et al., 2006; Cavalcante et al., 2018; Broyles and Stoj, 2019). 뿐만 아니라, 최근에는 수종별 화밀분비 특성을 비롯하여 생장 특성 및 개화량을 이용하여 본당 또는 단위면적당 꿀 생산량을 추정하는 연구가 이루어지고 있다 (Adgaba, 2016; Bareke et al., 2021; 김 등, 2021a, 2021b, 2021c).
분비된 화밀을 채취하는 방법으로는 Bonnier (1879)가 pipette을 이용한 방법을 최초로 보고한 이후 capillary method, filter paper method, centrifuge method, wash, rinse 등 다양한 방법이 보고되었다.
Pipette을 이용한 화밀 수집 방법은 꽃의 밀선으로부터 화밀을 직접 채취하는 방법으로, 채취 후 capillary tube 또는 micro-syringe를 이용하여 분비된 화밀의 양을 정량하는 것이다. Capillary tube를 이용한 화밀 수집 방법은 특정 부피의 미세한 튜브를 이용하여 모세관 현상에 의해 화밀을 수집하고, 수집과 동시에 튜브의 부피와 수집된 화밀의 길이 비를 이용하여 화밀량을 정량하는 방법이다 (Corbet, 2003). Pipette을 이용한 방법은 화밀 수집 후 화밀량을 별도로 측정해야 하는 반면, capillary tube 방법은 화밀량을 상대적으로 쉽게 정량할 수 있으므로 조사 시간이 절약된다는 점에서 효율적이다. 이러한 방법들은 하나의 꽃을 대상으로 개화부터 탈락까지 반복적으로 화밀 수집이 가능하므로, 전체 개화기간 동안 분비된 총 화밀량과 시점별 화밀분비 패턴을 알 수 있다는 장점이 있다 (Morrant et al., 2009). 다만, 상대적으로 화밀 수집에 오랜 시간이 걸리고, 화관 (corolla)이 길고 좁아 밀선까지 조사 장비의 접근이 어려운 꽃 구조를 가지는 수종에는 적용할 수 없으며, 화밀을 반복적으로 수집하는 과정에서 밀선이나 꽃 구조가 파괴될 수 있다는 단점이 있다 (Corbet, 2003).
Centrifuge에 의한 화밀 수집 방법은 조사하고자 하는 꽃을 채취하여 수술과 암술 등 불필요한 기관을 제거한 후 tube에 넣고, 2∼3000 rpm의 속도로 원심분리를 하여 화밀을 수집하는 방법이다 (Swanson and Shuel, 1950; Armstrong and Paton, 1990). 수집된 화밀은 capillary tube 또는 micro-syringe를 이용하여 정량이 가능해 화밀분비량을 측정할 수는 있지만, 꽃을 채취하여 화밀을 수집하기 때문에 화밀분비 패턴을 조사하기 어려우며, 특정 시점의 화밀만 수집 가능하다는 단점이 있다.
Filter paper를 이용한 방법은 완전히 건조된 filter paper 조각을 이용하여 화밀을 흡수하고, 이를 증류수에 담가 nectar-water solution을 만든 후 HPLC 등 기기분석에 이용하는 방법이다 (Kearns and lnoye, 1993). 이 방법은 수집된 화밀량을 정확히 파악하기 어려우며, filter paper를 완전히 건조시킨 후 화밀 수집 전까지 외부환경에 영향을 받지 않도록 보관해야 하는데 이 과정이 매우 까다로워 현장 적용이 어렵다는 단점이 있다 (Mckenna and Thomson, 1988).
Wash와 rinse의 방법은 적은 양의 화밀이 분비되는 경우, 꽃의 크기가 매우 작거나, 화밀 내 수분 증발로 인해 점성이 높은 화밀을 수집하는 방법이다. Wash 법은 꽃을 채취한 후 20 mL vial에 꽃과 증류수 2 mL을 넣고 1분 동안 흔들어 제조된 nectar-water solution을 분석에 이용한다 (Grunfeld et al., 1989). 이러한 방법은 꽃을 채취하여 진행하기 때문에 원심분리 방법과 마찬가지로 하나의 꽃에서 지속적인 화밀 수집이 불가능하다. Rinse 법은 꽃을 증류수로 반복적으로 씻어 nectar-water solution을 얻는 방법으로 wash 방법과 유사하나, 꽃을 채취하지 않고 현장에서 바로 수집한다는 차이점이 있다 (Nunez, 1997; Mallick, 2000). 위의 두 가지 방법은 분비된 화밀량을 정밀하게 측정하기 어려우며, 화밀을 씻어내는 과정에서 화분이 첨가되어 유리당 및 아미노산 함량이 과대치를 나타내는 경향이 있다 (Morrant et al., 2009).
지금까지 국내 밀원수종의 화밀 특성에 관한 연구는 주로 capillary tube 방법과 centrifuge 방법으로 수행되었다 (한과 김, 2008; Kim et al., 2015; 김 등, 2017; Kim et al., 2021). 하지만, 화밀 수집 방법에 따라 화밀분비량과 화밀 내 유리당 함량이 달라질 수 있음에도 이를 비교 분석한 연구가 미흡한 상황이다. 또한, 현재까지 다양한 수종을 대상으로 화밀특성 조사가 수행되었으나, 동일 수종 내에서 화밀 수집 방법에 따라 화밀분비량은 큰 차이를 나타내고 있으며 (김 등, 2011; Kim et al., 2018), 화밀분비량 조사와 유리당 함량 분석에 이용되는 화밀 수집 방법이 상이하거나, 원심분리 방법을 이용한 경우 꽃의 개화기간 (수명)을 고려하지 않고 화밀을 수집하여 단편적인 조사에 그쳤다는 문제점이 있다 (Kim et al., 2012; 김 등; 2015; 김 등, 2019).
이에 본 연구는 capillary tube 방법과 원심분리 방법을 모두 이용할 수 있는 헛개나무, 쉬나무, 머귀나무를 대상으로 화밀 수집 방법 간 화밀분비량, 유리당 함량을 비교 분석하여 화밀 수집 방법에 따른 특성 차이를 검증하고자 하였다. 아울러, 수종별 화밀 수집 방법을 결정하는 데 고려해야 할 사항들에 대해 제언하고자 한다.
재료 및 방법
1. 공시수종 선정
본 실험은 capillary tube를 이용해 반복적으로 화밀을 수집하는 방법과 원심분리 방법을 이용하여 개화기 동안 누적된 화밀을 수집하는 방법 간 화밀 특성 차이를 비교하기 위해 수행되었다. 따라서, capillary tube 방법과 원심분리 방법을 모두 적용할 수 있는 화기 구조를 가지면서, 비교적 많은 화밀이 분비되는 헛개나무, 쉬나무 (수꽃), 머귀나무 (수꽃)를 공시 수종으로 선정하였다. 조사 장소는 헛개나무의 경우 경기도 수원시 소재의 국립산림과학원 산림생명자원부 (37°15′04.18″N, 126°57′16.80″E)에 식재된 클론보존원이며, 쉬나무는 경기도 수원시 소재의 원평시험림 (37°14′43.38″, 126°54′51.64″), 머귀나무는 산림바이오소재 연구소 진주 시험림 (35°12′26.32″, 128°10′01.35″)에서 조사를 실시하였다. 각 수종별 조사목의 생장특성은 헛개나무의 경우 수고 4.0±0.4 m, 근원경 15.6±1.8 cm이며, 쉬나무는 수고 6.8±0.9 m, 근원경 29.2±5.6 m, 머귀나무 수고 9.1±2.1 m, 근원경 22.3±4.9 cm였다.
2. 화밀 수집 방법
화밀 수집 방법에 따른 화밀분비량, 유리당 특성 비교를 위해 수종별로 병충해의 피해를 받지 않고, 정상적으로 생육하고 있는 조사목 3본을 각각 선정하였다. 개화 최성기에 도달한 시기에 각 개체별 방위와 위치를 고려하여 개화 직전의 화서 (Inflorescence)를 선정한 후, 화분매개자에 의한 화밀 손실을 방지하기 위한 차단망을 사전에 설치하였다. 개화 시점을 명확히 구분하기 위해 선정된 화서 내에서 이미 개화한 꽃은 미세가위를 이용하여 모두 제거한 후 차단망을 씌웠으며, 다음 날 개화한 꽃을 대상으로 빠짐없이 라벨을 실시하여 개화 시점을 구분하였다. 이후 capillary tube 방법과 원심분리 방법을 이용하여 각각 화밀을 수집하였다 (Fig. 1).
Capillary tube 방법은 3 μL capillary tube (Drummond)를 이용하였으며, 1일 2회 오전 (10:30∼12:00)과 오후 (16:00∼17:30)로 구분하여 개화 시작부터 탈락까지 지속적으로 화밀을 수집하였다. 채취한 화밀은 tube 길이와 부피비를 이용하여 정량한 다음 (Corbet, 2003), 화밀을 재추출하여 유리당 분석에 이용하였다.
원심분리 방법은 꽃을 채취하여 화밀을 수집하는 방법으로, 하나의 꽃에서 지속적인 화밀 수집이 불가능하다. 따라서, 차단망을 씌운 후 익일 오전에 개화한 꽃을 대상으로 빠짐없이 라벨을 실시하여 개화시점을 구분한 다음, 꽃의 수명 동안 존치시킨 후 누적된 화밀을 수집하였다. 즉, 헛개나무의 경우 하나의 꽃이 2일 동안 개화하다가 3일차에 모두 낙화하였기 때문에, 개화 후 2일차 오후까지 분비된 누적 화밀을 수집하였고, 1일 동안만 개화가 유지되는 쉬나무와 머귀나무는 라벨을 실시하고, 1일차 오후 (17:00)까지 분비된 화밀을 수집하였다. 수집된 화밀은 100 μL syringe를 이용하여 정량한 다음 유리당 분석에 이용하였다.
각 방법별 조사에 이용한 꽃의 수는 개화 정도에 따라 다르게 적용하였으나 수종별로 3본의 공시목에서 최소 30개 이상의 꽃을 대상으로 조사하여 평균 값을 산출하였다. 헛개나무와 쉬나무는 capillary tube 방법과 원심분리 방법을 이용하여 같은 날짜에 화밀을 수집하였고, 머귀나무의 경우 capillary tube를 이용한 조사는 7월 27일부터 7월 29일까지, 원심분리를 이용한 조사는 8월 9일부터 11일까지 수행하여 조사 일자에 따른 화밀특성 차이를 분석하였다 (Table 1).
3. 유리당 함량 분석
화밀 내 유리당 함량을 분석하기 위해 수집된 화밀에 80% 에탄올 (v/v) 10배액을 가한 후 0.45 μm centrifugal filter로 정제했다. 유리당 분석은 HPLC (Dionex ultimate 3000, Dionex, USA)를 이용하여 분석하였다. 이동상으로는 3차 증류수를 사용하였고, 유속은 0.5 mL/min, 온도는 80℃로 설정하였다. 화밀 내 유리당은 sucrose, glucose, fructose가 주요 구성요소이며, 이 외의 단당류 (mannose, arabinose, xylose)와 이당류 (maltose, melibiose) 등을 일부 포함하기도 하나 매우 소량이므로 무시 가능한 수준임이 밝혀졌다 (Nicolson et al., 2007; Witt et al., 2013). 따라서, 유리당의 표준품으로는 sucrose, glucose, fructose (Sigma Aldrich, USA) 3종을 사용하였으며, Aminex 87P column (Bio-rad, USA)을 사용하여 Ri-101 detector (Shodex, Japan)로 유리당을 검출하였다. 함량은 적분계에 의한 외부표준법으로 계산하였다 (Linear regression equation, r2>0.999). 분석 후 각각의 당 함량을 모두 합하여 단위용량당 유리당 함량 (μg/μL)을 구하고, 화밀분비량 (μL/flower)을 곱하여 꽃 하나당 유리당 함량 (mg/flower)을 산출하였다.
4. 통계분석
조사된 자료는 SPSS for windows ver. 18 (IBM, Chicago, USA)을 이용하여 화밀 수집 방법에 따른 화밀분비량, 단위용량당 유리당 함량, 꽃 하나당 유리당 함량을 비교하기 위해 T-test를 실시하였다 (p=0.05). 또한, Pearson 상관분석을 이용하여 화밀특성 간 상관관계를 분석하였다.
결과 및 고찰
1. 화밀 수집 방법에 따른 특성 비교
헛개나무를 대상으로 화밀 수집 방법에 따른 화밀분비량, 단위용량당 유리당 함량 (Free sugar content, FSC) 및 꽃 하나당 유리당 함량 (Nectar sugar content per flower, NSCF)을 비교한 결과는 Table 2와 같다. Capillary tube를 이용하여 화밀을 수집한 결과, 2일 동안 평균 4.32±1.06 μL의 화밀이 분비되었으며, 단위용량당 유리당 함량은 434.4±80.4 μg/μL를 나타냈고, 꽃 하나당 유리당 함량은 1.81±0.58 mg으로 조사되었다. 반면, centrifuge를 이용하여 개화 2일차에 누적 화밀을 수집한 결과 화밀분비량은 2.52±0.13 μL로 조사되었고, 단위용량당 유리당 함량은 727.8±76.2 μg/μL, 꽃 하나당 유리당 함량은 1.83±0.17 mg으로 나타났다. 화밀 수집 방법에 따라 화밀분비량과 유리당 함량은 유의한 차이가 인정되었으나, 꽃 하나당 유리당 함량은 차이가 없는 것으로 나타났다.

Comparison of properties of nectar secretion, free sugar and nectar sugar content of Hovenia dulcis by sampling method.
일반적으로 화밀분비량은 상대습도와 온도 등 환경요인에 의해 영향을 받는다. 높은 온도와 낮은 상대습도 조건에서는 화밀을 농축시키고, 낮은 온도와 높은 상대습도에서는 화밀의 농도를 묽게 하는 경향이 있다 (Jakobsen and Kristjansson, 1994; Burquez and Corbet, 1998). 다만, 이러한 환경변화 속에서 식물은 번식에 필요한 적절한 화분매개자를 유인하기 위해 화밀 내 당도를 유지하기 위해 노력한다 (Nepi and Stpiczynska, 2007; Sangeetha and Palatty, 2019). Bareke et al. (2021)은 아라비카커피 (Coffea arabica)를 대상으로 개화 후 07:00부터 18:00까지 시간대별 화밀을 수집한 결과 기온이 낮은 오전에는 많은 화밀이 분비되었으나 당도는 낮았고, 오후에 기온이 점차 증가함에 따라 화밀량은 감소하고, 당도는 증가하는 경향을 보였으며, 꽃 하나당 유리당 함량은 화밀 수집 시간에 관계없이 일정하게 유지된다고 보고하여 본 연구 결과와 유사하였다. 이를 고려할 때, 원심분리 방법을 이용한 방법은 꽃에서 분비된 화밀을 2일 동안 존치함에 따라 외부환경에 의해 화밀 내 수분이 증발하였기 때문에 화밀량은 급격히 감소한 반면, 단위용량당 유리당 함량은 약 2배 정도 높게 나타난 것으로 보인다. 반면, capillary tube를 이용한 방법은 1일 2회 오전과 오후를 구분하여 화밀을 수집함으로써, 화밀이 분비된 직후 비교적 빠른 시간에 화밀을 채취했기 때문에 수분의 증발이 적어 화밀분비량은 높고, 단위용량당 유리당 함량은 다소 낮은 것으로 판단된다.
쉬나무를 대상으로 capillary tube를 이용하여 화밀을 수집한 결과, 화밀분비량은 3.53±1.10 μL, 단위용량당 유리당 함량은 330.6±33.9 μg/μL를 나타냈고, 꽃 하나당 유리당 함량은 1.17±0.29 mg으로 조사되었다 (Table 3). 반면, 원심분리 방법의 경우 화밀분비량은 1.90±0.20 μL로 다소 낮게 나타났으나, 단위용량당 유리당 함량은 685.7±119.6 μg/μL로 비교적 높았고, 꽃 하나당 유리당 함량은 1.16±0.17 mg을 나타냈다. 원심분리 방법은 capillary tube 방법에 비해 화밀분비량이 47%가 낮았으나, 단위용량당 유리당 함량은 약 2배 높았으며, 꽃 하나당 유리당 함량은 차이를 나타내지 않았다. 이는 앞선 헛개나무와 동일한 경향을 나타낸 것으로 화밀 내 수분증발에 의해 화밀량은 감소되었으나, 단위용량당 유리당 함량은 증가하여 꽃 하나당 당 함량이 일정하게 유지되는 것으로 판단된다.

Comparison of properties of nectar secretion, free sugar and nectar sugar content of Tetradium daniellii by sampling method
머귀나무에서 capillary tube에 의해 수집된 총 화밀분비량은 0.95±0.28 μL였으며, 단위용량당 유리당 함량은 1,156.5±153.9 μg/μL, 꽃 하나당 유리당 함량은 1.08±0.21 mg으로 조사되었다 (Table 4). 반면, 원심분리 방법으로 수집한 총 화밀분비량은 1.39±0.09 μL를 나타냈고, 단위용량당 유리당 함량은 732.6±124.1 μg/μL로 비교적 낮았으나, 꽃 하나당 유리당 함량은 1.02±0.15 mg으로 화밀 수집 방법에 의한 차이가 인정되지 않았다. 다만, 앞선 헛개나무와 쉬나무의 경우 capillary tube 방법에서 화밀분비량은 높고, 단위용량당 유리당 함량은 낮은 경향을 보였으나, 머귀나무는 원심분리 방법에서 화밀분비량이 높고, 단위용량당 유리당 함량이 낮게 나타나 서로 다른 경향을 보였다. 이와 같은 결과는 capillary tube 방법으로 화밀을 수집한 7월 27일부터 29일까지의 일 평균기온 (26.9∼27.8℃)이 원심분리 방법으로 조사한 8월 9일부터 11일까지 일 평균 기온 (25.5∼26.3℃)보다 비교적 높았기 때문에, 화밀 내 수분 증발에 관여하여 화밀분비량과 단위용량당 유리당 함량에 영향을 미친 것으로 판단된다. 그러나, 머귀나무에서도 헛개나무, 쉬나무와 마찬가지로 화밀 수집 방법에 따라 꽃 하나당 유리당 함량은 차이가 없다는 동일한 결과를 확인할 수 있었다.

Comparison of properties of nectar secretion, free sugar and nectar sugar content of Zanthoxylum ailanthoides by sampling method
화밀 내 유리당 구성은 주로 sucrose, glucose, fructose로 구성되며, sucrose와 hexose (fructose, glucose)의 비율은 화분매개자 섭식에 영향을 미치는 중요한 요소로 알려졌다 (Freeman et al., 1991; Stiles and Freeman, 1993). 따라서, 수종별로 화밀 내 유리당 구성 비율을 구명하고 화분매개자와의 상호관계를 이해하려는 연구가 활발히 수행된 바 있다 (Southwick et al., 1981; Galetto and Bernardello, 2004). 본 연구에 사용된 3수종을 대상으로 화밀 수집 방법에 따른 유리당 구성비를 비교한 결과는 Fig. 2에 나타냈다. 헛개나무에서 capillary tube 방법으로 화밀을 수집했을 때 sucrose 95.3±1.7%, glucose 2.4±0.8%, fructose 2.2±0.9%를 나타냈으며, 원심분리 방법으로 화밀을 수집한 결과는 sucrose 93.7±2.1%, glucose 2.8±0.8%, fructose 3.5±1.3%로 유의한 차이가 없었다. 또한, 쉬나무 화밀 내 sucrose (capillary tube: 49.4±14.3% vs. centrifuge: 54.2±3.6), glucose (27.0±7.3% vs. 24.4±1.9), fructose (23.6±7.0% vs. 21.4±1.7%) 구성비는 화밀 수집 방법에 따라 차이가 없었으며, 머귀나무 역시 sucrose (51.3±7.9% vs. 48.6±3.0%), glucose (29.0±4.5% vs. 31.0±2.7%), fructose (19.6±3.7% vs. 20.4±0.5%) 구성비는 화밀 수집 방법 간 차이가 없는 것으로 나타나 3수종에서 동일한 경향을 나타냈다. 이러한 결과를 통해 화밀 수집 방법에 따라 단위용량당 유리당 함량 값은 차이를 나타내지만, 각 유리당의 구성 비율은 일정하게 유지된다는 것을 유추할 수 있다.
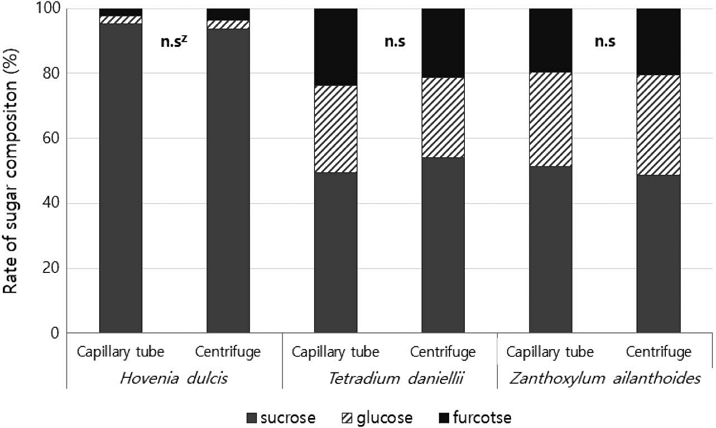
Comparison of sugar composition in floral nectar collected by two methods from three species. zNon-significant (T-test, p>0.05).
종합하면, capillary tube를 이용한 반복적인 화밀 수집과 원심분리 방법을 이용하여 누적 화밀을 수집하는 방법은 화밀분비량과 단위용량당 유리당 함량은 다소 차이가 있었으나, 유리당 구성비와 꽃 하나당 유리당 함량은 차이를 나타내지 않았으므로 두 가지 방법 모두 화밀 내 유리당 구성을 구명하고, 밀원 생산성을 평가하는 데 적용할 수 있을 것으로 판단된다.
2. 화밀 특성 간 상관관계 분석
화밀 특성 간 관계를 파악하기 위해 수종별 화밀 수집 방법에 따른 화밀분비량 (NV), 단위용량당 유리당 함량 (FSC), 꽃 하나당 유리당 함량 (NSCF) 값을 이용하여 Pearson 상관분석을 실시한 결과는 Table 5와 같다. 헛개나무, 쉬나무, 머귀나무에서 화밀분비량과 단위용량당 유리당 함량 사이에 부의 상관관계 (r=-0.883, r=-0.773, r=-0.937)가 나타났으며, 꽃 하나당 유리당 함량은 화밀분비량 또는 단위용량당 유리당 함량과 상관관계가 인정되지 않았다. 즉, 화밀분비량이 감소하는 대신 단위용량당 유리당 함량은 증가하는 상호보완적인 특성으로 부의 상관관계가 인정되는 것으로 판단되며, 화밀 수집 방법의 차이에 따른 화밀분비량의 다소 (多少)와 관계없이 꽃 하나당 당 함량은 일정하게 유지되는 것을 확인할 수 있었다. 이러한 결과는 밀원수종의 정확한 가치평가를 위해서는 환경의 영향을 받는 화밀분비량보다 꽃 하나당 유리당 함량을 주요 인자로 고려되어야 함을 의미한다.
화밀분비량과 당도는 다양한 환경조건하에서 유동적으로 변화하며, 부의 상관을 나타내는 것이 일반적이다. 선행 연구 결과에 쉬나무의 일자별 화밀분비 특성과 기후요인과 상관관계를 분석한 결과 화밀분비량은 온도 (r=-0.800), 상대습도 (r=0.726)와 상관을 나타냈고, 화밀당도는 온도 (r=0.670), 상대습도 (r=-0.802)와 상관관계가 성립하였으며, 화밀분비량과 화밀당도 간 부의 상관관계 (r=-0.746)를 보고하였다 (김 등, 2014). 또한, 산사나무의 일자별 화밀분비량은 상대습도와 정의 상관 (r=0.582)을 나타내며, 화밀분비량과 당도는 부의 상관 (r=-0.763)이 있음을 보고하였다 (Kim et al., 2018). 이러한 결과들을 고려할 때, 화밀이 분비되고 이를 수집하기까지의 온도, 상대습도 등 기후요인이 화밀분비량과 단위용량당 유리당 함량에 영향을 준다는 것을 유추할 수 있다. 추가적으로, 본 연구에서는 조사 방법에 의한 화밀특성 간 상관관계 분석에 그쳤으나, 추후 연구에서는 시간대별 기후요인과 화밀분비량과의 상관관계를 분석하는 등 보다 심도 있는 연구가 이루어져야 할 것으로 판단된다.
3. 화밀 수집 방법 결정을 위한 제언
화밀 수집 방법을 결정함에 있어 첫 번째로 고려해야 할 것은 화밀량 측정 여부이다. 꽃 하나에서 분비되는 화밀량의 측정 없이 단순히 유리당 구성 등 화밀 내 성분 분석을 목적으로 할 경우 wash, rinse, filter paper의 방법을 적용할 수 있다 (Morrant et al., 2009). 그러나, 화밀분비량은 밀원식물로서의 가능성을 평가하는 가장 기본적인 전제조건이며, 꽃 하나당 유리당 함량 산출에 이용되는 요인이기 때문에 밀원수종의 가치 평가를 위한 조사에서 화밀분비량을 정량할 수 없는 위의 방법들은 추천하지 않는다.
두 번째로는 조사하고자 하는 수종의 꽃 구조를 관찰하여 capillary tube 등 조사 장비의 접근 가능 여부를 파악해야 한다. 밀선으로부터 직접 화밀을 채취할 수 없는 구조를 가지거나 (Broyles and Stoj, 2019), 꽃의 화관 (corolla tube)이 좁은 구조로 인해 pipette, capillary tube 등 조사 장비의 접근이 불가능한 꽃 구조를 가지는 수종은 원심분리 방법에 의한 화밀 수집을 권장한다 (Corbet, 2003). 다만, 원심분리를 이용하기 위해서는 반드시 꽃의 수명을 고려하여, 개화기간 동안 누적된 화밀을 수집해야만 정확한 측정이 가능하다.
마지막으로, 밀선으로부터 직접 화밀을 채취할 수 있는 구조를 갖는 경우에는 화밀이 분비되는 양에 따라 조사 장비를 다르게 적용할 수 있다. 꽃 하나에서 분비되는 화밀량이 20 μL 이상일 경우에는 100 μL pipette을 이용해 수집하고, 20 μL 미만인 경우에는 1~20 μL capillary tube 중 적절한 용량의 튜브를 선택하는 것이 조사 시간을 줄이는 측면에서 바람직하다 (Corbet, 2003). 이러한 방법들은 하나의 꽃에서 지속적으로 화밀 수집이 가능하므로 화밀이 분비되는 정확한 시점을 구명하고, 시간대별 유리당 함량 변화를 구명하는 등 구체적인 조사가 가능하다는 장점이 있다. 따라서, 밀원수종 가치평가를 위한 화밀 수집 방법으로 capillary tube 방법과 pipette을 이용한 조사방법을 가장 추천하나 꽃 하나에서 분비되는 총량이 1 μL 이하 (low nectar volume)인 경우와 화밀의 점성이 너무 높아 capillary tube에 의한 화밀 수집이 불가능한 경우에는 원심분리 방법을 이용하는 것이 노동력 절감 측면에서 바람직할 것으로 판단된다 (Silva et al., 2004; Arnold and Michaels, 2017).
요약하면, 화밀량 측정 여부, 꽃의 구조, 화밀 분비량을 종합적으로 고려하여 화밀 수집 방법을 결정하여야 하며, 조사목을 대상으로 사전에 꽃 구조와 화밀분비량을 관찰하여 어떠한 방법을 적용할지 판단하는 과정이 필요하다. 본 연구에서는 밀원수종 가치평가에 가장 바람직하다고 생각되는 capillary tube와 원심분리 방법 간 꽃 하나당 유리당 함량에 차이가 없음을 증명하였으므로 수종별로 각기 다른 화밀 수집방법을 적용하더라도 꽃 하나당 유리당 함량에 기초하여 산출된 본당 꿀 생산량 또는 단위면적당 꿀 생산량을 통해 수종 간 비교가 가능할 것으로 판단된다.
적 요
본 연구는 화밀을 수집하는 다양한 방법들 가운데 밀원수종 가치평가에 가장 적합한 capillary tube 방법과 원심분리 방법 간 화밀분비량 (μL/flower), 단위용량당 유리당 함량 (μg/μL), 꽃 하나당 유리당 함량 (mg/flower) 차이를 비교하기 위해 수행되었다. 헛개나무, 쉬나무, 머귀나무를 대상으로 capillary tube를 이용하여 반복적으로 화밀을 수집하는 방법과 원심분리 방법을 이용하여 누적된 화밀을 일시에 수집하는 방법을 비교한 결과, 화밀분비량과 단위용량당 유리당 함량은 통계적으로 유의한 차이가 있었으나 꽃 하나당 유리당 함량은 차이를 나타내지 않았다. 즉, 화밀분비량이 감소하면 단위용량당 유리당 함량은 증가하는 상호 보완적인 특성 (부의 상관)으로 꽃 하나당 유리당 함량은 일정하게 유지되었다. 이러한 결과는 화밀분비량은 환경요인에 의해 가변적이기 때문에 밀원수종의 가치를 평가하기 위해서는 꽃 하나당 유리당 함량을 주요 인자로 고려해야 함을 의미한다. 또한, 꽃의 화관이 좁은 구조로 인해 capillary tube를 이용한 화밀 수집이 불가능한 수종은 원심분리 방법에 의한 화밀 수집이 가능할 것으로 판단된다.
Acknowledgments
본 연구는 국립산림과학원 산림과학연구사업 (과제번호: FG0403-2022-01-2022)의 지원에 의해 수행되었습니다.
References
- 김문섭, 김세현, 한진규, 강문수, 박영기. 2011. 중국 산사나무의 꿀벌 방화와 화밀 분비 특성. 한국양봉학회지 26(1): 163-167.
- 김문섭, 김세현, 송정호, 김혜수. 2014. 밀원수종 쉬나무 수꽃과 암꽃의 화밀분비량, 당 함량 및 아미노산 분석. 한국임학회지 103(1): 43-50.
- 김문섭, 김혜수, 김소담, 박상진, 송정호, 김세현. 2015. 황칠나무 꽃의 곤충 방화, 화밀의 분비 특성과 당 함량 및 아미노산 분석. 한국양봉학회지 30(4): 307-314.
- 김세현, 이안도성, 권해연, 이욱, 김문섭. 2017. 밤나무 주요 4품종의 개화 및 화밀 특성 분석. 한국양봉학회지 32(3): 237-246.
- 김영기, 김세현, 송정호, 남재익, 송재모, 김문섭. 2019. 왕벚나무와 산벚나무의 화밀분비량, 당 함량 및 아미노산 분석. 한국양봉학회지 34(3): 225-232.
- 김영기, 유희원, 권해연, 나성준. 2021a. 매실나무의 화밀분비량, 유리당 함량 및 꿀 생산량 추정. 한국양봉학회지 36(3): 141-147.
- 김영기, 유희원, 박문수, 권해연, 김만조, 나성준. 2021b. 남부권역 유망 밀원수종 동백나무의 밀원가치 평가. 한국양봉학회지 36(3): 149-159.
- 김영기, 유희원, 권해연, 나성준. 2021c. 명자나무의 꿀벌 방화와 밀원가치 평가. 한국양봉학회지 36(3): 161-168.
- 한진규, 김세현. 2008. 밀원수종 헛개나무의 개화 및 화밀분비 특성. 한국양봉학회지 23(3): 199-205.
-
Adgaba, N., A. A. Ghamdi, Y. Tadesse, A. Getachew, A. M. Awad, M. J. Ansari, A. A. Owayss, S. A. Mohammed and A. S. Alqarni. 2016. Nectar secretion dynamics and estimated honey production potentials of some major honey plants in Saudi Arabia. Saudi J. Biol. Sci. 24(1): 180-191.
[https://doi.org/10.1016/j.sjbs.2016.05.002]

-
Adler, L. S. 2000. The ecological significance of toxic nectar. Oikos 91: 409-420.
[https://doi.org/10.1034/j.1600-0706.2000.910301.x]

-
Afik, O., K. S. Delaplane, S. Shafir, H. M. Valle and J. J. G. Quezada-Euan. 2014. Nectar minerals as regulators of flower visitation in stingless bees and nectar hoarding wasps. J. Chem. Ecol. 40: 476-483.
[https://doi.org/10.1007/s10886-014-0455-8]

-
Armstrong, D. P. and D. C. Paton. 1990. Methods for measuring amounts of energy available from banksia inflorescences. Austral Ecology 15: 291-297.
[https://doi.org/10.1111/j.1442-9993.1990.tb01033.x]

-
Arnold, P. M. and H. J. Michaels. 2017. Nectar sampling for prairie and Oak Savanna butterfly restoration. Appl. Plant Sci. 5(6): 1660148.
[https://doi.org/10.3732/apps.1600148]

- Bareke, T., A. Addi, K. Wakjira and T. Kumsa. 2021. Dynamics of nectar secretion, honey production potential and colony carrying capacity of Coffea arabica L., Rubiaceae. J. Agric. Environ. Int. 115(1): 125-138.
- Bonnier, G. 1879. Les nectaires: étude critique, anatomique et physiologique. Annal. Sci. Nat. Botanique 8: 5-212.
-
Broyles, S. B. and K. R. Stoj. 2019. Patterns of nectar production in Asclepias curassavica (Apocynaceae). J. Poll. Ecol. 25(8): 78-88.
[https://doi.org/10.26786/1920-7603(2019)541]

- Burquez, A. and S. A. Corbet. 1998. Dynamics of production and exploitation of nectar: Lessons from Impatiens glandulifera Royle. In Nectary Biology Bahadur, B., ed. Dattsons: London, UK, pp. 130-152.
-
Cavalcante, M. C., L. Galetto, M. M. Maues, A. S. Filho, I. G. A. Bomfim and B. M. Freitas. 2018. Nectar production dynamics and daily pattern of pollinator visits in Brazil nut (Bertholletia excelsa Bonpl.) plantations in Central Amazon: implications for fruit production. Apidologie 2018(49): 505-516.
[https://doi.org/10.1007/s13592-018-0578-y]

-
Corbet, S. A. 2003. Nectar sugar content: Estimating standing crop and secretion rate in the field. Apidologie 34: 1-10.
[https://doi.org/10.1051/apido:2002049]

-
Freeman, C. E., R. D. Worthington and M. S. Jackson. 1991. Floral nectar sugar compositions of some South and Southeast Asian species. Biotropica 23: 568-574.
[https://doi.org/10.2307/2388394]

-
Galetto, L. and G. Bernardello. 2004. Floral nectaries, nectar production dynamics and chemical composition in six Ipomoea species (Convolvulaceae) in relation to pollinators. Ann. Bot. 94(2): 269-280.
[https://doi.org/10.1093/aob/mch137]

-
Grunfeld, E., C. Vincent and D. Bagnara. 1989. High-performance liquid chromatography analysis of nectar and pollen of strawberry flowers. J. Agric. Food Chem. 37: 290-284.
[https://doi.org/10.1021/jf00086a003]

-
Heil, M. 2011. Nectar: generation, regulation and ecological functions. Trends. Plant Sci. 16(4): 191-200.
[https://doi.org/10.1016/j.tplants.2011.01.003]

-
Jakobsen, H. B. and K. Kristjansson. 1994. Influence of temperature and floret age on nectar secretion in Trifolium repens L. Ann. Bot. 74: 327-334.
[https://doi.org/10.1006/anbo.1994.1125]

- Kearns, C. A. and D. W. Inouye. 1993. Techniques for pollination biologists. Niwot, Colorado: University Press of Colorado.
- Kim, M. S., S. H. Kim, J. Han and J. S. Kim. 2012. Analysis of secretion quantity and sugar composition of nectar from Tilia amurensis Rupr. J. Apic. 27(1): 79-85.
-
Kim, M. S., S. H. Kim, J. H. Song, H. Y. Kwon, H. Kim and Y. S. Choi. 2015. Honeyee visiting and floral nectar characteristics of Styrax Japonicus Sieb & Zucc. J. Apic. 30(1): 13-20.
[https://doi.org/10.17519/apiculture.2015.04.30.1.13]

-
Kim, S., A. Lee, D. Kang, H. W. Kwon, Y. K. Park and M. S. Kim. 2018. Analysis of floral nectar characteristics of Korean and Chinses hawthorns (Crataegus pinnatifida Bunge). J. Apic. Res. 14: 119-128.
[https://doi.org/10.1080/00218839.2017.1357942]

-
Kim, Y. K., M. S. Kim, J. I. Nam, J. H. Song and S. H. Kim. 2021. Analysis on floral nectar characteristics among the selected black locust (Robinia spp.) individuals. J. Apic. Res.
[https://doi.org/10.1080/00218839.2021.1891743]

-
Mallick, S. A. 2000. Technique for washing nectar from the flowers of Tasmanian leatherwood (Eucryphia lucida Eucryphiaceae). Austral Ecol. 25: 210-212.
[https://doi.org/10.1046/j.1442-9993.2000.01010.x]

-
McKenna, M. A. and J. D. Thomson. 1988. A technique for sampling and measuring small amounts of floral nectar. Ecology 69: 1306-1307.
[https://doi.org/10.2307/1941289]

-
Morrant, D. S., R. Schumann and S. Petit. 2009. Field methods for sampling and storing nectar from flowers with low nectar volumes. Annal. Bot. 103: 533-542.
[https://doi.org/10.1093/aob/mcn241]

-
Nepi, M. and M. Stpiczynska. 2007. Nectar resorption and translocation in Cucurbita pepo L. and Platanthera chlorantha Custer (Rchb.). Plant Biol. 9: 93-100.
[https://doi.org/10.1055/s-2006-924287]

-
Nepi, M. C., D. Soligo, M. Nocentini, M. Abate, G. Guarnieri, L. Cai, M. Bini, M. Puglia, L. Bianchi and E. Pacini. 2012. Amino acids and protein profile in floral nectar: much more than a simple reward. Flora 207: 475-481.
[https://doi.org/10.1016/j.flora.2012.06.002]

-
Nicolson, S. W. and R. W. Thornburg. 2007. Nectar chemistry. pp. 215-264. in Nectaries and nectar, eds. by S.W. Nicolson, M. Nepi, and E. Pacini, Springer: Dordrecht, The Netherlands.
[https://doi.org/10.1007/978-1-4020-5937-7_5]

-
Nunez, J. 1977. Nectar flow by melliferous flora and gathering flow by Apis mellifera ligustica. J. Insect Physiol. 23: 265-275.
[https://doi.org/10.1016/0022-1910(77)90041-5]

-
Sangeetha, V. and A. S. Palatty. 2019. Nectar robbing in bellflower (Sesamum radiatum) benefited pollinators but unaffected maternal function of plant reproduction. Sci. Rep. 9: 8357.
[https://doi.org/10.1038/s41598-019-44741-y]

-
Silva, E. M., B. B. Dean and L. Hiller. 2004. Patterns of floral nectar production of onion (Allium cepa L.) and the effects of environmental conditions. J. Amer Soc. Hort. Sci. 129(3): 299-302.
[https://doi.org/10.21273/JASHS.129.3.0299]

-
Southwick, E. E., G. M. Loper and S. E. Sadwick. 1981. Nectar production, composition, energetics and pollinator attractiveness in spring flowers of western New York. American J. Bot. 68(7): 994-1002.
[https://doi.org/10.1002/j.1537-2197.1981.tb07816.x]

-
Stiles, F. G. and C. E. Freeman. 1993. Patterns in floral nectar characteristics of some bird-visited plant species from Costa Rica. Biotropica 25: 191-205.
[https://doi.org/10.2307/2389183]

-
Swanson, C. A. and R. W. Shuel. 1950. The centrifuge method for measuring nectar yield. Plant Physiol. 25: 513-520.
[https://doi.org/10.1104/pp.25.3.513]

-
Witt, T., A. Jurgens and G. Gottsberger. 2013. Nectar sugar composition of European Caryophylloideae (Caryophyllaceae) in relation to flower length, pollination biology and phylogeny. J. Evol. Biol. 26(10): 2244-2259.
[https://doi.org/10.1111/jeb.12224]

-
Wolff, D., T. Witt, A. Jurgens and G. Gottsberger. 2006. Nectar dynamics and reproductive success in Saponaria officinalis (Caryophyllaceae) in southern Germany. Flora 201(2006): 353-364.
[https://doi.org/10.1016/j.flora.2005.07.010]

