서양종꿀벌이 채집한 벚나무 화분의 항산화 활성
Abstract
Bee pollen is composed of pollen by gathering honey and enzymes on the hind legs of honeybees when they collect nectar from flowers and it is used as a raw material for producing royal jelly, a protein source for larvae and nutrition for queen bee. Although bee pollen contains plenty of various nutrients and physiologically active substances such as flavonoid and phenolic compounds, there are inadequate reports about antioxidant capacity of Prunus serrulata var. spontanea pollen collected by Apis mellifera. To evaluate the functionality, the bee pollen ethanol extracts were prepared and antioxidant activities by DPPH, ABTS, and FRAP assays were performed. In addition, the total polyphenol and total flavonoid contents were examined. At the highest concentration of 1,000 μg/mL, the DPPH and ABTS radical scavenging activity of the bee pollen showed 41.56% and 65.15%, respectively. The FRAP of the bee pollen showed 542.94 μM compared with control (88.7 μM). The total polyphenol and total flavonoid contents of the pollen showed 58.49 mg GAE/g and 5.53 mg QE/g, respectively.
Keywords:
Bee pollen, Prunus serrulata var. spontanea, Apis mellifera, Antioxidant activity서 론
벌 화분 (Bee pollen)은 꿀벌이 꽃에서 화밀 (nectar from flowers) 채취 시 뒷다리에 꿀과 효소 등을 뭉쳐 경단의 형태로 수집한 것으로, 꿀벌 유충의 단백질원이자 여왕벌의 영양원인 로열젤리 (royal jelly)를 생산하는 원료로 사용한다 (Kocot et al., 2018). 또한 화분은 기원 식물과 가공 방법에 따라 차이가 있으나 일반적으로 3대 필수 영양소인 탄수화물, 단백질과 지방이 함유되어 있을 뿐 아니라 아미노산 (류신, 이소류신 등), 비타민 (카로티노이드, 엽산 등), 무기질 및 페놀성 유기 화합물 (플라보노이드, 페놀산 및 그 유도체 등) 등 풍부한 영양성분이 함유된 자연 건강식품으로 이용되어 왔다 (Denisow and Denisow-Pietzyk, 2016). 이처럼 화분은 풍부한 영양성분이 함유된 자연 건강식품으로 이용됐으며 화분을 활용한 건강 기능성 식품 소재화 연구가 활발히 진행되고 있다 (Hong et al., 2016). 화분 내 영양성분은 천연 생리활성 물질로의 이용 가치가 매우 높아 항산화 효능 평가 (Kim et al., 2005), 간 기능 보호 효과 (Wojcicki et al., 1985), 죽상 경화 억제 효과 (Yakusheva, 2010) 등 다양한 생리활성을 나타내고 있으며, 최근에는 전립선 비대증 및 전립선염 치료 (Shim, 2007) 등 다양한 질환에 효과가 있으며 새로운 화장품 원료 소재화 연구 (Pyeon et al., 2017)도 활발히 진행되고 있다. 특히 화분은 페놀성 화합물, 플라보노이드, 토코페롤 등의 생리활성 물질을 다량 함유한 것으로 보고되어 대표적으로 항산화 활성이 우수한 것으로 알려져 있다 (Block and Langseth, 1994). 활성산소 (Reactive oxygen specoes, ROS)는 인체 내 세포나 조직에 손상을 유발하여 각종 만성 질환과 노화를 촉진하는 것으로 알려져 왔다 (Lee et al., 2007). 이에 활성산소에 의한 생체 산화를 방지할 수 있는 항산화제에 관한 관심이 높아짐에 따라 부작용이 낮은 생리활성 천연물 소재 발굴 연구가 활발하게 진행되고 있다 (Hyun et al., 2019). 천연물인 화분의 우수한 항산화 활성 능력에도 불구하고 최근까지 보고된 연구에서는 다양한 화분의 종류 중 벚나무의 꽃으로부터 서양종꿀벌이 채집한 화분에 대한 항산화 활성 평가 연구가 미흡한 실정이다. 최근 벚나무류 꽃 형질과 화분 형태 특성 비교 (Jin et al., 2020)와 왕벚나무와 산벚나무의 화밀분비량 등에 관한 연구 (Kim et al., 2014) 등 벚나무 관련 연구가 진행되고 있지만, 벚나무 화분에 대한 항산화 효능 평가에 관한 연구는 미미한 수준이다. 따라서 본 연구에서는 서양종꿀벌이 벚나무로부터 채집한 벚나무 화분의 에탄올을 이용한 추출물을 제조하여 항산화 활성을 평가하여 건강 기능성 식품 소재로서의 활용 가능성을 조사하였다.
재료 및 방법
1. 실험재료
오프라인 시장에서 유통되고 있는 도토리 화분을 구매한 다음 진한 보랏빛을 띠는 검은색의 색상을 나타내는 벚나무 화분을 분류하여 -20℃에서 냉동 보관하면서 분석에 이용하였다. 모든 시약은 Sigma Co. (St. Louis, MO, USA)에서 시약급 이상의 제품을 구매하여 분석에 사용하였다
2. 분석 시료 추출
화분 추출물은 시료 3 g에 대해 70% 에탄올 10배를 가한 후 sonicator (Branson 8510, Emerson Electric Co., Ltd., USA)를 이용하여 1시간 동안 추출하여 여과지 (filter paper No. 2, Whatman, UK)로 여과하는 과정을 3회 반복하였다. 추출물은 감압 농축기 (eyela Rotary evaporator N-1200, Tokyo Rikakikai Co., Ltd. Japan)를 이용하여 conical tube에 농축하였으며, 최종 시료 수득량은 1.3924 g으로 분석에 사용하였다.
3. 화분의 형태 관찰
화분의 외관은 현미경 (evos XL Core microscope, Thermo Fisher Scientific, MA, USA, ×200)으로 확인하였으며, 화분의 형태는 주사전자현미경 (emission-scanning electron microscope, SEM, S-2460N, Hitachi, Japan)으로 관찰하였다.
4. 항산화 활성 측정
DPPH (1,1-diphenyl-2-picryl hydrazyl) 라디칼 소거능은 Pyo et al. (2020) 방법을 변형하여 측정하였다. 각 시료 20 μL에 0.2 mM DPPH 180 μL를 넣고 voltex mixer로 10초간 진탕하고 30분 동안 방치한 후 spectrometer (spectramax M2 microplate reader, Molecular Devices, San Jose, CA)를 이용하여 517 nm에서 흡광도를 측정하였다. DPPH 라디칼 소거능은 다음의 계산식을 이용하여 산출하였다.
ABTS[2,2-azobis (3-ethylbenzothiazoline-6-sulfonate)] 라디칼 소거능은 Bang et al. (2019)의 방법을 변형하여 측정하였다. 7.4 mM ABTS와 2.6 mM potassium persulfate를 1 : 1 동일한 비율로 혼합한 후 냉암소에서 라디칼이 형성되는 24시간 동안 방치하였다. 제조한 ABTS 용액을 실험 직전에 분광광도계를 이용하여 732 nm 파장에서 흡광도 0.700이 되도록 에탄올을 이용하여 희석하여 사용하였다. 화분 추출물에 제조한 ABTS 용액을 첨가하여 냉암소에서 10분간 반응시킨 후 동일한 735 nm 파장에서 흡광도를 측정하였다.
5. FRAP (Ferric reducing antioxidant power) 활성 측정
FRAP assay 방법은 FRAPTM colorimetric detection kit (Arbor Assays, MI, USA)를 사용하여 실험하였다. 실험 방법은 제조사에서 제공한 프로토콜에 따라 분석하였고, 분광광도계를 이용하여 560 nm에서 흡광도를 측정하였고, FRAP 활성도는 Fe (II) 표준곡선에 대한 선형 방정식을 기반으로 평가하였다. 시료 간의 활성을 비교하기 위해 대조군으로 ascorbic acid를 선정하여 같은 방법으로 측정하였다.
6. 총 폴리페놀 및 플라보노이드 함량
총 폴리페놀 함량은 Hong et al. (2012) 방법을 이용하여 실험하였다. 시료 100 μL에 Folin-Ciocalteu reagent 50 μL를 첨가하고 증류수 750 μL를 넣어 잘 섞어 준 다음 5분간 실온에서 방치한 후 10% Na2CO3 1 mL를 가하여 725 nm에서 1시간 이내에 흡광도를 측정하였다. 표준물질로 gallic acid를 이용하여 검량선을 작성하였고, 이로부터 시료의 총 폴리페놀 함량을 산출하여 mg GAE/g으로 나타내었다.
총 플라보노이드 함량은 Kim et al. (2005)에 따라 염화알루미늄법을 이용하여 측정하였다. 농도별로 제조한 표준물질 quercetin과 시료를 각 0.5 mL에 95% 에탄올 1.5 mL, 10% AlCl3 용액 0.1 mL, 1 M C2H3KO2 용액 0.1 mL와 증류수 2.8 mL를 가하여 충분히 교반한 다음 30분간 방치한 후 415 nm에서 흡광도를 측정하였다. 대조군은 AlCl3 용액 대신 증류수를 가한 것으로 상기 실험과 동일하게 조작한 다음 시료의 흡광도로부터 대조군 흡광도를 뺀 흡광도 차를 이용하여 작성한 표준검량선에 적용하여 총 플라보노이드 함량을 산출하였다.
7. 통계처리
본 실험결과는 3회 반복 측정하여 평균±표준편차로 나타내었다. 통계 분석은 SPSS 22.0 (SPSS Inc., Chicago, IL, USA)를 사용하여 분산분석 (ANOVA)을 실시하였으며, 시료 간의 유의성은 Duncan’s multiple range test로 차이를 검정하였다 (p<0.05).
결과 및 고찰
1. 화분 형태 특성
서양종 꿀벌이 수집한 벚나무 화분의 형태적 특성은 Fig. 1에서 나타내었다. 본 연구에서는 서양종 꿀벌이 벚나무 화분을 경단처럼 알갱이 형태로 뭉친 상태의 벚나무 화분을 수집하여 시료로 사용하였다 (Fig. 1A). 화분은 일반적으로 발아구의 형태와 수, 모양, 세포 단위, 분포, 표면 무늬, 크기 등에 따라 분류된다 (Ryu, 2003). 벚나무 화분을 광학현미경 (Fig. 1B)과 주사전자현미경 확인한 결과 (Fig. 1C), 벚나무 화분립의 발아구 형태 (aperture type)는 3공구형 (3-colporate)이며 화분의 표면은 매끄럽지 않고 표면 무늬는 유선상으로 유선과 유선 사이에 유공상 천공이 있다고 보고한 선행 연구 (Jin et al., 2020)와 본 연구에 사용된 벚나무 화분과의 형태학적 일치함을 확인할 수 있었다.
2. 항산화 활성 평가
항산화제는 산화작용으로 형성된 화학적 물질인 자유 라디칼을 소거하는 능력을 갖추고 있으며 DPPH 라디칼 소거능은 산화에 의해 발생하는 hydroxyl radical 등을 제거하는 항산화능을 평가할 때 가장 정확성 높고 간단한 분석법으로 널리 사용되고 있다 (Park et al., 2015). 벚나무 화분 농도별 추출물의 DPPH 라디칼 소거능 결과는 Fig. 2와 같다. 항산화 물질로 잘 알려진 ascorbic acid를 양성 대조군으로 하여 분석하였으며, 대조구인 ascorbic acid의 DPPH와 ABTS 라디칼 소거능은 농도 20 μg/mL에서 각각 45.38%, 55.76%로 나타났다. 대조구와의 농도 차이 측면에서 차이가 있지만 벚나무 화분 추출물 농도 범위에서 항산화 활성도를 보였다. 벚나무 화분 추출물을 농도별로 분석한 결과, DPPH 라디칼 소거능 평가에서는 농도 의존적으로 항산화 활성도가 증가하였으며 가장 높은 농도인 1,000 μg/mL에서 41.56%로 높은 활성도를 보였다. 벚나무 화분 추출물의 동일한 농도 구간에서 DPPH 라디칼 소거능을 비교하였을 때, 국내 메밀 화분 (Hong et al., 2017)의 활성도 (8.10%)보다 우수한 항산화 활성도를 나타내었지만, 국내 벼 화분 (Hong et al., 2016)의 활성도 (36.09%)와 Pyo et al. (2020)에서 보고한 도토리 화분 에탄올 추출물의 DPPH 라디칼 소거능 결과 (38.8%)보다는 활성도가 낮게 측정되었다.
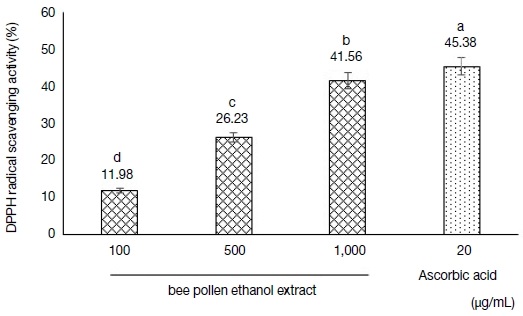
DPPH radical scavenging activities of the bee pollen extracts. Error bars represent the standard deviation of the mean and different letters indicate significant difference (p<0.05).
ABTS 라디칼 소거 활성 평가에서도 DPPH 라디칼 소거능 결과와 유사한 경향의 활성 패턴을 나타내었다 (Fig 3). 측정 결과, 가장 높은 농도인 1,000 μg/mL에서 65.15%로 우수한 항산화 활성도를 보였다. ABTS 라디칼 소거 활성은 과황산칼륨과 ABTS 용액과의 반응으로 생성된 ABTS 라디칼이 시료 내 항산화 물질과 반응하여 청록색이 투명한 색으로 탈색되어 흡광도의 변화를 나타내어 항산화 활성도를 측정하는 분석법이다 (Kim and Kim, 2016). 본 연구에서는 항산화 활성도 대조구로 Ascorbic acid를 positive control로 사용하였고, 결과적으로 벚나무 화분 추출물은 농도 의존적으로 활성도가 높아지며 가장 높은 농도에서 ABTS 라디칼 소거능이 DPPH 라디칼 소거능에 비하여 높게 나타났다. 이는 DPPH는 지용성 항산화제의 소거능에 주로 적용되는 데 반해 ABTS는 지용성과 수용성 물질의 항산화 활성도를 모두 측정할 수 있다는 점 등에 따라 벚나무 화분 추출물의 ABTS 라디칼 소거능이 높게 나타난 것으로 사료된다 (Bang and Ann, 2019).
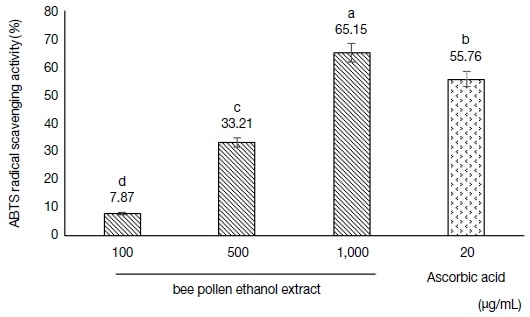
ABTS radical scavenging activities of the bee pollen extracts. Error bars represent the standard deviation of the mean and different letters indicate significant difference (p<0.05).
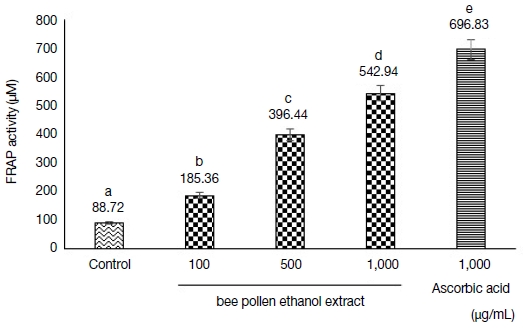
FRAP 분석법은 시료의 총 항산화 능력을 측정하는 방법으로, colored ferrous-TPTZ 복합체에 의해 ferric ion이 ferrous로 전환되는 과정을 분석하여 낮은 pH에서 ferric-TPTZ 복합체가 ferrous-TPTZ로 환원되는 원리를 이용한다 (Seo et al., 2011). FRAP 활성 평가에서도 벚나무 화분 추출물이 농도 의존적으로 높아지는 경향을 보이며 가장 높은 농도에서 542.94 μM으로 나타났다 (Fig. 4). 그러나 Ascorbic acid의 FRAP 활성도 (696.83 μM)와 비교하였을 때 낮은 환원력을 보였다 (p<0.05).
3. 총 폴리페놀 및 플라보노이드 함량
벚나무 화분 추출물을 분석한 총 폴리페놀 및 플라보노이드 함량 결과는 Table 1에 나타내었다. Folin-Ciocalteu 시약은 phosphotungstic과 phosphomolybdic acids의 혼합물로 페놀 산화 동안 tungstene과 molybdene의 청색 환원물로 환원된다. 청색 coloration은 760 nm 파장에서 일반적으로 gallic acid equivalent (GAE) 또는 catechin equivalent로 발현되는 폴리페놀의 함량을 반영한다. 이 분석법은 벌 화분이 많은 종류의 폴리페놀을 함유하고 있기에 벌 화분 시료를 평가할 때 신속하고 유용한 방법으로 사용된다 (Carpes et al., 2007). 벚나무 화분 추출물의 총 폴리페놀 함량 (TPC)은 58.49 mg GAE/g으로 나타났으며, 총 플라보노이드 함량 (TFC)는 5.53 mg QE/g으로, TPC 결과와 비교하였을 때 낮은 함량을 보였다. Rebiai and Lanez (2012)가 보고한 알제리산 화분의 총 폴리페놀 함량은 26.69~36.02 mg GAE/g 범위로 본 실험결과가 상대적으로 높은 함량을 나타내었다. 벚나무 화분의 경우 높은 폴리페놀 함량과 비교하면 비교적 낮은 플라보노이드가 함유된 것을 확인할 수 있었다. 화분 내 페놀 성분 중 플라보노이드가 대부분 차지하고 있다고 알려져 있으나 (Bang and Ann, 2019) 본 실험결과를 통해 화분 내 비플라보노이드 성분이 월등히 많이 함유된 경우가 있으므로 추가적인 연구가 필요할 것으로 사료된다.
적 요
벌 화분 (Bee pollen)은 꿀벌이 꿀과 타액 물질로 꽃가루를 뒷다리를 이용하여 응집한 덩어리로, 영양성분이 풍부하며 우수한 항산화 능력을 가진 것으로 보고되었다. 서양종꿀벌이 채집한 벚나무 화분의 에탄올 추출물을 제조하여 항산화 활성을 평가하고자 DPPH 및 ABTS 라디칼 소거능 활성도, FRAP 활성 평가, 총 폴리페놀 및 플라보노이드 함량을 분석하였다. 벚나무 화분 추출물을 농도별 (100, 500, 1,000 μg/mL)로 처리하여 항산화 활성도를 평가한 결과, 처리 농도 중 가장 높은 농도인 1,000 μg/mL에서 DPPH 라디칼 소거능 (41.56%) 및 ABTS 라디칼 소거능 (65.15%)과 FRAP (542.94 μM)로 가장 높게 나타났다. 총 폴리페놀 함량은 58.49 mg GAE/g으로 우수한 함량에 반해 총 플라보노이드는 5.53 mg QE/g 낮은 함량을 보이며 벚나무 화분의 페놀성 화합물은 비플라보노이드 계열 성분들이 대부분 구성하고 있는 것으로 확인하였다. 본 연구 결과를 통해 벚나무 화분의 우수한 항산화 활성도가 확인됨에 따라 벚나무 화분을 건강 기능성 식품 소재로 활용하기 위한 기초 자료로 활용되어 양봉산업의 고부가가치 창출 실현에 이바지할 수 있을 것으로 판단된다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원의 농업기초기반연구 (과제번호: PJ01512903)에 의하여 수행되었으므로 감사를 드립니다.
References
-
Bang, H. J. and M. R. Ann. 2019. Antioxidant and Antiangiogenic Activities of Bee Pollen Collected in Various Regions of Korea. J. Apic. 34: 87-97.
[https://doi.org/10.17519/apiculture.2019.04.34.1.87]

- Block, G. and L. Langseth. 1994. Antioxidant vitamins and disease prevention. Food Technol.
-
Carpes, S. T., R. Beginini, S. M. D. Alencar and M. L. Masson. 2007. Study of preprations of bee pollen extracts, antioxidant and antibacterial activity. Cien. Agotecnolgia 31: 1818-1825.
[https://doi.org/10.1590/S1413-70542007000600032]

-
Denisow, B. and M. Denisow-Pietrzyk. 2016. Biological and therapeutic properties of bee pollen: a review. J. Sci. Food Agric. 96: 4303-4309.
[https://doi.org/10.1002/jsfa.7729]

-
Hong, I. P., O. K. Woo, S. M. Han, S. G. Kim, H. R. Jang, M. Y. Lee, Y. S. Choi, H. K. Kim and M. R. Lee. 2016. Evaluation of Nutritional Potential and Antioxidant Activity of Oryza sativa (Rice) Pollen Collected by Honey Bee, Apis mellifera. J. Apic. 31: 219-225.
[https://doi.org/10.17519/apiculture.2016.09.31.3.219]

-
Hong, I. P., S. O. Woo., S. M. Han and M. K. Lee. 2017. Chemical composition and antioxidant activity of Korean buckwheat (Fagoppyrum esculentum) pollen grain collected by honey bee, Apis mellifera. Korean J. Apic. 32: 261-268.
[https://doi.org/10.17519/apiculture.2017.09.32.3.261]

-
Hong, M. H., Y. J. Jin and Y. H. Pyo. 2012. Antioxidant properties and ubiquinone contents in different parts of several commercial mushrooms. J. Korean Soc. Food Sci. Nutr. 41: 1235-1241.
[https://doi.org/10.3746/jkfn.2012.41.9.1235]

- Hyun, J. M., Y. J. Jo., Y. B. Kim., S. M. Park., K. S. Yoon. and N. H. Lee. 2019. Anti-inflammatory and anti-oxidative activities of flavonoids extracted from dendranthema indicum flowers in Jeju Island. J. Korean Appl. Sci. Technol. 36: 1259-1267.
-
Jin, E. J., J. H. Yoon., C. H. Sung., E. J. Bae., H. J. Hyun., S. Y. Jung and Y. O. Seo. 2020. Comparison of flower morphological chracteristics and palynological characteristics of native Prunus spp. in South Korea. J. Agric. & Life Sci. 54: 11-20.
[https://doi.org/10.14397/jals.2020.54.5.11]

- Kim, C. S. and H. K. Kim. 2016. Antioxidant activity of Makgeolli supplemented with pollen. J. Foodservice Management 19: 339-354.
- Kim, E. J., H. J. Lee, H. J. Kim, H. S. Nam, M. K. Lee, H. Y. Kim and H. Y. Kim. 2005. Comparison of colorimetric methods for the determination of flavonoid in propolis extract products. Korean J. Food Sci. Technol. 37: 918-921.
-
Kim, M. S., S. H. Kim., J. H. Song and H. S. Kim. 2014. Analysis of secreted nectar volume, sugar, and amino acid content in male and female flower of Evodia daniellii Hemsl. J. Korean. For. Soc. 103: 43-50.
[https://doi.org/10.14578/jkfs.2014.103.1.43]

- Kim, S. J., K. S. Youn and H. S. Park. 2005. Antioxidant effect of pine, oak, and lily pollen extracts. Korean. J. Food Sci. Technol. 37: 833-837.
-
Kocot, J., M. Kielczykowska, D. Luchowska-Kocot, J. Kurzepa and L. Musik. 2018. Antioxidant potential of propolis, bee pollen, and royal jelly: Possible medical appication. Oxid. Med. Cell. Longev.
[https://doi.org/10.1155/2018/7074209]

-
Lee, B. B., M. R. Cha, S. Y. Kim, H. R. Park and S. C. Lee. 2007. Antioxidative and anticancer activity of extracts of cherry (Prunus serrulata var. spontanea) blossoms. Plant Foods Hum. Nutr. 62: 79-84.
[https://doi.org/10.1007/s11130-007-0045-9]

-
Park, Y. G, C. W. Kim, J. H. Kim, S. H. Kim, S. U. Han and Y. S. Choi. 2015. Antioxidant activity of pollens from Quercus spp. in Korea. Korean J. Apic. 30: 299-306.
[https://doi.org/10.17519/apiculture.2015.11.30.4.299]

-
Pyeon, H. I., J. Bak, J. I. Seok, S. So, H. J. Suh, M. Oh and Y. S. Choi. 2017. Effects of nano-sized bee pollen as a new cosmetic ingredients. Asian. J. Beauty. Cosmetol. 15: 1-9.
[https://doi.org/10.20402/ajbc.2016.0078]

-
Pyo, S. J., J. S. Jang and H. Y. Sohn. 2020. Evaluation of Anti-oxidant, Anti-microbial and Anti-diabetic Activities of Five Different Pollen. J. Apic. 35: 65-73.
[https://doi.org/10.17519/apiculture.2020.04.35.1.65]

-
Rebiai, A. and T. Lanez. 2012. Chemical composition and antioxidant of Apis mellifera bee pollen from Northwest Algeria. Int. J. Fundam. Appl. Sci. 4: 155-163.
[https://doi.org/10.4314/jfas.v4i2.5]

- Ryu, J. B. 2003. Pollen morphology honey plant in spring with scanning electron microscopy. J. Apic. 18: 71-82.
- Seo, W. T., H. G. Kim, J. S. Lee and K. M. Cho. 2011. Making dongchimi naengmyeoun broth which has enhanced antioxidant activity using purple sweet potato. Korean J. Microbiol. 47: 143-150.
- Shim, B. S. 2007. Complementary and alternative therapy for chronic prostatitis/chronic pelvic pain syndrome. Korean J. UTII. 2: 143-150.
- Wojcicki, J., A. Hinek and L. Samochowiec. 1985. The protective effect of pollen extracts against allyl alcohol damage of the liver. Arch. Immunol. Ther. Exp. 33: 841-849.
- Yakusheva, E. 2010. Pollen and bee bread: physico-chemical properties, biological and pharmacological effects, and use in medical practice. Theoretical and Practice Basics of Api. 84-97.