UPLC를 이용한 동결건조 로열젤리 내 spermidine의 분석조건 확립 및 함량 분석
Abstract
Spermidine is one of biological amines with various functions such as anti-aging and life extension. This study aimed to analyze content of spermidine in freeze-dried royal jelly and establish an optimal analysis method. This assay was optimized to analyze spermidine in lyophilized royal jelly within 13 minutes using UPLC and evaluated the following performance parameters: linearity, limit of detection, limit of quantification, specificity, accuracy, and precision. The linear range of spermidine was 7.8~125 μg/mL with the correlation coefficient (R2)>0.9998. Limit of detection and limit of quantification were 0.63 and 1.93 μg/mL, respectively. Average recovery of spermidine ranged from 96.6% to 109.8%. The relative standard deviation (RSD) of the intra-day precision and inter-day precision for spermidine were 3.47~4.33% and 4.54~6.77%, respectively. Through this method, it was found that content of spermidine was 131.3±4.9 mg/kg in the freeze-dried royal jelly. This study revealed that this validated method was suitable for spermidine determination and it can be used as basic data in further studies on the bioactivity of spermidine.
Keywords:
UPLC, Spermidine, Biogenic amine, Validation, Royal jelly서 론
일반적으로 생체아민은 살아있는 세포 내에서 다양한 생리활성을 수행하는 저분자량의 유기질소 화합물을 말하며, 세포 내 아미노산의 탈탄산 작용 (decarboxylation)이나 아미노기 전이작용 (transamination) 등에 의해 생성되는 대사산물이다 (Harro and Oreland, 2001; Clark and Camargo, 2007; Kim et al., 2011). 이러한 생체아민은 세포 내 생합성을 통해 공급이 가능하지만 상당 부분 음식을 통한 외부 공급원으로부터 흡수되기 때문에 천연 생체아민의 섭취가 중요하다 (Zoumas-Morse et al., 2007; Ali et al., 2011; Comas-Basté et al., 2019). 특히 식품에 존재하는 생체아민 중 하나인 spermidine의 경우에는 노화 방지에 있어 우수한 효과를 갖는다고 알려져 있으며 (Eisenberg et al., 2009; Eisenberg et al., 2016; Madeo et al., 2019), 최근 일부 문헌에서는 spermidine이 수명 연장에 기여한다고 보고하였다 (Madeo et al., 2018). 나이가 들어감에 따라 혈청과 혈액에서의 spermidine 수치가 감소하였으며 (Pucciarelli et al., 2012; Pekar et al., 2020), 여러 조직에서 또한 노화와 spermidine을 비롯한 생체아민의 수치가 서로 연관성이 있음을 동물 실험을 통해 확인하였다 (Nishimura et al., 2006).
로열젤리는 사람의 정액에서 유래된 spermidine과 유사하게 특유의 비릿한 향을 갖는 유백색의 물질로 봉군 내의 어린 유충을 비롯한 여왕벌 유충의 먹이로 사용된다 (Moritz et al., 2012). 이러한 로열젤리를 평생 섭취하는 여왕벌은 일벌의 40배가 넘는 수명을 갖는 것으로 알려져 있다 (Viuda-Martos et al., 2008). 이러한 이유로 로열젤리 또한 장수의 목적으로 많이 섭취하고 있으며, 수명 연장 효능에 관한 다양한 연구가 진행되었다 (Inoue et al., 2003; Kunugi et al., 2019). 로열젤리의 지속적인 섭취 유무는 여왕벌이냐 일벌이냐를 결정하는 중요한 요인으로 작용하며, 이러한 측면에서 보면 생식과 연관성이 있다고 생각되어진다. 마찬가지로 spermidine 또한 정자에서 유래된 물질로 생식과 직접적인 연관이 있는 물질이다.
그래서 본 연구를 통해 로열젤리 내에 존재하는 spermidine의 함량을 분석하고자 하였으며, 이를 위한 분석법을 확립하고 검증하고자 하였다.
재료 및 방법
1. 공시 시료
분석시료로 사용된 로열젤리는 2021년에 경상남도 진주의 로열젤리 생산농가에서 채집된 생로열젤리를 구입하여 동결건조 후 실험에 사용하였으며, 모든 시료는 -20℃에서 냉동보관하였다.
2. 시약
표준품으로 이용된 spermidine trihydrochoride는 Sigma-Aldrich Co. (St. Louis, MO, USA) 제품을 사용하였다. Spermidine 추출을 위해 5% TCA (trichloroacetic acid)를 이용하였으며, 표준품인 spermidine trihydrochoride는 1 mg/mL 농도로 0.1 N 염산에 녹여 필요한 농도로 희석하여 사용하였다. 분석용 용매로는 HPLC 등급의 acetonitrile (Merck, Darmstadt, Germany)과 water (Honeywell Burdick & Jackson, Ulsan, Korea)을 사용하였다.
3. 유도체화 용액제조
Spermidine의 유도체화를 위해 375 mg dansyl chloride (Sigma-Aldrich, St. Loius, MO, USA)를 50 mL acetone (Merck, Darmstadt, Germany)에 녹여 사용하였으며, 50 mL 3차 증류수에 4 g sodium bicarbonate (Sigma-Aldrich, St. Loius, MO, USA)를 녹여 포화상태의 sodium bicarbonate 용액을 제조하였다. 100 mg L-proline (Sigma-Aldrich, St. Loius, MO, USA)을 3차 증류수에 녹여 10% L-proline 용액을 제조하였다.
4. Dansyl chloride 유도체화
Spermidine 분석은 생체아민 분석을 위해 가장 널리 이용되는 dansyl chloride를 이용한 유도체화를 통해 분석하였다 (de Figueiredo et al., 2015). 동결건조 로열젤리 3 g을 5% TCA 20 mL를 이용하여 30분간 추출한 후에 원심분리기 (Hanil science, Daejeon, Korea)를 이용하여 상등액만을 취해 실험에 이용하였다. 로열젤리 추출액과 spermidine 표준용액 100 μL를 dansyl chloride 용액 400 μL와 sodium bicarbonate 용액 200 μL와 혼합하여 60℃에서 호일로 감싸 빛을 차단하여 10분간 반응시켜 유도체화를 실시하였다. 유도체화된 용액에 L-proline 용액 100 μL를 첨가하여 혼합후 4℃, 13000 rpm 속도로 10분간 원심분리하였으며, 상등액만을 취하여 질소농축기 (Caliper life science Inc, MA, USA)를 이용하여 농축하였다. Spermidine 분석을 위해 농축된 시료에 acetonitrile 1 mL를 첨가한 후 0.2 μm syringe filter에 걸러낸 후 분석에 이용하였다.
5. UPLC 분석조건
분석을 위한 UPLC 기기는 Waters (Minneapolis, MN, USA)사의 ACQUITY UPLC I-class 모델을 사용하였으며, 분석조건은 Table 1과 같았다.
6. 분석법 밸리데이션
동결건조 로열젤리 내 spermidine 분석법은 식품의약품안전처의 분석법 밸리데이션에 대한 가이드라인에 따라 특이성 (specificity), 직선성 (linearity), 검출한계 (limit of detection, LOD), 정량한계 (limit of quantification, LOQ), 정확성 (accuracy), 정밀성 (precision) 등을 평가하여 검증하였다 (KFDA, 2015). 특이성은 표준용액과 시료용액에서 검출된 지표성분의 UV 흡수스펙트럼 (200~400 nm) 패턴의 일치 여부로 평가하였으며, 직선성은 지표성분을 acetonitrile에 녹인 후 이를 희석하여 7.8, 15.6, 31.3, 62.5, 125.0 μg/mL의 5가지 농도에서 각각 3회 반복실험을 실시하여 검량선을 작성하고, 이에 대한 회귀식을 설정하여 상관계수 (R2) 값이 0.99 이상일 때 직선성을 인정하였다. 검출한계와 정량한계는 표준용액의 검량선을 이용하여 y절편의 표준편차 (σ)와 기울기 (S)에 근거하여 계산하였으며, 검출한계는 3.3 * (σ/S), 정량한계는 10 * (σ/S)로 각각 계산하였다. 정확성은 시료용액에 3가지 농도의 표준용액을 첨가하여 ±10% 범위의 회수율로 평가하였으며, 정밀성은 생체아민류 표준용액의 3가지 농도를 설정하여 일내 (intra-day) 및 일간 (inter-day) 변화를 측정하여 상대표준편차 (relative standard deviation, RSD)를 계산하여 정밀도를 평가하였다.
결과 및 고찰
1. 최적 분석조건 확립
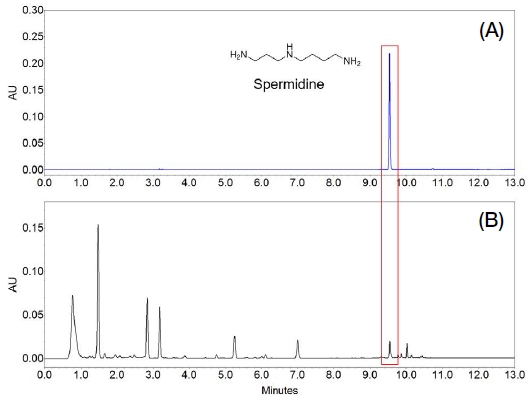
일반적으로 spermidine과 같은 생체아민을 분석하기 위해서는 주로 HPLC를 이용하여 유도체화를 통해 분석을 실시한다 (Mantoanelli et al., 2020). 본 실험에서는 동결건조 로열젤리 내에 존재하는 spermidine을 dansyl chloride를 이용하여 유도체화하였으며, UPLC를 이용하여 단시간에 높은 분리능을 갖는 분석법을 확립하고자 하였다. 다양한 용매를 이용하여 가장 높은 추출 효율을 갖는 추출 방법을 선정하였으며, 추출 효율이 우수했던 TCA를 이용하여 30분간 교반을 통한 추출법을 선정하였다 (Mantoanelli et al., 2020). 또한 기기분석을 위해서 컬럼의 종류, 온도, 검출기의 파장대, 이동상 용매 조성 등을 다양하게 하여 최적의 분석조건을 확립하였다 (Table 1). 총 분석시간은 13분으로, 이동상으로 HPLC용 acetonitrile과 증류수를 각각 사용하였으며, 컬럼의 온도를 20℃로 설정하고 254 nm 파장대에서 분석하였을 때 spermidine과 인접한 피크 간에 양호한 분리도를 확인할 수 있었다. 동결건조 로열젤리 내 spermidine의 머무름 시간은 9.553분으로 인접 피크의 간섭 없이 비교적 짧은 시간 동안 높은 분리능을 나타내었다 (Fig. 1).
Spermidine과 같은 생체아민의 정량적 분석에 관한 연구는 과일, 채소, 빵, 고기 등 다양한 음식에서 보고된 바 있으며 (Bardocz et al., 1993; Ali et al., 2011; Muñoz-Esparza et al., 2019), 와인과 같은 발효주에서도 다양한 연구가 진행되었으나 (Konakovsky et al., 2011) 로열젤리에 존재하는 spermidine의 분석법에 관한 언급은 찾을 수 없었다.
확립된 UPLC 분석법은 de Figueiredo et al. (2015)이 보고한 HPLC에서 사용되던 방법을 UPLC에 적용하여 분석시간을 단축하고 분리 효율을 높여 spermidine을 검출할 수 있었다.
2. 분석법 검증
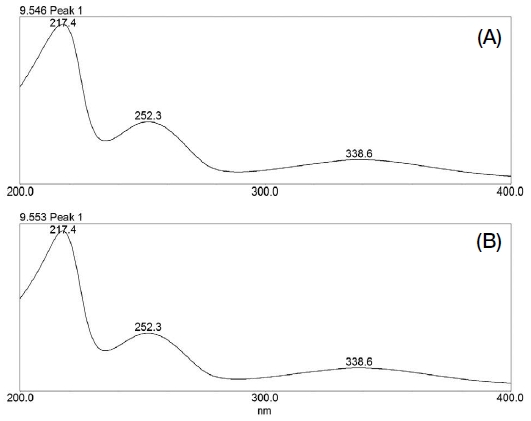
Fig. 2에서 보는 바와 같이 동결건조 로열젤리 내 spermidine 표준품과 동일한 머무름 시간을 갖는 피크가 검출되었으며, 해당 성분의 UV 흡수 스펙트럼 패턴을 비교해본 결과 동일한 패턴을 나타내었다. 이를 통해 확립된 분석방법이 특이성을 나타내는 것으로 확인되었다.
동결건조 로열젤리 내 spermidine의 함량을 포함하는 표준품의 농도 구간 (7.8~125.0 μg/mL)을 설정하여 7.8, 15.6, 31.3, 62.5, 125.0 μg/mL의 5가지 농도에서 검량선을 그려 회귀식을 확인한 결과 y=1670.78x-1533.68이었으며, 상관계수 (R2) 값이 0.9998로 높은 직선성을 나타내었다 (Table 2).
검량선을 그려 산출한 회귀방정식으로부터 구한 spermidine의 검출한계 값은 각각 0.63 μg/mL와 1.93 μg/mL였으며 (Table 2). 검출한계와 정량한계를 계산하는데 사용된 신호대잡음비는 baseline에 대한 잡음 (noise)과 피크 (peak)의 상대비로 그 값이 낮을수록 해당 표준물이 주어진 조건에서 잘 검출된다는 의미를 나타낸다 (He et al., 2015).
직선성을 평가한 농도 범위에서 3가지 농도를 설정하여 일내 (intra-day) 및 일간 (inter-day) 정밀도를 측정한 결과 3.47~4.54%의 상대표준편차 (RSD) 값을 갖는 우수한 정밀성을 갖는 것으로 확인되었다 (Table 3).
3. 동결건조 로열젤리 내 spermidine 함량평가
확립된 UPLC 분석법을 이용하여 국내에서 생산된 동결건조 로열젤리에서 spermidine의 함량을 분석한 결과 131.3±4.9 mg/kg였으며, 상대표준편차 (RSD) 값은 3.76%로 확인되었다 (Table 5).
Spermidine은 살아있는 세포 내에서 다양한 생리활성을 수행하는 생체아민으로 putrescine, cadaverine, β-phenylethylamine, tyramine, tryptamine, histamine, spermine 등과 같이 식품에서 주로 검출되는 생체아민 중 하나이다 (Halasz et al., 1994). Spermidine은 과일, 야채, 빵, 고기, 치즈 등 다양한 식품에 함유되어 있으며, 치즈나 와인과 같은 발효 음식에 특히 많이 함유되어 있다. Ali 등이 보고한 식품에 존재하는 폴리아민에 대한 데이터베이스를 보면 식품 중 비교적 높은 함량을 갖는 치즈의 경우 100 mg/kg 정도의 spermidine을 함유하고 있었다. 그러나 본 연구에서 이용된 진주 농가에서 생산된 동결건조 로열젤리에는 이보다 높은 함량 (131.3±4.9 mg/kg)의 spermidine이 존재하였다. 특히, 식이요법을 통한 spermidine의 섭취는 뇌 인지기능을 개선할 수 있으며 (Schroeder et al., 2021), 수명을 연장하고 암 발생률을 감소시키는 등 다양한 생리적인 기능을 갖는 것으로 알려져 있다 (Miao et al., 2016; Pietrocola et al., 2019).
따라서 본 연구를 통해 동결건조 로열젤리 내에 spermidine을 분석하기 위한 분석법을 확립하고 이에 대한 밸리데이션을 실시하였으며, 이를 통해 동결건조 로열젤리 내에 spermidine의 함량이 여타 식품에 비해 높게 존재함을 알 수 있었고, 향후 로열젤리 내 생체아민에 대한 기초자료로서 활용할 수 있을 것으로 기대 되어진다.
적 요
본 연구에서는 동결건조된 로열젤리 내에 존재하는 spermidine의 함량을 분석하기 위해 UPLC를 이용한 분석법을 개발하였다. 본 UPLC 분석법은 Halo C18 (2.1×100 mm, 2.0 μm) 컬럼을 고정상으로, acetonitrile과 증류수를 이동상으로 사용하여 동결건조된 로열젤리 내의 spermidine을 13분 이내에 정량분석이 가능하도록 하였으며, 특이성·직선성·검출한계·검량한계·정밀성·정확성 등의 평가를 통해 분석법을 검증하였다. 확립된 분석법을 통한 분석 결과, 동결건조된 로열젤리 내 spermidine의 함량은 여타 식품에 비해 높게 존재하였으며, 향후 로열젤리의 기능성과 생체아민과의 연관성 등에 대한 기초자료로서 활용할 수 있을 것으로 기대된다.
Acknowledgments
본 연구는 농촌진흥청 농업기초기반연구 (과제번호: PJ01513502)에 의하여 수행되었습니다.
References
-
Ali, M. A., E. Poortvliet, R. Strömberg and A. Yngve. 2011. Polyamines in foods: development of a food database. Food Nutr. Res. 55(1): 5572.
[https://doi.org/10.3402/fnr.v55i0.5572]

-
Bardócz, S., G. Grant, D. S. Brown, A. Ralph and A. Pusztai. 1993. Polyamines in food-implications for growth and health. J. Nutr. Biochem. 4(2): 66-71.
[https://doi.org/10.1016/0955-2863(93)90001-D]

-
Clark, S. and C. A. Camargo. 2007. Epidemiology of anaphylaxis. Immunol. Allergy Clin. North Am. 27: 145-163.
[https://doi.org/10.1016/j.iac.2007.03.002]

-
Comas-Basté, O., M. Latorre-Moratalla, S. Sánchez-Pérez, M. Teresa Veciana-Nogués and M. del Carmen Vidal-Carou. 2019. Histamine and Other Biogenic Amines in Food. From Scombroid Poisoning to Histamine Intolerance. Biogenic Amines. IntechOpen; London, UK.
[https://doi.org/10.5772/intechopen.84333]

-
de Figueiredo, T. C., D. C. S. de Assis, L. D. M. Menezes, G. R. da Silva, I. P. Lanza, L. G. D. Heneine and S. de Vasconcelos Cançado. 2015. HPLC-UV method validation for the identification and quantification of bioactive amines in commercial eggs. Talanta 142: 240-245.
[https://doi.org/10.1016/j.talanta.2015.04.056]

-
Eisenberg, T., H. Knauer, A. Schauer, S. Buttner, C. Ruckenstuhl, et al. 2009. Induction of autophagy by spermidine promotes longevity. Nat. Cell Biol. 11(11): 1305-1314.
[https://doi.org/10.1038/ncb1975]

-
Eisenberg, T., M. Abdellatif, S. Schroeder, U. Primessnig, S. Stekovic, et al. 2016. Cardioprotection and lifespan extension by the natural polyamine spermidine. Nat. Med. 22(12): 1428-1438.
[https://doi.org/10.1038/nm.4222]

-
Halasz, A., A. Barath, L. Simon-Sarkadi and W. Holzapfel. 1994. Biogenic amines and their production by microorganisms in food. Trends Food Sci. Technol. 5(2): 42-49.
[https://doi.org/10.1016/0924-2244(94)90070-1]

-
Harro, J. and L. Oreland. 2001. Depression as a spreading adjustment disorder of monoaminergic neurons: a case for primary implication of the locus coeruleus. Brain Res. Rev. 38(1-2): 79-128.
[https://doi.org/10.1016/S0165-0173(01)00082-0]

-
He, X., J. Li, W. Zhao, R. Liu, L. Zhang and X. Kong. 2015. Chemical fingerprint analysis for quality control and identification of Ziyang green tea by HPLC. Food Chem. 171: 405-411.
[https://doi.org/10.1016/j.foodchem.2014.09.026]

-
Inoue, S. I., S. Koya-Miyata, S. Ushio, K. Iwaki, M. Ikeda and M. Kurimoto. 2003. Royal Jelly prolongs the life span of C3H/HeJ mice: correlation with reduced DNA damage. Exp. Gerontol. 38(9): 965-969.
[https://doi.org/10.1016/S0531-5565(03)00165-7]

- KFDA, Drug etc. 2015. Test method validation guidelines. Osong.
-
Kim, M. J., B. K. Kim, S. M. Kim, J. S. Park and J. K. Hong. 2011. Profiling analysis of catecholamines and polyamines in biological samples. J. Anal. Sci. Technol. 24: 319-333.
[https://doi.org/10.5806/AST.2011.24.5.319]

-
Konakovsky, V., M. Focke, K. Hoffmann-Sommergruber, R. Schmid, O. Scheiner, P. Moser, R. Jarisch and W. Hemmer. 2011. Levels of histamine and other biogenic amines in high-quality red wines. Food Addit Contam Part A Chem Anal Control Expo Risk Assess. 28(4): 408-416.
[https://doi.org/10.1080/19440049.2010.551421]

-
Kunugi, H. and A. M. Ali. 2019. Royal jelly and its components promote healthy aging and longevity: from animal models to humans. Int. J. Mol. Sci. 20(19): 4662.
[https://doi.org/10.3390/ijms20194662]

-
Madeo, F., D. Carmona-Gutierrez, S. J. Hofer and G. Kroemer. 2019. Caloric restriction mimetics against age-associated disease: targets, mechanisms, and therapeutic potential. Cell Metab. 29(3): 592-610
[https://doi.org/10.1016/j.cmet.2019.01.018]

-
Madeo, F., T. Eisenberg, F. Pietrocola and G. Kroemer. 2018. Spermidine in health and disease. Science 359(6374): eaan2788.
[https://doi.org/10.1126/science.aan2788]

-
Mantoanelli, J. O. F., L. M. Goncalves and E. A. Pereira. 2020. Dansyl chloride as a derivatizing agent for the analysis of biogenic amines by CZE-UV. Chromatographia 83(6): 767-778.
[https://doi.org/10.1007/s10337-020-03896-x]

-
Miao, H., J. Ou, Y. Peng, X. Zhang, Y. Chen, L. Hao, G. Xie, Z. Wang, X. Pang, Z. Ruan, J. Li, L. Yu, B. Xue, H. Shi, C. Shi and H. Liang. 2016. Macrophage ABHD5 promotes colorectal cancer growth by suppressing spermidine production by SRM. Nat. Commun. 7: 11716.
[https://doi.org/10.1038/ncomms11716]

- Moritz, R. F. A. and E. E. Southwick. 2012. Bees as superorganisms: an evolutionary reality. 1st ed., 58-60p. Springer Science & Business Media, Berlin.
-
Muñoz-Esparza, N. C., M. L. Latorre-Moratalla, O. Comas-Basté, N. Toro-Funes, M. T. Veciana-Nogués and M. C. Vidal-Carou. 2019. Polyamines in food. Front. Nutr. 6: 108.
[https://doi.org/10.3389/fnut.2019.00108]

-
Nishimura, K., R. Shiina, K. Kashiwagi and K. Igarashi. 2006. Decrease in polyamines with aging and their ingestion from food and drink. J. Biochem. 139(1): 81-90.
[https://doi.org/10.1093/jb/mvj003]

-
Pekar, T., A. Wendzel, W. Flak, A. Kremer, S. Pauschenwein-Frantsich, A. Gschaider, F. Wantke and R. Jarisch. 2020. Spermidine in dementia. Wien Klin. Wochenschr. 132(1): 42-46.
[https://doi.org/10.1007/s00508-019-01588-7]

-
Pietrocola, F., F. Castoldi, O. Kepp, D. Carmona-Gutierrez, F. Madeo and G. Kroemer. 2019. Spermidine reduces cancer-related mortality in humans. Autophagy 15(2): 362-365.
[https://doi.org/10.1080/15548627.2018.1539592]

-
Pucciarelli, S., B. Moreschini, D. Micozzi, G. S. De Fronzo, F. M. Carpi, V. Polzonetti, S. Vincenzetti, F. Mignini and V. Napolioni. 2012. Spermidine and spermine are enriched in whole blood of nona/centenarians. Rejuvenation Res. 15(6): 590-595
[https://doi.org/10.1089/rej.2012.1349]

-
Schroeder, S., S. J. Hofer, A. Zimmermann, R. Pechlaner, C. Dammbrueck, T. Pendl, et al. 2021. Dietary spermidine improves cognitive function. Cell Reports 35(2): 108985.
[https://doi.org/10.1016/j.celrep.2021.108985]

-
Viuda-Martos, M., Y. Ruiz-Navajas, J. Fernandez-Lopez and J. A. Perez-Alvarez. 2008. Functional properties of honey, propolis and royal jelly. J. Food. Sci. 73: 117-124.
[https://doi.org/10.1111/j.1750-3841.2008.00966.x]

-
Zoumas-Morse, C., C. L. Rock, E. L. Quintana, M. L. Neuhouser, E. W. Gerner and F. L. Jr. Meyskens. 2007. Development of a polyamine database for assessing dietary intake. J. Am. Diet. Assoc. 107(6): 1024-1027.
[https://doi.org/10.1016/j.jada.2007.03.012]