소포체 스트레스에 의한 미세소관 중합 저해에 대한 국산 프로폴리스의 효과
Abstract
Microtubules (MTs) are a major components of cytoskeletal structure. It is biopolymers formed through polymerization of heterodimers of α-tubulin and β-tubulin. MTs play a critical role for maintain of cell shape, cell division, migration and transport of materials in the cells. Endoplasmic reticulum (ER) stress disrupts posttranslational modification of protein and consequently inhibits the formation of MTs structure. Here, we investigated the improving effect of Korean propolis for microtubule polymerization during ER stress by tunicamycin. Tunicamycin and propolis concentration for PC12 cell treatment is 150 µg/mL and 10 µg/mL, respectively. Tunicamycin treatment decreases the expression level of acetylation of α-tubulin and it was inhibits MTs formation in tubulin polymerization assay. However, although the presence of tunicamycin, propolis extracts recovers acetylation of α-tubulin level and polymerized β-tubulin. Especially, pre-treatment of propolis group exhibits higher polymerization level more than tunicamycin pre-treatment group. Fluorescence microscopy analysis shows the MTs structure recovery by propolis treatment. Our results suggested that propolis can be prevents the apoptosis, allowing protects the cells.
Keywords:
Propolis, Microtubules polymerization, Acetylated α-tubulin, ER stress서 론
미세소관 (Microtubules)은 세포 형태 유지 및 세포 운동성에 중요한 필수 세포골격 단백질로서 세포 분열에서 중요한 역할을 담당한다. 미세소관은 세포 내 튜불린 단백질의 이형중합체로 구성되며, 속이 빈 형태의 실린더 형태로 이루어져 있다 (Honore et al., 2005; Pellegrini and Budman, 2005). 튜불린 단백질은 구형의 단백질로서 알파 (α), 베타 (β), 감마 (γ), 델타 (δ), 엡실론 (ε) 그리고 제타 (ζ) 튜불린의 5가지 소단위체로 구성되며, 이 중 알파 튜불린과 베타 튜불린은 미세소관을 형성하는 주요 구성원이다 (Wade, 2007). 세포 내 알파 튜불린과 베타 튜불린이 특정 농도 이상이 될 경우, 두 단백질은 이형중합체를 형성하고, 서로 교차 결합하면서 프로토필라멘트로 자가조립된다. 프로토필라멘트는 알파 튜불린과 베타 튜불린이 병렬로 결합하여, 중심부에 공간이 빈 극성을 띤 형태를 이룬다. 이렇게 형성된 프로토필라멘트가 미세소관의 ‘core’가 되며, 여기에 다른 튜불린 단백질 소단위체가 결합하여 완전한 미세소관을 형성하게 된다 (Walker et al., 1988). 형성된 미세소관은 세포 내에서 구조적 역동성을 띠며, 이 상태는 결합된 튜불린 단백질 및 세포 내의 수많은 조절 요인과 상호작용에 따라 생체 내에서 고도로 조절된다 (Mitchison and Kirschner, 1984; Mitchison, 1993).
세포 내에서의 미세소관 구조 및 기능에 대한 역동성에 대한 기전은 튜불린 소단위체의 번역 후 가공 (post-translation modification)이다. 튜불린 단백질이 번역된 후 추가적인 화학 그룹의 공유 결합, 단백질의 분해 또는 분자 스플라이싱에 따른 조절로 미세소관의 안정성과 기능을 조절한다. 대부분의 튜불린 단백질 번역 후 가공은 미세소관에서 확장되는 튜불린의 C-말단 꼬리 내 잔기 변화 및 미세소관 결합 단백질 (microtubule-associated protein)의 결합에 중요한 역할을 한다 (Janke and Montagnac, 2017; Magiera et al., 2018). 여기에는 acetylation, detyrosination, polyglutamination 그리고 polyglycylation 등이 포함된다. 그중에서도 알파 튜불린 단백질의 acetylation은 미세소관의 안정성에 매우 중요한 역할을 하며, 알파 튜불린 아세틸전달효소에 의해 수행되고, NAD-dependent 탈아세틸효소 SIRT2와 histone deacetylase 6 (HDAC6)에 의해 제거된다 (Howes et al., 2014; Magiera et al., 2018). 이 단백질 가공 부분에 대한 기능적인 연구에 대한 부분은 많이 이루어지고 있지만, 아직 명확한 기전은 밝혀지지 않고 있다. 여러 연구에 의하면 알파 튜불린의 아세틸화 감소는 신경관련 질병에서 축삭을 통해 이동하는 물질 수송에 장애를 일으키는 것으로 알려져 있다 (Dompierre et al., 2007; d’Ydewalle et al., 2011; Li et al., 2012; Kim et al., 2016). 이 경우 알파 튜불린 아세틸화의 회복은 물질 수송이 개선될 수 있으며 (Godena et al., 2014), 반면 알파 튜불린 아세틸화의 증가는 전이성 암 세포주에서 세포의 집합, 이동 및 종양화를 촉진한다 (Boggs et al., 2015; Di Martile et al., 2016). 따라서 알파 튜불린 아세틸화는 세포 간 물질 수송에 영향을 끼치고 있는 것을 알 수 있으며, 현재 질병으로 발생된 세포의 사멸 촉진 현상에서 미세소관 조립 개선을 통한 세포 기능 회복에 대한 연구가 이루어지고 있다.
꿀벌이 생산하는 프로폴리스는 밀원에서 유래하는 삼출물에 꿀벌의 타액이 혼합된 수지성 물질로서, 벌집을 방어하는 꿀벌의 주요 방어 기전 물질이다 (Burdock, 1998; Almeida and Menezes, 2002). 꿀벌은 여러 혼합물에 의해 생산된 프로폴리스를 이용하여 곤충이나 미생물과 같은 다양한 침입자들을 미라로 만들어 벌통을 보호하고, 균열이 발생한 공간을 밀폐하여 벌집을 수리하기도 한다. 인류는 프로폴리스의 기능적 우수성을 이용하여 상처 회복과 같은 치료제로 많이 이용하였다. 그러나 프로폴리스가 가진 기능적 우수성에 대한 이화학적 분석 및 생리 활성에 대한 관심이 시작된 것은 불과 100년 전에 시작되었다 (Marcucci, 1995). 이후 프로폴리스의 생물학적 기능성에 주목하면서 약리적 작용에 대한 연구가 이루어지고 있다 (Castaldo and Capasso, 2002). 프로폴리스는 벌집 내의 원괴로부터 추출하는데, 용매에 따라 구성 성분 및 기능성에 일부 차이를 나타내기도 하지만 프로폴리스 기능성에 가장 큰 영향을 미치는 요인은 벌집 주변에 있는 밀원에 따라 결정된다 (Tosi et al., 1996; Marcucci et al., 1998; Kumazawa et al., 2004). 수많은 기능성 물질이 혼합된 프로폴리스에서 가장 큰 생물학적 특성을 나타내는 성분은 플라보노이드와 폴리페놀이다 (Havsteen, 2002). 이들 성분으로 인해 프로폴리스는 다양한 의약학적 특성을 나타내는데, 특히 면역 조절 (Kim et al., 2018), 항균 (Sforcin, 2000; Schnitzler et al., 2010), 항산화 (Jeong, 2004), 항염증 (Khayyal, 1993; Ledon et al., 1997), 그리고 항암 (Bazo et al., 2002; Orsolic et al., 2005)에 프로폴리스를 활용하고 있다. 하지만 프로폴리스의 기능성에 대한 명확한 분자기전은 밝혀지지 않았으며, 특히 세포 내에서의 분자 조절에 대한 효과는 아직 기초적인 수준에 불과하다.
따라서 본 연구에서는 세포 골격을 이루는 미세소관 조립에 대한 프로폴리스의 효과를 확인하고자 하였다. 이를 위해 소포체 스트레스를 일으키는 tunicamycin을 처리하여 단백질의 비정상적인 가공을 유도하여 미세소관 조립을 차단하고 여기에 프로폴리스 추출물을 처리하여 미세소관 조립 회복에 대한 효과를 확인하고자 하였다.
재료 및 방법
1. 프로폴리스 추출
실험 재료로 사용한 프로폴리스는 대한민국 충주의 양봉농가에서 제공받은 원괴 50 g에 500 mL의 80% 에탄올을 첨가하여 48시간 동안 실온에서 추출하였다. 추출물은 미라클로스로 1차 여과한 후, Whatman No. 2 필터로 2차 여과하였다. 여과한 프로폴리스 추출물은 감압농축 장치에서 완전히 농축시킨 후, 10 mg/mL의 농도가 되도록 에탄올 원액을 첨가하고 완전히 용해시켰다. 세포에 대한 실험을 위해 0.22 μm의 syringe filter에 여과하였고, 사용 시까지 냉장보관하였다.
2. 배지 및 시약
세포 배양에 사용된 RPMI-1640, penicillin-streptomycin 그리고 horse serum은 Gibco (U.S.A.)사에서 구입하였으며, fetal bovine serum (FBS)은 GenDEPOT (Korea)사에서 구입하였다. 소포체 스트레스 유발을 위한 tunicamycin은 Sigma (U.S.A.)사에서 구입하였다. 튜불린 중합반응을 위한 MES, EGTA, MgCl2, EDTA, glycerol, MgSO4, Triton X-100은 Sigma사에서 구입하였고, Protease inhibitor cocktail solution은 GenDEPOT사에서 구입하였다. Western blotting에 사용된 acetylated α-tubulin 항체는 Cell signaling (U.S.A.)사에서 구입하였으며, α-tubulin, β-tubulin, PCNA, GAPDH 항체는 Santacruz (U.S.A.)에서 구입하였다. Immunocytochemistry에 사용된 goat anti mouse-FITC 항체는 Gibco사에서 구입하였다.
3. 실험 세포주
실험에 사용한 rat pheochromocytoma 12 (PC12) 세포주는 한국세포주은행에서 구입하였으며, 세포 배양은 RPMI-1640 배지에 100 unit/mL의 penicillin-streptomycin, 15% horse serum과 5%의 FBS가 첨가된 배지에서 배양하였다. 세포 배양은 37℃로 유지되고 5%의 CO2가 공급되는 배양기에서 배양하였다.
4. 세포 실험 조건
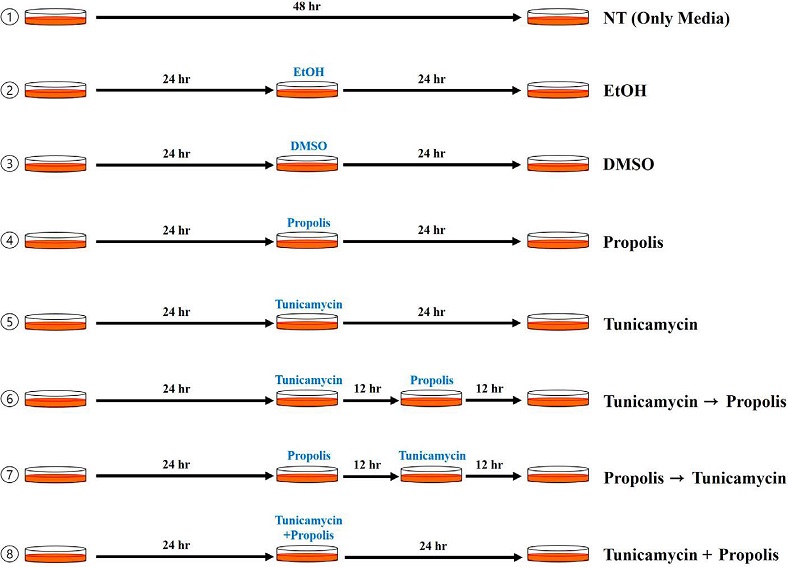
앞선 연구에서 결정된 tunicamycin과 프로폴리스의 세포 처리 농도를 바탕으로 튜불린 중합 반응에 대한 세포 처리 농도를 결정하였다 (Kim et al., 2021). Tunicamycin과 프로폴리스는 각각 150 μg/mL와 10 μg/mL로 처리하였으며, 프로폴리스의 세포 보호 효과 여부를 확인하기 위해 다음의 조건에 따라 실험을 진행하였다 (Fig. 1).
5. Tubulin 중합 반응 & Western blotting
6-well plate에 2×105 cells/well로 세포를 접종하고, 24시간 후 tunicamycin과 프로폴리스를 각각 150 μg/mL, 10 μg/mL의 농도로 처리하였다. Fig. 1의 조건에 따라 시약을 처리하고 이후 튜불린 단백질 중합 반응을 진행하였다. 튜불린 단백질 중합 반응은 세포의 배지를 완전히 제거하고 37℃에서 데운 phosphate-buffered saline (PBS)로 세포를 수세하였다. 수세한 세포에 실험 직전에 0.1 mM GTP를 첨가한 tubulin polymerizing buffer (0.1 M MES, 1 mM EGTA, 0.5 mM MgCl2, 0.1 mM EDTA, 2.5 M glycerol, 1 mM MgSO4, 0.1% Triton X-100, 1× protease inhibitor cocktail)를 200 μL 첨가하였고, 37℃로 유지되는 CO2 배양기에서 매 5분마다 부드럽게 흔들어주며 20분을 반응시켰다. 반응 후 세포가 흡입되지 않도록 상층액을 제거하고 SDS lysis buffer (25 mM Tris, pH 7.5, 0.4 M NaCl, 0.5% SDS)를 200 μL 첨가한 후, 37℃로 유지되는 CO2 배양기에서 10분간 반응시켰다. 10분 후 중합 반응이 일어난 튜불린 중합체가 존재하는 세포 추출물을 수거하고, bicinchronic acid (BCA) 단백질 정량법으로 정량하여 10% sodium dodecyl sulfate-polyarylamide gel electrophoresis (SDS-PAGE)로 전개하였다. 전개된 단백질은 polyvinylidene fluoride (PVDF) membrane에 transfer하고, 항체의 비특이적 반응을 차단하기 위해 2% non-fat dry milk로 실온에서 1시간 동안 반응시켰다. 1차 항체로는 acetylated α-tubulin, α-tubulin 그리고 β-tubulin 항체를 2% non-fat dry milk에 각각 1 : 1,000으로 희석한 뒤, 실온에서 16시간 동안 반응시켰다. 1차 항체 반응 후 1× tris-buffered saline-tween-20 (TBS-T) 용액으로 membrane을 수세하고, 2차 항체를 1차 항체 생산 host에 따라 goat anti-rabbit-HRP 또한 goat anti-mouse-HRP를 1 : 2,000으로 5% non-fat dry milk에 희석하여 실온에서 1시간 동안 반응시켰다. 이후 TBS-T 용액으로 membrane을 수세한 후, ECL pico detection system (GenDEPOT, Korea)으로 발색 후, ChemiDOC (Bio-Rad, U.S.A.) 장치에서 단백질 띠를 검출하였다.
6. Immunocytochemistry
미세소관 조립을 직접 확인하기 위해 튜불린 중합 반응 후, 형광 현미경을 이용하여 촬영하였다. 6-well plate에 cover-glass를 넣고 50 μg/mL의 농도로 poly-D-lysine (Gibco, U.S.A.) 용액을 처리하여 세포의 부착이 용이하도록 준비하였다. 2×105 cells/well로 세포를 접종하고, 24시간 후 150 μg/mL의 tunicamycin과 10 μg/mL의 프로폴리스를 실험 조건에 따라 처리한 후, 24시간을 배양하였다. 이후 tubulin polymerizing buffer를 처리하여 중합 반응을 유도한 후, SDS lysis buffer는 처리하지 않고 그대로 4% paraformaldehyde 용액으로 세포를 고정하였다. 고정된 세포에 0.1% triton X-100이 포함된 phosphate-buffered saline-tween 20 (PBS-T)를 첨가하고 10분간 반응시켜 세포를 permeabilization한 후, 1% bovine serum albumin (BSA)가 첨가된 PBS-T 용액에서 1시간 반응시켜 항체의 비특이적 반응을 차단했다. 이후 1차 항체로 β-tubulin 항체를 1 : 200으로 PBS-T에 희석하여 4℃에서 24시간 반응시켰다. 1차 항체 반응 후 PBS-T로 3회 수세하고, goat anti-mouse-FITC 항체를 PBS-T에 1 : 200으로 희석하여 4℃에서 2시간 반응시켰다. 2차 항체 반응 후, PBS-T로 4회 수세하고 slide-glass에 세포가 붙은 cover-glass를 mount solution으로 마운트하고 건조시킨 후, 형광 현미경 (Leika DMI6000 B, Germany)으로 튜불린 단백질을 확인하였다.
결과 및 고찰
1. 프로폴리스 추출
프로폴리스 추출물은 총 3회에 걸쳐 추출하였으며, 추출 후 수율을 확인한 결과, 1차 36.8%, 2차 39.1% 그리고 3차 35.8%로 나타났다. 전체 추출에 대한 평균은 37.2%로 확인되었다.
2. 튜불린 중합 반응에 대한 프로폴리스 추출물의 효과
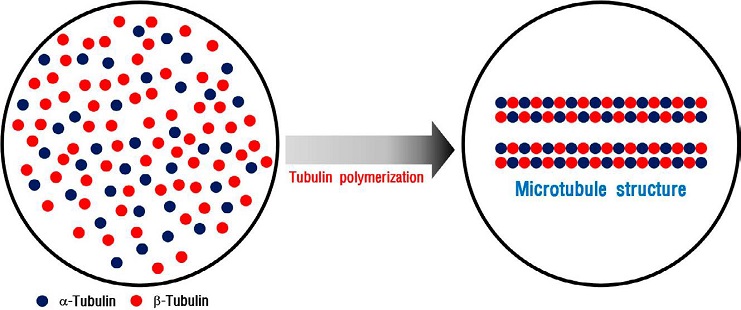
Fig. 2에서는 튜불린 중합 반응에 대한 모식도를 나타냈다. 세포 내에 단량체로 존재하던 알파 튜불린과 베타 튜불린은 튜불린 중합 반응이 발생하면 미세소관 조립을 위한 프로토필라멘트를 형성하기 때문에 긴 막대 모양으로 형성된다. In vitro에서 튜불린 중합 반응을 유도할 시 중합 반응 완충액 내의 triton X-100으로 인해 중합되지 않은 단량체 튜불린 분자는 세포 외부로 분비된다. 프로토필라멘트를 형성한 중합체는 거대한 분자를 이루기 때문에 세포 외부로 분비되지 않고 세포 내부에 그대로 존재하게 된다. 이후 세포 내의 단백질을 추출하여 튜불린 중합 반응에 관여하는 단백질의 발현 변화를 확인하였다.
Fig. 3에는 튜불린 중합 반응의 결과로 나타난 분자의 변화를 Western blotting에 의해 확인한 것이다. 알파 튜불린의 아세틸화는 미세소관 조립에 있어 중요한 분자 기전으로 아세틸화가 감소되면 정상적인 미세소관 중합이 발생하지 않는다. Tunicamycin만을 처리한 실험군에서는 알파 튜불린의 아세틸화가 정상군보다 감소되었으며, 알파 튜불린 자체의 발현양도 정상군에 비해 감소되었음이 확인되었다. 튜불린 중합 반응에서 단백질 표지 마커로 알려진 베타 튜불린의 발현은 tunicamycin 처리군에서 정상군보다 감소되었으며, 이는 세포에 발생된 소포체 스트레스로 인해 단백질의 번역 후 가공이 정상적으로 이루어지지 않아 알파 튜불린의 아세틸화가 감소되고 이는 미세소관의 중합이 정상적으로 일어나지 않았음을 의미한다. Tunicamycin을 전처리하고 프로폴리스를 후처리한 경우에도 알파 튜불린의 아세틸화 및 베타 튜불린의 발현이 감소된 것을 알 수 있다. 즉, 세포가 독성 물질과 같은 외부 요인에 먼저 자극을 받는 경우 프로폴리스에 의한 교정은 나타나지 않는 것이다. 그러나 프로폴리스를 전처리하고 tunicamycin을 후처리한 경우에는 알파 튜불린의 아세틸화와 베타 튜불린의 발현이 정상적으로 회복되는 것을 알 수 있다. 이는 프로폴리스에 의해 세포가 보호를 받게 되면서 tunicamycin에 의한 독성을 저해시키는 것을 의미한다. 프로폴리스와 tunicamycin을 동시에 처리한 경우도 알파 튜불린의 아세틸화와 베타 튜불린의 발현을 회복시켰으나, 프로폴리스를 전처리한 것에는 미치지 못하였다. 이는 프로폴리스가 이미 발생된 세포 내 오류를 정상으로 회복시키는 것이 아니라 외부의 물질로부터 세포를 보호한다는 것을 의미한다. 즉, 건강기능식품으로 현재 프로폴리스가 이용되고 있는데 프로폴리스의 섭취가 외부의 독성 물질로부터 세포를 보호한다는 것을 나타낸다. 세포의 분열 촉진 마커 중의 하나인 PCNA의 경우, tunicamycin을 처리하면 소포체의 스트레스로 인해 세포의 사멸이 발생하기 때문에 단백질의 발현이 감소하는 것을 알 수 있다. 그러나 프로폴리스의 전처리의 경우 PCNA가 정상적으로 발현되어 세포가 사멸하지 않도록 보호하고 있음을 의미한다. GAPDH의 경우 본 실험의 loading control로서 tunicamycin이 처리된 모든 실험군에서는 GAPDH의 양이 tunicamycin을 처리하지 않은 실험군에 비해 증가한 것을 알 수 있다. 이는 tunicamycin을 처리한 세포군의 단백질 양이 많음에도 불구하고 미세소관 조립에 관여하는 단백질의 양이 더 적다는 것을 뜻하는 것이다.
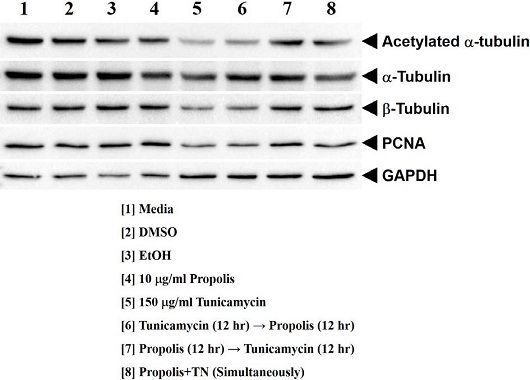
The effect of propolis for tubulin polymerization and expression of polymerization-related protein. Polymerized tubulin resoved in 10% SDS-PAGE and carried out Western blotting. Each antibody were diluted in 2% skim milk at 1 : 1,000 except GAPDH (1 : 5,000) for overnight. Tunicamycin and propolis were treated at 15 μg/mL and 10 μg/mL each for 24 hr.
3. Tunicamycin과 프로폴리스 처리에 따른 미세소관 구조의 관찰
Tunicamycin과 프로폴리스를 세포에 처리함으로써 나 타나는 미세소관 구조의 변화를 직접 확인하기 위해 immunocytochemistry를 수행하였다. PC12 세포는 cover-glass 상에서 세포 접착이 잘 이루어지지 않기 때문에 50 μg/mL의 농도로 poly-D-lysine solution을 cover-glass에 코팅한 후, 세포를 접종하였다. 24시간 후 세포에 tunicamycin과 프로폴리스를 처리하고 다시 24시간을 배양한 후 튜불린 중합 반응을 유도하였다. 세포 내의 미세소관 구조를 관찰하기 위해 중합 반응 후 SDS lysis buffer를 처리하지 않고 세포를 그대로 고정하여 β-tubulin 항체로 반응시키고, 형광 관찰을 위해 2차 항체로 goat anti-mouse-FITC 항체로 염색하였다. Fig. 4에서는 tunicamycin과 프로폴리스를 처리함에 따른 미세소관 구조를 보여주고 있다.
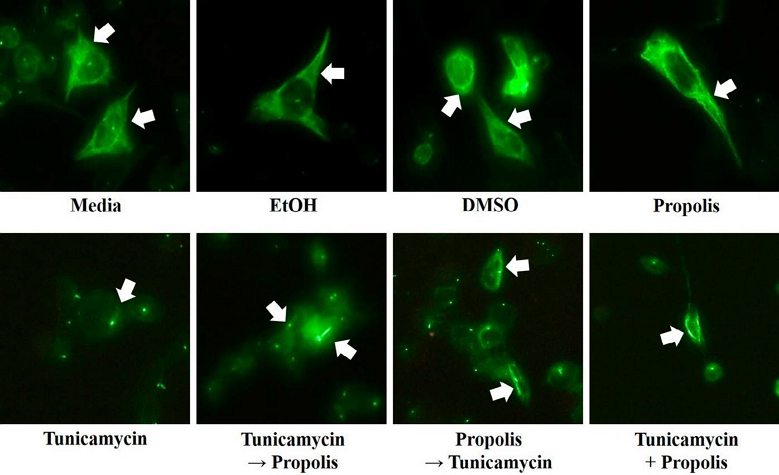
Fluorescence microscopy analysis for polymerized microtubule by tunicamycin and propolis treatment. Cover-glass were coated with 50 μg/mL of poly-D-lysine before cell seeding. After polymerization, tubulin incubated with β-tubulin antibody at 1 : 200. Goat anti-mouse-FITC antibody were diluted at 1 : 200. Fluorescence image visualized with LAP4000 image system.
대조구, EtOH, DMSO 그리고 프로폴리스만을 처리한 세포는 모두 실과 같은 정상적인 미세소관 구조를 보여주고 있다. 하지만 tunicamycin을 처리한 세포는 미세소관 구조가 나타나지 않고, 세포질 일부에 튜불린 단백질이 뭉친 형태로 나타났다. In vitro 튜불린 중합 반응이 일어나지 않고 단량체 상태로 존재하는 튜불린 단백질이 세포 외부로 빠져나가면서 정상적인 미세소관 구조를 형성하지 못하고 세포질에 퍼진 형태 혹은 뭉친 형태로 나타난 것이다. Tunicamycin을 전처리한 세포에서도 마찬가지의 결과를 나타냈다. 반면 프로폴리스를 전처리하거나 tunicamycin과 프로폴리스를 동시에 처리한 세포에서는 일부 미세소관 구조가 나타났다. 이는 프로폴리스에 의해 세포가 보호됨으로써 미세소관 구조의 붕괴를 차단했음을 나타내며, 프로폴리스를 전처리한 세포에서 더욱 명확하게 나타났다. 이는 세포 내 단백질을 직접 형광으로 관찰한 것과 Western blotting의 결과가 서로 일치되고 있음을 나타낸다.
프로폴리스에 의한 생물학적 기능성 효과는 이미 수많은 연구에 의해 알려졌으나 세포에서 작용하는 구체적인 기전은 명확하게 제시된 바 없다. 본 논문에서는 소포체 스트레스로 인한 세포 사멸 현상에서 프로폴리스에 의한 세포 보호 효과에 대한 결과를 제시하였다. 프로폴리스가 튜불린 중합 반응을 회복시킴으로써 세포의 구조가 붕괴되는 것을 차단하고, 이를 통해 세포의 물질 수송과 세포의 이동성이 정상적으로 이루어질 수 있도록 함을 의미한다. 흥미로운 점은 프로폴리스의 전처리를 통한 결과에서 미세소관의 구조 회복이 뚜렷이 나타났다는 것이다. 즉, 외부 독성 물질로부터 프로폴리스가 세포를 보호할 수 있으며, 이는 현재 건강기능식품으로 널리 이용되고 있는 프로폴리스의 기능적 우수성을 나타내는 것이라 할 수 있다. 본 연구를 바탕으로 프로폴리스 내 세포 보호 및 미세소관 구조 유지에 대한 지표 성분의 연구와 분자 기전을 구명함으로써 프로폴리스의 세포 내 작용 기전을 명확히 제시해야 할 것이다.
Acknowledgments
본 연구는 농촌진흥청 어젠다연구사업 (과제번호: PJ01512905)에 의해 수행되었습니다.
References
-
Almeida, E. C. and H. Menezes. 2002. Anti-inflammatory activity of propolis extracts: a review. J. Venom. Anim. Toxins 8: 191-212.
[https://doi.org/10.1590/S0104-79302002000200002]

-
Bazo, A. P., M. A. Rodrigues, S. M. Sforcin, J. L. de Camargo, L. R. Ribeiro and D. M. Salvadori. 2002. Protective action of propolis on the rat colon carcinogenesis. Teratog. Carcinog. Mutagen. 22: 183-194.
[https://doi.org/10.1002/tcm.10011]

-
Boggs, A. E., M. I. Vitolo, R. A. Whipple, M. S. Charpentier, O. G. Goloubeva, O. B. Joffe, K. C. Tuttle, J. Slovic, Y. Lu, G. B. Mills and S. S. Martib. 2015. α-Tubulin acetylation elevated in metastatic and basal-like breast cancer cells promotes microtentacle formation, adhesion, and invasive migration. Cancer Res. 75: 203-215.
[https://doi.org/10.1158/0008-5472.CAN-13-3563]

-
Burdock, G. A. 1998. Review of the biological properties and toxicity of bee propolis (propolis). Food Chem. Toxicol. 36: 347-363.
[https://doi.org/10.1016/S0278-6915(97)00145-2]

-
Castaldo, S. and F. Capasso. 2002. Propolis, an old remedy used in modern medicine. Fitoterapia 73: 1-6.
[https://doi.org/10.1016/S0367-326X(02)00185-5]

-
Di Martile, M., D. Del Bufalo and D. Trisciuoglio. 2016. The multifaceted role of lysine acetylation in cancer: Prognostic biomarker and therapeutic target. Oncotarget 7: 55789-55810.
[https://doi.org/10.18632/oncotarget.10048]

-
Dompierre, J. P., J. D. Godin, B. C. Charrin, F. P. Cordelieres, S. J. King, S. Humbert and F. Saudou. 2007. Histone deacetylase 6 inhibition compensates for the transport deficit in Huntington’s disease by increasing tubulin acetylation. J. Neurosci. 27: 3571-3583.
[https://doi.org/10.1523/JNEUROSCI.0037-07.2007]

-
d’Ydewalle, C., J. Krishnan, D. M. Chiheb, P. V. Damme, J. Jrobi, A. P. Kozikwoski, P. V. Berghe, V. Timmerman, W. Robberecht and L. V. D. Bosch. 2011. HDAC6 inhibitors reverse axonal loss in a mouse model of mutant HSPB1-induced Charcot-Marie-Tooth disease. Nat. Med. 17: 968-974.
[https://doi.org/10.1038/nm.2396]

-
Godena, V. K., N. Brookes-Hocking, A. Moller, G. Shaw, M. Oswald, R. M. Sancho, C. C. J. Miller, A. J. Whitworth and K. J. D. Vos. 2014. Increasing microtubule acetylation rescues axonal transport and locomotor deficits caused by LRRK2 Roc-COR domain mutations. Nat. Commun. 5: 5245.
[https://doi.org/10.1038/ncomms6245]

-
Havsteen, B. H. 2002. The biochemistry and medical significance of the flavonoids. Pharmacol. Ther. 96: 67-202.
[https://doi.org/10.1016/S0163-7258(02)00298-X]

-
Honore, S., E. Pasquier and D. Braguer. 2005. Understanding microtubule dynamics for improved cancer therapy. Cell. Mol. Life Sci. 62: 3039-3056.
[https://doi.org/10.1007/s00018-005-5330-x]

-
Howes, S. C., G. M. Alushin, T. Shida, M. V. Nachury and E. Nogales. 2014. Effects of tubulin acetylation and tubulin acetyltransferase binding on microtubule structure. Mol. Biol. Cell 25: 257-266.
[https://doi.org/10.1091/mbc.e13-07-0387]

-
Janke, C. and G. Montagnac. 2017. Causes and consequences of microtubule acetylation. Curr. Biol. 27: R1287-R1292.
[https://doi.org/10.1016/j.cub.2017.10.044]

-
Jeong, I. Y. 2004. Antioxidant activity and radioprotection of two flavonoids from propolis. J. Med. Food. 34: 162-166.
[https://doi.org/10.3746/jkfn.2005.34.2.162]

- Khayyal, M. T., M. A. el-Ghazaly and A. S. el-Khatib. 1993. Mechanisms involved in the anti-inflammatory effect of propolis extract. Drugs Exp. Clin. Res. 19: 197-203.
-
Kim, J. Y., S.-Y. Woo, Y. B. Hong, H. Choi, J. Kim, H. Choi, I. Mook-Jung, N. Ha, J. Kyung, S. K. Koo, S.-C. Jung and B.-O. Choi. 2016. HDAC6 inhibitors rescued the defective axonal mitochondrial movement in motor neurons derived from the induced pluripotent stem cells of peripheral neuropathy patients with HSPB1 mutation. Stem Cells Int. 2016: 9475981.
[https://doi.org/10.1155/2016/9475981]

-
Kim, S. K., S. O. Woo, S. M. Han, S. G. Kim, K. W. Bang, H. R. Jang, H. J. Moon and H. J. Kim 2018. Anti-inflammatory effects of Korean propolis extracts on Raw264.7 macrophage cells. Korean J. Apic. 33: 187-194.
[https://doi.org/10.17519/apiculture.2018.09.33.3.187]

-
Kim, S. K., S. M. Han, S. G. Kim, H. Y. Kim, S. Ryu and S. W. Woo. 2021. Inhibition of tau hyperphosphorylation and its molecular mechanism by Korean propolis extracts. J. Apic. 36: 169-176.
[https://doi.org/10.17519/apiculture.2021.09.36.3.169]

-
Kumazawa, S., T. Hamasaka and T. Nakayama. 2004. Antioxidant activity of propolis of various geographic origins. Food Chem. 84: 329-339.
[https://doi.org/10.1016/S0308-8146(03)00216-4]

- Ledon, N., A. Casaco, R. Gonzalez, N. Merino, A. Gonzalez and Z. Tolon. 1997. Antipsoriatic, anti-inflammatory, and analgesic effects of an extract of red propolis. Acta Pharmacol. Sin. 18: 274-276.
-
Li, L., D. Wei, Q. Wang, J. Pan, R. Liu, X. Zhang and L. Bao. 2012. MEC-17 deficiency leads to reduced α-tubulin acetylation and impaired migration of cortical neurons. J. Neurosci. 32: 12673-12683.
[https://doi.org/10.1523/JNEUROSCI.0016-12.2012]

-
Magiera, M. M., P. Singh, S. Gadadhar and C. Janke. 2018. Tubulin posttranslational modifications and emerging links to human disease. Cell 173: 1323-1327.
[https://doi.org/10.1016/j.cell.2018.05.018]

-
Marcucci, M. C. 1995. Propolis: Chemical composition, biological properties and therapeutic activity. Apidologie 26: 83-99.
[https://doi.org/10.1051/apido:19950202]

-
Marcucci, M. C., J. Rodriguez, F. Ferrerez, V. Vankova, R. Grotor and S. Popov. 1998. Chemical composition of Brazilian propolis from São Paulo State. Z. Neturforsch. Sect. C. Biosc. 53: 117-119.
[https://doi.org/10.1515/znc-1998-1-220]

-
Mitchison, T. and M. Kirschner. 1984. Dynamic instability of microtubule growth. Nature 312: 237-242.
[https://doi.org/10.1038/312237a0]

-
Mitchison, T. J. 1993. Localization of an exchangeable GTP binding site at the plus end of microtubules. Science 261: 1044-1047.
[https://doi.org/10.1126/science.8102497]

-
Orsolic, N., I. Kosalec and I. Basic. 2005. Synergistic antitumor effect of polyphenolic components of water soluble derivative of propolis against Ehrlich ascites tumour. Biol. Pharm. Bull. 28: 694-700.
[https://doi.org/10.1248/bpb.28.694]

-
Pellegrini, F. and D. R. Budman. 2005. Review: tubulin function, action of antitubulin drugs, and new drug development. Cancer Invest. 23: 264-273.
[https://doi.org/10.1081/CNV-200055970]

-
Schnitzler, P., A. Neuner, S. Nolkemper, C. Zundel, H. N. Karl, H. Sensch and J. Reichling. 2010. Antiviral activity and mode of action of propolis extracts and selected compounds. Phytother. Res. 24: S20-S28.
[https://doi.org/10.1002/ptr.2868]

-
Sforcin, J. M. 2000. Seasonal effect on Brazilian propolis anti-bacterial activity. J. Ethnopharmacol. 73: 243-249.
[https://doi.org/10.1016/S0378-8741(00)00320-2]

-
Tosi, B., A. Donini, C. Romagnoli and A. Bruni. 1996. Antimicrobial activity of some commercial extracts of propolis prepared with different solvents. Phytother. Res. 1014: 335-336.
[https://doi.org/10.1002/(SICI)1099-1573(199606)10:4<335::AID-PTR828>3.0.CO;2-7]

-
Wade, R. H. 2007. Microtubules: an overview. Methods Mol. Med. 137: 1-16.
[https://doi.org/10.1007/978-1-59745-442-1_1]

-
Walker, R., E. O’brien, N. Pryer, M. Soboeiro, W. Voter, H. Erickson and E. Salmon. 1988. Dynamic instability of individual microtubules analyzed by video light microscopy:rate constants and transition frequencies. J. Cell. Biol. 107: 1437-1448.
[https://doi.org/10.1083/jcb.107.4.1437]