2021~2022년 국내 아까시나무 개화기 중의 꿀벌 질병 발생 현황
Abstract
Several diseases of the honeybee (Apis mellifera L.) pose severe problems on honeybee production and productivity. In addition, it become a serious economic lost in the beekeeping sector. The acacia (Robinia pseudoacacia) honey is a major product of the beekeeping industry in Korea. Therefore, detecting diseases of honeybee is important during the blooming season of acacia. In this study, we performed the polymerase chain reaction (PCR) analysis to detect seven viruses (Sacbrood Virus (SBV); Acute Bee Paralysis Virus (ABPV); Deformed Wing Virus (DWV); Black Queen Cell Virus (BQCV); Kashmir Bee Virus (KBV); Chronic Bee Paralysis Virus (CBPV); Israel Acute Paralysis Virus (IAPV)), two bacteria (Paenibacillus larvae and Melissococcus pluton), and three fungi (Ascosphaera apis, Nosema ceranae, and N. apis) in samples of honeybees (A. mellifera) that were collected from 24 apiaries in Korea during the blooming season of acacia. In 2021, three diseases (BQCV, N. ceranae, and N. apis) were detected from 24, 23, and 24 apiaries respectively, and in 2022, seven diseases (SBV, DWV, BQCV, IAPV, EFB, N. ceranae, and N. apis) were detected from 4, 5, 24, 4, 1, 20, and 20 apiaries respectively. In particular, three viral diseases (SBV, DWV, and IAPV) were newly detected in 2022 from 4, 5, and 4 apiaries respectively. These diseases are mainly transmitted by Varroa destructor. This could be attributed to high damages caused by the V. destructor in 2022. Our present study could be a milestone to beekeepers in fighting against these diseases during the blooming seasons of acacia to bust up honey production and other hives products.
Keywords:
Disease, Honeybee, Acacia, Blooming, Korea서 론
벌의 질병은 크게 바이러스성, 세균성, 진균성으로 분류할 수 있다. 꿀벌에게 치명적인 바이러스성 질병은 낭충봉아부패병 바이러스 (sacbrood virus, SBV), 날개불구바이러스 (deformed wing virus, DWV), 급성벌마비증 바이러스 (acute bee paralysis virus, ABPV), 만성벌마비증 바이러스 (chronic bee paralysis virus, CBPV), 이스라엘급성마비증 바이러스 (Israel acute paralysis virus, IAPV), 검은여왕벌방 바이러스 (black queen cell virus, BQCV), 카슈미르벌 바이러스 (kashmir bee virus, KBV) 등 7종이 보고되어 있다 (Allen and Ball, 1996). 급성벌마비증 바이러스와 같이 급성 마비증세를 나타내는 바이러스는 특히 양봉 생산성에 치명적인 영향을 미치는 것으로 보고되어 있으며 (Choi et al., 2007), 그중 이스라엘급성마비증 바이러스는 꿀벌의 높은 사망률을 나타내고 (Maori et al., 2009; Carrillo-Tripp et al., 2016) 봉군붕괴현상 (Colony Collapse Disorder, CCD)과도 연관되어 있는 것으로 알려져 있다 (Cox-Foster et al., 2007). 그리고 검은여왕벌방 바이러스는 죽은 여왕벌의 유충과 번데기에서 처음 발견되었으며, 호주에서는 여왕벌 유충을 사멸시키는 가장 흔한 원인균으로 알려져 있다 (Bailey and Wood, 1977; Anderson, 1993).
세균성 질병은 최소 6종 이상의 질병이 보고되어 있으며 그중 미국부저병과 유럽부저병의 감염률이 가장 높은 것으로 보고되어 있다 (Chung, 2012a). 이 두 종은 각각 Paenibacillus larvae와 Melissococcus pluton에 의해 발병되는 질병으로 유충에만 감염이 되며, 미국부저병에 감염된 유충은 크림갈색으로 변하고 밖으로 꺼냈을 때 끈끈한 암갈색의 형태를 띤다고 보고되어 있다 (Chung, 2012a).
Ascosphaerea apis의 감염에 의해 유발되어 발생하는 백묵병은 유충에 발생하는 질병이며, 유충의 입을 통해 A. apis의 포자가 유입되면 유충의 몸은 백묵처럼 굳어진다 (Choi et al., 2013). 다른 진균성 질병인 노제마증은 미포자충류인 N. ceranae와 N. apis에 감염되는 질병으로, 꿀벌이 먹이활동을 하는 도중 포자가 체내로 유입되어 감염된다 (Higes et al., 2007; Fries, 2010). Nosema 포자는 주로 꿀벌의 중장 상피세포에 정착하고 증식한 후 꿀벌의 분변을 통해 다른 개체와 주변 봉군으로 쉽게 전이된다 (de Graaf et al., 1994; Higes et al., 2007; Fries, 2010; Gisder et al., 2011). Nosema 포자에 감염된 꿀벌은 소화불량으로 인해 복부팽만과 잦은 설사 그리고 벌통 앞을 기어다니는 증상이 나타난다 (Chung, 2012b). 또한 증상이 악화된 꿀벌은 충분한 에너지원을 섭취하지 못하여 전반적인 양봉 활동이 저조하게 되고 이는 봉군 소실로 이어지게 된다 (Martín-Hernández et al., 2018; Chaimanee et al., 2019).
이렇듯 꿀벌의 질병은 꿀벌 활동 능력에 직접적인 악영향을 미칠 뿐만 아니라 봉군의 세력 약화로 이어져 꿀 생산과 화분 매개 등 전반적인 양봉 활동에도 영향을 미치게 된다.
한편, 국내 최대 밀원인 아까시나무에서 생산되는 아카시아 벌꿀은 국내 벌꿀 총 생산량의 약 70%를 차지하며 양봉 산업에서 큰 비중을 차지하고 있다 (Lew, 1992; Park et al., 2020). 이에, 아까시나무 개화기 중 봉군의 상태는 양봉농가의 소득에 매우 중요한 요인이 된다. 본 연구에서는 아까시나무 개화기에 활동 중인 꿀벌들의 질병 발생 현황을 조사하여 주로 발생되는 꿀벌 질병 예찰 및 관리 체계 확립을 위한 기초자료를 확보하고자 한다.
재료 및 방법
1. 꿀벌 시료
꿀벌의 질병을 진단하기 위하여 아까시나무 개화기간인 5월에 꿀벌 성충 시료를 채집하였으며 2021년부터 2년간 동일 농가를 대상으로 연구를 진행하였다. 꿀벌 시료를 채집한 농가는 세종시 1개 농가, 경기도 (연천, 파주, 화성, 이천) 6개 농가, 강원도 (철원) 3개 농가, 충청북도 (보은) 2개 농가, 경상북도 (안동, 예천, 상주, 구미, 김천) 9개 농가 그리고 경상남도 (창녕) 3개 농가로 총 24개의 농가였으며 (Table 1), 채집된 시료는 살아있는 상태를 유지한 후 핵산을 추출하기 전까지 -70℃에 보관하였다.
2. 핵산 추출 및 cDNA 합성
채집한 꿀벌 성충 시료는 각 농가별로 5마리씩 액체질소와 막자사발을 이용하여 균질화하고 Clear-STM Total RNA Extraction kit와 Clear-STM Quick DNA Extraction kit (InVIRUStech, Korea)를 이용하여 제품의 시약 용법에 따라 RNA와 DNA를 추출하였다. 추출된 total RNA는 amfiRivert Platinum cDNA synthesis enzyme (GenDEPOT, TX, USA)을 이용하여 제품의 사용 용법에 따라 cDNA를 합성하였으며, 합성된 cDNA와 추출된 DNA는 -20℃에 보관하여 분석에 이용하였다.
3. 병원체 시발체 (primer)
꿀벌의 12가지 질병인 낭충봉아부패병, 날개불구바이러스감염증, 급성벌마비증, 만성벌마비증, 이스라엘급성벌마비증, 검은여왕벌방바이러스감염증, 카슈미르벌바이러스감염증, 미국부저병, 유럽부저병, 백묵병, 노제마증 (Nosema ceranae, N. apis)의 병원체를 대상으로 시발체를 제작하였다 (Table 2). 중합효소연쇄반응 (PCR, polymerase chain reaction) 시 편의를 위해 100 pmol/μL 농도의 forward primer 10 μL와 reverse primer 10 μL 그리고 DEPC water 180 μL를 혼합하여 primer mixer를 제조하였다.
4. 중합효소연쇄반응 및 증폭산물 분석
유전자 증폭은 AccuPower® HotStart PCR PreMix (Bioneer, Korea) 제품의 사용 용법에 따라 PCR PreMix tube 1개당 primer mixer 1 μL, 주형 (template) 1 μL 그리고 nuclease-free water 18 μL를 첨가하여 총량이 20 μL가 되도록 하였다. 바이러스성 질병 검사일 경우 주형은 cDNA를 사용하였고 세균 또는 진균성 질병 검사일 경우 DNA를 사용하였다. 유전자 증폭은 2720 Thermal Cycler (Applied Biosystems, USA)을 사용하였으며 94℃에서 5분간 pre-denaturation을 수행하고 94℃에서 30초, 55℃에서 30초 그리고 72℃에서 30초로 32 cycle을 반복한 후 72℃에서 5분간 최종 연장 (final extension)을 하였다. 유전자 증폭 산물은 100 bp DNA ladder (Bioneer, Korea)와 함께 0.1 µL/mL의 ethidium bromide (Sigma-Aldrich, USA)가 함유된 1.8% agarose gel (Lonza, Swiss)로 전기영동을 하였고 자외선 램프를 통해 밴드를 확인하였다.
결 과
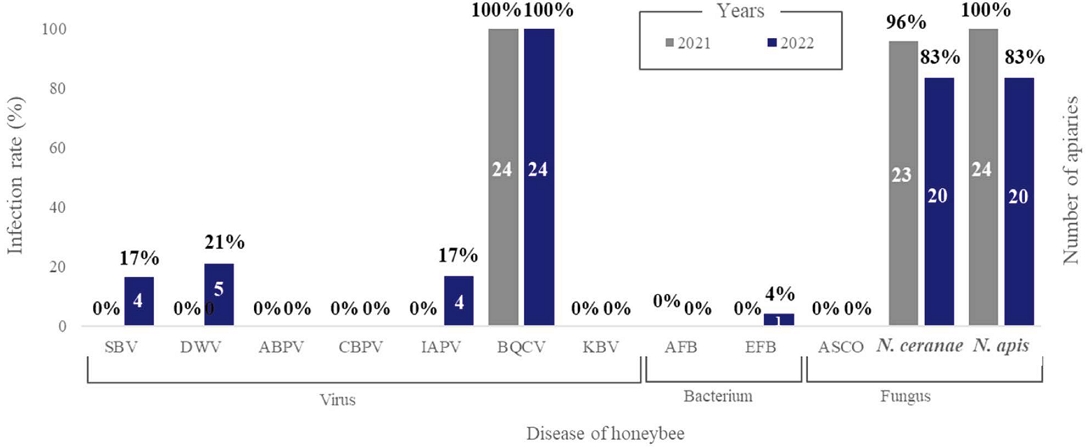
본 연구는 2021년부터 2년간 수행되었으며, 아까시나무 개화기에 활동 중인 꿀벌들의 질병 발생 현황을 조사하였다. 시료는 세종시, 경기도, 강원도 등 6개의 시도와 13개 지역에 위치하고 있는 24개의 양봉농가에서 채집하였으며, 12종의 질병에 대한 감염 여부를 조사하였다 (Table 3과 4,). 그 결과, 2021년에는 12종의 질병원 중 3종 (검은여왕벌방 바이러스, N. ceranae, N. apis)의 질병원이 검출되었고 2022년에는 7종 (낭충봉아부패병 바이러스, 날개불구 바이러스, 검은여왕벌방 바이러스, 이스라엘급성마비증 바이러스, 유럽부저병, N. ceranae, N. apis)의 질병원이 검출되었다. 검은여왕벌방 바이러스는 2년의 연구 기간 동안 100% (24개 농가)의 감염률을 나타냈으며 (Table 3과 4), 노제마증을 유발하는 원인균 중의 하나인 N. apis도 높은 비율 (2021년, 100%; 2022년, 83%)로 관찰되었다. 한편, 2022년에는 2021년과 달리 3종의 바이러스성 질병 (낭충봉아부패병, 4개 농가; 날개불구바이러스감염증, 5개 농가; 이스라엘급성마비증, 4개 농가)과 1종의 세균성 질병 (유럽부저병, 1개 농가)이 추가 감염된 것으로 확인되었다 (Table 4, Fig. 1).

Results of qPCR-based infection diagnosis of 12 diseases in honeybees sampled during blooming season of acacia in 2021 from apiaries in 24 regions in South Korea

Results of qPCR-based infection diagnosis of 12 diseases in honeybees sampled during blooming season of acacia in 2022 from apiaries in 24 regions in South Korea
고 찰
2021년과 2022년 아까시나무 개화기에 24개의 양봉농가를 대상으로 검은여왕벌방 바이러스 감염 여부를 조사한 결과, 매우 높은 수준의 감염률로 나타났다 (2021년, 2022년 100%; Table 3과 4). 본 연구 결과와 마찬가지로, 아까시나무 개화기에 조사된 다른 선행 연구에서는 2011년에 감염률 100% (20개 농가, Hong et al., 2011), 2012년에 83% (23개 농가, Hong et al., 2012), 2013년에 100% (16개 농가, Hong et al., 2013)로 확인되어 이 질병은 꿀벌에 만성적으로 존재하는 것으로 추정된다 (Hong et al., 2013).
또한 본 연구에서는 노제마증을 유발하는 N. ceranae (2021년, 96%; 2022년, 83%)와 N. apis (2021년, 100%; 2022년, 83%)도 대다수 감염되어 있는 것으로 확인되었다. 이 결과는 2009년과 2012년 아까시나무 개화기에 조사된 결과보다 더 높거나 비슷한 수준이다 (22개 농가 중 73%, Kim et al., 2010; 23개 농가 중 83%, Hong et al., 2012). 과거의 연구에서는 노제마 포자의 종간 분류 없이 꿀벌의 중장 속 포자의 개수를 조사하였기 때문에 본 연구 결과와의 정확한 비교는 어렵지만, 노제마증은 검은여왕벌방 바이러스와 마찬가지로 아까시나무 개화기에 주로 감염되어 있는 질병인 것으로 추정된다 (Kim et al., 2010; Hong et al., 2012).
2022년에 분석된 결과 중 일부 농가에서는 응애류가 주로 매개하는 3종의 바이러스 (낭충봉아부패병, 날개불구바이러스감염증, 이스라엘급성마비증)가 복합 감염되어 있는 것으로 확인되었다 (Table 4, Fig. 1). 이 중 낭충봉아부패병은 아까시나무 개화기간에 조사된 Hong의 연구 결과에서도 감염이 확인된 바 있지만 (22개 농가 중 3개 농가, Hong et al., 2011; 23개 농가 중 17개 농가, Hong et al., 2012), 서양종 꿀벌 (Apis mellifera)에는 큰 영향이 없는 것으로 알려져 있다 (Yongsawas et al., 2020).
반면에 날개불구병과 이스라엘급성마비증은 이전 해와 달리 2022년에만 높은 비율 (17~21%)로 감염된 것으로 나타났다 (Hong et al., 2011; Hong et al., 2012; Fig. 1). 이 두 질병은 주로 꿀벌응애 (Varroa destructor)에 의해 감염되는 질병으로 알려져 있으며 (Bowen-Walker et al., 1999; Chung, 2012c), 특히 날개불구바이러스감염증은 꿀벌응애와 깊은 연관성이 보고된 바 있어 (Ball, 1989; Martin et al., 2001; Shen et al., 2005) 내검 시 봉군 내 응애류 발생 증가지표가 되기도 한다.
한편, 최근 발표된 자료에 의하면 2022년 6월 전국 42개의 지역에서 채집된 꿀벌응애를 대상으로 응애 방제 약제에 대한 저항성을 분석한 결과 대부분의 지역 (35개 지역)에서 fluvalinate에 대한 저항성 돌연변이가 나타난 것으로 조사되었다 (이 등, 2022). 또한 같은 해 5월에 분석된 본 연구 결과에서도 이전 해와 달리 응애 매개 바이러스가 복합 감염된 것으로 확인되어, 이를 종합하여 보았을 때 2022년 아까시나무 개화기 전에 일부 농가에서는 꿀벌응애류 피해가 많았을 것으로 추측된다.
꿀벌의 건강은 꿀벌에게 면역원이 되는 양봉 산물의 생산량과 밀접한 연관이 있다 (Branchiccela et al., 2019). 또한 아까시나무 개화기간의 꿀벌건강은 농가 소득과도 직결된다. 따라서, 꿀벌의 건강과 양봉 산물의 생산 그리고 농가 소득의 선순환을 위해서는 이 시기에 주로 발생할 수 있는 질병을 예찰하고 선제적인 방제가 이루어져야 한다. 본 연구 결과는 아까시나무 개화기 동안에 주로 발생할 수 있는 질병 예찰을 위한 기초자료로 활용될 수 있을 것으로 기대되며, 앞으로도 이에 관한 연구가 지속적으로 수행되어야 할 것으로 판단된다.
적 요
본 연구에서는 2021년부터 2년간 아까시나무 개화기 중의 꿀벌의 질병 발생 현황을 조사하여 질병 발생 변화에 대한 정보를 제공하고자 하였다. 꿀벌 시료를 채집한 농가는 세종시 1개 농가, 경기도 6개 농가, 강원도 3개 농가, 충청북도 2개 농가, 경상북도 9개 농가 그리고 경상남도 3개 농가로 총 24개의 농가이며 2년간 동일 농가를 대상으로 아까시나무 개화기간에 꿀벌 시료를 채집하였다. PCR 분석법을 이용하여 질병 감염 여부를 조사한 결과 2021년에는 3종의 질병 (검은여왕벌방바이러스감염증, 100%; N. ceranae 감염증, 96%; N. apis 감염증, 100%)이 검출되었고, 2022년에는 7종의 질병 (낭충봉아부패병, 17%; 날개불구바이러스감염증, 21%; 이스라엘급성꿀벌마비증, 17%; 검은여왕벌방바이러스감염증, 100%; 유럽부저병, 4%; N. ceranae, 83%; N. apis, 83%)이 검출되었다. 검은여왕벌방바이러스와 노제마증은 2년간 높은 감염률을 나타냈으며 꿀벌에 만성적으로 존재하는 것으로 추정된다. 한편, 2022년에는 지난해에 비해 응애가 매개하는 것으로 알려진 바이러스 질병 감염률이 증가 (17~21%)하였으며 이에, 꿀벌응애류 방제에 대한 적절한 조치가 필요할 것으로 판단된다.
Acknowledgments
본 연구는 농촌진흥청 연구과제 PJ01576305의 연구비로 지원된 결과이다.
References
- 이준희, 조수지, 김상현, 임영천, 이시혁. 2022. 꿀벌응애 살비제 저항성 기작, 진단 및 국내 현황. 2022년 제38차 한국양봉학회 하계학술대회. pp. 20
-
Allen, M. and B. Ball. 1996. The incidence and world distribution of honey bee viruses. Bee World 77: 141-162.
[https://doi.org/10.1080/0005772X.1996.11099306]

- Anderson, D. L. 1993. Pathogens and queen bees. Australasian Beekeeper 94: 292-296.
-
Bailey, L. and R. D. Woods. 1977. Two more small RNA viruses from honey bees and further observations on sacbrood and acute bee-paralysis viruses. J. Gen. Virol. 25: 175-186.
[https://doi.org/10.1099/0022-1317-37-1-175]

- Ball, B. V. 1989. Varroa jacobsoni as a virus vector. pp. 241-244. in Present status of varroatosis in Europe and progress in Varroa mite control, ed. by R. Cavalloro. Office for Official Publications of the European Communities, Luxembourg.
-
Bowen-Walker, P. L., S. J. Martin and A. Gunn. 1999. The transmission of deformed wing virus between honeybees (Apis mellifera L.) by the ectoparasitic mite Varroa jacobsoni Oud. J. Invert. Pathol. 73: 101-106.
[https://doi.org/10.1006/jipa.1998.4807]

-
Branchiccela, B., L. Castelli, M. Corona, S. Díaz-Cetti, C. Invernizzi, M. G. de la Escalera, Y. Mendoza, E. Santos, C. Silva, P. Zunino and K. Antúnez. 2019. Impact of nutritional stress on the honeybee colony health. Sci. Rep. 12: 10156.
[https://doi.org/10.1038/s41598-019-46453-9]

-
Carrillo-Tripp, J., A. G. Dolezal, M. J. Goblirsch, W. A. Miller, A. L. Toth and B. C. Bonning. 2016. In vivo and in vitro infection dynamics of honey bee viruses. Sci. Rep. 6: 22265.
[https://doi.org/10.1038/srep22265]

-
Chaimanee, V., P. Chantawannakul, K. Khongphinitbunjong, T. Kamyo and J. S. Pettis. 2019. Comparative pesticide exposure to Apis mellifera via honey bee-collected pollen in agricultural and non-agricultural areas of Northern Thailand. J. Apic. Res. 58: 720-729.
[https://doi.org/10.1080/00218839.2019.1637224]

- Choi, S., M. Lee, I. Hong, W. Choi, H. Kim, N. Kim, K. Lee, J. Kim and C. Hwang. 2013. Antimicrobial activity of herbal plants extracts on Ascosphaera apis. Korean J. Apic. 28: 211-216.
- Choi, Y., M. Lee and M. Lee. 2007. Detection of israle acute paralysis virus (IAPV) from the honeybee in Korea. Korean J. Apic. 22: 159-165.
- Chung, N. 2012a. Disease of honeybee (Bacteria). J. Korean Vet. Med. Assoc. 48: 556-571.
- Chung, N. 2012b. Disease of honeybee (Protozoa and Parasite). J. Korean Vet. Med. Assoc. 48: 303-313.
- Chung, N. 2012c. Disease of honeybee (Virus-1). J. Korean Vet. Med. Assoc. 48: 748-762.
-
Cox-Foster, D. L., S. Conlan, E. C. Holmes, G. Palacios, J. D. Evans, N. A. Moran, P. Quan, T. Briese, M. Hornig, D. M. Geiser, V. Martinson, D. van Engelsdorp, A. L. Kalkstein, A. Drysdale, J. Hui, J. Zhai, L. Cui, S. K. Hutchison, J. F. Simons, M. Egholm, J. S. Pettis and W. I. Lipkin. 2007. A metagenomic survey of microbes in honey bee colony collapse disorder. Science 318: 283-287.
[https://doi.org/10.1126/science.1146498]

-
de Graaf, D. C., H. R. Sabbe, P. H. de Rycke and F. J. Jacobs. 1994. Early development of Nosema apis (Microspora: Nosematidae) in the midgut epithelium of the honeybee (Apis mellifera). J. Invertebr. Pathol. 63: 74-81.
[https://doi.org/10.1006/jipa.1994.1012]

-
Fries, I. 2010. Nosema ceranae in European honey bees (Apis mellifera). J. Invertebr. Pathol. 103: 73-79.
[https://doi.org/10.1016/j.jip.2009.06.017]

-
Gisder, S., N. Möckel, A. Linde and E. Genersch. 2011. A cell culture model for Nosema ceranae and Nosema apis allows new insights into the life cycle of these important honey bee-pathogenic microsporidia. Environ. Microbiol. 13: 404-413.
[https://doi.org/10.1111/j.1462-2920.2010.02346.x]

-
Higes, M., P. García-Palencia, R. Martín-Hernández and A. Meana. 2007. Experimental infection of Apis mellifera honeybees with Nosema ceranae (Microsporidia). J. Invertebr. Pathol. 94: 211-217.
[https://doi.org/10.1016/j.jip.2006.11.001]

-
Hong, I., S. Woo, Y. Choi, S. Han, N. Kim, H. Kim, S. Han, M. Lee, M. Lee and K. Byeon. 2011. Prevalence of Nosema and virus in honey bee (Apis mellifera L.) colonies on flowering period of Acacia in Korea. Microbiology 39: 317-320.
[https://doi.org/10.5941/MYCO.2011.39.4.317]

- Hong, I., S. Woo, Y. Choi, S. Han, H. Sim, H. Kim, S. Han, M. Lee, K. Byeon and N. Ha. 2012. Prevalence of honeybee viruses on flowering season of Acacia. Korean J. Apic. 27: 117-121.
- Hong, I., M. Lee, S. Woo, H. Sim, Y. Choi, S. Han, H. Kim, K. Byeon, N. Kim and M. Lee. 2013. Prevalence of honeybee Nosema disease and black queen cell virus on flowering periods of Robinia pseudoacacia in 2013. Korean J. Apic. 28: 199-203.
- Kim, N., M. Y. Lee, I. Hong, Y. S. Choi, H. K. Kim, M. L. Lee and K. G. Lee. 2010. Prevalence of honey bee (Apis mellifera) Nosema disease by season in Korea. Korean J. Apic. 25: 25-29.
- Lew, Y. S. 1992. A study on Robinia pseudoacacia and beekeeping industry in Korea. Korean J. Apic. 7(1): 78-94.
-
Maori, E., N. Paldi, S. Shafir, H. Kalev, E. Tsur, E. Glick and I. Sela. 2009. IAPV, a bee-affecting virus associated with colony collapse disorder can be silenced by dsRNA ingestion. Insect. Mol. Biol. 18: 55-60.
[https://doi.org/10.1111/j.1365-2583.2009.00847.x]

-
Martín-Hernández, R., C. Bartolomé, N. Chejanovsky, Y. Le Conte, A. Dalmon, C. Dussaubat, P. García-Palencia, A. Meana, M. A. Pinto, V. Soroker and M. Higes. 2018. Nosema ceranae in Apis mellifera: a 12 years postdetection perspective. Environ. Microbiol. 20: 1302-1329.
[https://doi.org/10.1111/1462-2920.14103]

-
Martin, S. J. 2001. The role of Varroa and viral pathogens in the collapse of honeybee colonies: a modeling approach. J. Appl. Ecol. 38: 1082-1093.
[https://doi.org/10.1046/j.1365-2664.2001.00662.x]

- Park, B., Y. S. Choi, E. J. Kang, H. Park, F. Olga and D. Kim. 2020. Analysis of royal jelly production status against establishment of smart farm system in Korea. JKITS 15: 845-853.
-
Shen, M., L. Cui, N. Ostiguy and D. Cox-Foster. 2005. The role of Varroa mites in infections of Kashmir bee virus (KBV) and deformed wing virus (DWV) in honey bees. Virology 342: 141-149.
[https://doi.org/10.1016/j.virol.2005.07.012]

-
Yongsawas, R., V. Chaimanee, J. S. Pettis, H. F. Boncristiani Junior, D. Lopez, A. In-On, P. Chantawannakul and T. Disayathanoowat. 2020. Impact of Sacbrood Virus on Larval Microbiome of Apis mellifera and Apis cerana. Insects 13: 439-452.
[https://doi.org/10.3390/insects11070439]