비글 개에서 프로폴리스가 나타내는 면역반응
Abstract
The objective of this study was to determine the immunological effect of honeybee propolis in beagle dogs based on peripheral mononuclear cell proliferation assay, cytokine assay, and T cell/B cell ratio. Total ten beagle dogs were assigned to this experiment. To investigate the immunological effect of honeybee propolis in beagle dogs, we performed oral administration of propolis (5%) for 8 weeks. Among ten beagle dogs, three beagle dogs were randomly allocated to the control group which were fed only regular fodder, and another three dogs were assigned as the treatment group which were fed regular fodder and 10 g of propolis (5%). The other four dogs were assigned as treatment group which were fed regular fodder and 40g of propolis (5%). After 8 weeks of administration of propolis, there were significant change in PBMC proliferation and cytokine density. There was no significant change in T cell and B cell ratio. This study showed that oral consumption of honeybee propolis cause immunological effects in beagle dogs.
Keywords:
Honeybee propolis, Beagle dogs, Lymphocyte, Cytokine, Immunological response서 론
프로폴리스 (propolis)는 식물들이 잎, 열매, 새싹을 보호하기 위해 분비하는 수지성 화합물을 꿀벌이 채취하여 꿀벌의 침의 효소와 혼합함으로 만든 황갈색 또는 암갈색 물질로 천연항생물질로 알려져 있으며 (Chung et al., 2010), polyphenol, flavonoid, phenolic acid, ester, phenolic aldehyde, ketone, wax, 수지, 화분, 비타민, 미네랄 등이 함유되어 있고 (Son, 2003), 젖소의 유방염 관리를 위한 연고, 돼지의 호흡기 및 소화기 질병 예방, 오리의 장티푸스 예방과 상처 치료, 개의 종양 치료, 각종 세균 감염, 곰팡이 감염, 기생충 감염 치료 및 백신 보조제로도 널리 사용되고 있다 (Kang, 2019). 그리스어로 before를 뜻하는 pro와 city를 의미하는 polis의 합성어인 propolis (Heo et al., 2015)는 항산화 기능과 항바이러스 효과도 있고 (Kim et al., 2019), 약리학적 그리고 면역학적인 잠재력을 인정받으며 다양한 연구에 사용되고 있으며 (Lílian et al., 2012), 스트레스에 대한 효과 (Kim et al., 2022)도 있다. 최근 국내 반려동물 문화가 급성장하는 추세에 발맞추어, 이번 연구에서는 그동안 개의 종양치료제 (Kang, 2019)로 사용된다는 꿀벌의 프로폴리스에 대해 실제 개에서의 면역반응을 확인하고자, 프로폴리스 농축액을 비글 개에게 투여한 후 투여된 개체의 면역반응을 기록하여 대조군과 투여군 간에 면역 지표의 차이를 평가하고자 하였다.
재료 및 방법
1. 실험물질 및 실험동물
실험용 프로폴리스 농축액은 아미아스 (Seoul, Korea)에서 공급한 농도 5%의 농축액으로 실온 보관하면서 사용하였고, 실험용 비글 개 (beagle dogs) (Kang, 2019; Nam et al., 2018)는 동물실험윤리위원회 (IACUC, Institutional Animal Care and Use Committee)에서 승인받았으며 (SNU-190102-2), Raon Bio Animal, Inc. (Yongin, Gyeonggi-do, Korea)에서 디스템퍼바이러스, 파보바이러스, 코로 나바이러스에 대한 백신 접종을 완료한 12~36개월 령, 7~10 kg 체중의 실험동물로 공급받았다. 개들은 X-ray, 초음파, 혈액 검사 결과 건강한 동물임을 확인하고 사용하였다.
실험동물 사육환경은 25℃, humidity 50%, 12 hrs 조명주기를 유지하였고, 1마리씩 cage에 수용하였으며, 하루에 두 번씩 동일한 일반 사료를 급여하였다.
비글 개는 3그룹으로 나누었고, 3마리는 1개의 대조군으로, 3마리는 5% 프로폴리스 농축액 10 g의 급여군으로, 또 다른 4마리는 5% 프로폴리스 농축액 40 g 급여군으로 각각 배정하였다. 3개 그룹의 비글에게 하루 한 번 동일 시간에 프로폴리스 농축액을 8주간 경구 투여하였으며, 투여 전, 투여 4주 후, 투여 8주 후에 각각 혈액을 채취하였다.
2. 말초혈액단핵세포 (peripheral blood mononuclear cells, PBMCs)의 증식능 평가
프로폴리스 농축액 경구 투여 후 0주, 4주, 8주차에 각각 12시간의 절식 후 24-guage needle을 사용하여 jugular vein에서 채혈하였고, PBMC 분리를 위해 5 mL의 혈액과 동일한 양의 PBS로 혼합한 다음 세포를 분리하기 위해 밀도 기울기를 형성하는 물질인 Ficoll gradient of Ficoll-Paque PLUS density gradient media (GE Healthcare company, Illinois, USA) 15 mL가 담긴 50 mL 튜브 위에 조심스럽게 띄워주고 샘플이 담긴 50 mL 튜브를 원심분리 (2,000 rpm/30min)하였다. 분리된 세포 washing을 위해 새로운 PBS 용액이 담긴 튜브로 옮겨 원심분리 (1,500 rpm/15 min)하고, 분리된 PBMC는 Roswell Park Memorial Institute-1640 medium (RPMI-1640 medium) (Thermo Fisher Scientific company, Massachusetts, USA)과 20% fetal bovine serum (FBS) (PAN biotech company, Germany) 에 혼합해 주었다.
비글 개의 혈액에서 분리된 PBMC는 96 well plates (SPL Life science company, Pocheon, Gyeonggi-do, Korea)에 심어, 200 μL RPMI-1640과 200 μL 20% FBS 그리고 10 ng/mL recombinant canine IL-2 (interleukin-2) protein (R&D systems company, Yongin, Gyeonggi-do, Korea)과 함께 CO2 incubator (37℃, 5% humidity)에서 1주일간 배양되었다. 2~3일 간격으로 100 μL의 세포 상층액을 버리고 새로운 200 μL RPMI-1640과 200 μL 20% FBS, recombinant canine IL-2 (10 ng/mL) 혼합물을 100 μL씩 넣어주었다. 증식능은 제공된 매뉴얼에 따라 D-Plus CCK Cell viability assay kit (Donginbio company, Seoul, Korea)로 측정하여 450 nm의 흡광도에서 확인하였다.
3. 세포분열촉진물질 (mitogen) 증식능 평가
또한, 비글 개의 혈액에서 분리된 PBMC를 96 well plate에서 200 μL RPMI-1640과 200 μL 20% FBS 혼합물에 풀어주었고, recombinant canine IL-2 (10 ng/mL), lipopolysaccharides (LPS) (50 ng/mL, Sigma-Aldrich, St. Louis, MO, USA)로 자극시켜 CO2 incubator (37℃, 5% humility)에서 배양하였다. 24시간 후, 상층액을 얻은 다음 원심분리 (7,500 rpm/10 min)하여 불순물을 제거하였다.
Recombinant canine IL-2 (10 ng/mL), LPS (50 ng/mL)로 24시간 동안 자극시켜 배양한 PBMC 상층액에서 canine tumor necrosis factor-alpha (TNF-alpha), interleukin-1 beta (IL-1 beta) 그리고 interferon-gamma (IFN-gamma)를 각각 quantikine colorimetric sandwich ELISA kit (R&D systems company, Yongin, Gyeonggi-do, Korea)를 이용하여 공급자들의 권고에 따라 측정하였다.
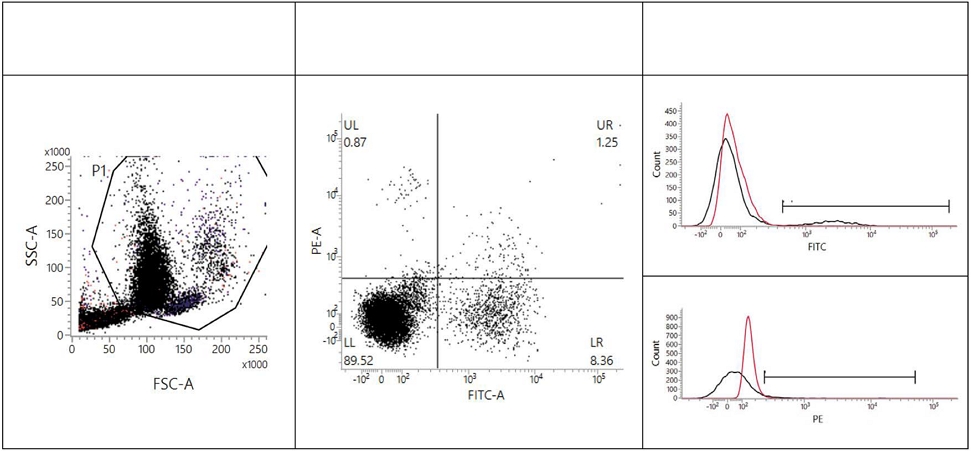
4. B cell과 T cell의 분포 평가
프로폴리스 급여 0, 4, 8주 후 비글 개의 혈액에서 105 cell/mL 이상으로 분리된 PBMC 세포를 PBS로 2번 세척한 후, 원심분리 (1,200 rpm/5 min)하여 다른 100 μL의 PBS 위에 부유시켰다. 50 μL는 unstained 상태로 두고, 나머지 50 μL는 B cell marker인 CD21 antibody와 T cell marker인 CD3 antibody를 넣고 얼음 위에서 반응시켜 염색하였다. PBS로 다시 2번 세척한 후 2% paraformaldehyde (PFA) solution (Sigma Aldrich, St. Louis, USA)을 넣어 10분간 고정시키고 PBS로 2번 세척한 다음 PBS를 담아 부유시켜 차광상태에서 보관한 다음 FACS Calibur (BD Biosciences, California, USA)를 사용하여 평가하였다.
5. 통계 분석
본 실험에서 얻은 결과 자료는 평균±표준편차로 표기하였다. 검사 결과 자료에 대한 통계 분석은 IBM® SPSS® version 25 (SPSS, IBM, New York, USA)를 이용하여 Student t-test를 실시 (P<0.05)하였다.
결 과
1. 말초혈액단핵세포 (PBMC) 증식능 평가 결과
프로폴리스를 투여하지 않은 대조군의 림프구 증식능은 0주차에 1.02±0.06이었고 10 g의 프로폴리스를 투여한 처치군은 1.16±0.08이었으며, 40 g의 프로폴리스를 투여한 처치군은 1.34±0.27이었다. 프로폴리스 투여 4주차에 대조군의 림프구 증식능은 0.80±0.16이고 10 g 투여 처치군은 0.97±0.06, 40 g 투여 처치군은 1.29±0.07로 0주차의 증식능과 유의성 있는 차이는 없었다. 8주차의 대조군은 0.73±0.13인 반면 10 g 투여 처치군의 림프구 증식능은 1.11±0.13이고, 40 g 투여 처치군은 2.03±0.19로 0주, 4주차의 증식능에 비해 유의성 있는 차이를 보여 대조군에 비해 mitogen에 자극되었을 때 증식능이 더 커진 것을 확인할 수 있었다 (Table 1).
2. 세포분열촉진물질 (mitogen) 증식능 결과
측정된 TNF-alpha는 프로폴리스 투여 0주차의 대조군이 81.02±4.00이었고 10 g을 투여한 처치군이 85.81±10.61이었으며, 40 g을 투여한 처치군이 73.72±10.79로, 유의성 있는 차이는 없었다. 투여 4주차에는 대조군은 83.88±7.31이었던 반면 10 g 투여 처치군은 67.54±23.48이고 40 g 투여 처치군은 162.31±31.37로 40 g 투여군에서 TNF-alpha 생산의 유의성 있는 차이를 보였다. 투여 8주차에 대조군은 121.70±31.09였고, 10 g 투여군은 128.39±11.17인 반면, 40 g 투여군은 286.44±30.61로 40 g 투여군에서 유의성 있는 차이를 보였다 (Table 2, Fig. 1).

Cytokine levels of beagle species dogs after feeding honeybee propolis concentration solution by quantikine colorimetric sandwich ELISA kit
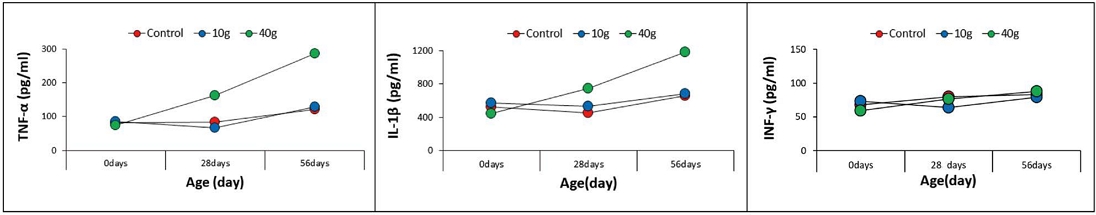
Cytokine levels of beagle species dogs after feeding honeybee propolis concentration solution by quantikine colorimetric sandwich ELISA kit.
IL-1-beta는 0주차에 대조군이 526.13±84.53이었으며 10 g 투여군이 570.37±135.84이고, 40 g 투여군이 444.50±80.74였고, 유의성 있는 차이가 없었다. 프로폴리스 투여 4주차에 대조군은 456.15±46.70이었고, 10 g 투여군은 533.19±11.06, 40 g 투여군은 747.79±104.5로, 40 g 투여군에서 IL-1-beta 생산의 유의성 있는 차이를 보였다. 프로폴리스 투여 8주차에 대조군의 수치는 656.88±109.29, 10 g 투여군은 683.71±69.84, 40 g 투여군은 1182.88±155.29로, 역시 40 g 투여군에서 IL-1-beta 생산의 유의성 있는 차이를 보였다 (Table 2, Fig. 1).
IFN-gamma 측정 결과 프로폴리스 투여 0주차에는 대조군의 수치가 67.98±18.78, 10 g 투여군이 72.88±17.82, 40 g 투여군은 58.95±5.08이었다. 투여 4주차의 결과는 대조군이 79.66.±12.07, 10 g 투여군이 63.69±17.12, 40 g 투여군은 76.31±14.53이었다. 투여 마지막인 8주차에 대조군은 82.93±12.37, 10 g 투여군은 79.39±27.73, 40 g 투여군은 87.52±15.49였다. IFN-gamma 생산의 유의성 있는 차이는 세 가지 군에서 모두 없었다 (Table 2, Fig. 1).
3. B cell과 T cell의 분포 결과
Flow cytometry 방법을 통하여 평가한 항체는 각 개체와 그룹에서 B cell과 T cell의 비율이 유의성 차이 없이 비슷하게 유지되어 정상 면역이 유지되는 것을 확인할 수 있었다 (Fig. 2).
고 찰
비글 개에 프로폴리스 경구 투여 이후 면역반응이 유도되었는지를 확인하였다. 실험용 비글 개를 사용한 이유는 최근 국내 반려동물 문화가 급성장하는 추세에 따라, 개의 종양치료제 (Kang, 2019)로 사용된다는 꿀벌의 프로폴리스에 대해 실제 개에서의 면역반응을 확인하는 목적도 있었고, 인삼 추출물이나 홍삼 추출물 등을 비글 개에게 투여 (Nam et al., 1918)하여 유의할 독성이 없었고, 부작용이 없었으며, 만성독성도 없었다는 보고를 참고하였으며, 이러한 목적을 위하여 말초혈액단핵세포 (PBMC), 세포분열촉진물질 (mitogen) 즉, 림프구와 cytokine (TNF-alpha, IL-1-beta, IFN-gamma) 농도, B cell과 T cell의 분포도를 대조군과 비교 분석하였다. 비글 개에 대해서 꿀벌의 프로폴리스 첨가에 대한 논문 보고는 처음이며, 전체적인 실험에서 무처리군과 프로폴리스 처리군만으로 실험을 수행하는 점을 보완하고자 프로폴리스 처리군은 10 g 처리군으로 하고, 양성대조군은 40 g 투여군을 사용함으로 대체하였는데, 이는 이미 증명된 비글 개에 대한 양성대조군이 없었기 때문이었다.
프로폴리스 추출물의 비글 개에 대한 섭취량 설정의 근거는 인삼 추출물의 아만성 독성 실험에서 인삼 추출물을 최대 15 mg/kg의 용량으로 비글 개에 투여 (Nam et al., 1918)한 점과, 홍삼 추출물의 아급성 독성 실험에서의 비글 개에 대한 투여 용량 (2 g/kg/day, 4 weeks, p.o.) (Nam et al., 1918) 그리고 만성 독성 실험에서의 비글 개에 대한 투여 용량 (375 mg/kg, p.o.) (Nam et al., 1918) 등을 근거로 하였다.
말초혈액단핵세포 (PBMC)는 B 세포, T 세포, NK 세포 (Natural Killer cells), 단핵구로 구성되어 있어서 면역계에 선택적인 반응을 일으키는 면역 세포들이다 (Jalal and Ahmad, 2015). 세포분열촉진물질 (mitogen)은 Concanavalin A (Con A), polyhydroxyalkanoate (PHA) 그리고 LPS 등이 있으며 림프구의 세포막 표면의 막 수용기에 결합하여 해당 세포의 DNA 합성 및 세포 분열을 야기하는 물질이다. Con A는 원래 jack bean (Canavalia ensiformis)에서 추출한 lectin (탄수화물 결합 단백질)이고, PHA는 미생물 세포에 축적되는 열가소성 천연 폴리에스터 중합체이며, 퇴비화되고 최종적으로는 유독성 폐기물을 발생시키지 않고 이산화탄소, 물, 유기성 폐기물로 분해될 수 있는 생분해성 물질이며, LPS는 그람 음성 균 외벽의 주성분으로 면역계의 강력한 활성제로 패혈성 쇼크와 같은 병리학적 반응을 유도할 수 있다.
꿀벌의 프로폴리스가 PBMC의 면역기능을 변화하고 통제하는 역할을 하는 것은 Toll-like receptor (TLR)와 같은 항원 인식 수용체에 영향을 미쳐 병원체 관련 분자 패턴을 인식하는 데 도움을 주고 결과적으로 외부에서 들어온 병인체 박멸을 용이하게 하기 때문이다 (Rezzan and Seyda, 2018). 이번 연구에서는 8주차에 40 g 투여군이 대조군에 비해 mitogen에 자극에 대한 림프구 증식능이 유의한 차이를 보였는데 프로폴리스가 개에서도 PBMC 증식능에 영향을 미친다는 것을 알 수 있었다 (Tables 1, 2, Fig. 1).
본 실험에서는 사이토카인으로 TNF-alpha, IL-1-beta, IFN-gamma를 각각 측정하였다. TNF-alpha의 주요 역할은 면역 세포 조절인데 체내 발열원으로 작용하거나 세포 자살 등을 유도한다. 종양괴사인자로 염증반응 중에서 급성기 반응에서 관찰된다. TNF-alpha는 주로 대식세포가 활성화되면서 분비되는데 T 세포, NK 세포 등에서도 분비된다 (Liu et al., 1994). 본 연구에서는 4주와 8주차에 40 g 투여군이 대조군에 비해 유의성 있는 차이를 보였는데 (Table 2, Fig. 1), 이는 프로폴리스에 의해 증식된 림프구가 많아져 TNF-alpha 분비에도 영향을 미친 것으로 보인다. IL-1-beta는 전염성 사이토카인 (pro-inflammatory cytokine)으로 감염이나 손상에 대한 염증 반응의 주요 조절 인자이다. IL-1-beta는 다양한 세포로부터 생산되는데 그중 단핵구와 대식세포가 대표적이다 (Lopez-Castejon and Brough, 2011). IL-1-beta는 4주와 8주차에 40 g 투여군이 대조군에 비해 유의미한 차이를 보였으며 이는 TNF-alpha와 마찬가지로 프로폴리스에 의해 증식된 단핵구의 영향으로 보인다. IFN-gamma는 면역세포 활성화에 기여하는데 NK 세포 및 T 세포로부터 분비되고, T 세포에 의한 적응 면역반응의 매개역할을 하는 것으로 알려져 있다 (Baumjohann and Ansel, 2013). 이번 실험에서는 프로폴리스 투여군과 대조군 간에 IFN-gamma 생산은 유의미한 차이가 관찰되지 않았다.
T 세포는 항원 특이적인 적응 면역을 주관하는 림프구 중에 하나이고, B 세포는 림프구 중 항체를 생산하는 세포로 면역반응에서 외부로부터 침입하는 항원에 대항하는 항체를 만들어낸다. 개 혈액에서의 T cell과 B cell 비율은 3 : 1 또는 4 : 1 정도 수준에서 유지가 되는데 (Galler et al., 2017) 이번 실험에서도 유의적 차이 없이 정상 면역이 유지되는 것을 확인할 수 있었다.
이번 연구를 통하여 프로폴리스가 면역체계를 조절할 수 있다는 것이 확인되었다. 프로폴리스가 단핵구나 대식세포를 활성화시킬 수 있다는 것 또한 보고되었다 (Eyng et al., 2015). 이외에도 프로폴리스는 각종 사이토카인을 조절하기도 하고 백신 보조제로 쓰여 항체 생성을 촉진하기도 한다. 또한, 프로폴리스는 특정 림프구를 감소시키는 성질도 있기 때문에 항염증 작용을 위해 쓰이기도 한다 (Ashry and Ahmad, 2012). 프로폴리스는 면역학적인 가치가 높은 천연 약제로 영향을 미쳐왔다. 본 실험을 통하여 프로폴리스가 개에서 면역학적 효과가 있는 것이 확인되었다. 앞으로 수의학 분야에서도 비임상학적 및 임상학적 연구를 통하여 프로폴리스의 면역학 효과를 좀 더 과학적으로 밝혀 특정 감염성 질병 등에 응용될 것으로 전망된다.
적 요
이번 실험에서 비글 개에게 투여한 프로폴리스는 10 g 투여할 때는 대조군과 유의미한 차이가 없었지만, 40 g 투여할 때는 유의미한 차이를 보였으므로, 이를 통하여 투여 양에 따라 프로폴리스의 면역학적인 효과가 달라진다는 것을 알 수 있었다. PBMC 증식능이 프로폴리스 40 g 투여군에서 대조군과 유의한 차이를 보였다는 점에서 면역학적인 효과가 있다는 것을 확인하였고 사이토카인 또한 TNF-alpha, IL-1-beta의 경우 그 농도가 높아졌다는 점에서 프로폴리스의 면역학적인 효과를 확인해 볼 수 있었다. B cell과 T cell의 분포는 유의성 없이 유지되었다는 점에서 프로폴리스가 비정상적인 면역반응이 아닌 정상적인 면역반응을 유도한다는 것을 입증하였다.
References
-
Ashry, E. and T. A. Ahmad. 2012. The use of propolis as vaccine’s adjuvant. Vaccine 31(1): 31-39.
[https://doi.org/10.1016/j.vaccine.2012.10.095]

-
Baumjohann, D. and K. M. Ansel. 2013. Micro RNA-mediated regulation of T helper cell differentiation and plasticity. Nature 13(9): 666-678.
[https://doi.org/10.1038/nri3494]

- Chung, N. K., Y. C. Cho, C. S. Ha and H. S. Kim. 2010. Hypoglycemic effects of nano powder propolis on streptozotocin-induced diabetic rats. Korean J. Vet. Serv. 33(2): 199-206.
-
Eyng, C., A. E. Murakami, T. C. Santos, T. G. V. Silveira, R. B. Pedroso and D. A. L. Lourenço. 2015. Immune responses in broiler chicks fed propolis extraction residue-supplemented diets. Asian Australas J. Anim. Sci. 28(1): 135-142.
[https://doi.org/10.5713/ajas.14.0066]

-
Galler, A., B. C. Rutgen, E. Haas, A. Saalmuller, R. A. Hirt, W. Gerner, I. Schwendenwein, B. Richter, J. G. Thalhammer and N. Luckschander-Zeller. 2017. Immunophenotype of peripheral blood lymphocytes in dogs with inflammatory bowel disease. J. Vet. Intern. Med. 31(6): 1730-1739.
[https://doi.org/10.1111/jvim.14812]

-
Heo, G. J., T. G. Won and G. W. Shin. 2015. In vitro antimicrobial activity of Korean propolis against fish pathogenic bacteria. Korean J. Vet. Serv. 38(2): 65-70.
[https://doi.org/10.7853/kjvs.2015.38.2.65]

- Jalal, P. and S. Ahmad. 2015. Isolated human peripheral blood mononuclear cell (PBMC), a cost effective tool for predicting immunosuppressive effects of drugs and xenobiotics. Iran J. Pharm. Res. 14(4): 979.
- Kang, I. 2019. Safety test for propolis in beagle dogs based on hematology and serum biochemistry analysis. Korean J. Vet. Serv. 42(4): 305-311.
- Kim, J. Y., I. S. Choi, A. J. Ann, H. J. Jeong, M. S. Jang, Y. K. Cho and Y. H. Kim. 2019. Reduction effect of bee disease caused by propolis feeding in beekeeping farm. Korean J. Vet. Serv. 42(2): 85-92.
-
Kim, S. K., H. Y. Kim, S. G. Kim, S. M. Han, S. Ryu and S. O. Woo. 2022. The inhibition effect of Korean propolis on microtubule polymerization disassembly caused by endoplasmic reticulum (ER) stress. J. Apic. 37(1): 75-82.
[https://doi.org/10.17519/apiculture.2022.04.37.1.75]

- Lílian, F., F. Paula, C. Clarissa, S. Bianca, M. Lívia, V. Gilberto, F. Geferson and H. Silvia. 2012. Effect of the ethanolic extract from green propolis on production of antibodies after immunization against canine parvovirus (CPV) and canine coronavirus (CoV). Braz. J. Vet. Res. Anim. Sci. 49(2): 116-121.
-
Liu, T., R. K. Clark, P. C. McDonnell, P. R. Young, R. F. White, F. C. Barone and G. Z. Feuerstein. 1994. Tumor necrosis factor-alpha expression in ischemic neurons. Stroke 25(7): 1481-1488.
[https://doi.org/10.1161/01.STR.25.7.1481]

-
Lopez-Castejon, G. and D. Brough. 2011. Understanding the mechanism of IL-1β secretion. Cytokine Growth Factor Rev. 22(4): 189-195.
[https://doi.org/10.1016/j.cytogfr.2011.10.001]

- Nam, K. Y., B. W. Yang, S. S. Wang and J. D. Park. 2018. A comprehensive review of the comparative studies of Korean (Panax ginseng) and American (Panax quinquefolium) ginsengs on the thermogenic response. Kor. J. Pharmacogn. 49(3): 203-218.
-
Rezzan, A. and K. Seyda. 2018. Therapeutic effects of propolis: review article. Chem. Sci. Int. J. 24(2): 1-6.
[https://doi.org/10.9734/CSJI/2018/44457]

- Son, Y. R. 2003. Studies on the antimicrobial effect of extracts of propolis. J. Fd. Hyg. Safety 18(4): 189-194.