꿀벌 영양학의 최신 연구 동향
Abstract
Honey bees play a vital role as a major pollinator in both natural and agricultural ecosystems. In recent years, we have witnessed an alarming decline in honey bee populations worldwide, which poses a threat to global food security. The health and welfare of honey bees are heavily dependent upon the supply of an adequate amount and balance of macro- and micronutrients at both individual and colony level. Failing to achieve this nutrient target engenders nutritional stresses, which are thought to be one of the main factors driving the decline in honey bees and other pollinators. Besides their direct effects, nutritional stresses can seriously compromise health and fitness in honey bees through interacting with other types of biotic and abiotic stresses, such as pathogens or parasites, pesticides, climate extremes, etc. To cope with this ongoing honey bee crisis, there have been growing efforts to advance our basic knowledge of nutritional physiology and ecology of honey bees. Despite such increasing interests, our complete understanding of nutrition in honey bees has been hampered by the lack of an appropriate method that can deal with the multidimensional, interactive, and dynamic nature of nutrition. The Nutritional Geometry (NG) is a powerful, state-space modelling framework that is developed to visually analyze highly complex nutritional dataset in n-dimensional Euclidean space. The major objective of this review is to provide a comprehensive overview of the recent developments in honey bee nutritional research, which have been mainly achieved through the application of this novel framework. We first start this review by highlighting the importance of nutrition in the health and fitness in honey bees, especially in the context of their recent global crisis. Before introducing the key concepts and principles of NG, we outline the current status and limitations of conventional honey bee nutritional research and explain how NG has paved a new path towards understanding their nutritional biology from a multidimensional perspective. In the main body of this review, we summarize the key discoveries and implications drawn from recent studies that have explored the impacts of macronutrient balance on health in honey bees. Finally, we discuss how NG can further deepen our understanding of colony-level nutritional homeostasis in honey bees and also how this approach will help us to develop nutritional interventions that can mitigate and, hopefully, stop the honey bee population decline.
Keywords:
Apis mellifera, Macronutrient, Nutrient balance, Nutritional Geometry머리말
꿀벌 (Apis mellifera)은 주요 화분매개자로서 생태계에서 핵심적인 역할을 담당한다. 하지만 현재 꿀벌은 전 세계적으로 개체 수가 급격하게 감소하는 등 심각한 위기에 봉착해 있다. 이러한 꿀벌의 위기는 농업 생산성의 감소로 이어질 것이며, 이는 곧 인류의 식량 위기로 직결된다. 꿀벌 개체 수 감소를 일으키는 주요 요인으로 기후변화, 서식지 감소와 파편화, 질병, 살충제 남용 등과 같은 다양한 요인들이 거론되고 있다 (Potts et al., 2010; Vanbergen and the Insect Pollinators Initiative, 2013). 본 총설은 이러한 다양한 요인 중 먹이 부족과 영양 불균형으로 야기된 영양 스트레스가 꿀벌이 당면하고 있는 이러한 위기에 어떻게 직·간접적으로 영향을 미치는지를 살펴보고, 지난 반세기 동안 축적된 꿀벌 영양학 연구의 주요 성과와 한계에 대해 검토할 것이다. 또한 본 총설은 최근 곤충 영양학의 혁신적인 연구 방법론으로 부상하고 있는 “영양 기하학 (Nutritional Geometry)”의 기본 개념과 원리를 간단히 설명하고, 이러한 최신 방법론이 꿀벌 영양학 연구에 어떻게 적용되고 있는지를 구체적인 사례를 중심으로 소개하고자 한다. 마지막으로 본 총설은 꿀벌 영양학의 주요 현안과 과제, 그리고 전망에 대해 논의할 것이다.
영양의 중요성
영양은 모든 생명 활동의 근간이 되며, 모든 생물은 적절한 영양 공급을 통해 생명을 유지하고, 다음 세대에 자신의 유전자를 남길 수 있다. 이러한 영양의 중요성은 꿀벌에게도 예외 없이 적용되며, 꿀벌 개체와 봉군의 건강과 생존을 위해서는 충분한 양과 양질의 먹이자원 공급이 그 무엇보다 중요하다.
꿀벌의 주 먹이원은 화밀과 화분이다 (Brodschneider and Crailsheim, 2010). 화밀은 꿀벌에게 비행 에너지원인 탄수화물을 제공한다. 반면 꿀벌은 화분을 통해 단백질과 아미노산, 지방, 비타민, 그리고 각종 미네랄 등을 공급받는다. 먹이자원 부족과 같은 여러 가지 환경적 제약으로 인해 충분한 양과 질의 영양분을 공급받지 못할 경우, 꿀벌은 영양 스트레스 (nutritional stress)를 받게 되며, 이는 성장 둔화, 수명 단축, 생식 능력 저하 등과 같은 적응도 감소로 이어진다. 꿀벌이 당면하는 가장 일반적인 영양 스트레스로는 먹이 부족으로 인한 기아 (starvation)가 있다. 호주와 미국에서 수행된 일련의 조사에 따르면, 월동기에 충분한 양의 탄수화물을 비축하지 못한 봉군은 기아 상황에 노출될 가능성이 크며, 이러한 영양 부족 상태는 질병 및 살충제 등과 같은 다른 요인들과의 상호작용을 일으키며 월동기 봉군 폐사의 주요 원인이 된다 (Brodschneider et al., 2010). 먹이 부족 외에도, 영양 스트레스는 단조로운 식단 (monotonous diet)으로 인한 영양 불균형에 의해서도 야기될 수 있다. 자연 상태에서 꿀벌은 여러 식물 종의 화분을 섭취하며, 다양한 화분의 혼식 (pollen mixing)을 통해 영양 균형 (nutritional balance)을 맞추는 것으로 알려져 있다 (Brodscheider and Crailsheim, 2010). 하지만 현재 전 세계적으로 시행되고 있는 집약적 농업은 단일 작물을 대량으로 재배함으로써 꿀벌 먹이자원의 다양성을 감소시키고 있으며, 이는 결국 꿀벌의 심각한 영양 불균형을 일으키는 원인이 되고 있다 (Schmidt et al. 1995; Goulson et al., 2015).
봉군 붕괴 현상 (Colony Collapse Disorder, CCD)으로 대표되는 꿀벌의 위기를 일으키는 원인으로 현재 여러 가지 요인들이 지목되고 있는데 (VanEngelsdorp et al., 2009), Goulson et al. (2015)은 그중 가장 중요한 요인으로 1) 질병, 2) 합성 살충제, 그리고 3) 먹이자원 고갈 및 영양 스트레스를 꼽았다 (Fig. 1). 일반적으로 네오니코티노이드 (neonicotinoid)계 살충제 남용과 질병 감염이 꿀벌 감소의 가장 큰 원인이라고 널리 인식되어지고 있지만, Goulson et al. (2015)의 분석에 따르면, 이러한 3가지 주요 요인들은 모두 긴밀하게 연결되어 있으며, 이들 간에 일어나는 상호작용이야말로 꿀벌의 감소를 가속하는 가장 근본적인 원인이라 할 수 있다. 실제로 Di Prisco et al. (2013)의 연구에 따르면, 클로티아니딘 (clothianidin) 및 이미다클로프리드 (imidaclopird)와 같은 네오니코티노이드 살충제는 직접적인 살충효과 외에도, 꿀벌의 면역력을 억제시키는 것으로 보고되었으며, 이러한 면역력 약화는 결국 날개불구병 바이러스 (deformed wing virus)의 증식으로 이어지는 것으로 확인되었다.
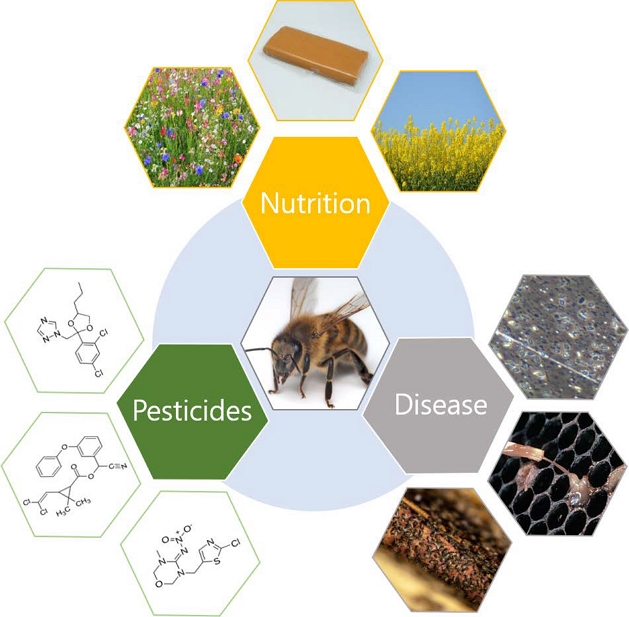
Three major stressors that have profound and interacting effects on honey bee health (Goulson et al., 2015).
영양은 이와 같은 상호작용들의 핵심적인 고리의 역할을 담당한다. 영양 스트레스는 꿀벌 개체와 봉군에 미치는 직접적인 영향 외에도 (Naug, 2009), 꿀벌의 면역기능을 약화시킴으로써 꿀벌이 질병에 더 취약하도록 만든다 (Alaux et al., 2010). 일련의 연구 결과에 따르면, 영양 상태가 좋지 못한 꿀벌은 정상적인 꿀벌보다 노제마병 감염으로 인한 사망률이 더 높다 (Anderson and Giacon, 1992; Di Pasquale et al., 2013; Jack et al., 2016). 영양 스트레스는 꿀벌의 살충제에 대한 내성과 해독작용 또한 약화시키는 것으로 밝혀졌다 (Schmehl et al., 2014). 최근 연구에 따르면, 영양적 질이 나쁜 화분을 섭취한 꿀벌이 양질의 화분을 섭취한 꿀벌에 비해 살충제 노출에 의한 사망률이 더 높은 것으로 나타났는데, 이는 살충제 해독 효소의 활성이 저하되었기 때문에 일어난 현상이다 (Barascou et al., 2021). 이상과 같이 영양 부족과 불균형으로 발생하는 영양 스트레스는 다양한 직·간접적인 경로를 통해 꿀벌 개체와 봉군의 건강에 심대한 영향을 미치는 요인이라 할 수 있다.
기존의 꿀벌 영양 연구
꿀벌 영양학의 체계는 1950년대부터 70년대에 걸쳐 정립되었으며 (De Groot, 1953; Haydak, 1970), 이후 꾸준히 발전하여 현재에 이르고 있다. 꿀벌은 개체와 봉군의 생존과 번식을 위해 단백질, 탄수화물, 지방, 비타민, 미네랄, 수분 등과 같은 다양한 영양소를 동시에 요구한다. 꿀벌 영양학 연구는 특히 단백질과 탄수화물 같은 거대 영양소가 개체의 발육과 수명 그리고 봉군의 성장에 미치는 영향을 분석하는 것을 중심으로 수행되었다. 꿀벌 영양학의 최신 연구 경향을 소개하기에 앞서, 본 장은 탄수화물과 단백질 섭식이 꿀벌에 미치는 영향에 대한 그동안의 연구 성과를 간략히 살펴볼 것이다 (Brodschenider and Crailsheim, 2010; Wright et al., 2018).
탄수화물은 성충의 주된 비행 에너지원으로 사용되며, 꿀벌 성충은 하루 평균 11 mg의 당을 섭취해야 한다. 이를 5만 마리 봉군 기준으로 환산해 본다면, 봉군당 하루 평균 1.1 L의 50% 설탕 시럽을 소모한다는 것을 의미한다 (Huang, 2010). 꿀벌은 자신이 필요로 하는 탄수화물의 대부분을 화밀 (nectar)을 통해 공급받는다. 화밀의 탄수화물 함유량은 대략 10~70%이며, 설탕, 포도당 그리고 과당으로 구성되어 있다. 꿀벌이 선호하는 화밀의 탄수화물 농도는 대략 30~50% 정도로 알려져 있다 (Wright et al., 2018). 화밀은 외역봉에 의해 수집되며, 소낭 (crop)에 저장된 체 운반된다. 소낭에 저장된 화밀은 인버타제 (invertase)와 포도당 산화효소 (glucose oxidase)에 의해 1차적인 화학적 전환과정을 거치게 된다. 이렇게 전환된 화밀은 벌집에서 내역봉에게 인계되고, 내역봉은 이를 벌집 방에 안치한다. 이때 내역봉은 선풍 작업이나 반복적으로 되새김하는 과정을 통해 벌집 방에 안치된 꿀의 수분을 20% 이하로 낮추는 작업을 수행하며, 이렇게 농축된 벌꿀은 이후 벌방에 밀봉되어 저장된다.
단백질은 동물의 체조직을 구성하며, 호르몬, 효소, 항체 등의 중요 생체기능을 담당한다. 따라서 꿀벌 유충의 원활한 성장, 성충의 비행 근육 (flight muscle) 및 하인두샘 (hypopharyngeal gland)의 발달, 그리고 여왕의 산란을 위해서는 충분한 양의 단백질 공급이 전제되어야 한다. 화분은 꿀벌에게 있어 가장 중요한 단백질 원이며 (Keller et al., 2005a), 특히 꿀벌은 화분 섭식을 통해서만 필수 아미노산 (essential amino acid)을 획득할 수 있다. 일벌은 하루 동안 약 3.4~4.3 mg의 화분을 소비하며 (Crailsheim et al., 1992), 한 봉군은 연간 5.6~222 kg의 화분을 수집한다 (Keller et al., 2005b). 화분은 꿀벌의 뒷다리에 달린 화분 바구니 (pollen basket 혹은 cubicula)에 의해 수집되며, 꿀 및 꿀벌의 분비물과 혼합되어 “꿀벌 빵 (bee bread)”으로 전환된다. 꿀벌 빵은 막 수집된 화분에 비해 pH가 낮으며 적은 양의 녹말을 포함하는 등 영양적으로 화분과 큰 차이를 보이는데, 이러한 변화는 꿀벌의 장내 미생물인 젖산균에 의한 발효과정을 통해 일어나는 것으로 알려져 있다 (Vásquez and Olofsson, 2009). 꿀벌 빵은 내역봉에 의해 섭취되고, 이들의 하인두샘에서 로열젤리의 단백질 성분을 합성하는 데 사용된다.
화분의 섭취는 꿀벌 개체의 발달과 수명은 물론 봉군의 성장과 존망에 결정적인 영향을 미친다. 만약 화분 공급이 부족해진다면, 내역봉의 하인두샘 발달과 로열젤리 생산은 정지되고, 육아활동과 여왕벌의 산란도 중단된다. 여왕벌의 산란 중단으로 인해 봉군에 새로운 일벌들이 충원되지 못한다면, 이는 봉군의 먹이자원 확보 감소로 이어질 것이며, 이러한 악순환이 거듭되면서 봉군은 결국 붕괴된다 (Keller et al., 2005a). 꿀벌에게 있어 얼마나 많은 양의 화분을 확보하느냐 못지않게 중요한 사항은 얼마나 영양적으로 우수한 질의 화분을 수집하느냐이다. 화분의 영양적 질을 결정하는 주 요인으로는 1) 단백질의 총 함량과 2) 필수 아미노산의 조성이 있다. 화분의 단백질 함량은 2~60%로 변동이 매우 심하며, 식물의 종 및 지역별로 큰 차이를 보인다 (Roulston et al., 2000; Keller et al., 2005a). 그동안 수행되었던 많은 연구 결과에 따르면, 화분 내 함유된 조단백질 (crude protein)량은 일벌의 수명과 양의 상관관계를 갖는 것으로 나타났다 (Schmidt et al., 1987; Di Pasquale et al., 2013). 일벌의 수명 외에도 봉군의 성장 또한 화분의 조단백질 함량에 의해 큰 영향을 받는다고 보고되었는데, Kleinschmidt and Kondos (1976)에 따르면 봉군의 지속적인 성장을 위해선 화분의 조단백질 함량이 최소 20% 이상이어야 한다.
사실 화분의 영양적 질을 결정하는데 있어 단백질 총 함량보다 더 중요하게 고려되어야 할 것은 화분의 아미노산 조성이다. De Groot (1953)에 따르면, 꿀벌은 총 10가지의 필수 아미노산을 요구하며 (Fig. 2), 그중에서도 특히 류신 (leucine), 이소류신 (isoleucine), 발린 (valine)에 대한 요구도가 높다. 이 10가지 필수 아미노산 중 1가지라도 화분에 결여되어 있다면, 아무리 단백질 총 함량이 높더라도 이 화분은 꿀벌에게 양질의 먹이가 될 수 없다. 현재까지 수행된 조사에 따르면, 대부분의 화분들은 모든 필수 아미노산을 꿀벌의 요구량 이상으로 함유하는 것으로 알려져 있다 (Keller et al., 2005a). 하지만 일부 식물의 화분에는 특정 필수 아미노산이 결핍되거나 부족한 경우도 있다. 예를 들자면, 유칼립투스, 민들레, 옥수수 화분에는 각각 이소류신 (isoleucine), 아르기닌 (arginine), 히스티딘 (histidine)이 부족하다 (Herbert et al., 1970; Somerville and Nicol, 2006; Hocherl et al., 2012). 필수 아미노산이 꿀벌의 건강에 미치는 효과에 대한 연구는 그동안 많이 수행되어 왔는데, 특히 Hendriksma et al. (2019a)의 최근 연구에 따르면, 필수 아미노산 섭취는 내역봉의 하인두샘과 외역봉의 비행 근육의 발달에 결정적인 영향을 미치는 것으로 나타났다.
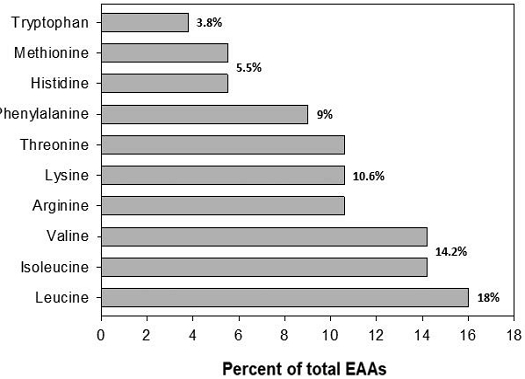
Horizontal bar chart describing the proportion of 10 essential amino acids (EAAs) required by honey bee (De Groot, 1953).
화분의 영양적 질과 관련하여 가장 주목할 만한 사실은 꿀벌의 선택적인 화분 수집 및 섭식이다. 필수 아미노산 조성이 불균형한 화분을 장기간 섭취하였을 경우, 꿀벌은 부족분의 필수 아미노산을 보충하기 위해서 영양적으로 보완되는 화분들을 선택적으로 수집하는 것으로 최근 보고되었다 (Hendriksma and Shafir, 2016). 행동생태학의 “최적 섭식 이론 (Optimal foraging theory)”의 관점에서 보았을 때, 이러한 꿀벌의 화분 선택 행동은 영양 균형을 맞춤으로써 꿀벌 자신과 봉군의 진화적 적응도 (Darwinian fitness)를 증가시키기 위한 적응적 의미 (adaptive significance)가 있을 것으로 해석된다 (Simpson et al., 2004; Raubenheimer and Simpson, 2018). 선택적 화분 섭식 못지않게 중요한 사항으로, 다양한 종류의 화분을 혼합하여 섭식하는 행동 (dietary mixing)이 꿀벌의 영양 균형과 건강에 미치는 긍정적인 효과를 언급할 필요가 있다. 지난 반세기 동안 축적된 연구 결과에 따르면 (Brodschneider and Crailsheim, 2010), 여러 종의 화분들을 혼합하여 섭식한 꿀벌이, 단일 종의 화분을 섭취한 꿀벌에 비해, 더 오래 생존하였으며 질병에 대한 면역력과 회복력도 더 높았다 (Schmidt et al., 1987, 1995; Di Pasquale et al., 2013). 특히 Alaux et al. (2010)의 연구에 따르면, 꿀벌의 사회적 면역기능과 관련된 포도당 산화효소 (glucose oxidase)의 활성도는 여러 가지 화분을 혼합하여 섭식한 처리군에서, 단일종의 화분만을 섭식한 처리군보다, 더 높게 발현되는 것으로 확인되었다. 이상과 같은 최신 연구 결과들은 한결같이 화분 다양성의 확보와 이를 통한 영양 균형 유지가 꿀벌 개체와 봉군의 건강에 얼마나 중요한지를 보여주고 있다 (Goulson et al., 2015).
영양 기하학: 개념과 원리
기존의 곤충 영양학 연구는 먹이에 함유된 단일 영양성분의 유무와 양의 차이가 곤충의 표현형에 미치는 개별적인 영향을 분석하는 것을 중심으로 수행되었다. 하지만 이러한 단순한 연구 방법으로는 영양과 같이 매우 복잡한 생물학적 현상을 분석하기에는 한계가 있다 (Simpson et al., 2015). 따라서 영양과 생물의 건강 간의 관계를 설명하는데 있어서 보다 정밀하고 효과적인 연구 방법론에 대한 요구가 꾸준히 제기되어 왔으며, 영양 기하학 (Nutritional Geometry)은 이러한 요구에 부응하기 위해 고안된 혁신적인 영양학 분석 모형이다 (Simpson and Raubenheimer, 1993, 2012). 영양 기하학의 기본 개념과 원리를 소개하기에 앞서, 영양이 갖는 복잡성과 영양 연구의 난점에 대해 간략히 설명하고자 한다.
영양 연구가 어려운 첫 번째 이유로 영양의 다차원 (multidimensional)적인 성격을 들 수 있다. 모든 생물은 생명 활동을 위해 여러 가지 거대 영양소 (단백질, 탄수화물, 지방)와 미세 영양소 (비타민, 미네랄 등)를 동시에 요구하며, 또한 생물이 섭취하는 먹이에는 다양한 영양소들이 각기 다른 비율로 혼합되어 존재한다. 이러한 사실은 수요와 공급 측면 모두, 생물은 다양한 영양적 변수를 동시다발적으로 고려해야 한다는 것을 의미한다. 두 번째로, 생물이 요구하는 영양소들은 독립적으로 작용하지 않으며, 서로 간의 복잡한 상호작용을 통해 생물 표현형에 영향을 미친다. 예를 들어 설명하자면, 개별 영양소의 효과는 음식물에 함께 함유된 다른 영양소의 양에 따라 매우 다른 양상을 보이는데, 단백질 5 g을 섭취한 효과는 그와 동시에 탄수화물을 1 g을 섭취했을 때와 5 g을 섭취했을 때처럼, 영양소들의 배합 비율이 다를 때 상이하게 나타난다 (Simpson et al., 2015). 마지막으로, 영양은 매우 가변적이고 역동적인 성격을 띤다. 자연 상태에서 영양소의 분포는 시간과 공간에 따라 항시 변하기 때문에 생물이 언제나 충분한 양과 균형의 영양소를 획득하기란 어렵다. 이러한 영양 환경의 변동성에 더하여, 생물이 최적으로 요구하는 영양소의 양과 균형은 생물의 생리적 상태, 발달 단계, 주변 환경 등에 따라 역동적으로 변화한다 (Lee et al., 2006, 2013, 2015; Rho and Lee, 2017). 꿀벌의 예를 들어 부연하자면, 벌집에서 육아를 담당하는 내역봉은 로열젤리를 생산하기 위해 많은 양의 단백질과 지방 섭식을 요구하는 데 비해, 화밀과 화분을 수집하는 외역봉은 비행을 위한 다량의 탄수화물을 필요로 한다.
영양 기하학은 1990년대 초, Stephen J. Simpson과 David Raubenheimer에 의해 최초 개발되었으며, 영양성분들의 선형적 및 비선형적 효과와 이들 간의 상호작용을 시각적으로 분석할 수 있도록 고안된 다차원적 공간 분석 모형이다. 영양 기하학은 현재 영양과 관련된 다양한 학문 분야에서 광범위하게 사용되고 있다 (Simpson and Raubenheimer, 2012). 영양 기하학의 핵심 개념으로는 1) 영양 공간 (nutrient space), 2) 영양 선 (nutritional rail), 그리고 3) 섭식 목표 (intake target)가 있다. 영양 공간이란, 단백질과 탄수화물 같은 영양소의 섭식량과 함량을 각각 x축과 y축으로 설정한 2차원적인 좌표 평면 (coordinate plane)을 일컫는다. 이 영양 공간에는 한 생물 개체나 집단이 섭취한 단백질과 탄수화물 (혹은 지방)의 양이 좌표의 점으로 표시될 수 있다 (Fig. 3). 영양 선은 원점에서 방사되는 직선으로, 생물이 섭취하고 있는 먹이에 함유된 영양소들 간의 비율 (예, 단백질 : 탄수화물)은 이 영양 선의 기울기로 표현된다. 마지막으로 섭식 목표란, 생물이 자신의 적응도를 극대화시키기 위해 섭식해야 할 영양소들의 양과 비율을 의미하며, 이 또한 영양 공간에 점으로 표현된다. 생물은 자신이 요구하는 영양 비율과 완벽하게 일치하는 먹이를 섭취하거나 (Fig. 3a), 영양적으로 불균형하지만 서로 보완적인 2가지 이상의 먹이를 선택함으로써 섭식 목표에 도달할 수 있다 (Fig. 3b). 만일 영양적으로 불균형한 먹이만 먹도록 제한되었을 경우 (Fig. 3c), 생물은 자신의 최적 영양 상태에 절대 도달할 수 없다. 이러한 상황에서 생물은 다양한 섭식 반응을 보이게 되는데, 특정 영양소를 다른 영양소보다 우선하여 조절하는 전략을 취하거나 (Fig. 3c의 Case 1 혹은 2), 특정 영양소의 과다와 이와 다른 영양소의 부족을 절충하는 전략을 취하기도 한다 (Case 3) (Simpson and Raubenheimer, 2012).
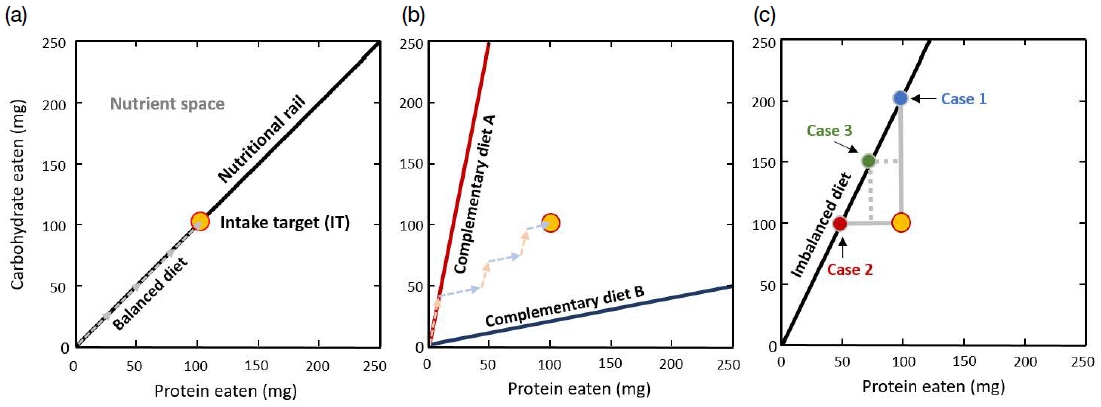
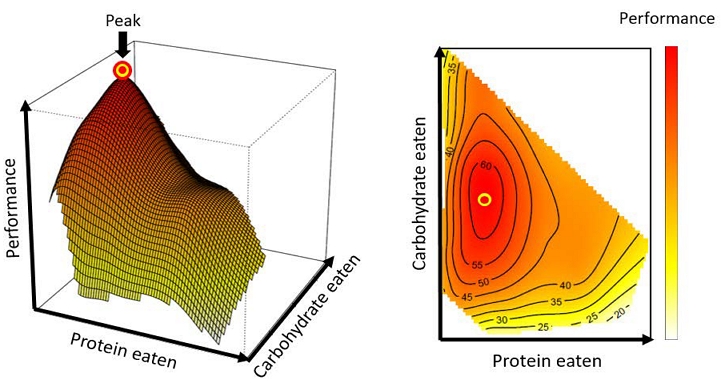
Protein-carbohydrate nutrient space for a hypothetical animal. The intake target (yellow circle) represents the amount and balance of the two nutrients that are optimally required by an animal. The solid lines (nutritional rails) in each panel represent the protein-to-carbohydrate ratio of the diets.
최근 영양 기하학은 기존의 모형에서 진일보하여, 2차원적 영양 공간 위에 해당 영양소 섭식의 결과 발현되는 생물의 표현형을 z축에 표시할 수 있는 3차원적인 “영양 적응도 경관도 (nutritional fitness landscape, 이하 영양 경관도)”로 발전하였다 (Fig. 4). 영양 경관도에서 산봉우리에 해당하는 지점 (즉, 생물의 표현형이 가장 높게 발현되는 지점)의 좌표를 영양 최적점 (nutritional optimum)이라 한다. 메뚜기와 초파리 등 다양한 곤충을 대상으로 수행된 일련의 연구에 따르면, 먹이를 자유롭게 선택할 수 있는 조건을 제공할 경우, 곤충들은 자신이 섭취하는 단백질과 탄수화물의 양과 비율을 조절함으로써 영양 최적점에 도달할 수 있는 것으로 확인되었다 (Simpson et al., 2004; Jensen et al., 2012; Rho and Lee, 2016; Raubenheimer and Simpson, 2018). 이러한 사실은 곤충은 스스로 자신의 영양 균형을 맞출 수 있는 능력이 있으며 이를 통해 자신의 적응도를 극대화할 수 있음을 보여준다. 영양 경관도의 가장 큰 장점은 다변량적인 영양 자료를 3차원적인 경관도로 시각화하고, 이를 통해 복잡하게 얽혀 있는 영양소들 간의 상호작용을 정확하게 해석할 수 있다는 데 있다. 영양 경관도를 사용한 중요 연구 사례로 Lee et al. (2008)이 수행한 노랑초파리 (Drosophila melanogaster) 연구가 있다. 이 연구에서 Lee et al. (2008)은 1,008마리의 암컷 초파리에게 단백질과 탄수화물의 비율과 총 함량이 각기 다른 28가지의 먹이를 각각 제공한 뒤, 그에 따른 초파리의 수명과 산란 수를 측정하였고, 이를 영양 경관도로 적합하였다. 원래 초파리를 비롯한 생물의 수명은 총 칼로리 섭취량에 의해 좌우된다는 것이 정설이었으나, Lee et al. (2008)의 연구 결과는, 이러한 기존의 통념과는 상반되게, 초파리의 수명과 이들의 생식 능력을 결정하는 가장 중요한 영양적 요인은 거대 영양소의 비율 (단백질 : 탄수화물)이라는 사실을 규명하였다. 이와 같은 결론은 이후 귀뚜라미, 과실파리 등과 같은 다양한 다른 곤충은 물론이고 미생물과 생쥐에서도 확인되었다 (Maklakov et al., 2008; Fanson et al., 2009; Dussutour et al., 2010; Solon-Biet et al., 2014).
꿀벌의 영양 기하학 연구 현황: 사례를 중심으로
앞장에서 서술한 바와 같이, 영양 기하학은 곤충 영양학과 영양 생태학의 혁신적인 발전을 가능케 한 원동력이었다. 영양 기하학을 통해 우리는 다음과 같은 4가지 결론에 도달할 수 있었다. 첫째, 곤충은 섭식 행동과 먹이 선택을 능동적으로 조절함으로써, 영양분들을 최적의 비율로 획득할 수 있다. 이처럼 곤충이 스스로 자신의 영양 균형을 맞추는 능력을 “영양적 지혜 (nutritional wisdom)”라 한다. 둘째, 만약 영양 균형이 깨어졌을 경우, 즉 섭취한 영양분들이 최적 요구량보다 부족하거나 과도할 경우, 곤충은 적응도의 감소 (fitness losses)를 겪게 되고, 그 정도가 심화될수록 적응도의 감소 폭 또한 증가한다. 셋째, 곤충은 비록 영양적으로 불균형한 먹이를 섭취할지라도, 섭식 행동과 생리 기작을 조정함으로써 영양 불균형으로 인해 발생하는 비용을 최소화한다. 마지막으로, 곤충의 적응도를 결정하는 수명, 생식, 성장 등과 같은 생활사 형질 (life-history trait)들은 각기 다른 거대 영양소 비율에서 극대화된다. 이는 곧 형질별로 각기 다른 영양 최적점 (nutritional optimum)을 갖는다는 것을 의미한다. 많은 곤충에서 일관적으로 관찰된 바에 따르면, 곤충의 수명은 고탄수화물·저단백질 먹이에서 가장 긴 데 비해, 산란 수와 같은 암컷의 생식 능력은 저탄수화물·고단백질 먹이에서 가장 높다 (Simpson and Raubenheimer, 2012). 이러한 사실은 먹이에 함유된 거대 영양소의 균형이 수명과 생식 간의 진화적 절충 관계 (evolutionary trade-off)를 결정한다는 것을 의미한다 (Rapkin et al., 2018; Morimoto and Lihoreau, 2019). 현재 영양 기하학은 꿀벌의 영양 연구에도 도입되어서 활발한 연구가 진행 중에 있다. 본 장은 현재까지 발표된 꿀벌 영양 기하학 연구의 주요 내용과 결과를 소개할 것이며, 이를 정리하면 다음과 같다.
영양 기하학을 적용하여 꿀벌과 영양 균형 간의 관계를 분석한 최초의 연구는 Pirk et al. (2010)에 의해 수행되었다. 이 연구에서 Pirk et al. (2010)은 이제 막 우화한 일벌에게 단백질의 종류와 단백질 : 탄수화물 비율이 각각 다른 먹이를 제공하고, 이를 섭취한 일벌들의 수명과 난소 발달 정도를 측정하였다. 단백질의 종류로는 카제인 (casein), 로열젤리, 알로에 화분의 3가지가 사용되었으며, 이들은 각각 설탕과 0 : 1, 1 : 3, 1 : 1, 3 : 1, 1 : 0의 비율로 배합되었다. 이렇게 제조된 실험 먹이는 사육장 (cage) 안에 100마리씩 방사된 벌들에게 제공되었다. 실험 결과, 카제인을 섭취한 처리군이 다른 단백질원을 섭취한 처리군보다 더 오래 사는 것으로 나타났다. 또한, 단백질의 종류와는 상관없이 단백질 : 탄수화물 비율이 낮을수록 일벌들의 수명이 연장되는 것이 확인되었다. 특히 단백질 비율이 고도로 높은 먹이에서 극심한 수명 단축이 관찰되었는데, 이러한 결과는 기존의 다른 곤충 (초파리, 귀뚜라미, 개미 등)에서 보고된 결과와 일치한다 (Lee et al., 2008; Maklakov et al., 2008; Dussutour and Simpson, 2012; Lee, 2015; Jang and Lee, 2018; Kim et al., 2021). 일벌의 난소 발달 정도는 단백질 : 탄수화물 비율이 1 : 3인 먹이에서 가장 활성화된 것으로 확인되었다.
Pirk et al. (2010)의 연구 결과 밝혀진 먹이의 단백질 : 탄수화물 비율이 일벌의 수명에 미치는 영향은 뒤에 이어진 Paoli et al. (2014)의 연구에서도 재현되었다. Pirk et al. (2010)의 연구와 차별되게, Paoli et al. (2014)은 단백질 대신 유리 필수 아미노산을 사용하였으며, 꿀벌의 먹이도 고형이 아닌 액상 형태로 제조하였다. 이 연구에서 Paoli et al. (2014)은 필수 아미노산과 설탕 (탄수화물)을 1 : 750, 1 : 500, 1 : 250, 1 : 100, 1 : 75, 1 : 50, 1 : 10, 1 : 5의 8가지의 비율로 배합한 액상 인공사료를 일벌에게 각각 제공하였다. 일벌의 수명과 난소 발달에 초점을 맞춘 이전의 연구에 비해, Paoli et al. (2014)의 연구는 꿀벌의 섭식반응을 추가적으로 측정하였으며, 막 우화한 어린 일벌, 즉 내역봉, 외에도 먹이 채집 활동을 수행하고 있는 외역봉 또한 실험 대상으로 포함시켰다.
Paoli et al. (2014)의 주요 연구 결과를 정리하면 다음과 같다. 우선, 내역봉과 외역봉 모두, 필수 아미노산 : 탄수화물 비율이 상대적으로 높은 먹이를 제공받았을 때 섭식량을 증가시키는 반응을 보였다. 그리고 그 결과, 꿀벌은 필수 아미노산 : 탄수화물의 비율이 다른 8가지 먹이 처리군들에 걸쳐, 거의 일정한 양의 탄수화물을 섭취하는 양상을 보였다. 이러한 섭식 반응은 이들이 영양 불균형에 불가피하게 노출되었을 시, 탄수화물 섭식을 우선 조절함으로써 자신이 요구하는 최적 탄수화물 섭식량에 도달하고자 하는 전략 (carbohydrate prioritization rule)을 취한다는 것을 의미한다. 이러한 ‘탄수화물 우선 전략’은 다른 꿀벌 연구 (Archer et al., 2014a)와 서양뒤영벌 연구 (Bombus terrestris; Stabler et al., 2015; Archer et al., 2021)에서도 반복적으로 관찰되었던 현상이다. 이처럼 탄수화물 및 지방과 같은 비단백질성 에너지원 (non-protein energy)의 섭식을 우선적으로 조절하는 섭식 전략은 밍크나 거미와 같은 포식자나 상대적으로 단백질이 풍부한 식물 부위를 주로 섭식하는 소수의 식식성 동물에서 이미 보고되었는데 (Raubenheimer et al., 2007; Mayntz et al., 2009; Rothman et al., 2011), 이는 아마도 단백질이 상대적으로 풍부하고 탄수화물 및 지방이 비교적 제한된 영양 환경에서 이들이 적응하는 과정에서 진화한 것으로 추측되고 있다 (Simpson and Raubenheimer, 2012; Lee et al., 2022). 최근 발표된 연구에 따르면, 뿔가위벌 (Osmia bicornis) 유충 또한 탄수화물 섭식을 우선하는 전략을 취하는 것으로 나타났다 (Austin and Gilbert, 2021). 왜 벌들이 이러한 탄수화물 우선 조절 전략을 일관적으로 보이는지에 대해서는 앞으로 더 많은 연구와 논의가 필요할 것이다. 이러한 질문에 대한 해답은 아마도 이들의 주 먹이인 화분이 단백질이 풍부한 먹이라는 사실과 비행과 온도조절 같은 활동을 위해 이들은 항상 많은 양의 탄수화물을 요구한다는 사실에서 그 실마리를 찾을 수 있을 것 같다.
Paoli et al. (2014)은 영양적으로 불균형한 조건에서 내역봉과 외역봉의 섭식량을 분석함으로써, 이들의 최적 영양 요구, 즉 섭식 목표 (intake target)를 비교하였다. 이때 이들은 꿀벌에게 8가지 먹이 중 1가지를 제공하고, 이 중 섭식량이 가장 적은 처리군의 필수 아미노산 : 탄수화물 비율을 일벌의 최적 영양 요구로 추정하였다. 그 결과 우화한지 2주일 이내로 육아를 담당하는 내역봉의 최적 영양 비율은 1 : 50에서 1 : 75인데 비해, 비행 활동에 많은 에너지를 소모하는 외역봉은 1 : 250으로 매우 탄수화물 쪽으로 치우쳐진 비율을 갖는 것으로 분석되었다 (Fig. 5). 이러한 결과는 꿀벌이 최적으로 요구하는 필수 아미노산 : 탄수화물 비율은 이들의 나이와 그에 따른 역할 변화에 따라 변한다는 것을 시사한다. 하지만 꿀벌의 먹이 선택 조건을 제공하지 않고 얻어진 이러한 Paoli et al. (2014)의 결과는, 과연 꿀벌이 실제로 먹이 선택 및 선호도를 능동적으로 변화시킴으로써 나이에 따라 변화한 자신의 최적 필수 아미노산 : 탄수화물 비율을 섭취하는지는 보여주지 못한 근본적인 한계가 있다.
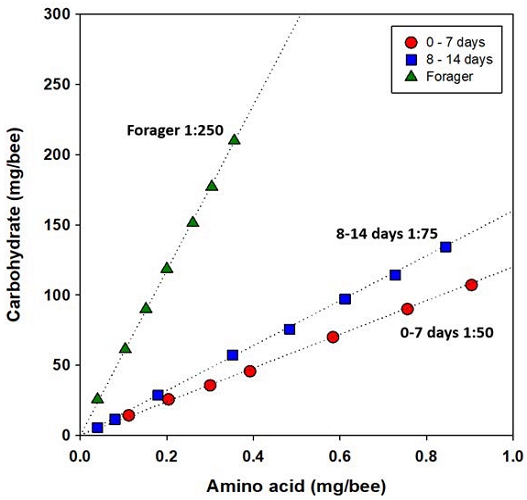
The estimated intake target of honey bee workers from three different age groups in Paoli et al. (2014). The dotted lines represent the ratio of essential amino acid to carbohydrate consumed by bees (From Paoli et al., 2014).
한 생물의 영양 최적점을 동정하는 가장 쉽고 널리 사용되는 방법은 생물에게 영양적으로 서로 보완적인 2가지 이상의 먹이를 동시에 제공하고, 이 생물이 어떤 비율로 단백질, 탄수화물 및 지방을 스스로 선택하는지를 조사하는 것이다. 특히 여기서 주의해야 할 사항으로는 생물이 섭취한 영양소들의 비율이 무작위적인 먹이 선택의 결과가 아닌지를 통계적으로 검정해야 한다는 점이다. 이를 위해서, 실험자는 가능하다면 여러 가지 먹이 선택 조건들을 생물에게 제공한 후, 각기 다른 먹이 선택 조건을 제공받은 개체들이 섭취한 영양소들의 양과 비율이 과연 2차원적인 영양 공간에서 동일한 지점으로 수렴하는지를 확인해야 한다. 이와 같은 먹이 선택 실험 (food choice experiment)을 이용하여 꿀벌의 섭식 목표를 실제로 측정한 시도는 현재까지 2차례 있었다 (Altaye et al., 2010; Archer et al., 2014b). 먼저 Archer et al. (2014b)의 연구를 소개하면 다음과 같다. Archer et al. (2014b)은 카제인과 설탕을 각각 단백질과 탄수화물 원으로 이용하여, 이들을 1 : 1과 1 : 3으로 배합한 고체 인공사료를 제조하였다. 그리고 이들을 각각 단백질 : 탄수화물 비율이 0 : 1인 먹이와 쌍을 지워서, 이렇게 조합된 2가지 먹이 선택 처리군 (1 : 1과 0 : 1, 1 : 3과 0 : 1)을 이제 막 우화한 일벌에게 제공하였다. 실험 결과, 일벌은 먹이 선택 처리군과 상관없이, 모두 1 : 6.5의 비율로 단백질과 탄수화물을 일관되게 선택하는 것으로 나타났다. Archer et al. (2014b)의 결과는 꿀벌 또한 다른 곤충들과 마찬가지로 단백질과 탄수화물의 섭식을 조절한다는 것을 의미한다. Archer et al. (2014b)에 앞서, Altaye et al. (2010) 또한 이와 비슷한 결과를 보고하였는데, 이 경우에도 일벌은 먹이 선택 조건에 상관없이 일정한 비율의 단백질과 탄수화물을 섭취하는 것으로 확인되었다. Altaye et al. (2010)의 실험에서 일벌들이 선택한 단백질 : 탄수화물 비율은 1 : 11~1 : 14로, Archer et al., (2014b)에서 확인한 비율보다 훨씬 탄수화물 쪽으로 치우쳐졌다. Altaye et al. (2010)의 연구에서 추가적으로 언급할 사항은 단백질의 종류에 따라 일벌이 선택한 단백질 : 탄수화물 수렴 비율에 차이가 존재한다는 점이다. 가령, 단백질이 카제인이었을 때, 최적 섭식 비율은 1 : 12였으며, 로열젤리였을 때 1 : 14, 그리고 화분 대체재인 Feed-Bee®였을 때 1 : 11이었다. 앞으로 심층적인 연구가 이루어져야 하겠지만, 단백질 종류에 따른 이러한 거대 영양소 선택 양상의 차이는 아마도 단백질에 함유된 아미노산 조성의 차이에 기인한 것으로 예상된다 (Lee, 2007).
기존의 꿀벌 영양 기하학 연구는 영양 균형이 꿀벌의 생활사 형질과 생리적 활성에 미치는 직접적 영향에 초점을 맞추어 수행되었다. 하지만 최근 발표된 일련의 연구 결과에 따르면, 먹이의 영양 균형은 질병과 살충제, 그리고 각종 환경 스트레스에 대한 꿀벌의 민감도를 크게 변화시키는 등 간접적인 효과도 상당하다는 증거가 보고되고 있다. 가령 예를 들자면, 먹이의 단백질 : 탄수화물 비율의 적당한 증가는 저온 스트레스와 니코틴 노출에 의한 꿀벌의 사망 위험을 감소시키고 (Archer et al., 2014b), 꿀벌의 인지 기능을 높이는 것으로 나타났다 (Bouchebti et al., 2022). 또한, 최근 Crone and Grozinger (2021)의 연구에 따르면, 꿀벌은 이들이 섭취하는 화분의 단백질 : 지방 비율이 높았을 때 유기인산염 (organophosphate)계 살충제에 대한 높은 회복 능력을 보이는 것으로 나타났다. 아직 꿀벌에서 구체적인 연구 결과가 보고된 사례는 없지만, 먹이의 단백질 : 탄수화물 균형은 곤충의 면역기능에도 큰 영향을 끼치는 것으로 보고되었다 (Lee et al., 2006; Povey et al., 2009; Cotter et al., 2011). 이상의 연구 결과를 종합하여 보았을 때, 적절한 영양 균형은 꿀벌에게 있어 다양한 환경의 위협으로부터 봉군의 건강을 지키는 가장 결정적인 요인이라 할 수 있을 것이다.
영양 기하학을 적용하여 꿀벌의 영양과 관련되어 밝혀진 사실을 요약하면 다음과 같다. 우선 꿀벌은 단백질보다 탄수화물을 선호하며, 이는 꿀벌의 높은 탄수화물 요구를 반영한다. 또한, 만일 탄수화물이 부족한 먹이에 노출되었을 때, 꿀벌은 탄수화물 기본 요구량을 충족시키기 위해 먹이 섭식을 증가시키며, 이러한 섭식 반응은 부득이하게 단백질 과잉 섭식으로 이어진다. 단백질 섭취량 감소는 꿀벌의 수명을 연장시키는 효과가 있는 반면, 질병과 살충제에 대한 내성을 저하시킨다.
향후 과제와 전망
본 장은 향후 꿀벌 영양 연구에 있어 해결해야 할 몇 가지 숙제와 연구 방향에 대해 고찰하고자 한다. 꿀벌은 진사회성 (eusocial) 곤충이다. 따라서 일벌은 거대한 봉군의 구성원이며, 다른 일벌, 여왕벌 그리고 유충과 불가분의 관계를 맺으며 살아간다. 하지만 지금까지의 꿀벌 영양 기하학 연구는 봉군으로부터 분리된 일벌을 대상으로 수행되었던 관계로, 이렇게 도출된 결과를 봉군 안에서 다른 벌들과 긴밀하게 상호작용하면서 살아가는 꿀벌의 영양 반응으로 단정하기는 어렵다. 최근 보고된 서양뒤영벌 연구에 따르면, 일벌은 봉군 내 유충 (brood)의 유무에 따라 단백질 수집을 다르게 조절하는 것으로 확인되었다 (Kraus et al., 2019). 이러한 결과는 개미에서도 이미 보고되었는데 (Dussutour and Simpson, 2009), 이는 봉군에서 자라는 유충과 일벌 간에 벌어지는 상호작용이 봉군 수준의 먹이 수집에 얼마나 유의한 영향을 미치는지를 단적으로 보여준다. 따라서 앞으로의 꿀벌 영양 연구는 실제 봉군에서 살아가는 꿀벌의 영양 조절 및 항상성을 규명하는데 초점을 맞추어 수행되어야 할 것이다.
꿀벌이 어떻게 봉군 수준에서 단백질과 탄수화물 간의 균형을 맞추는지에 대한 연구는 Hendriksma et al. (2019b)에 의해 처음 수행된 바 있다. 이 연구에서, Hendriksma et al. (2019b)은 꿀벌의 봉군에서 단백질과 탄수화물 저장량을 인위적으로 추가하거나 제거함으로써 봉군의 단백질 혹은 탄수화물 부족을 실험적으로 조작하였고, 그 결과 봉군 수준에서 일어나는 먹이 수집 및 섭식 행동의 변화를 추적하였다. 연구 결과, 꿀벌은 봉군의 화분과 화밀을 각각 수집하는 일벌의 수를 조정함으로써, 봉군의 영양 균형을 맞추는 것으로 확인되었다. 이상의 연구 결과는 향후 꿀벌 봉군의 영양 요구에 대한 보다 정밀하고 고도화된 영양 기하학 연구로 발전할 수 있을 것으로 기대된다 (Lihoreau et al., 2018).
꿀벌 영양학에서 앞으로 집중적인 연구가 이루어져야할 또 다른 과제로는 지방 섭식이 꿀벌의 건강에 미치는 영향에 대한 연구일 것이다. 현재까지의 꿀벌 영양학 연구는 주로 단백질과 탄수화물에 집중되었으며, 지방에 대한 관심은 상대적으로 미미했던 것이 사실이다 (Brodschneider and Crailsheim, 2010; Wright et al., 2018). 지방은 화분에 대략 2~20% 정도 함유되어 있으며, 인지질 (phospholipids), 스테롤 (sterols), 각종 지방산 (fatty acids) 등으로 구성된다 (Roulston and Cane, 2000). 특히 최근 많은 꿀벌 연구자들은 다중불포화지방산 (polyunsaturated fatty acids)의 영양적 중요성에 주목하고 있다. 다중불포화지방산은 꿀벌이 필수적으로 섭취해야만 하는 영양소인데, 최근 Arien et al. (2015)의 연구에 따르면, 화분 내 오메가-3 지방산 부족은 꿀벌의 학습 능력과 기억을 감퇴시키는 것으로 나타났다. 이러한 인지 기능 저하는 꿀벌의 먹이 수집 효율을 떨어뜨리는 등 봉군에 부정적인 영향을 미칠 것으로 예상되며, 결국 봉군 붕괴로 이어질 가능성이 높다 (Klein et al., 2017). 또한, 오메가-6 대 3 비율이 높은 화분 먹이에서 꿀벌의 사망률이 증가하고 봉군에서 육아되는 유충의 수가 감소하는 것으로 나타났는데 (Arien et al., 2018, 2020), 이는 오메가-6 대 3 비율이 꿀벌 개체와 봉군의 건강에도 직접적인 영향을 미친다는 것을 보여준다.
지방이 꿀벌의 영양에서 차지하는 중요성은 실제로 많은 벌들이 단백질과 탄수화물 외에도 지방의 섭식 또한 능동적으로 조절한다는 사실에 의해 증명된다 (Stabler et al., 2021). 영양 기하학을 사용하여 먹이의 지방 함량이 벌과 봉군에 미치는 영향에 대한 연구는 그동안 주로 뒤영벌에서 활발히 수행되었다. 야외 및 실험실 조건에서 Vaudo et al. (2016a, 2020)이 수행한 연구에 따르면, 동부뒤영벌 (Bombus impatiens)은 화분에 함유된 단백질과 지방의 비율을 기준으로 봉군에 필요한 화분을 선택하는 것으로 확인되었다. 후속으로 진행된 연구에서 Vaudo et al. (2016b)은 2종의 뒤영벌 (B. impatiens와 B. terrestris)에게 다양한 먹이 선택 조건을 제공하고, 이들이 스스로 선택한 단백질 : 지방 비율을 조사하였다. 조사 결과, 2종의 뒤영벌 모두, 먹이 선택 조건과 상관없이, 일정한 비율로 단백질과 지방을 섭취하는 것으로 나타났으며, 이때 서양뒤영벌과 동부뒤영벌이 각각 선택한 단백질 : 지방 비율은 14 : 1와 12 : 1이었다. 최근 Kraus et al. (2019)은 서양뒤영벌에게 먹이 선택 조건을 제공한 후, 이들의 봉군에 수집된 단백질, 탄수화물, 지방의 양을 측정하였다. 측정 결과, 서양뒤영벌의 봉군은 단백질 71%, 탄수화물 6%, 지방 23%이라는 일관된 비율로 이 3가지 거대 영양소를 획득하도록 수집 행동을 조절하였다. 이러한 Kraus et al. (2019)의 연구는 단백질, 탄수화물, 그리고 지방의 3가지 거대 영양소 모두를 포괄한 새로운 영양 기하학 연구 방법론이 꿀벌 영양학 연구에 도입되어야 할 필요성을 제기한다 (Raubenheimer, 2011).
마지막으로 언급할 꿀벌 영양 연구의 당면 과제로 꿀벌 유충의 영양에 대한 심도 있는 연구의 필요성을 들 수 있을 것이다. 유충의 영양은 개체의 성장과 발달은 물론 꿀벌의 생식적 계급을 결정하는 절대적인 요인임에도 불구하고, 영양 균형이 꿀벌 유충에 미치는 영향에 대한 연구는 많이 부족한 실정이다. 영양 기하학을 사용하여 먹이의 단백질 : 탄수화물 비율이 꿀벌 유충의 발육에 미치는 영향을 분석한 연구는 Helm et al. (2017)의 연구가 현재까지 유일하다. 하지만 이 연구는 매우 제한된 수의 먹이를 사용했다는 점, 그리고 대부분의 실험 곤충이 전용단계에서 사망했다는 점에서 거대 영양소들 간에 일어나는 복잡한 상호작용이 유충 발달에 미치는 영향을 파악하기에는 한계가 있다. 향후 꿀벌 유충 영양학 연구의 원활한 수행을 위해서는 꿀벌 유충의 완벽한 인비트로 (in vitro) 사육 방법 구축과 영양성분이 정밀하게 통제된 인공사료의 개발이 선결되어야 할 것이다.
맺음말
본 총설에서 우리는 현재까지 진행되고 있는 꿀벌 영양학 연구의 최신 동향을 살펴봤으며, 앞으로 해결되어야 할 연구 숙제 그리고 전망에 대해 심층적으로 논의해 보았다. 이전의 꿀벌 영양학 연구는 단백질과 탄수화물을 중심으로, 이들 영양소들이 꿀벌의 건강에 미치는 영향을 개별적으로 연구하였다. 하지만 현재의 꿀벌 영양학 연구는 꿀벌의 먹이를 구성하는 여러 가지 영양소들 간의 상호작용과 균형이 갖는 역할을 통합적으로 이해하기 위한 방향으로 발전하고 있다. 이러한 연구 환경의 변화는 지난 30년간 지속적으로 발전한 곤충 영양학의 성과와 이를 뒷받침한 영양 기하학에 힘입은 바가 크며, 향후 꿀벌 영양학 연구의 주류로 그 위치를 굳건히 차지할 것으로 예상된다.
현재 꿀벌은 먹이자원 부족과 다양성 감소로 인한 영양 불균형과 같은 심각한 영양적 위기에 직면해 있다. 하지만 현재까지 영양 기하학 연구를 통해 얻은 결론을 종합해 보면, 꿀벌은 스스로 자신과 봉군의 영양 불균형을 회복하고 영양 항상성을 유지할 수 있는 매우 효율적인 자기조직화 (self-organization) 능력을 갖추고 있다. 따라서 먹이자원의 다양성 확보를 통해 꿀벌이 스스로 영양 균형을 맞출 수 있는 환경을 제공하는 것이야말로 오늘날 꿀벌이 당면한 위기를 해결할 수 있는 방안으로 떠오르고 있다 (Goulson et al., 2015; Dolezal et al., 2019). 이상과 같이 영양 기하학을 통해 밝혀진 꿀벌의 영양 요구, 자기 조절 능력, 그리고 영양 항상성에 관한 최신 연구 결과들은 향후 CCD현상과 월동기 폐사 등으로 대표되는 전 지구적인 꿀벌의 위기를 극복하기 위한 전략을 수립하는 데 있어 중요한 단서를 제공할 것이다.
적 요
꿀벌은 자연 및 농업생태계에서 화분매개자로서 중요한 역할을 담당한다. 최근 전 지구적으로 문제가 되고 있는 꿀벌 개체 수 감소는 세계 식량안보에 중대한 위협이 되고 있다. 영양은 꿀벌 개체와 봉군의 건강에 결정적인 영향을 미치는 요인으로, 충분한 양과 적절한 비율의 영양소가 섭취되지 못한다면, 꿀벌은 영양 스트레스에 직면하게 되며, 이는 꿀벌의 개체 수의 감소와 봉군 붕괴의 원인이 된다. 이러한 직접적인 영향 외에도, 영양 스트레스는 병원균, 기생충, 살충제, 극한기후 등 다른 환경 스트레스와 상호작용을 일으킴으로써 꿀벌의 건강과 적응도에 심각한 손상을 유발할 수 있다. 현재 꿀벌이 당면한 위기를 극복하기 위해서는 꿀벌의 영양 생리와 생태를 이해하는 것이 그 무엇보다도 중요한 과제로 부상하고 있다. 이렇게 증대하는 관심에도 불구하고, 꿀벌의 영양 연구는 영양이 갖는 복잡성과 다차원적인 특성을 적절하게 분석할 수 있는 연구 방법론의 부재로 인해, 그동안 발전이 많이 지체되었다. 영양 기하학 (Nutritional Geometry)은 다변량적인 영양 데이터를 유클리드 공간에 시각화함으로써, 영양소들 간에 일어나는 복잡한 상호작용을 정확하게 분석할 수 있도록 개발된 분석 모형으로, 현대 곤충 영양 생리 및 생태학 연구에 혁신을 가져왔다. 본 총설의 목적은 최근 영양 기하학을 통해 발전한 꿀벌 영양 연구의 성과를 소개하는 것이다. 본 총설은 최근 꿀벌의 전 세계적인 위기와 관련하여 영양이 갖는 중요성과 기존 꿀벌 연구의 현황과 한계에 대해 우선 살펴보고, 영양 기하학의 핵심 개념과 원리 그리고 영양 기하학이 어떻게 꿀벌 영양학의 혁신에 기여했는지를 설명할 것이다. 특히 본 총설은 최근 영양 기하학을 적용하여 수행된 주요 꿀벌 연구의 내용과 결과를 정리하고, 영양 기하학이 어떻게 꿀벌의 봉군 수준에서의 영양 항상성에 대한 이해를 심화시킬 수 있는지, 그리고 어떻게 현재 우리가 당면한 꿀벌의 위기를 해결하기 위한 해답을 제시할 수 있는지에 대해 논의할 것이다.
Acknowledgments
본 연구는 한국연구재단 학문균형발전지원사업의 보호연구과제 (NRF-2020R1I1A2070399)와 창의·도전 연구기반지원과제 (NRF-2020R1I1A1A01068375)의 지원을 통해 수행되었다.
References
-
Alaux, C., F. Ducloz, D. Crauser and Y. Le Conte. 2010. Diet effects on honeybee immunocompetence. Biol. Lett. 6: 562-565.
[https://doi.org/10.1098/rsbl.2009.0986]

-
Altaye, S. Z., C. W. Pirk, R. M. Crewe and S. W. Nicolson. 2010. Convergence of carbohydrate-biased intake targets in caged worker honeybees fed different protein sources. J. Exp. Biol. 213: 3311-3318.
[https://doi.org/10.1242/jeb.046953]

-
Anderson, D. L. and H. Giacon. 1992. Reduced pollen collection by honey bee (Hymenoptera: Apidae) colonies infected with Nosema apis and sacbrood virus. J. Econ. Entomol. 85: 47-51.
[https://doi.org/10.1093/jee/85.1.47]

-
Archer, C. R., A. Köhler, C. W. Pirk, V. Oosthuizen, Z. Apostolides and S. W. Nicolson. 2014a. Antioxidant supplementation can reduce the survival costs of excess amino acid intake in honeybees. J. Insect Physiol. 71: 78-86.
[https://doi.org/10.1016/j.jinsphys.2014.10.006]

-
Archer, C. R., C. W. Pirk, G. A. Wright and S. W. Nicolson. 2014b. Nutrition affects survival in African honeybees exposed to interacting stressors. Funct. Ecol. 28: 913-923.
[https://doi.org/10.1111/1365-2435.12226]

-
Archer, C. R., J. Fähnle, M. Pretzner, C. Üstüner, N. Weber, A. Sutter, V. Doublet and L. Wilfert. 2021. Complex relationship between amino acids, fitness and food intake in Bombus terrestris. Amino Acids 53: 1545-1558.
[https://doi.org/10.1007/s00726-021-03075-8]

-
Arien, Y., A. Dag, S. Zarchin, T. Masci and S. Shafir. 2015. Omega-3 deficiency impairs honey bee learning. Proc. Natl. Acad. Sci. U.S.A. 112: 15761-15766.
[https://doi.org/10.1073/pnas.1517375112]

-
Arien, Y., A. Dag and S. Shafir. 2018. Omega-6:3 ratio more than absolute lipid level in diet affects associative learning in honey bees. Front. Psychol. 9: 1001.
[https://doi.org/10.3389/fpsyg.2018.01001]

-
Arien, Y., A. Dag, S. Yona, Z. Tietel, T. L. Cohen and S. Shafir. 2020. Effect of diet lipids and omega-6:3 ratio on honey bee brood development, adult survival and body composition. J. Insect Physiol. 124: 104074.
[https://doi.org/10.1016/j.jinsphys.2020.104074]

-
Austin, A. J. and J. D. Gilbert. 2021. Solitary bee larvae prioritize carbohydrate over protein in parentally provided pollen. Funct. Ecol. 35: 1069-1080.
[https://doi.org/10.1111/1365-2435.13746]

-
Barascou, L., D. Sene, A. Barraud, D. Michez, V. Lefebvre, P. Medrzycki, G. Di Prisco, V. Strobl, O. Yañez, P. Neumann and Y. Le Conte. 2021. Pollen nutrition fosters honey bee tolerance to pesticides. R. Soc. Open Sci. 8: 210818.
[https://doi.org/10.1098/rsos.210818]

- Bouchebti, S., G. A. Wright and S. Shafir. 2022. Macronutrient balance has opposing effects on cognition and survival in honey bees. Funct. Ecol. 00: 1-11.
-
Brodschneider, R. and K. Crailsheim. 2010. Nutrition and health in honey bees. Apidologie 41: 278-294.
[https://doi.org/10.1051/apido/2010012]

-
Brodschneider, R., R. Moosbeckhofer and K. Crailsheim. 2010. Surveys as a tool to record winter losses of honey bee colonies: a two year case study in Austria and South Tyrol. J. Apic. Res. 49: 23-30.
[https://doi.org/10.3896/IBRA.1.49.1.04]

-
Cotter, S. C., S. J. Simpson, D. Raubenheimer and K. Wilson. 2011. Macronutrient balance mediates trade offs between immune function and life history traits. Funct. Ecol. 25: 186-198.
[https://doi.org/10.1111/j.1365-2435.2010.01766.x]

-
Crailsheim, K., L. H. W. Schneider, N. Hrassnigg, G. Bühlmann, U. Brosch, R. Gmeinbauer and B. Schöffmann. 1992. Pollen consumption and utilization in worker honeybees (Apis mellifera carnica): dependence on individual age and function. J. Insect Physiol. 38: 409-419.
[https://doi.org/10.1016/0022-1910(92)90117-V]

-
Crone, M. K. and C. M. Grozinger. 2021. Pollen protein and lipid content influence resilience to insecticides in honey bees (Apis mellifera). J. Exp. Biol. 224: jeb.242040.
[https://doi.org/10.1242/jeb.242040]

- De Groot, A. P. 1953. Protein and amino acid requirements of the honeybee (Apis mellifica L.). Physiol. Comp. Oecol. 3: 197-285.
-
Di Pasquale, G., M. Salignon, Y. Le Conte, L. P. Belzunces, A. Decourtye, A. Kretzschmar, S. Suchail, J. L. Brunet and C. Alaux. 2013. Influence of pollen nutrition on honey bee health: do pollen quality and diversity matter? PLoS ONE 8: e72016.
[https://doi.org/10.1371/journal.pone.0072016]

-
Di Prisco, G., V. Cavaliere, D. Annoscia, P. Varricchio, E. Caprio, F. Nazzi, G. Gargiulo and F. Pennacchio. 2013. Neonicotinoid clothianidin adversely affects insect immunity and promotes replication of a viral pathogen in honey bees. Proc. Natl. Acad. Sci. U.S.A. 110: 18466-18471.
[https://doi.org/10.1073/pnas.1314923110]

-
Dolezal, A. G., A. L. St. Clair, G. Zhang, A. L. Toth and M. E. O’Neal. 2019. Native habitat mitigates feast-famine conditions faced by honey bees in an agricultural landscape. Proc. Natl. Acad. Sci. U.S.A. 116: 25147-25155.
[https://doi.org/10.1073/pnas.1912801116]

-
Dussutour, A. and S. J. Simpson. 2009. Communal nutrition in ants. Curr. Biol. 19: 740-744.
[https://doi.org/10.1016/j.cub.2009.03.015]

-
Dussutour, A. and S. J. Simpson. 2012. Ant workers die young and colonies collapse when fed a high-protein diet. Proc. R. Soc. Lond. B: Biol. Sci. 279: 2402-2408.
[https://doi.org/10.1098/rspb.2012.0051]

-
Dussutour, A., T. Latty, M. Beekman and S. J. Simpson. 2010. Amoeboid organism solves complex nutritional challenges. Proc. Natl. Acad. Sci. U.S.A. 107: 4607-4611.
[https://doi.org/10.1073/pnas.0912198107]

-
Fanson, B. G., C. W. Weldon, D. Pérez-Staples, S. J. Simpson and P. W. Taylor. 2009. Nutrients, not caloric restriction, extend lifespan in Queensland fruit flies (Bactrocera tryoni). Aging Cell 8: 514-523.
[https://doi.org/10.1111/j.1474-9726.2009.00497.x]

-
Goulson, D., E. Nicholls, C. Botias and E. L. Rotheray. 2015. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science 347: 1255957.
[https://doi.org/10.1126/science.1255957]

-
Haydak, M. H. 1970. Honey bee nutrition. Annu. Rev. Entomol. 15: 143-156.
[https://doi.org/10.1146/annurev.en.15.010170.001043]

-
Helm, B. R., G. P. Slater, A. Rajamohan, G. D. Yocum, K. J. Greenlee and J. H. Bowsher. 2017. The geometric framework for nutrition reveals interactions between protein and carbohydrate during larval growth in honey bees. Biol. Open 6: 872-880.
[https://doi.org/10.1242/bio.022582]

-
Hendriksma, H. P. and S. Shafir. 2016. Honey bee foragers balance colony nutritional deficiencies. Behav. Ecol. Sociobiol. 70: 509-517.
[https://doi.org/10.1007/s00265-016-2067-5]

-
Hendriksma, H. P., C. D. Pachow and J. C. Nieh. 2019a. Effects of essential amino acid supplementation to promote honey bee gland and muscle development in cages and colonies. J. Insect Physiol. 117: 103906.
[https://doi.org/10.1016/j.jinsphys.2019.103906]

-
Hendriksma, H. P., A. L. Toth and S. Shafir. 2019b. Individual and colony level foraging decisions of bumble bees and honey bees in relation to balancing of nutrient needs. Front. Ecol. Evol. 7: 177.
[https://doi.org/10.3389/fevo.2019.00177]

-
Herbert, E. W., W. E. Bickley and H. Shimanuki. 1970. The brood-rearing capability of caged honey bees fed dandelion and mixed pollen diets. J. Econ. Entomol. 63: 215-218.
[https://doi.org/10.1093/jee/63.1.215]

-
Hocherl, N., R. Siede, I. Illies, H. Gatschenberger and J. Tautz. 2012. Evaluation of the nutritive value of maize for honey bees. J. Insect Physiol. 58: 278-285.
[https://doi.org/10.1016/j.jinsphys.2011.12.001]

- Huang, Z. 2010. Honey bee nutrition. Am. Bee J. 150: 773-776.
-
Jack, C. J., S. S. Uppala, H. M. Lucas and R. R. Sagili. 2016. Effects of pollen dilution on infection of Nosema ceranae in honey bees. J. Insect Physiol. 87: 12-19.
[https://doi.org/10.1016/j.jinsphys.2016.01.004]

-
Jang, T. and K. P. Lee. 2018. Comparing the impacts of macronutrients on life-history traits in larval and adult Drosophila melanogaster: the use of nutritional geometry and chemically defined diets. J. Exp. Biol. 221: jeb181115.
[https://doi.org/10.1242/jeb.181115]

-
Jensen, K., D. Mayntz, S. Toft, F. J. Clissold, J. Hunt, D. Raubenheimer and S. J. Simpson. 2012. Optimal foraging for specific nutrients in predatory beetles. Proc. R. Soc. Lond. B: Biol. Sci. 279: 2212-2218.
[https://doi.org/10.1098/rspb.2011.2410]

-
Keller, I., P. Fluri and A. Imdorf. 2005a. Pollen nutrition and colony development in honey bees: Part 1. Bee World 86: 3-10.
[https://doi.org/10.1080/0005772X.2005.11099641]

-
Keller, I., P. Fluri and A. Imdorf. 2005b. Pollen nutrition and colony development in honey bees: Part II. Bee World 86: 27-34.
[https://doi.org/10.1080/0005772X.2005.11099650]

-
Kim, S. H., H. Park, W. Kim, J. H. Song, S. J. Roh, S. Y. Kim, Y. H. Je and K. P. Lee. 2021. The impact of dietary protein: carbohydrate balance on lifespan and reproduction in Protaetia brevitarsis (Coleoptera: Scarabaeidae: Cetoniinae). J. Insects Food Feed 7: 1235-1241.
[https://doi.org/10.3920/JIFF2020.0117]

-
Klein, S., A. Cabirol, J. M. Devaud, A. B. Barron and M. Lihoreau. 2017. Why bees are so vulnerable to environmental stressors. Trends Ecol. Evol. 32: 268-278.
[https://doi.org/10.1016/j.tree.2016.12.009]

- Kleinschmidt, G. J. and A. C. Kondos. 1976. Influence of crude protein levels on colony production. Aust. Beekeep. 79: 36-39.
-
Kraus, S., T. Gómez-Moracho, C. Pasquaretta, G. Latil, A. Dussutour and M. Lihoreau. 2019. Bumblebees adjust protein and lipid collection rules to the presence of brood. Curr. Zool. 65: 437-446.
[https://doi.org/10.1093/cz/zoz026]

-
Lee, K. P. 2007. The interactive effects of protein quality and macronutrient imbalance on nutrient balancing in an insect herbivore. J. Exp. Biol. 210: 3236-3244.
[https://doi.org/10.1242/jeb.008060]

-
Lee, K. P. 2015. Dietary protein: carbohydrate balance is a critical modulator of lifespan and reproduction in Drosophila melanogaster: a test using a chemically defined diet. J. Insect Physiol. 75: 12-19.
[https://doi.org/10.1016/j.jinsphys.2015.02.007]

-
Lee, K. P., J. S. Cory, K. Wilson, D. Raubenheimer and S. J. Simpson. 2006. Flexible diet choice offsets protein costs of pathogen resistance in a caterpillar. Proc. R. Soc. Lond. B: Biol. Sci. 273: 823-829.
[https://doi.org/10.1098/rspb.2005.3385]

-
Lee, K. P., S. J. Simpson, F. J. Clissold, R. Brooks, J. W. O. Ballard, P. W. Taylor, N. Soran and D. Raubenheimer. 2008. Lifespan and reproduction in Drosophila: new insights from nutritional geometry. Proc. Natl. Acad. Sci. U.S.A. 105: 2498-2503.
[https://doi.org/10.1073/pnas.0710787105]

-
Lee, K. P., J. S. Kim and K. J. Min. 2013. Sexual dimorphism in nutrient intake and life span is mediated by mating in Drosophila melanogaster. Anim. Behav. 86: 987-992.
[https://doi.org/10.1016/j.anbehav.2013.08.018]

-
Lee, K. P., T. Jang, N. Ravzanaadii and M. S. Rho. 2015. Macronutrient balance modulates the temperature-size rule in an ectotherm. Am. Nat. 186: 212-222.
[https://doi.org/10.1086/682072]

- Lee, K. P., T. Jang and M. S. Rho. 2022. Recent trends in integrative insect nutrition: a nutritional geometry perspective. Korean J. Appl. Entomol. 61: 129-142.
-
Lihoreau, M., T. Gómez-Moracho, C. Pasquaretta, J. T. Costa and J. Buhl. 2018. Social nutrition: an emerging field in insect science. Curr. Opin. Insect 28: 73-80.
[https://doi.org/10.1016/j.cois.2018.05.003]

-
Maklakov, A. A., S. J. Simpson, F. Zajitschek, M. D. Hall, J. Dessmann, F. Clissold, D. Raubenheimer, R. Bonduriansky and R. C. Brooks. 2008. Sex-specific fitness effects of nutrient intake on reproduction and lifespan. Curr. Biol. 18: 1062-1066.
[https://doi.org/10.1016/j.cub.2008.06.059]

-
Mayntz, D., V. H. Nielsen, A. Sørensen, S. Toft, D. Raubenheimer, C. Hejlesen and S. J. Simpson. 2009. Balancing of protein and lipid intake by a mammalian carnivore, the mink, Mustela vison. Anim. Behav. 77: 349-355.
[https://doi.org/10.1016/j.anbehav.2008.09.036]

-
Morimoto, J. and M. Lihoreau. 2019. Quantifying nutritional trade-offs across multidimensional performance landscapes. Am. Nat. 193: E168-E181.
[https://doi.org/10.1086/701898]

-
Naug, D. 2009. Nutritional stress due to habitat loss may explain recent honeybee colony collapses. Biol. Conserv. 142: 2369-2372.
[https://doi.org/10.1016/j.biocon.2009.04.007]

-
Paoli, P. P., D. Donley, D. Stabler, A. Saseendranath, S. W. Nicolson, S. J. Simpson and G. A. Wright. 2014. Nutritional balance of essential amino acids and carbohydrates of the adult worker honeybee depends on age. Amino Acids 46: 1449-1458.
[https://doi.org/10.1007/s00726-014-1706-2]

-
Pirk, C. W., C. Boodhoo, H. Human and S. W. Nicolson. 2010. The importance of protein type and protein to carbohydrate ratio for survival and ovarian activation of caged honeybees (Apis mellifera scutellata). Apidologie 41: 62-72.
[https://doi.org/10.1051/apido/2009055]

-
Potts, S. G., J. C. Biesmeijer, C. Kremen, P. Neumann, O. Schweiger and W. E. Kunin. 2010. Global pollinator declines: trends, impacts and drivers. Trends Ecol. Evol. 25: 345-353.
[https://doi.org/10.1016/j.tree.2010.01.007]

-
Povey, S., S. C. Cotter, S. J. Simpson, K. P. Lee and K. Wilson. 2009. Can the protein costs of bacterial resistance be offset by altered feeding behaviour? J. Anim. Ecol. 78: 437-446.
[https://doi.org/10.1111/j.1365-2656.2008.01499.x]

-
Rapkin, J., K. Jensen, C. R. Archer, C. M. House, S. K. Sakaluk, E. Del Castillo and J. Hunt. 2018. The geometry of nutrient space-based life-history trade-offs: sex-specific effects of macronutrient intake on the trade-off between encapsulation ability and reproductive effort in decorated crickets. Am. Nat. 191: 452-474.
[https://doi.org/10.1086/696147]

-
Raubenheimer, D. 2011. Toward a quantitative nutritional ecology: the right-angled mixture triangle. Ecol. Monogr. 81: 407-427.
[https://doi.org/10.1890/10-1707.1]

-
Raubenheimer, D. and S. J. Simpson. 2018. Nutritional ecology and foraging theory. Curr. Opin. Insect Sci. 27: 38-45.
[https://doi.org/10.1016/j.cois.2018.02.002]

-
Raubenheimer, D., D. Mayntz, S. J. Simpson and S. Tøft. 2007. Nutrient-specific compensation following diapause in a predator: implications for intraguild predation. Ecology 88: 2598-2608.
[https://doi.org/10.1890/07-0012.1]

-
Rho, M. S. and K. P. Lee. 2016. Balanced intake of protein and carbohydrate maximizes lifetime reproductive success in the mealworm beetle, Tenebrio molitor (Coleoptera: Tenebrionidae). J. Insect Physiol. 91: 93-99.
[https://doi.org/10.1016/j.jinsphys.2016.07.002]

-
Rho, M. S. and K. P. Lee. 2017. Temperature-driven plasticity in nutrient use and preference in an ectotherm. Oecologia 185: 401-413.
[https://doi.org/10.1007/s00442-017-3959-4]

-
Rothman, J. M., D. Raubenheimer and C. A. Chapman. 2011. Nutritional geometry: gorillas prioritize non-protein energy while consuming surplus protein. Biol. Lett. 7: 847-849.
[https://doi.org/10.1098/rsbl.2011.0321]

-
Roulston, T. H. and J. H. Cane. 2000. Pollen nutritional content and digestibility for animals. pp. 187-209. in Pollen and Pollination, eds. by Dafni, A., M. Hesse and E. Pacini. 1st ed., 341p. Springer, Vienna.
[https://doi.org/10.1007/978-3-7091-6306-1_10]

-
Roulston, T. H., J. H. Cane and S. L. Buchmann. 2000. What governs protein content of pollen: pollinator preferences, pollen-pistil interactions, or phylogeny? Ecol. Monogr. 70: 617-643.
[https://doi.org/10.1890/0012-9615(2000)070[0617:WGPCOP]2.0.CO;2]

-
Schmehl, D. R., P. E. A. Teal, J. L. Frazier and C. M. Grozinger. 2014. Genomic analysis of the interaction between pesticide exposure and nutrition in honey bees (Apis mellifera). J. Insect Physiol. 71: 177-190.
[https://doi.org/10.1016/j.jinsphys.2014.10.002]

-
Schmidt, J. O., S. C. Thoenes and M. D. Levin. 1987. Survival of honey bees, Apis mellifera (Hymenoptera: Apidae), fed various pollen sources. Ann. Entomol. Soc. Am. 80: 176-183.
[https://doi.org/10.1093/aesa/80.2.176]

-
Schmidt, L. S., J. O. Schmidt, H. Rao, W. Wang and L. Xu. 1995. Feeding preference and survival of young worker honey bees (Hymenoptera: Apidae) fed rape, sesame, and sunflower pollen. J. Econ. Entomol. 88: 1591-1595.
[https://doi.org/10.1093/jee/88.6.1591]

-
Simpson, S. J. and D. Raubenheimer. 1993. A multi-level analysis of feeding behaviour: the geometry of nutritional decisions. Philos. Trans. R. Soc. Lond. B: Biol. Sci. 342: 381-402.
[https://doi.org/10.1098/rstb.1993.0166]

-
Simpson, S. J. and D. Raubenheimer. 2012. The nature of nutrition: a unifying framework from animal adaption to human obesity. 1st ed., 256p. Princeton University Press, Princeton.
[https://doi.org/10.1515/9781400842803]

-
Simpson, S. J., R. M. Sibly, K. P. Lee, S. T. Behmer and D. Raubenheimer. 2004. Optimal foraging when regulating intake of multiple nutrients. Anim. Behav. 68: 1299-1311.
[https://doi.org/10.1016/j.anbehav.2004.03.003]

-
Simpson, S. J., D. G. Le Couteur and D. Raubenheimer. 2015. Putting the balance back in diet. Cell 161: 18-23.
[https://doi.org/10.1016/j.cell.2015.02.033]

-
Solon-Biet, S. M., A. C. McMahon, J. W. O. Ballard, K. Ruohonen, L. E. Wu, V. C. Cogger, A. Warren, X. Huang, N. Pichaud, E. G. Melvin and R. Gokarn. 2014. The ratio of macronutrients, not caloric intake, dictates cardiometabolic health, aging, and longevity in ad libitum-fed mice. Cell Metab. 19: 418-430.
[https://doi.org/10.1016/j.cmet.2014.02.009]

-
Somerville, D. C. and H. I. Nicol. 2006. Crude protein and amino acid composition of honey bee-collected pollen pellets from south-east Australia and a note on laboratory disparity. Aust. J. Exp. Agric. 46: 141-149.
[https://doi.org/10.1071/EA03188]

-
Stabler, D., P. P. Paoli, S. W. Nicolson and G. A. Wright. 2015. Nutrient balancing of the adult worker bumblebee (Bombus terrestris) depends on the dietary source of essential amino acids. J. Exp. Biol. 218: 793-802.
[https://doi.org/10.1242/jeb.114249]

-
Stabler, D., M. Al-Esawy, J. A. Chennells, G. Perri, A. Robinson and G. A. Wright. 2021. Regulation of dietary intake of protein and lipid by nurse-age adult worker honeybees. J. Exp. Biol. 224: jeb230615.
[https://doi.org/10.1242/jeb.230615]

-
Vanbergen, A. J. and the Insect Pollinators Initiative. 2013. Threats to an ecosystem service: pressures on pollinators. Front. Ecol. Environ. 11: 251-259.
[https://doi.org/10.1890/120126]

-
VanEngelsdorp, D., J. D. Evans, C. Saegerman, C. Mullin, E. Haubruge, B. K. Nguyen, M. Frazier, J. Frazier, D. Cox-Foster, Y. Chen and R. Underwood. 2009. Colony collapse disorder: a descriptive study. PLoS ONE 4: e6481.
[https://doi.org/10.1371/journal.pone.0006481]

-
Vaudo, A. D., H. M. Patch, D. A. Mortensen, J. F. Tooker and C. M. Grozinger. 2016a. Macronutrient ratios in pollen shape bumble bee (Bombus impatiens) foraging strategies and floral preferences. Proc. Natl. Acad. Sci. U.S.A. 113: E4035-E4042.
[https://doi.org/10.1073/pnas.1606101113]

-
Vaudo, A. D., D. Stabler, H. M. Patch, J. F. Tooker, C. M. Grozinger and G. A. Wright. 2016b. Bumble bees regulate their intake of essential protein and lipid pollen macronutrients. J. Exp. Biol. 219: 3962-3970.
[https://doi.org/10.1242/jeb.140772]

-
Vaudo, A. D., J. F. Tooker, H. M. Patch, D. J. Biddinger, M. Coccia, M. K. Crone, M. Fiely, J. S. Francis, H. M. Hines, M. Hodges and S. W. Jackson. 2020. Pollen protein: lipid macronutrient ratios may guide broad patterns of bee species floral preferences. Insects 11: 132.
[https://doi.org/10.3390/insects11020132]

-
Vásquez, A. and T. C. Olofsson. 2009. The lactic acid bacteria involved in the production of bee pollen and bee bread. J. Apic. Res. 48: 189-195.
[https://doi.org/10.3896/IBRA.1.48.3.07]

-
Wright, G. A., S. W. Nicolson and S. Shafir. 2018. Nutritional physiology and ecology of honey bees. Annu. Rev. Entomol. 63: 327-344.
[https://doi.org/10.1146/annurev-ento-020117-043423]