국내 꿀벌응애에서의 플루발리네이트 저항성 발달 현황과 해결 방안 제안
Abstract
The beekeeping industry in Korea has been severely challenged by winter losses of honey bee colonies recently. Various factors such as climate changes, pesticides, pathogens, nutritional imbalance, parasitic mites and other environmental factors are argued as the causes of the large-scale losses of winter bees. However, it is more rational to suggest that a combination of these multiple stressors rather than a single factor is responsible for this damage. Among these factors, the ectoparasitic mites, particularly Varroa destructor, has been widely reported to significantly cause winter losses of honey bee colonies in various countries, and beekeepers in Korea complain that it is difficult to control mites with conventional methods. Considering that fluvalinate has been the most abundantly used synthetic acaricide in Korea, and intensive and repetitive use of fluvalinate has been suggested to be result in the development of resistant V. destructor populations in previous studies, we first focused on discussing the mode of action of fluvalinate and the mechanism of pyrethroid resistance. Current status of the fluvalinate resistance V. destructor in Korea and selection of alternative acaricides are further discussed in this review.
Keywords:
Honey bee colony losses, Varroa destructor, Fluvalinate, Acaricide, Resistance서 론
최근 우리나라 양봉 업계와 양봉학 분야에서 가장 큰 이슈 중 하나는 2022년 초 우리나라 남부지방을 중심으로 보고되고 있는 대규모의 월동 꿀벌 폐사 현상일 것이다 (RAD, 2022). 급격한 기후/기상 변화, 드론을 이용한 농약 살포, 질병 발생, 불량 꿀벌 사료의 공급으로 인한 영양 불균형, 응애 방제의 실패 등 다양한 요인이 월동 꿀벌 폐사 현상의 원인으로 제안되고 있으나, 특정 한 요인에 의해 발생한 피해라기 보다는 이들 요인들이 복합적으로 작용하여 나타나는 현상이라는 것이 대부분 연구자들의 공통된 의견이다 (Choi et al., unpublished data; VanEngelsdorp et al., 2009; VanEngelsdorp and Meixner, 2010; Currie et al., 2015). 이러한 다양한 요인들 중 꿀벌 외부기생충인 응애의 발생이 북반구의 여러 나라에서 관찰되는 꿀벌 폐사 현상의 주요한 원인 중 하나로 지목되고 있다 (Downey and Winston, 2001; RW, 2001; Genersch et al., 2010; Guzmán-Novoa et al., 2010; Schäfer et al., 2010; Van Dooremalen et al., 2012). 실제 우리나라 양봉 농가에서도 응애 방제 어려움에 대한 강력한 호소가 지속되는 상황에서 본 연구에서는 응애 방제에 있어서 대두되고 있는 살비제 저항성 문제와 그 대체 살비제 선발에 기반한 해결 방안을 모색하고자 한다.
국내 응애 발생 상황
전 세계적으로 꿀벌에 기생하거나 벌통에서 발견되는 응애류는 100여 종이 알려져 있으며, 우리나라에서는 6종이 보고되어 있다 (Lee and Woo, 1995). 우리나라 양봉장에서 육안으로 주로 관찰되는 응애류는 꿀벌응애 (Varroa destructor)와 중국가시응애 (Tropilaelaps mercedesae)로 (Lee et al., 2005), 꿀벌응애는 꿀벌의 유충과 번데기, 성충에 기생하여 지방체를 섭식하고, 중국가시응애는 꿀벌 유충 및 번데기의 체액을 흡즙하여 일벌의 체중, 활력, 면역력, 살충제에 대한 내성을 감소시키고 수명을 단축시키는 등 꿀벌의 생장에 부정적인 영향을 준다 (Bowen-Walker and Gunn, 2001; Yang and Cox-Foster, 2005, 2007; Rosenkranz et al., 2010; Annoscia et al., 2012; Phokasem et al., 2019; Ramsey et al., 2019). 또한 이들 응애류들은 급성마비병 바이러스 (Acute Bee Paralysis Virus, ABPV) 및 날개기형 바이러스 (Deformed Wing Virus, DWV) 등의 질병을 매개하여 봉군 내 일벌 개체수 감소 및 봉군 망실의 원인이 되기도 한다. 특히 봉군 내 높은 밀도의 꿀벌응애는 월동 봉군 폐사의 주요한 원인이라는 보고가 있고 (Genersch et al., 2010), 월동전 꿀벌응애의 성공적인 방제는 이듬해 봄의 꿀벌응애 밀도 감소와 강군 봉세 형성에 도움을 준다는 보고가 있다 (Van Dooremalen et al., 2012). 이러한 연구 결과들은 꿀벌응애 방제의 실패가 최근 우리나라에서 발생한 월동 봉군 폐사 현상의 주요한 원인 중 하나일 수 있다는 것을 시사한다.
국내 응애 방제 주요 약제인 피레스로이드의 작용 기작
1. 국내 응애 방제 약제
2021년 우리나라 양봉 농가를 대상으로 실시한 설문조사에 의하면 개미산, 옥살산과 같은 유기산, 아미트라즈 (amitraz)와 플루발리네이트 (fluvalinate) 등의 합성 살비제를 통해 응애 방제를 실시하고 있으며, 이들 중 플루발리네이트를 성분으로 하는 살비제를 가장 많이 사용하고 있는 것으로 나타났다 (Jeong et al., 2016). 1980년대 중반 이후로 플루발리네이트는 응애 방제를 위해 우리나라를 포함하여 세계적으로도 가장 많이 사용되는 약제로 (Lee et al., 2004), 우리나라에서는 스트립 (strip) 형태로 제작된 만푸골드, 홍사방, 왕스, 마브릭 등 다양한 상품명으로 판매되고 있다.
2. 신경세포의 전기적 신호 전달 기작
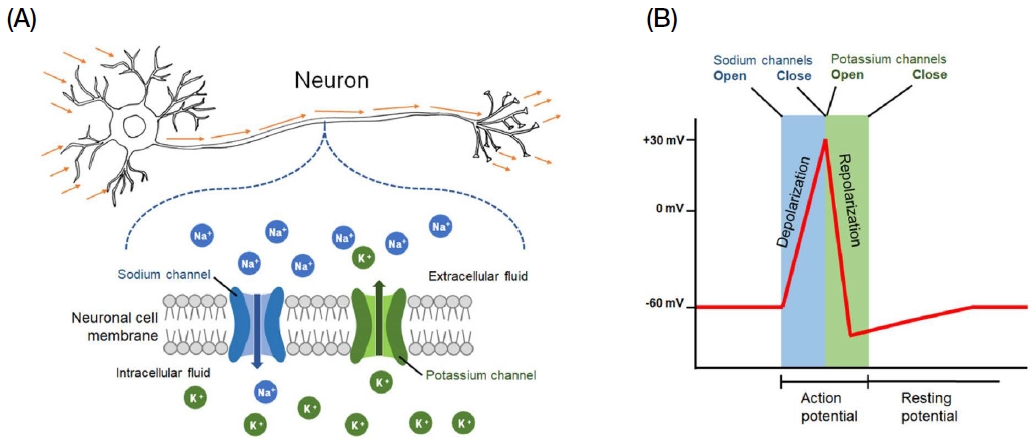
응애 방제를 위해 가장 널리 사용되는 플루발리네이트는 피레스로이드 (pyrethroid)계에 속하는 살충제로, 피레스로이드는 신경세포막에 존재하는 voltage-gated sodium channel (VGSC) 기능을 억제하여 살충효과를 유발한다는 것은 잘 알려져 있다 (Sherby et al., 1986; Ray and Fry, 2006; Davies et al., 2007). 뉴런 (neuron)이라 칭하는 신경세포의 막에는 sodium channel과 potassium channel이 있는데 이들 각 통로 (channel)를 통해 Na+ 이온과 K+ 이온이 세포막을 통과하여 이동하게 된다 (Fig. 1A) (Sengupta et al., 2010). 곤충에서 기본적으로 신경전달이 없는 휴지기의 뉴런 막의 전위는 -50 mV에서 -60 mV 수준을 유지하나 (Rohrbough and Broadie, 2002; Choi et al., 2004; Jiang et al., 2005; Gu and O̓Dowd, 2006; Park and Griffith, 2006; Sheeba et al., 2008a, 2008b), 신경세포가 자극 및 흥분되면 sodium channel이 열리고 이에 따라 Na+ 이온이 세포 내부로 이동하며 세포막 내부가 30~40 mV 수준의 양전위로 상승하게 되는데, 이를 탈분극 (depolarization)이라 한다 (Fig. 1B). 곧이어 인접한 potassium channel이 개방되어 K+ 이온이 세포 외부로 이동하여 막 전위는 다시 -50 mV에서 -60 mV 수준으로 회귀하는데 이를 재분극 (repolarization)이라 한다 (Fig. 1B). 신경세포 막을 경계로 위치하고 있는 sodium channel과 potassium channel을 통한 Na+ 이온과 K+ 이온의 이동과 차단으로 신경세포 막의 활동전위 (action potential)와 휴지전위 (resting potential)를 조절함으로써 신경세포 막을 따라 전기적 신호를 전달하게 된다 (Dong et al., 2014).
3. 피레스로이드의 작용 기작
플루발리네이트가 속하는 피레스로이드계 약제의 작용 표적이 되는 VGSC은 1952년 Hodgkin과 Huxley에 의해 처음 그 존재가 발견되었으며 (Hodgkin and Huxley, 1952), 곤충에서는 1989년 초파리 (Drosophila melanogaster)에서 처음으로 클로닝 (cloning)되었다 (Loughney et al., 1989). 곤충의 VGSC의 구조는 척추동물의 것과 상당히 유사하며 그 구조는 세포막을 관통하는 6개의 알파나선구조 (S1-S6 transmembrane α-helix segment)로 구성된 4개의 반복 도메인 (domain I-IV)에 의해 Na+ 이온의 이동 통로를 형성하는 것으로 밝혀져 있다 (Fig. 2) (Ffrench-Constant et al., 2016). 독일바퀴 (Blattella germanica)와 집파리 (Musca domestica)를 포함한 다양한 피레스로이드계 살충제에 대한 저항성 해충을 대상으로 수행된 연구를 종합하면 VGSC domain II의 S4와 S5 사이의 loop 지역과 domain II S5 및 S6 지역에서 발생하는 돌연변이가 저항성의 원인으로 이들 VGSC 지역이 피레스로이드계 살충제의 주요한 결합부위인 것으로 추정된다 (Fig. 2A, see red arrow) (O̓Reilly et al., 2006).
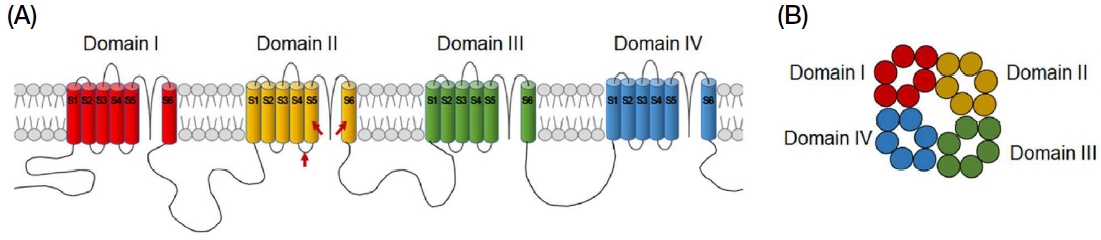
Diagram of voltage-gated sodium channel (VGSC). The VGSC possesses four repeat domains (labelled domain I-IV), each containing six transmembrane α-helix segments (labelled S1 through S6). Red arrows indicate putative binding sites of pyrethroid (A). The four domains are arrayed in the membrane to form a central pore (B).
VGSC은 피레스로이드계 살충제뿐만 아니라 dichlorodiphenyltrichloroethane (DDT)의 표적 분자로 많은 연구가 진행되어 왔는데, 이들 신경독소들이 VGSC에 결합할 경우 Na+ 이온의 이동에 따른 전도도 (ion conductance), 이온 선택 정도 (ion selectivity) 및 통로의 개폐 수준 등을 포함하는 VGSC의 생리학적 특징을 변화시킨다 (Narahashi, 1996, 2002; Catterall et al., 2007). 정상적인 VGSC의 경우, 개폐를 통해 신경전달에 따라 활동전위와 휴지전위가 조절되나 (Fig. 3A), 피레스로이드계 살충제에 노출될 경우 약제가 VGSC에 결합하여 channel이 열려 있는 상태를 지속시키거나 닫히는 과정을 지연시켜 Na+ 이온의 과도한 유입을 유발한다. 이는 결국 신경 세포막의 재분극 상태를 막고 탈분극 상태를 지속시킴으로 신경 세포의 전기적 신호 전달의 기능을 교란함으로써 과도흥분으로 인한 사충효과를 유발하게 된다 (Fig. 3B) (Narahashi, 1996, 2000; Soderlund, 2012).
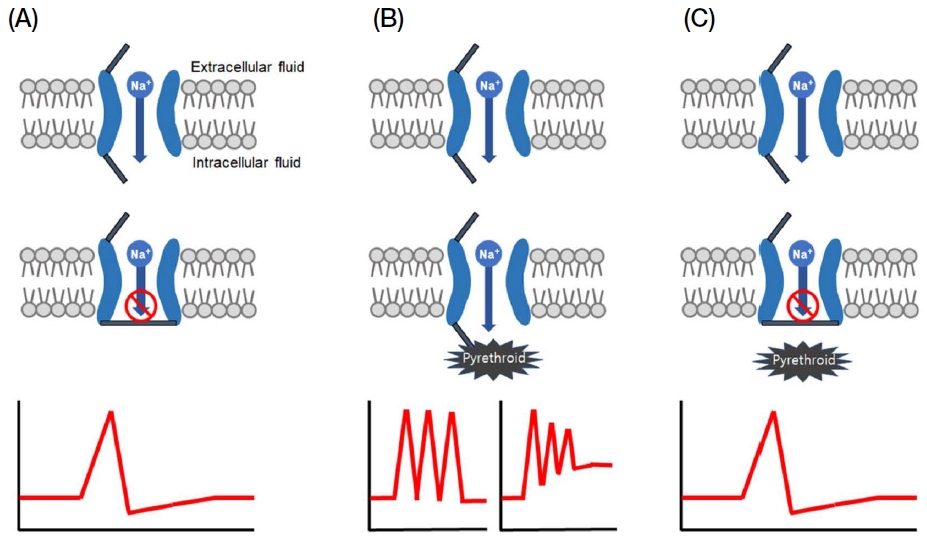
Mechanism of pyrethroid resistance. In normal conditions, depolarization and repolarization are created by respective open and close of voltage-gated sodium channel (VGSC) (A). When susceptible pests are exposed to pyrethroid, pyrethroids bind the VGSC and inhibit the function of VGSC, which cause prolonged depolarization or tail current of VGSC (B). In the pyrethroid resistant pests, pyrethroid cannot bind the VGSC and normal action potential is created (C).
플루발리네이트 약제 저항성 기작
1. 피레스로이드계 약제 저항성 기작
피레스로이드계 살충제와 DDT의 뛰어난 살충효과로 인해 해충방제를 위해 농업현장과 방역현장에서 지난 수 십년간 집중적으로 사용되어 왔으며, 이는 결국 이들 살충제에 대한 저항성 발달을 유발하였다. Knockdown resistance (KDR) 이라고 명명되는 DDT와 피레스로이드 살충제의 감수성 저하가 집파리에서 처음 보고된 이후 (Milani, 1956), 다양한 해충에서 유사한 형태의 저항성이 지속적으로 보고되고 있다 (Soderlund, 2005; Soderlund, 2012; Rinkevich et al., 2013). 특히 VGSC의 돌연변이와 피레스로이드계 살충제에 대한 저항성과의 상관성이 검증되고 있는데, L1014F와 M918T의 보고 (Williamson et al., 1996) 이후로 V410, G923, L925, T929, L932, F979, L982, I1011, L1014, V1016, F1534, G1535, F1538을 포함하는 50개 이상의 돌연변이가 다양한 종류의 피레스로이드계 살충제 저항성 해충들에서 발견되고 있다 (Dong et al., 2014). 이들 모든 돌연변이와 살충제 저항성 발달과의 직접적 상관성이 실험적으로 증명된 것은 아니지만, 대표적으로 M918T와 T929I, F1538I, L1014F 등의 돌연변이로 인한 피레스로이드 살충제의 표적분자에 대한 결합력 감소가 실험적으로 증명 (Vais et al., 2000; Vais et al., 2003; Tan et al., 2005)됨에 따라 VGSC에서 발생하는 돌연변이와 피레스로이드계 살충제 저항성 기작을 합리적으로 추정하게 된다 (Fig. 3C).
2. 플루발리네이트 약제 저항성 기작
꿀벌응애 방제에 가장 많이 이용되는 플루발리네이트 약제 또한 집중적이고 반복적인 사용으로 인한 꿀벌응애 방제 효과의 감소에 대한 보고는 유럽에서 1990년대부터 시작했고 (Milani, 1995), 이후 플루발리네이트 저항성 형질을 획득한 꿀벌응애가 미주, 유럽, 아프리카, 아시아의 여러 지역에서 보고되고 있다 (Elzen et al., 1998, 1999; Trouiller, 1998; Mozes-Koch et al., 2000; Macedo et al., 2002; Martin, 2004; Tremolada et al., 2004; Noureddine and Haddad, 2013; Sammataro et al., 2013; González-Cabrera et al., 2016; Kamler et al., 2016; Higes et al., 2020; Benito-Murcia et al., 2021; Millan-Leiva et al., 2021). 플루발리네이트 저항성 꿀벌응애 VGSC에서 발견되는 돌연변이들은 L1770P, L925V/M/I, F975L이 보고된 바가 있으나 (Liu et al., 2006; Hubert et al., 2014; González-Cabrera et al., 2016), 이들 중 L925V/M/I가 플루발리네이트 저항성에 주요하게 관여하는 것으로 생각된다. VGSC의 L925 지점은 domain II S5 지역에 위치하는 아미노산으로 피레스로이드의 주요한 결합부위로 알려져 있기에 (O̓Reilly et al., 2006) L925 돌연변이 발생이 플루발리네이트의 결합력을 감소시켜 저항성을 유발하는 것으로 보인다. 이는 L925 돌연변이 빈도와 플루발리네이트 저항성 간의 높은 상관성에서도 입증된다 (González-Cabrera et al., 2013, 2016, 2018; Hubert et al., 2014; Alissandrakis et al., 2017). L925I/M 돌연변이는 플로리다와 조지아에서 보고되었고 (González-Cabrera et al., 2016), L925I/V 돌연변이는 그리스에서 채집된 꿀벌응애에서 (Alissandrakis et al., 2017) 검출된 바가 있다. 이들 플루발리네이트 저항성에 관여하는 VGSC의 L925 지점의 돌연변이를 가지고 있는 꿀벌응애의 분포는 세계적으로 점점 더 증가하는 경향을 보이는 것으로 보인다 (González-Cabrera et al., 2018).
우리나라 플루발리네이트 약제 저항성 발달 실태
1. 우리나라 플루발리네이트 저항성 연구의 필요성
우리나라의 경우 2008년 꿀벌응애에 대한 플루발리네이트, 플루메트린, 아미트라즈, 쿠마포스 약제에 대한 효과를 비교 검증한 결과, 대체적으로 플루발리네이트의 효과가 가장 높은 것으로 관찰되었고 (Kim and Jung, 2008), 우리나라 8개 지역에서 채집된 꿀벌응애를 대상으로 실시한 플루발리네이트에 대한 감수성을 비교한 2009년 실험에서는 경기도 안성과 광주가 다른 지역에 비해 높은 저항성이 관찰된 바가 있다 (Kim et al., 2009). 이 연구에서는 VGSC의 서열의 지역별 차이가 관찰되기는 했지만, 플루발리네이트 저항성과의 상관성을 확인하지는 못하였다 (Kim et al., 2009). 우리나라에서는 대규모의 플루발리네이트 저항성과 관련된 연구가 수행된 바가 없지만, 앞서 두 연구를 근거할 때 2010년 이전까지는 플루발리네이트를 통한 꿀벌응애 방제에 큰 어려움이 없었던 것으로 판단된다. 그러나 최근 양봉 농가에서 응애 방제의 어려움이 강력하게 호소하고 있고, 현재 유통되고 있는 플루발리네이트 제제의 효과가 거의 없다는 호소가 지속되고 있다. 그리고 2022년 초에 발생한 월동 봉군 폐사 현상의 원인 중 하나로 꿀벌응애의 방제 실패가 지목되고 있는 상황에서 (RAD, 2022) 우리나라 꿀벌응애의 플루발리네이트 저항성 발달 실태에 대한 체계적인 연구는 필수적인 사항이라 판단된다.
2. 우리나라 플루발리네이트 저항성 돌연변이 발생 현황
채집된 꿀벌응애에 플루발리네이트를 처리한 후 생존한 개체와 사망한 개체에서 DNA를 추출하여 VGSC의 L925 지점의 유전자 서열을 분석한 결과, 사망한 개체의 46%에서는 돌연변이가 발생하지 않은 homozygote (SS), 31% 개체에서는 저항성과 감수성 유전자 서열이 함께 존재하는 heterozygote (RS)가 관찰되었고, 23% 개체에서만 저항성 형질 (RR)이 관찰되었다 (Fig. 4). 반면 플루발리네이트 노출 후에도 생존한 개체의 100%에서 저항성 형질의 homozygote (RR)가 분석되었는데, 이는 VGSC의 L925에서 발생하는 돌연변이가 플루발리네이트 저항성에 주요한 원임을 재차 증명한 결과이다 (Fig. 4). 이를 통해 L925 지점의 돌연변이와 플루발리네이트 저항성과의 상관성이 확인된 바에 따라 2021년과 2022년 우리나라 전국에서 채집된 꿀벌응애에서의 L925 돌연변이 발생을 추가 조사하였다. 2021년 채집된 17개 지역의 꿀벌응애 샘플 중 4개 지역에서 L925I 돌연변이 유전형이 관찰되었고, 2022년에는 41개 채집지역 중 34개 지역에서 L925I 돌연변이 유전형이 검출되었다 (unpublished data). 2년간 총 58개 지역의 응애에서 발견된 돌연변이는 모두 L925I로 해외에서 보고된 3가지 형태의 돌연변이 L925V/I/M 중 (Liu et al., 2006), 우리나라에서는 L925I 돌연변이만 발생하고 있는 것이 특이한 사항이다.
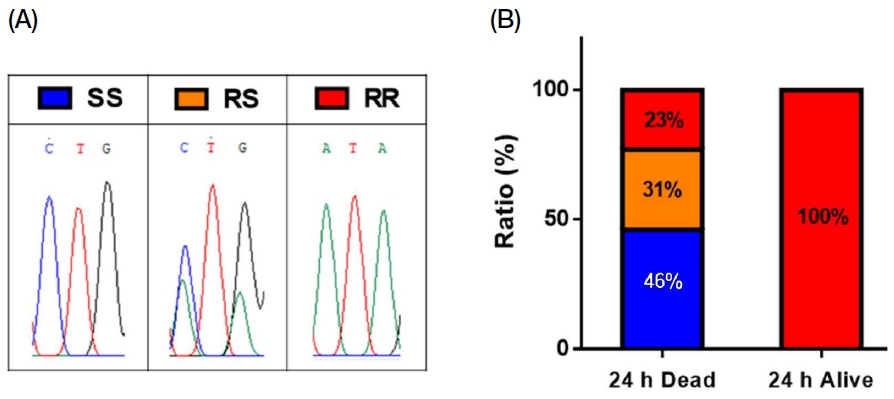
Representative electropherograms of Varroa destructor individual with different genotype (SS, RS and RR) at the V925I mutation site of the voltage-gated sodium channel (A). V925I allele frequencies found in dead or survived V. destructor at 24 h post-treatment of fluvalinate. Resistance homozygote (RR, L925I) was only found in the survived V. destructor (B).
3. 우리나라 플루발리네이트 약제 저항성의 확산
본 연구자가 수행한 2021년과 2022년 꿀벌응애 채집 지역의 수와 채집 장소가 동일하지 않아서 2년간의 결과를 직접적으로 비교할 수는 없지만, 저항성 돌연변이 샘플의 비율을 단순 비교하면 2021년 24%에서 2022년 83%로 크게 증가한 것에 주목할 필요가 있다 (unpublished data). 1년간 플루발리네이트 저항성 유전형질의 전국적인 확산과 유사한 현상이 경북대학교에서 사육 중인 봉군에서도 관찰되었다 (Table 1). 경북대학교에서는 2021년 봄, 상주에서 구매한 3개 봉군 (Sangju 1-3), 대구 (Daegu) 및 의령 (Uiryeong)에서 각각 구매한 2개 봉군을 사육하고 있었고, 2021년 7월 이들 봉군에서 채집한 꿀벌응애의 VGSC의 L925I 돌연변이 검출시 상주 3개 봉군 및 대구 봉군에서 저항성 유전형질은 전혀 관찰되지 않았으나, 의령 봉군에서는 채집된 꿀벌응애 개체 100%에서 저항성 형질이 관찰되었다 (Table 1). 2022년 5월 이들 봉군의 꿀벌응애에 대한 L925I 돌연변이에 대한 유전형질을 조사한 결과, 상주 2개 (Sangju 1, 2) 봉군과 대구 봉군에서 감수형 유전형질은 관찰되지 않고, 채집 개체 100%에서 L925I 돌연변이가 관찰되었다. 상주 3 봉군의 경우 채집된 꿀벌응애 개체의 62% 정도는 저항성 형질, 나머지 38% 정도는 감수형 유전형질이 확인되었다 (Table 1). 2개월 후 2022년 7월 추가 유전형 검사 결과, 상주 3 봉군을 포함한 모든 봉군의 꿀벌응애 100%에서 L925I 돌연변이가 검출되었다 (Table 1). 본 결과는 전국에서 채집된 꿀벌응애에서의 L925I 저항성 유전형 보유 비율이 2021년 24%에서 2022년 83%로 크게 확대된 현상과 유사하게 동일 봉군 내에서도 저항성 유전형질을 가지고 있지 않던 꿀벌응애 개체군에서 1년간의 기간 동안 저항성 유전형질이 빠르게 확대되고 있음을 의미한다.

Genotype for position 925 of the voltage-gated sodium channel of Varroa destructor collected from Kyungpook National University apiary in July 2021, May 2022, and July 2022.
2021년 Benito-Murcia 등이 수행한 꿀벌응애 개체군내 감수성/저항성 유전형질의 변화를 1년간 추적한 연구에서도 본 연구에서와 동일하게 저항성 유전형이 차지하는 비율이 꾸준히 증가하고 있음을 관찰하였고, 그 원인을 지속적이고 반복적인 플루발리네이트 스트립의 사용이 밀납 내 약제 축적을 야기하고 이는 결국 저농도의 약제가 꿀벌응애에 지속적으로 노출되어 꿀벌응애가 저항성 유전형질을 획득한 것으로 보고 있다 (Benito-Murcia et al., 2021). 플루발리네이트는 친지성 (lipophilic) 화합물로 지질성 물질인 밀납에 쉽게 녹아 들 수 있고, 그 분자 구조가 안정적이어서 쉽게 분해되지 않으며, 밀납을 통해 저농도의 약제가 지속적으로 휘발될 가능성이 높다 (Bonzini et al., 2011). 특히 플루발리네이트의 지속적인 처리로 인한 밀납 내 약제 농도가 시간을 두고 꾸준히 증가하는 경향을 관찰한 바가 있고 (Bonzini et al., 2011), 여러 연구에서도 밀납 내 약체 농축에 대한 결과가 보고되고 있다 (Tsigouri et al., 2003; Johnson et al., 2009). 꿀벌응애 방제를 위해 지속/반복적으로 처리되는 친지성 합성 살비제는 꿀벌응애 개체군 내 감수성 개체들을 제거하나, 저항성 유전형질을 보유하고 있는 개체들만 생존하게 되고 이들로부터 동일한 유전형질 (저항성)을 보유한 개체들로 번식하게 하여 종국에는 봉군 내 저항성 유전형질을 가진 꿀벌응애 개체군의 급속한 증가를 유발하게 되는 것으로 판단된다 (Benito-Murcia et al., 2021). 우리나라의 경우, 현재 응애류 방제를 위해 유통, 판매되는 합성 살비제는 플루발리네이트가 절대 우위를 차지하고 양봉 농가에서는 이들 제품만 지속적으로 사용하고 있기에, 꿀벌응애의 저항성 발달의 강력한 도태압으로 작용하여 국내 꿀벌응애의 L925I 돌연변이 보유 비율이 상당히 높은 것으로 판단된다.
경북대학교에서 사육 중인 봉군의 꿀벌응애에서 L925I 유전형질의 급속한 확산 현상은 채밀 활동에서도 그 원인을 추정할 수 있을 것이다. 이들 실험 봉군 (상주 1, 상주 2, 상주 3, 대구, 의령)은 30개의 다른 봉군과 함께 2021년 여름부터 동일한 장소에서 사육되고 있으며, 이들과 함께 월동 및 유밀기를 보내었다. 2022년 7월 이들 30개 봉군에서 꿀벌응애를 채집한 후 저항성 유전형을 조사한 결과, 총 30개 봉군 중 꿀벌응애가 채집되지 않은 2개 봉군을 제외한 28개 봉군에서 모두 L925I 돌연변이 유전형질이 관찰되었고, 4개 봉군에서는 저항성 유전형질과 감수성 유전형질 모두 관찰된 반면 24개 봉군에서 채집된 꿀벌응애의 100% 개체에서 저항성 유전형질만 보유하고 있는 것으로 확인되었다 (Table 2). 이는 저항성 유전형질을 보유한 꿀벌응애의 밀도가 상당히 높은 봉군과 함께 사육되는 환경이 경북대학교 실험 봉군 내 저항성 유전형질의 확대에 영향을 준 것으로 추정된다. 특히, 실제 이들 봉군들은 유밀기에 함께 채밀활동을 하면서 봉군들 간 소비가 섞였을 가능성을 배제할 수 없기에 봉군 간 꿀벌응애의 인위적인 이동이 발생하였으며, 또한 플루발리네이트 약제의 지속적인 사용이 도태압으로 더해져 동일 양봉장 내 저항성 유전형질의 확대를 가속한 것으로 추정된다.
풀루발리네이트 대체 약제 제안
우리나라 내 꿀벌응애 방제 어려움에 대한 호소, 플루발리네이트 약제에 대한 꿀벌응애의 저항성 유전형질의 확산, 응애류 방제를 위한 합성 살비제가 플루발리네이트 제제 한 종만 주로 유통/소비되는 상황 및 플루발리네이트와 같은 피레스로이드 계통인 플루메스린 (바이바롤)은 교차저항성이 우려되는 상황 등을 고려할 때, 대체 약제를 선발하여 사용하는 것이 바람직하다. 대체 약제로서는 합성 살비제로서 쿠마포스, 아미트라즈, 시미아졸 (cymiazole), 브로모프로필레이트 (bromopropylate) 등을 들 수 있으며, 천연화합물로서는 티몰 (thymol), 개미산 등을 들 수 있는데 각 약제의 특성 및 사용상 주의점을 아래에 정리하였다.
1. 쿠마포스
쿠마포스는 유기인계 살충·살비제로서 콜린성신경계 (cholinergic nervous system)의 신경연접에서 신경전달물질인 아세틸콜린 (acetylcholine)을 분해하는 가수분해 효소인 아세틸콜린에스터레이즈 (acetylcholinesterase)를 비가역적으로 저해하여 독 작용을 일으킨다. 전 세계적으로 플루발리네이트와 함께 꿀벌응애 방제에 널리 사용되고 있다. 피레스로이드 약제의 작용기작과는 다르므로 피레스로이드계 약제에 대한 저항성이 의심될 때 대체 약제로서 사용을 권장할 수 있다. 꿀벌에 대해서는 독성이 극히 낮으나 꿀벌응애에는 고도의 선택성을 보여 꿀벌독성 우려 없이 벌통 내부에 안전하게 처리할 수 있는데, 최근 국소처리법에 의해 조사된 쿠마포스의 독성은 꿀벌과 꿀벌응애 간 약 750~800배의 차이를 보임으로써 꿀벌에 미치는 독성이 상대적으로 경미함을 확인할 수 있었다 (Cho et al., unpublished data). 그러나 플루발리네이트를 1시간 전에 처리된 꿀벌에 쿠마포스를 연속적으로 처리할 경우 꿀벌에 대한 독성이 다소 증가하는 협력작용에 대한 보고가 있으므로 (Johnson et al., 2009), 플루발리네이트 잔류가 의심되는 오염된 소비가 사용되는 벌통에 쿠마포스를 처리할 경우에는 주의가 요구된다. 지금까지 국내에서는 페리진, 코마에이치, 쿠마킹 등의 제품이 사용되고 있으나, 꿀벌응애 방제 효력에 대한 추가적인 연구가 필요하다 하겠다.
2. 아미트라즈 및 시미아졸
아미트라즈는 포름아미딘 (formamidine)계 광범위 살충·살비제의 일종으로서 전 세계적으로 꿀벌응애 방제에 오랫동안 사용되고 있는데, 국내에서는 바로캇트훈연지, 속살-골드, 아미키트 등의 제품명으로 유통되고 있다. 아미트라즈는 꿀벌응애 중추신경계의 옥토파민수용체 (octopamine receptor)에 작용제 (agonist)로 작용하여 자극전달을 교란함으로써 독성을 발휘한다. 또한, 옥토파민 수용체 이외에도 다양한 표적에 작용함으로써 꿀벌응애의 아미트라즈 저항성 발달이 지연되는 것으로 알려져 있고, 작용기작이 피레스로이드 약제와는 상이하므로 플루발리네이트 저항성 꿀벌응애 방제에 대체 약제로서 사용될 수 있다. 그러나, 최근 연구결과에 따르면 아미트라즈가 처리된 꿀벌은 바이러스에 대한 면역력을 약화시키는 것으로 알려져 있으므로 (O̓Neal et al., 2017), 꿀벌응애의 밀도가 높아서 바이러스 및 기타 질병에 대한 면역저하가 우려되는 봉군의 경우에는 아미트라즈의 사용을 신중히 결정해야 한다. 옥토파민 신호전달체계는 곤충의 면역조절에 중요한 역할을 하며 (Kuo and Cheng, 2018), 아미트라즈는 염증과 면역 반응의 신호물질로 작용하는 프로스타글란딘 (prostaglandin) 합성을 저해하는 것으로 알려져 있으므로 (Bonsall and Turnbull, 1983), 아미트라즈와 꿀벌면역 간의 상호 작용에 대한 보다 심도 있는 연구가 필요하다.
시미아졸 역시 포름아미딘계 살충·살비제로서 아미트라즈와 동일한 작용기작과 특성을 가지고 있으므로 플루발리네이트 저항성이 문제가 될 때 대체 약제로 사용할 수 있으나 아미트라즈와 유사한 주의사항을 염두에 두어야한다.
3. 브로모프로필레이트
브로모프로필레이트는 유기할로겐계 살비제로서 아세틸콜린에스터레이즈 저해제로 알려져 있다 (Mehlhorn, 2008). 다카르, 폴벡 등의 제품명으로 국내에서 유통되고 있으나 유기할로겐계 특성상 높은 잔류성이 우려되고 유럽연합에서는 2011년에 사용금지 되었으므로 대체 약제로서 권장되지 않는다.
4. 티몰
티몰은 타임에서 유래된 식물성 정유로서 아피가드, 티모바르, 아피라이프바 등의 제품명으로 국내에 유통되고 있으며 작용기작은 옥토파민수용체와 유사한 티라민 (tyramine)수용체 또는 GABA 수용체에 작용하여 독작용을 나타내는 것으로 알려져 있다 (Priestley et al., 2003; Enan, 2005). 다양한 표적을 대상으로 작용하므로 저항성 발달속도가 상대적으로 느릴 것으로 추정되고 있고 스트립제로 사용이 간편하므로 대체 약제로 활용할 수 있으나 티몰의 강한향으로 인한 도봉 발생을 유발할 수 있기에 이에 대한 보완 연구를 통해 대체 약제로 제안될 수 있다 .
5. 개미산과 옥살산
개미산과 옥살산은 꿀벌응에의 세포호흡을 저해하여 독성을 나타내는 것으로 알려져 있는데 훈증제로서 작용한다 (Song and Scharf, 2009). 국내에서도 널리 사용되고 있으나 사용시 처리방법에 대한 표준화가 부재하여 꿀벌에 대한 약해가 빈번히 발생하고 있다. 꿀벌에 대한 독성을 최소화할 수 있는 처리방식에 대한 보완이 이루어진다면 합성 살비제에 저항성이 발달된 꿀벌응애 방제에 유용하게 사용될 수 있다.
고찰 및 제언
월동 전 봉군 내의 꿀벌응애 밀도가 높을 경우 월동 실패 가능성이 크게 증가한다는 점은 이미 국외의 여러 사례들로 입증된 바 있으므로 (Genersch et al., 2010; Guzmán-Novoa et al., 2010; Schäfer et al., 2010; Van Dooremalen et al., 2012), 월동 전 꿀벌응애의 효율적인 방제가 필수적이다. 국내에서도 월동 전 꿀벌응애를 신속하고 효과적으로 방제하기 위해서는 비교적 살충효력이 우수한 합성 살비제를 관행적으로 사용하고 있다. 그러나, 최근 플루발리네이트를 비롯한 피레스로이드계 약제에 대한 국내 꿀벌응애의 저항성이 광범위하게 확산되고 있으므로 이는 저항성 발달에 따른 꿀벌응애 방제 실패가 최근 대두된 월동봉군 폐사의 원인이 될 수 있음을 시사한다. 월동봉군 폐사의 재발 방지를 위해서는 플루발리네이트 저항성 꿀벌응애의 확산에 따른 방제실패와 월동봉군 폐사 간의 연관성을 정확하게 규명하기 위해서는 몇 가지 체계적인 연구가 필요하다.
첫째, 최근 조사된 플루발리네이트 저항성 형질은 지역간 급속도로 확산되는 경향을 보이는데 급속한 확산이 가능한 제반 원인이 규명되어야 한다. 이를 위해 양봉장 내 뿐만아니라 양봉장 간 시기별 저항성 형질 동태를 추적하여 저항성 확산 및 발달을 억제할 수 있는 해결책을 제시할 수 있을 것으로 보인다.
둘째, 월동 전 플루발리네이트 저항성 꿀벌응애가 충분히 방제되지 않았을 경우를 가정하여 월동봉군 내 꿀벌응애 저항성 형질 동태를 조사하고 월동 전후 꿀벌응애의 유전자 발현양상 변화를 추적하여 월동시 저항성 꿀벌응애의 적응도 (fitness)에 대한 정보확보가 시급하다. 이를 통해 플루발리네이트 저항성 형질의 적응이점 (fitness advantage) 또는 적응비용 (fitness cost)을 정량화하여 저항성 형질의 존재가 봉군폐사에 미치는 영향을 검증할 수 있다.
셋째, 벌통 내 잔류물 (hive debris)을 대상으로 꿀벌응애 밀도와 바이러스를 비롯한 병원체의 밀도를 정량화함으로써 봉군 위해도 평가기술을 개발하여 보다 용이하게 상시적으로 봉군 건강도를 모니터링할 수 있는 체계구축이 필요하다. 이를 토대로 월동 전 봉군의 월동 성공가능성을 사전에 평가하고 보완함으로써 월동 성공률을 제고한다.
꿀벌응애의 플루발리네이트 저항성과 월동봉군 폐사 간의 연관성 규명 여부와 관계없이 월동 전 봉군 내 꿀벌응애의 플루발리네이트 저항성이 의심될 경우에는 플루발리네이트 및 플루메스린의 사용을 금지하고 여타의 합성 살비제 및 천연 살비제를 대체 약제로 선발하여 교차사용해야 한다. 이를 위해서는 전국적으로 꿀벌응애 저항성을 조사하여 저항성 지도를 작성하고 저항성 발달 실태에 따라 적절한 약제를 선발하는 것이 필수적이다. 따라서 정기적인 저항성 모니터링을 위해서는 농가현장에서 신속하고 용이하게 저항성 수준을 판별할 수 있는 생물검정 기법의 개발 뿐만 아니라 저항성 분자마커 (molecular resistance marker)를 발굴하고 이를 활용한 분자진단 (molecular diagnosis) 기법의 개발도 병행되어야 한다. 살비제별 표적유전자 상에서 발생되는 저항성 돌연변이 이외도 꿀벌응애 체내에서 독물질을 분해하는 산화효소 (cytochrome P450)를 비롯한 다양한 대사효소들도 저항성 요인으로 작용하므로 이들 효소의 발현량을 분자마커로 개발하여 저항성 모니터링에 활용한다면 보다 정확한 저항성 예측이 가능하다.
또한, 다양한 제품명으로 유통되고 있는 꿀벌응애 방제제의 유효성분에 따른 고유번호 또는 코드를 부여하여 양봉농가에서 약제의 교차사용을 용이하게 할 수 있는 체계구축과 교차사용의 중요성을 강조할 수 있는 농가교육이 시급하다. 아울러서 유통되고 있는 약제의 철저한 품질검사를 통해 함량미달 약제의 오사용을 통한 저항성 발달을 억제해야 한다. 꿀벌응애 밀도를 조사하기 위한 봉개 소방 조사법을 보완 및 체계화하여 농가에 보급함으로써 약제처리 후 꿀벌응애 방제가를 신속하게 조사하여 대상 약제의 저항성 발달 여부를 현장에서 파악하고 최적약제 선발에 필요한 정보를 조기에 확보할 수 있어야 한다. 또한, 꿀벌응애의 살비제 저항성을 신속하게 조사할 수 있는 바이알잔류접촉법과 같은 현장진단법을 보급하여 농가참여 저항성 모니터링을 통한 CT 기반 저항성 정보교류체계를 구축한다면 보다 용이하게 범국가적 꿀벌응애 저항성 관리가 가능하게 될 것이다.
꿀벌응애 방제를 위해 상이한 합성 살비제를 교차 사용하더라도 지속적으로 사용할 경우, 벌통 내의 과다잔류 문제를 야기할 수 있으므로 화학적 방제 수단뿐만 아니라 생태적·기계적 방제법 등을 동시에 활용하여 종합적 관리가 이루어질 수 있도록 해야 하며 건강한 봉군 육성에 만전을 기해야 한다. 2010년도 미국 펜실베니아 대학에서 보고한 미국 양봉농가의 벌통 내 농약잔류 실태에 대한 보고에 따르면 총 23개주의 양봉농가에서 수집한 259점의 밀납시료 및 350점의 화분시료를 분석한 결과 47% 이상의 밀납시료에서 살비제인 플루발리네이트, 쿠마포스 및 아미트라즈 대사물, 살균제인 Chlorothalonil이 검출되었으며 화분에서는 상술한 살비제 이외에도 다양한 살균제 및 살충제가 검출되었다 (Mullin et al., 2010). 따라서 벌통 내, 특히 소비밀납에 잔류된 다양한 꿀벌응애 방제용 살비제의 수준은 만성독성이 우려될 수 있는 수준이므로 향후 국내 양봉농가에서의 약제잔류 수준 실태에 대한 조사가 필요하며 더 나아가 이들 약제의 잔류수준이 꿀벌에 미칠 수 있는 만성적 영향에 대한 연구가 필요하다.
Acknowledgments
본 연구는 농촌진흥청 연구과제 (PJ015763)의 지원으로 수행되었다.
References
-
Alissandrakis, E., A. Ilias and A. Tsagkarakou. 2017. Pyrethroid target site resistance in Greek populations of the honey bee parasite Varroa destructor (Acari: Varroidae). J. Apic. Res. 56: 625-630.
[https://doi.org/10.1080/00218839.2017.1368822]

-
Annoscia, D., F. Del Piccolo and F. Nazzi. 2012. How does the mite Varroa destructor kill the honeybee Apis mellifera? Alteration of cuticular hydrcarbons and water loss in infested honeybees. J. Insect Physiol. 58: 1548-1555.
[https://doi.org/10.1016/j.jinsphys.2012.09.008]

-
Benito-Murcia, M., C. Bartolomé, X. Maside, J. Bernal, J. L. Bernal, M. J. del Nozal, A. Meana, C. Botías, R. Martín-Hernández and M. Higes. 2021. Residual Tau-Fluvalinate in Honey Bee Colonies is Coupled with Evidence for Selection for Varroa destructor Resistance to Pyrethroids. Insects 12: 731.
[https://doi.org/10.3390/insects12080731]

-
Bonsall, J. L. and G. J. Turnbull. 1983. Extrapolation from safety data to management of poisoning with reference to amitraz (a Formamidine Pesticide) and xylene. Hum. Toxicol. 2: 587-592.
[https://doi.org/10.1177/096032718300200403]

-
Bonzini, S., P. Tremolada, I. Bernardinelli, M. Colombo and M. Vighi. 2011. Predicting pesticide fate in the hive (part 1): experimentally determined τ-fluvalinate residues in bees, honey and wax. Apidologie 42: 378-390.
[https://doi.org/10.1007/s13592-011-0011-2]

-
Bowen-Walker, P. L. and A. Gunn. 2001. The effect of the ectoparasitic mite, Varroa destructor on adult worker honeybee (Apis mellifera) emergence weights, water, protein, carbohydrate, and lipid levels. Entomol. Exp. Appl. 101: 207-217.
[https://doi.org/10.1046/j.1570-7458.2001.00905.x]

-
Catterall, W. A., S. Cestèle, V. Yarov-Yarovoy, H. Y. Frank, K. Konoki and T. Scheuer. 2007. Voltage-gated ion channels and gating modifier toxins. Toxicon 49: 124-141.
[https://doi.org/10.1016/j.toxicon.2006.09.022]

-
Choi, J. C., D. Park and L. C. Griffith. 2004. Electrophysiological and morphological characterization of identified motor neurons in the Drosophila third instar larva central nervous system. J. Neurophysiol. 91: 2353-2365.
[https://doi.org/10.1152/jn.01115.2003]

-
Currie, R. W., S. F. Pernal and E. Guzmán-Novoa. 2015. Honey bee colony losses in Canada. J. Apic. Res. 49: 104-106.
[https://doi.org/10.3896/IBRA.1.49.1.18]

-
Davies, T., L. Field, P. Usherwood and M. Williamson. 2007. DDT, pyrethrins, pyrethroids and insect sodium channels. IUBMB life 59: 151-162.
[https://doi.org/10.1080/15216540701352042]

-
Dong, K., Y. Du, F. Rinkevich, Y. Nomura, P. Xu, L. Wang, K. Silver and B. S. Zhorov. 2014. Molecular biology of insect sodium channels and pyrethroid resistance. Insect Biochem. Mol. Biol. 50: 1-17.
[https://doi.org/10.1016/j.ibmb.2014.03.012]

-
Downey, D. L. and M. L. Winston. 2001. Honey bee colony mortality and productivity with single and dual infestations of parasitic mite species. Apidologie 32: 567-575.
[https://doi.org/10.1051/apido:2001144]

-
Elzen, P. J., F. A. Eischen, J. R. Baxter, G. W. Elzen and W. T. Wilson. 1999. Detection of resistance in US Varroa jacobsoni Oud. (Mesostigmata: Varroidae) to the acaricide fluvalinate. Apidologie 30: 13-17.
[https://doi.org/10.1051/apido:19990102]

- Elzen, P. J., F. A. Eischen, J. B. Baxter, J. Pettis, G. W. Elzen and W. T. Wilson. 1998. Fluvalinate resistance in Varroa jacobsoni from several geographic locations. Am. Bee J. 138: 674-676.
-
Enan, E. E. 2005. Molecular response of Drosophila melanogaster tyramine receptor cascade to plant essential oils. Insect Biochem. Mol. Biol. 35: 309-321.
[https://doi.org/10.1016/j.ibmb.2004.12.007]

-
Ffrench-Constant, R. H., M. S. Williamson, T. E. Davies and C. Bass. 2016. Ion channels as insecticide targets. J. Neurogenet. 30: 163-177.
[https://doi.org/10.1080/01677063.2016.1229781]

-
Genersch, E., W. Von Der Ohe, H. Kaatz, A. Schroeder, C. Otten, R. Büchler, S. Berg, W. Ritter, W. Mühlen and S. Gisder. 2010. The German bee monitoring project: a long term study to understand periodically high winter losses of honey bee colonies. Apidologie 41: 332-352.
[https://doi.org/10.1051/apido/2010014]

-
González-Cabrera, J., H. Bumann, S. Rodríguez-Vargas, P. J. Kennedy, K. Krieger, G. Altreuther, A. Hertel, G. Hertlein, R. Nauen and M. S. Williamson. 2018. A single mutation is driving resistance to pyrethroids in European populations of the parasitic mite, Varroa destructor. J. Pest Sci. 91: 1137-1144.
[https://doi.org/10.1007/s10340-018-0968-y]

-
González-Cabrera, J., T. G. E. Davies, L. M. Field, P. J. Kennedy and M. S. Williamson. 2013. An Amino Acid Substitution (L925V) Associated with Resistance to Pyrethroids in Varroa destructor. PloS one 8: e82941.
[https://doi.org/10.1371/journal.pone.0082941]

-
González-Cabrera, J., S. Rodríguez-Vargas, T. G. E. Davies, L. M. Field, D. Schmehl, J. D. Ellis, K. Krieger and M. S. Williamson. 2016. Novel Mutations in the Voltage-Gated Sodium Channel of Pyrethroid-Resistant Varroa destructor Populations from the Southeastern USA. PloS one 11: e0155332.
[https://doi.org/10.1371/journal.pone.0155332]

-
Gu, H. and D. K. O̓Dowd. 2006. Cholinergic synaptic transmission in adult Drosophila Kenyon cells in situ. J. Neurosci. 26: 265-272.
[https://doi.org/10.1523/JNEUROSCI.4109-05.2006]

-
Guzmán-Novoa, E., L. Eccles, Y. Calvete, J. McGowan, P. G. Kelly and A. Correa-Benítez. 2010. Varroa destructor is the main culprit for the death and reduced populations of overwintered honey bee (Apis mellifera) colonies in Ontario, Canada. Apidologie 41: 443-450.
[https://doi.org/10.1051/apido/2009076]

-
Higes, M., R. Martín-Hernández, C. S. Hernández-Rodríguez and J. González-Cabrera. 2020. Assessing the resistance to acaricides in Varroa destructor from several Spanish locations. Parasitol. Res. 119: 3595-3601.
[https://doi.org/10.1007/s00436-020-06879-x]

-
Hodgkin, A. L. and A. F. Huxley. 1952. A quantitative description of membrane current and its application to conduction and excitation in nerve. J. Physiol. 117: 500.
[https://doi.org/10.1113/jphysiol.1952.sp004764]

-
Hubert, J., M. Nesvorna, M. Kamler, J. Kopecky, J. Tyl, D. Titera and J. Stara. 2014. Point mutations in the sodium channel gene conferring tau-fluvalinate resistance in Varroa destructor. Pest Manag. Sci. 70: 889-894.
[https://doi.org/10.1002/ps.3679]

-
Jeong, S., C. Lee, D. Kim and C. Jung. 2016. Questionnaire study on the overwintering success and pest management of honeybee and damage assessment of vespa hornets in Korea. J. Apic. 31: 201-210.
[https://doi.org/10.17519/apiculture.2016.09.31.3.201]

-
Jiang, S. A., J. M. Campusano, H. Su and D. K. O̓Dowd. 2005. Drosophila mushroom body Kenyon cells generate spontaneous calcium transients mediated by PLTX-sensitive calcium channels. J. Neurophysiol. 94: 491-500.
[https://doi.org/10.1152/jn.00096.2005]

-
Johnson, R. M., H. S. Pollock and M. R. Berenbaum. 2009. Synergistic Interactions Between In-Hive Miticides in Apis mellifera. J. Econ. Entomol. 102: 474-479.
[https://doi.org/10.1603/029.102.0202]

-
Kamler, M., M. Nesvorna, J. Stara, T. Erban and J. Hubert. 2016. Comparison of tau-fluvalinate, acrinathrin, and amitraz effects on susceptible and resistant populations of Varroa destructor in a vial test. Exp. Appl. Acarol. 69: 1-9.
[https://doi.org/10.1007/s10493-016-0023-8]

- Kim, D. W. and C. E. Jung. 2008. Evaluation of Chemical Susceptibility for the Ectoparasitic Mite Varroa destructor Anderson and Trueman (Mesostigmata: Varroidae) in Honeybee (Apis mellifera L.). J. Apic. 23: 259-268.
- Kim, W., M. Lee, S. Han, K. Park, J. Choi, J. Kim, Y. Choi, G. Jeong and Y. Koh. 2009. A geographical polymorphism in a voltage-gated sodium channel gene in the mite, Varroa destructor, from Korea. J. Apic. 24: 159-165.
-
Kuo, H.-W. and W. Cheng. 2018. Octopamine enhances the immune responses of freshwater giant prawn, Macrobrachium rosenbergii, via octopamine receptors. Dev. Comp. Immunol. 81: 19-32.
[https://doi.org/10.1016/j.dci.2017.11.002]

- Lee, J.-H. and K.-S. Woo. 1995. The study on the mites inhabiting the bee-hives in Korea II. J. Apic. 10: 29-34.
- Lee, M.-L., M.-Y. Lee, Y.-S. Kim, S. H. Nam, S. J. Chang and C. H. Ryu. 2004. Preliminary tests of miticides and several natural compounds for control of Varroa destructor. J. Apic. 19: 57-60.
- Lee, M.-L., Y.-M. Park, M.-Y. Lee, Y.-S. Kim and H.-K. Kim. 2005. Density distribution of parasitic mites, Varroa destructor anderson & trumen and Tropilaelaps clareae delfinadi & baker, on honeybee pupae (Apis mellifera L.) in autumn season in Korea. J. Apic. 20: 103-108.
-
Liu, Z., J. Tan, Z. Y. Huang and K. Dong. 2006. Effect of a fluvalinate-resistance-associated sodium channel mutation from varroa mites on cockroach sodium channel sensitivity to fluvalinate, a pyrethroid insecticide. Insect Biochem. Mol. Biol. 36: 885-889.
[https://doi.org/10.1016/j.ibmb.2006.08.006]

-
Loughney, K., R. Kreber and B. Ganetzky. 1989. Molecular analysis of the para locus, a sodium channel gene in Drosophila. Cell 58: 1143-1154.
[https://doi.org/10.1016/0092-8674(89)90512-6]

- Macedo, P., M. Ellis and B. Siegfried. 2002. Detection and quantification of fluvalinate resistance in Varroa mites in Nebraska. Am. Bee J. 142: 523-526.
-
Martin, S. J. 2004. Acaricide (pyrethroid) resistance in Varroa destructor. Bee World 85: 67-69.
[https://doi.org/10.1080/0005772X.2004.11099632]

- Mehlhorn, H. 2008. Bromopropylate. Springer-Verlag Berlin Heidelberg, Berlin, Heidelberg.
-
Milani, N. 1995. The resistance of Varroa jacobsoni Oud to pyrethroids: a laboratory assay. Apidologie 26: 415-429.
[https://doi.org/10.1051/apido:19950507]

- Milani, R. 1956. Mendelian behavior of resistance to the knockdown action of DDT and correlation between knockdown and mortality in Musca domestica L. Rend Ist Sup Sanit 19: 1107-1143.
-
Millan-Leiva, A., O. Marin, K. Christmon, D. vanEngelsdorp and J. Gonzalez-Cabrera. 2021. Mutations associated with pyrethroid resistance in Varroa mite, a parasite of honey bees, are widespread across the United States. Pest Manag. Sci. 77: 3241-3249.
[https://doi.org/10.1002/ps.6366]

-
Mozes-Koch, R., Y. Slabezki, H. Efrat, H. Kalev, Y. Kamer, B. A. Yakobson and A. Dag. 2000. First detection in Israel of fluvalinate resistance in the varroa mite using bioassay and biochemical methods. Exp. Appl. Acarol. 24: 35-43.
[https://doi.org/10.1023/A:1006379114942]

-
Mullin, C. A., M. Frazier, J. L. Frazier, S. Ashcraft, R. Simonds, D. vanEngelsdorp and J. S. Pettis. 2010. High levels of miticides and agrochemicals in north american apiaries: implications for honey bee health. PloS one 5: e9754.
[https://doi.org/10.1371/journal.pone.0009754]

-
Narahashi, T. 1996. Neuronal ion channels as the target sites of insecticides. J. Pharmacol. Toxicol. 79: 1-14.
[https://doi.org/10.1111/j.1600-0773.1996.tb00234.x]

- Narahashi, T. 2000. Neuroreceptors and ion channels as the basis for drug action: past, present, and future. J. Pharmacol. Exp. Ther. 294: 1-26.
-
Narahashi, T. 2002. Nerve membrane ion channels as the target site of insecticides. Mini Rev. Med. Chem. 2: 419-432.
[https://doi.org/10.2174/1389557023405927]

- Noureddine, A. and N. Haddad. 2013. Varroa destructor resistance to fluvalinate in Algeria. Trends Entomol. 9: 35-38.
-
O̓Neal, S. T., C. C. Brewster, J. R. Bloomquist and T. D. Anderson. 2017. Amitraz and its metabolite modulate honey bee cardiac function and tolerance to viral infection. J. Invertebr. Pathol. 149: 119-126.
[https://doi.org/10.1016/j.jip.2017.08.005]

-
O̓Reilly, A. O., B. P. S. Khambay, M. S. Williamson, L. M. Field, B. A. WAllace and T. G. E. Davies. 2006. Modelling insecticide-binding sites in the voltage-gated sodium channel. Biochem. 396: 255-263.
[https://doi.org/10.1042/BJ20051925]

-
Park, D. and L. C. Griffith. 2006. Electrophysiological and anatomical characterization of PDF-positive clock neurons in the intact adult Drosophila brain. J. Neurophysiol. 95: 3955-3960.
[https://doi.org/10.1152/jn.00117.2006]

-
Phokasem, P., L. I. de Guzman, K. Khongphinitbunjong, A. M. Frake and P. Chantawannakul. 2019. Feeding by Tropilaelaps mercedesae on pre-and post-capped brood increases damage to Apis mellifera colonies. Sci. Rep. 9: 1-12.
[https://doi.org/10.1038/s41598-019-49662-4]

-
Priestley, C. M., E. M. Williamson, K. A. Wafford and D. B. Sattelle. 2003. Thymol, a constituent of thyme essential oil, is a positive allosteric modulator of human GABAA receptors and a homo-oligomeric GABA receptor from Drosophila melanogaster. Br. J. Pharmacol. 140: 1363-1372.
[https://doi.org/10.1038/sj.bjp.0705542]

- RAD. 2022. 전국 양봉농가 월동 꿀벌 피해 민관 합동 조사 결과. https://www.rda.go.kr/board/board.do?boardId=farmprmninfo&prgId=day_farmprmninfoEntry&currPage=1&dataNo=100000777725&mode=updateCnt&searchSDate=&searchEDate=&totalSearchYn=Y, Accessed 8 Sep. 2022.
-
Ramsey, S. D., R. Ochoa, G. Bauchan, C. Gulbronson, J. D. Mowery, A. Cohen, D. Lim, J. Joklik, J. M. Cicero and J. D. Ellis. 2019. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proc. Natl. Acad. Sci. 116: 1792-1801.
[https://doi.org/10.1073/pnas.1818371116]

-
Ray, D. E. and J. R. Fry. 2006. A reassessment of the neurotoxicity of pyrethroid insecticides. Pharmacol. Ther. 111: 174-193.
[https://doi.org/10.1016/j.pharmthera.2005.10.003]

-
Rinkevich, F. D., Y. Du and K. Dong. 2013. Diversity and convergence of sodium channel mutations involved in resistance to pyrethroids. Pestic. Biochem. Physiol. 106: 93-100.
[https://doi.org/10.1016/j.pestbp.2013.02.007]

-
Rohrbough, J. and K. Broadie. 2002. Electrophysiological analysis of synaptic transmission in central neurons of Drosophila larvae. J. Neurophysiol. 88: 847-860.
[https://doi.org/10.1152/jn.2002.88.2.847]

-
Rosenkranz, P., P. Aumeier and B. Ziegelmann. 2010. Biology and control of Varroa destructor. J. Invertebr. Pathol. 103: S96-S119.
[https://doi.org/10.1016/j.jip.2009.07.016]

- RW C. 2001. Management of parasitic mites in honey bees. Accessed
-
Sammataro, D., L. de Guzman, S. George, R. Ochoa and G. Otis. 2013. Standard methods for tracheal mite research. J. Apic. Res. 52: 1-20.
[https://doi.org/10.3896/IBRA.1.52.4.20]

-
Schäfer, M. O., W. Ritter, J. S. Pettis and P. Neumann. 2010. Winter Losses of Honeybee Colonies (Hymenoptera: Apidae): The Role of Infestations With Aethina tumida (Coleoptera: Nitidulidae) and Varroa destructor (Parasitiformes: Varroidae). J. Econ. Entomol. 103: 10-16.
[https://doi.org/10.1603/EC09233]

-
Sengupta, B., M. Stemmler, S. B. Laughlin and J. E. Niven. 2010. Action potential energy efficiency varies among neuron types in vertebrates and invertebrates. PLoS Comput. Biol. 6: e1000840.
[https://doi.org/10.1371/journal.pcbi.1000840]

-
Sheeba, V., H. Gu, V. K. Sharma, D. K. O̓Dowd and T. C. Holmes. 2008a. Circadian- and light-dependent regulation of resting membrane potential and spontaneous action potential firing of Drosophila circadian pacemaker neurons. J. Neurophysiol. 99: 976-988.
[https://doi.org/10.1152/jn.00930.2007]

-
Sheeba, V., V. K. Sharma, H. Gu, Y.-T. Chou, D. K. O̓Dowd and T. C. Holmes. 2008b. Pigment dispersing factor-dependent and- independent circadian locomotor behavioral rhythms. J. Neurosci. 28: 217-227.
[https://doi.org/10.1523/JNEUROSCI.4087-07.2008]

-
Sherby, S. M., A. T. Eldefrawi, S. S. Deshpande, E. X. Albuquerque and M. E. Eldefrawi. 1986. Effects of pyrethroids on nicotinic acetylcholine receptor binding and function. Pestic. Biochem. Physiol. 26: 107-115.
[https://doi.org/10.1016/0048-3575(86)90082-9]

-
Soderlund, D. M. 2005. Sodium Channels. Elsevier.
[https://doi.org/10.1016/B0-44-451924-6/00068-5]

-
Soderlund, D. M. 2012. Molecular mechanisms of pyrethroid insecticide neurotoxicity: recent advances. Arch. Toxicol. 86: 165-181.
[https://doi.org/10.1007/s00204-011-0726-x]

-
Song, C. and M. E. Scharf. 2009. Mitochondrial impacts of insecticidal formate esters in insecticide-resistant and insecticide-susceptible Drosophila melanogaster. Pest Manag. Sci. 65: 697-703.
[https://doi.org/10.1002/ps.1747]

-
Tan, J., Z. Liu, R. Wang, Z. Y. Huang, A. C. Chen, M. Gurevitz and K. Dong. 2005. Identification of amino acid residues in the insect sodium channel critical for pyrethroid binding. Mol. Pharmacol. 67: 513-522.
[https://doi.org/10.1124/mol.104.006205]

-
Tremolada, P., I. Bernardinelli, M. Colombo, M. Spreafico and M. Vighi. 2004. Coumaphos Distribution in the Hive Ecosystem: Case Study for Modeling Applications. Ecotoxicology 13: 589-601.
[https://doi.org/10.1023/B:ECTX.0000037193.28684.05]

-
Trouiller, J. 1998. Monitoring Varroa jacobsoni resistance to pyrethroids in western Europe. Apidologie 29: 537-546.
[https://doi.org/10.1051/apido:19980606]

- Tsigouri, A., U. Menkissoglu-Spiroudi, Spiroudi, A. Thrasyvoulou and G. Diamantidis. 2003. Fluvalinate residues in greek honey and beeswax. Apiacta 38: 50-53.
-
Vais, H., S. Atkinson, N. Eldursi, A. L. Devonshire, M. S. Williamson and P. N. R. Usherwood. 2000. A single amino acid change makes a rat neuronal sodium channel highly sensitive to pyrethroid insecticides. FEBS Lett. 470: 135-138.
[https://doi.org/10.1016/S0014-5793(00)01305-3]

-
Vais, H., S. Atkinson, F. Pluteanu, S. J. Goodson, A. L. Devonshire, M. S. Williamson and P. N. R. Usherwood. 2003. Mutations of the para sodium channel of Drosophila melanogaster identify putative binding sites for pyrethroids. Mol. Pharmacol. 64: 914-922.
[https://doi.org/10.1124/mol.64.4.914]

-
Van Dooremalen, C., L. Gerritsen, B. Cornelissen, J. J. van der Steen, F. van Langevelde and T. Blacquiere. 2012. Winter survival of individual honey bees and honey bee colonies depends on level of Varroa destructor infestation. PloS one 7: e36285.
[https://doi.org/10.1371/journal.pone.0036285]

-
VanEngelsdorp, D., J. D. Evans, C. Saegerman, C. Mullin, E. Haubruge, B. K. Nguyen, M. Frazier, J. Frazier, D. Cox-Foster and Y. Chen. 2009. Colony collapse disorder: a descriptive study. PloS one 4: e6481.
[https://doi.org/10.1371/journal.pone.0006481]

-
VanEngelsdorp, D. and M. D. Meixner. 2010. A historical review of managed honey bee populations in Europe and the United States and the factors that may affect them. J. Invertebr. Pathol. 103: S80-S95.
[https://doi.org/10.1016/j.jip.2009.06.011]

-
Williamson, M. S., D. Martinez-Torres, C. A. Hick and A. L. Devonshire. 1996. Identification of mutations in the houseflypara-type sodium channel gene associated with knockdown resistance (kdr) to pyrethroid insecticides. Mol. Genet. Genom. 252: 51-60.
[https://doi.org/10.1007/BF02173204]

-
Yang, X. and D. Cox-Foster. 2007. Effects of parasitization by Varroa destructor on survivorship and physiological traits of Apis mellifera in correlation with viral incidence and microbial challenge. Parasitology 134: 405-412.
[https://doi.org/10.1017/S0031182006000710]

-
Yang, X. and D. L. Cox-Foster. 2005. Impact of an ectoparasite on the immunity and pathology of an invertebrate: evidence for host immunosuppression and viral amplification. Proc. Natl. Acad. Sci. 102: 7470-7475.
[https://doi.org/10.1073/pnas.0501860102]