The Optimal Method and Solution for Collecting Sperm of Bumblebee Male
Artificial insemination is a technique to transfer instrumentally sperm from the male into the female’s reproductive system. A key factor among artificial insemination techniques is gathering sperms. Here, a method for collecting sperm of bumblebee male by pressing was firstly developed. This method has stage of separating reprodutive tract of male, separating accessory testis, separating vas deferens, pressing vas deferens with cover-glass and collecting sperm with syringe. The developed method was 2.8 fold higher in rate of collecting sperm than that of existing method. Among 1M NaCl-, Insect ringer solution-, Phosphate buffered saline (PBS) - collecting sperm solutions, PBS was exhibited the best result as 17.2 sperms/cell, which corresponded to 1.6~1.8 fold increased over the result of other collecting sperm solution. Consequently, we think that this method is very important technique to save time for collecting sperm, to keep activity of sperm and to reduce contamination of sperm.
Keywords:
Bumblebees, Bombus ignitus, Artificial insemination, Male, Collecting sperm서 론
인공수정이란 수컷의 정자를 암컷의 생식기관에 인공적으로 옮기는 기술을 말한다. 이 기술은 멸종위기에 있는 종을 보전하기 위해서 특별한 육종프로그램을 통해서 유용하게 응용되는 수정방법으로, 계절에 관계없이 육종이 가능하고 병의 전염을 예방할 수 있는 장점도 가지고 있다(Evans and Maxwell, 1987; Chen et al., 1994; Durrant et al., 1995; Holt et al., 1996). 인공수정은 돼지, 염소, 양 및 닭 등 척추동물에서 많이 사용, 발달되어 왔으나 무척추동물에서는 바다가재(Homarus sp.)(Waddy and Aiken, 1984), 참새우(Penaeus monodon)(Benzie et al., 1995) 및누에(Bombyx mori)(Takemura et al., 1996)와 같은 경제적으로 중요한 종에서만 발달되어 왔다. 사회성 곤충의 경우, 단지 꿀벌(Apis spp.)에서만 확실한 경제적 잠재성을 가지고 20세기 초 이후로 발달, 개선되어 왔다(Rutter, 1976). 하지만 같은 벌목(Hymenoptera), 꿀벌과(Apidae)에 속하는 뒤영벌의경우, 꿀벌에 비해 인공수정에 대한 연구가 상당히 미비한 편이다(Baer and Schmid-Hempel, 2000; Yoon et al., 2006, 2007). 이는 경제적인 면에서 꿀벌보다 효율성이 낮기 때문이라고 생각된다. 그러나 1987년부터 뒤영벌은 시설채소 및 과수 등의 화분매개곤충으로 상품화되어 세계 각국에 수출되고 있다(de Ruijter, 1997; Free, 1993; Masahiro, 2000). 2004년에는 전 세계의 뒤영벌 생산량이 100만 상자 이상으로 추정되고 있으며(Velthusis and Doorn, 2006), 그 양은 해마다 증가하고 있는 추세로, 세계적으로 경제적 중요 곤충으로 부각되고 있다(Yoon et al., 2013). 전 세계적으로 약 239종 중 단지 5종(Bombus terrestris, B. t. canariensis, B. lucorum, B. ignites, B. occidentalis and B. impatiens)만이 상업적으로 판매되고 있으며, 그중에서도 B. terrestris가 93%를 차지하고 있다(Williams, 1998; Velthusis and Doorn, 2006). 따라서 우수 종 육종을 위한 한 방법으로 뒤영벌 인공수정에 대한 연구도 활발히 진행될 것으로 생각된다. 인공수정에 있어서 가장 중요한 요소중의 하나가 정자 수집방법이다. 꿀벌의 경우, 1마리의 수벌이 약 1,000만 마리의 정자를 가지고 있다(Ruttner, 1976; Schley, 1987). 반면에 뒤영벌 수벌은 꿀벌보다는 크기는 하지만 정자수가 40만-60만으로 꿀벌 수벌 정자수의 1/10 정도밖에 되지 않는다(Roseler, 1973; Dechateau and Marien, 1995; Baer and Schmid-Hempel, 2000). 뒤영벌 수벌은 우화 6일 이후부터 정자가 정소관(또는 수정관 Vas deferentiae)으로 이동하여 정소관은 커지고 고환은 작아지며, 각 정소관의 중간 부분은 결국 두꺼워지고, 성숙한 정자를 위한 저장기관으로서 제공되는 정소낭(Accessory testis)을 형성한다. 또한 정소관에서 정자수는 우화 13일 동안은 증가 하지만 그 후부터는 감소를 한다(Dechateau and Marien, 1995). Tasei et al.(1998)은 뒤영벌 수벌은 우화 6일에서 20일 사이에 성적으로 숙성한다고 보고하였다. 정자를 채취할 경우, 살아있는 수벌의 복부를 눌러 정자와 점액이 도출되면 우유빛 점액위에 떠 있는 갈색 부분의 정자만을 수집하는 꿀벌과 달리 뒤영벌의 경우, 수벌을 탄산가스를 이용하여 마취시킨 후, 해부하여 생식기를 분리시킨 다음, 분리된 생식기로 부터 정자를 채취하는 방법이 이용되어 왔다(Baer and Schmid-Hempel, 2000). 그러나 이와 같은 정자 채취방법은 정자를 채취하는데 많은 시간이 소요되고, 수벌의 마취 후 해부과정을 거치면서 정자의 활성도가 떨어질 뿐 아니라, 정자가 오염될 우려가 있었다. 이러한 문제점을 생식기 돌출에 의한 뒤영벌 정자 채취법을 개발함으로서 해결할 수 있었다(Yoon et al., 2006). 하지만 이 방법중에서 정자 수집과정이 정소낭의 위쪽을 핀셋으로 고정시킨 후, 또 다른 핀셋으로 꼬여 있는 정소낭을 위부분에서 아래부분으로 길게늘여가면서 정자들을 정소낭의 외부로 밀어 쏟아내는 방법이기 때문에 정자 수집과정에서 시간의 소요와 정자 수획률에 다소 어려움이 있었다.
따라서 본 실험에서는 분리된 뒤영벌 수벌의 생식기로부터 활성이 높은 정자를 효과적으로 수집하는 방법을 개발하고자 하였다. 또한 뒤영벌 정자 수집과정에 필요한 용액을 선발하고자 하였다.
재료 및 방법
실험곤충
실험곤충은 국립농업과학원 농업생물부 곤충산업과 화분매개곤충연구실에서 실내 계대 사육한 2세대 호박벌(B. ignitus) 수벌을 대상으로 실험을 수행하였다. 호박벌 수벌은 우화 후 8일~10일 된 것을 사용하였다. 실험곤충 사육은 기본적으로 전에 보고된 방법(Yoon et al., 2002; Yoon et al., 2004)에 준하여 행하였다.
뒤영벌 정자 수집법
본 실험에서 효율적인 뒤영벌 정자 수집을 위해서 성숙한 수벌의 복부 내에 있는 생식기를 수벌에서 분리시키는 생식기 분리단계, 분리된 생식기로부터 정소낭이 붙어 있는 정소관을 분리시키는 정소관 분리 단계, 분리된 정소관으로부터 정소낭을 분리시키는 정소낭 분리단계, 분리된 정소낭을 용액이 있는 슬라이드글라스 위에 놓고 커버글라스를 덮는 단계, 상기 커버글라스를 눌러 정소낭으로부터 정자를 뽑아내는 단계 및 상기 정자를 주사기를 이용하여 흡입하는 단계를 이용하였다.
뒤영벌의 정자 수획률 및 용액별 활성도 조사
본 실험에서 개발된 누름에 의한 정자수집법과 정소낭의 윗부분을 핀셋으로 고정한 후, 다른 핀셋을 이용하여 꼬여 있는 정소낭을 아래쪽으로 길게 늘여 가면서 정소낭 내부에 있는 정자를 외부로 밀어내어 정자가 쏟아져 나오도록 하는 기존방법(Yoon et al., 2006)에 대해서 뒤영벌의 정자 수획률을 비교 조사하였다. 실험에 사용된 정소관수는 각각 20개이었다.
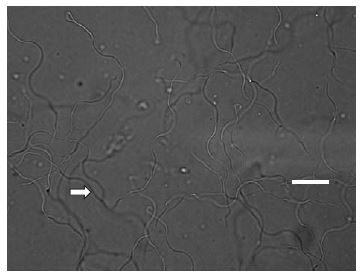
정자 수집과정에서 사용되는 용액종류별 정자 활성도를 조사하기위해서 증류수를 대조로 1M NaCl, Insect ringer 용액 및 생리식염수(Phosphate Buffered Saline, PBS) 등 3종류의 용액을 사용하였다. 실험에 사용한 곤충은 우화 8-10일 된 2세대 호박벌 수벌을 사용하였다. 시험구별로 증류수는 776개, 1M NaCl은 744개, Insect ringer 용액은 864개, 생리식염수는 1,377개의 정자를 조사하였다. 용액에 따른 정자 활성도를 측정은 정자의 형태에 따라 꼬임, 반 풀림, 풀림으로 구분한 다음, 풀림 형태로 된 정자가 활성도가 가장 높은 것으로 나타내었다(Fig. 4). 또한 정자활성도가 높았던 생리식염수와 Insect ringer 용액에 대해서 활동 cell 비율과 활동 정자비율로 정자 활동정도를 비교하였다. 실험에 사용한 곤충은 위의 용액종류별 정자활성도 조사와 동일하였다. 활동 cell 비율은 시험구별 80개의 cell을, 활동 정자비율은 Insect ringer 용액 395개, 생리식염수는 1,377개의 정자를 사용하였다.
통계분석
본 실험의 통계분석을 위하여 Oneway ANOVA test, Chi-square test(MINITAB Release 16 for Windows, 2013) 및 T-Test(SPSS PASW Statistics 18.0, 2009)을 사용하였다. 정자 수획률과 용액종류별 정자 활성도에 대한 통계분석은 Oneway ANOVA test을 사용한 후 사후검정으로 Tukey HSD test를 사용하였다. 정자 활동수는 Chi-square test와T-Test를 이용하였다.
결과 및 고찰
뒤영벌의 정자 수집법
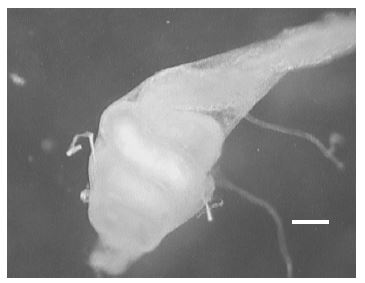
본 실험에서 효율적인 뒤영벌 정자 수집을 위해서 누름에 위한 정자수집법을 개발하였다. 개발된 방법은 성숙한 수벌의 복부 내에 있는 생식기를 분리하고, 이로부터 정소관 및 정소낭을 분리하는 단계, 상기 분리된 정소낭을 용액이 있는 용기 위에 놓고 커버글라스를 덮는 단계, 상기 커버글라스를 눌러 정소낭으로부터 정자를 뽑아내는 단계를 포함하는 것이다. 이를 각 단계별로 검토하면 다음과 같다. 첫 번째 단계는 성숙한 수벌의 복부 내에 있는 생식기를 분리하고, 이로부터 정소관 및 정소낭을 분리하는 단계로 전에 보고한 방법(Yoon et al., 2006)과 동일하다. 즉 본 단계에서는 수벌의 복부를 압박하여 생식기를 돌출시킨 후, 이를 핀셋 등으로 잡아 수벌에서 생식기를 분리한다(Fig. 1). 그 다음 분리된 생식기로부터 정소낭이 붙어 있는 정소관을 분리한다. 정소관은 생식기의 정소와 사정관 사이에 붙어 있는 코일 형태를 띄는 것으로, 이를 핀셋 등을 이용해서 떼어낸다. 떼어낸 정소관으로부터 정자가 저장되는 곳인 정소낭을 분리하는데, 정소낭은 정소에서 생성된 정자가 보관되어 두껍게 꼬여있는 형태를 이루며, 코일 모양의 정소관으로 부터 칼 또는 핀셋 등으로 이를 분리한다(Fig. 2).
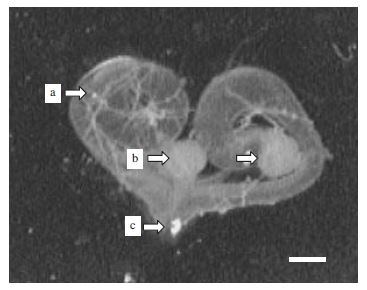
The reproductive system of B. ignitus male, (a) accessory gland; (b) accessory testes; ejaculatory duct (C). (×10) scale bar: 1mm.
두 번째 단계는 개발된 정자수집법의 핵심기술로서 다음과 같다. 첫 번째 단계에서 분리된 정소낭을 활성이 높은 정자를 수집하기 위하여, 용액이 있는 슬라이드글라스 위에 놓고 커버글라스를 덮는다. 그 다음 커버글라스를 눌러 정소낭으로 부터 정자를 뽑아낸다(Fig. 3 and Fig. 4). 이 방법을 사용할 경우, 정소낭내의 정자를 한 번에 신속하게 뽑아낼 수 있다. 이때, 커버글라스를 너무 강하게 누르면 커버글라스가 파손되거나 정자가 훼손되므로 적당한 힘으로 천천히 누르는 것이 좋다. 기존 방법은 분리된 정소낭으로부터 정자를 수집하기 위하여 정소낭을 용액이 들어 있는 글라스 위에서 핀센으로 잡아 고정시킨 후, 다른 핀셋으로 꼬여 있는 정소낭을 고정시킨 상측부터 길게 늘이면서 조심스럽게 밀어내면 정소낭 밖으로 정자가 밀려 쏟아져 나오게 하여 정자를 수집하였다. 이방법을 사용할 경우, 쏟아져 나온 정자를 수집하는 과정에서 손실이 발생할 수 있고, 외부에 노출되어 정자가 오염될 수 있다. 그러나 본 발명과 같이 커버글라스로 눌러서 정소낭으로 부터 정자를 뽑아내는 방법을 사용할 경우, 수집 효율을 높이는 동시에, 신속하게 정자를 뽑아낼 수 있고, 정자 활성도를 높게 유지 할수있다(Table 1 and Table 2).
뒤영벌의 정자 수획률 및 용액 종류별 활성도
본 실험에서 개발된 누름에 의한 정자수집법과 기존 방법(핀셋으로 정소낭의 윗부분을 고정한 후, 다른 핀셋으로 아래쪽으로 길게 늘여 가면서 정소낭 내부에 있는 정자를 외부로 밀어내는 방법)에 의한 뒤영벌의 정자 수획률을 비교 조사하였다(Table 1). 그 결과, 기존의 방식에 의할 경우, 정자의 수획률은 32.9±4.2%에 불과하였으나, 개발된 방법에 의할 경우, 90.5±4.4%로 약 2.8배나 현저하게 높았으며, 고도의 유의성이 확인되었다(Oneway ANOVA test: df=1, 36, F=1719.72, p=0.0001). 따라서 개발된 방법이 기존방법보다정자를수집하는데적합한기술이라고생각된다.
정자 수집과정에서 사용되는 용액종류별 정자활성도를 조사한 결과(Fig. 4 and Table 2), 생리식염수(PBS)가 17.2±16.2개로 활동 정자수가 가장 많았고, 그 다음은 Insect ringer 용액, 증류수, 1M NaCl 순이었다. 특히 정자의 활성도가 가장 높은 것으로 나타낸 풀림 형태의 경우, 생리식염수가 100%로 가장 높았고 그 다음이 Insect ringer 용액(89.1%), 1M NaCl(74.7%), 증류수(56.4%)순이었다. 더욱이 생리식염수의 경우, 정자의 형태가 꼬임 또는 반 풀림인 것이 전혀 없었다. 정자 활성정도는 용액종류에 따라서 큰 차이가 있었다(Oneway ANOVA test, Tukey HSD Test : df=3, df=36, F=1719.72, p=0.0001). 또한 비교적 정자 활성이 높은 것으로 나타난 Insect ringer 용액과 생리식염수의 활동 cell비율과 활동 정자비율을 비교하였다. 그 결과, Table 3에서 보는 바와 같이, 생리식염수를 처리한 경우, 활동 cell 비율이 100%로 Insect ringer 용액보다 2.5배나 높았다(Chi-square test: X2=68.571, df=1, p=0.0001). 활동 정자비율 역시 생리식염수가 48.7%로 Insect ringer 용액보다 11.3배나 높은 것을 확인하였다(TTest: F=35.393, df=20.018, p=0.0001). 위의 결과로 볼 때, 꿀벌 및 뒤영벌의 인공수정에 많이 사용되고 있는 Insect ringer 용액, 1M NaCl, 생리식염수 등 3가지 용액중에서는 생리식염수가가 정자 수획률과 활성도가 월등히 높아 뒤영벌 정자를 수집할 때 사용하기가 가장 적합한 것으로 생각된다.

Comparison of the activity of B. ignitus sperm at phosphate buffered saline and insect ringer solution
이상의 결과에서 살펴본 것처럼, 본 실험에서 개발된 뒤영벌 정자 수집법은 성숙된 뒤영벌 수벌로부터 생식기를 분리하고, 정소관 및 정소낭을 분리한 후, 분리된 정소낭에 생리식염수을 가하여 커버글라스로 눌러 내부에 있는 정자를 뽑아내는 것이다. 이 방법으로 뒤영벌 정자를 채집할 경우, 기존 정자 수집법에 비하여 정자 수획률이 높고, 활성도가 증가된 정자를 수집할 수 있었을 뿐 만 아니라 신속하게 정자를 수집할 수 있는 효과를 가지는 것을 알 수 있었다. 또한 이 때 사용하는 용액으로는 생리식염수가 가장 효과적이 있었다. 따라서 뒤영벌을 인공수정할 때, 특히 교미율이 낮은 토종 뒤영벌(Yoon et al., 2004)에 이 방법으로 정자를 수집하여 인공수정을 하면 낮은 교미율의 문제를 다소 해결할 수 있을 것으로 판단된다.
적 요
인공수정이란 수컷의 정자를 암컷의 생식기관에 인공적으로 옮기는 기술로 가장 핵심기술 가운데 하나가 정자 수집법이다. 뒤영벌 수벌에서 누름에 의해 정자를 수집하는 기술이 개발되었다. 이 기술은 수벌의 생식기를 분리 후 정소관 및 정소낭을 분리하고 커버글라스를 이용해 누름으로서 정소낭으로부터 정자를 뽑아내는 과정을 포함하는 방법이다. 이 방법으로 기존의 방법보다 정자의 수획률이 2.8배나 높았다. 3종류(1M NaCl, Insect ringer 용액, 생리식염수)의 용액에 대한 뒤영벌의 정자 활성도를 조사한 결과, 생리식염수에서 활동 정자수가 17.2개/cell로 다른 용액보다 1.6~1.8배나 많았다. 또한 정자 활성비율도 가장 높아 뒤영벌 정자 수집에 가장 적합한 용액으로 판단되었다. 결론적으로 개발된 방법은 인공수정에 필수적인 뒤영벌의 정자 활성을 높게 유지시킴과 동시에 수집 시간을 단축하고 정자의 오염을 방지할 수 있는 핵심 기술이라고 생각된다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술 연구개발사업(과제번호: PJ01001001)의 지원에 의해 이루어진 것입니다.
References
-
Baer, B., and P. Schmid-Hempel, (2000), The artificial insemination of bumblebee queens, Insects soc, 2000(47), p183-187.
[https://doi.org/10.1007/PL00001699]

-
Benzie, J.A.H., M. Kenway, E. Ballment, S. Frusher, and L. Trott, (1995), Interspecific hybridization of the tiger prawns Penaeus monodon and Penaeus esculentus, Aquacul, 133, p103-111.
[https://doi.org/10.1016/0044-8486(95)00013-R]

- Chen, M., Zhang, G., and Mainka, S.A., (1994), Semen evolution of giant pandas (Ailuropoda melanoleuca) at the Wolong Reserve, Zoo Biology, 13, p83-86.
- de Ruijter, A., (1997), Commercial bumblebee rearing and its implications, Proc, 7th Int. Symp, Pollination, Acat Hort, 437, p261-269.
- Duchateau, M.J., and J. Marien, (1995), Sexual biology of haploid and diploid males in the bumblebee Bombus terrestris, Insects soc, 42, p255-266.
- Durrant, B.S., Burch, C.D., Yamada, J.K., and J. Good, (1995), Seminal characteristics and artificial insemination of Chinese pheasants, Tragopan temminchii, Lophophorus impeyanus, and Lophophorus ihuysil. Zoo Biol, 14, p523-531.
- Evans, G., and W.M.C. Maxwell, (1987), Salmons artificial insemination of sheep and goats, Butterworths, Sydney.
- Free, J.B., (1993), Insect pollination of crops, 2nd ed, p684, Academic Press, London.
-
Holt, W.V., T. Abaigar, and H.N. Jabbour, (1996), Oestrous synchronization, semen preservation and artificial insemination in the Mohor Gazelle (Gazella dama mhorr) for the establishment of a genome resource bank programme, Reprod. Fertil. Dev, 8, p1215-1222.
[https://doi.org/10.1071/RD9961215]

- Masahiro, M., (2000), Pollination of crops with bumblebee colonies in Japan, Honeybee Sci, 21, p17-25.
- Minitab Incorporated Company, (2012), Minitab user's guide, Minitab Inc, USA.
- Röseler, P.F., (1973), Die anzahl der spermien im receptaculum seminis von hummelköniginnen (Hymenoptera, Apoidea, Bombinae), Apidologie, 4, p267-274.
- Ruttner, F., (1976), The instrumental insemination of the queen bee, 2nd ed. Apimondia. Bucharest.
- Schley, P., (1987), Einführung in die technik der instrumentellen Besamung von Bienenköniginnen, Köhler Offset KG, Giessen.
- SPSS incorporated company, (2009), SPSS Base 18.0 user's guide, SPSS inc, USA.
- Takamura, Y., T. Kanda, T. Tamura, H. Shinbo, and Y. Horie, (1996), Development of new method for artificial insemination of the silkworm, Bombyx mori, J. Sericul. Sci, Japan, 65, p456-463.
- Tasei, J.N., C. Moinard, L. Moreau, B. Himpens, and S. Guyonnaud, (1988), Relationship between aging, mating and sperm production in captive Bombus terrestris, J. of Apicul. Res, 37, p107-113.
-
Velthuis, H.H.W., V. van Doorn, (2006), A century of advances in bumblebee domestication and the economic and environmental aspects of its commercialization for pollination, Apidologie, 37, p421-451.
[https://doi.org/10.1051/apido:2006019]

- Waddy, S.L., and D.E. Aiken, (1984), Broodstock management for year-round production of larvae for culture of the American lobster, Canadian Technical Report of Fisheries and Aquatic Sciences, Ⅰ-Ⅲ 1-14.
- Williams, P.H., (1998), An annotated checklist of bumble bees with an analysis of patterns of description (Hymenoptera: Apidae, Bombini), Bull. Nat. Hist. Mus. (Ent.), 67, p79-152.
-
Yoon, H.J., S.E. Kim, Kim, Y.S., (2002), Temperature and humidity favorable for colony development of the indoor-reared bumblebee, Bombus ignitus, Appl. Entomol. Zool, 37, p419-423.
[https://doi.org/10.1303/aez.2002.419]

- Yoon, H.J., S.E. Kim, Y.S. Kim, and Lee, S.B., (2004), Colony developmental characteristics of the bumblebee queen, Bombus ignitus by the first oviposition day, Int. J. Induct, Entomol, 8, p139-143.
- Yoon, H.J., Y.S. Kim, , S.B., Y.H. Cho, (2006), An easy method for collecting sperm of bumblebees, Korean J. Api, 21, p157-162.
-
Yoon, H.J., Y.H. Cho, and B. Baer, (2007), Development of the artificial instrument of bumblebee queens, Korean J. Appl. Entomol, 46, p123-129.
[https://doi.org/10.5656/KSAE.2007.46.1.123]

- Yoon, H.J., K.Y. Lee, I.G. Park, M.A. Kim, Y.M. Kim, and P.D. Kang, (2013), Current status of insect pollinators use for horticultural crops in 2011, Korean J. Api, 28, p9-18.