Antioxidant Effect of Korean Royal Jelly in Oxidative Stress Induced HepG2 Cell
Antioxidant has known to effectively remove reactive oxygen species (ROS) which are regarded as a source of many types of diseases. In modern diets, the use of royal jelly (RJ) has more increased because of the trend toward the use of functional foods and dietary supplements. We investigated antioxidant effect of Korean royal jelly in oxidative stress induced HepG2 cell. The antioxidant activity was evaluated by means of DPPH free radical scavenging, thiobarbituric acid reactive substance (TBARS) products, and superoxide dismutase (SOD) and catalase activity assays. HepG2 cells treated with RJ at 100, 200, 500μg/ml significantly increased the DPPH scavenging activity in a dose-dependent manner. Also, the RJ significantly reduced the TBARS levels and increased the SOD activity compared to those of the control group. These results suggest that Korean RJ could be antioxidant functional food with high free radical scavenging activity and antioxidant capacity.
Keywords:
Royal Jelly, Antioxidant, DPPH, TBARS, SOD, Catalase서 론
인체 내에는 산화를 촉진하는 물질과 억제하는 물질이 서로 평형을 이루고 있다. 하지만 산화제와 항산화제의 균형상태가 무너지면 활성산소종이 과다 생성되거나 자체 항산화 시스템이 기능을 상실하여 산화적 스트레스가 유발되면서 병리적 질환이 야기된다(Park, 1997). 산화적 스트레스의 원인은 보편적으로 reactive oxygen species (ROS)의 축적에 의한다고 알려져 있는데 ROS는 세포가 에너지를 생성하기 위해 호흡하는 과정에서 필연적으로 발생된다. ROS의 산화적 대사산물인 free radical은 반응성이 매우 커서 인체 내의 생체막을 변질시키는데, 생체세포와 반응하게 되면 산화적 스트레스로 작용하여 단백질 분해, DNA 손상 및 합성억제 등을 초래한다(Lee and Min, 2006), (Fang et al., 2002), (Valko et al., 2007). 이밖에 자가면역질환, 피부질환 같은 다양한 질병이 ROS의 축적과 관련이 있다는 연구결과도 보고된 바 있는데(Lee et al., 2003), ROS 축적은 세포나 조직내에 손상을 야기시켜, 체내과산화지질과 염증을 증가시키는 원인이 된다(Reddy et al., 2008), (Wallace, 1992). Free radical은 세포막에 풍부한 불포화지방산에 결합하여 지질과산화를 유발시키는데(Radi et al., 1991) 이는 노화, 암, 생체막 파괴 등의 다양한 질환의 원인이 될 수 있다(Bidlack and Tapel, 1973), (Saito, 1988), (Vergroeson, 1997). 이러한 산화적 손상에 관여하는 free radical은 superoxide (O2-), nitric oxide (NO), hydroxyl radical (·OH)등이 알려져 있다 (Bhattacharyya et al., 2002).
생체 내에는 free radical에 의한 손상을 최소화 시킬 수 있는 항산화제, 항산화효소, 일부호르몬 등이 있다. 이러한 항산화물질에는 superoxide dismutase(SOD), catalase, glutathione peroxidase (GPX) 등이 있으며 L-ascorbic acid, uric acid 등의 수용성 항산화물질, α-tocopherol, carotenoids 같은 지용성 항산화물질도 있다(Castro and Freeman, 2001).
최근 웰빙과 함께 건강에 대한 관심이 상당히 높아 지면서 천연 소재로부터 항산화물질을 찾고자 하는 연구가 활발히 이루어지고 있다. 현재는 butylated hydroxytolune (BHT)나 butylated hydroxyanisole (BHA)등과 같은 합성 항산화제가 널리 쓰이고 있으나, 독성으로 인하여 인체에 유해할 수 있다는 문제 때문에 기피되고 있는 실정이어서 항산화효과가 높으면서 인체에 무해 천연소재의 식물이나 식품이 항산화물질로써 각광을 받고 있다. 최근까지 알려진 천연소재로는 녹차(Peter et al., 2001)나 포도(Kang et al., 2001)에 함유되어 있는 폴리페놀류의 catechin성분이 있으며 이러한 천연물질소재나 식품이 가지고 있는 다양한 성분 중에 항산화역할을 수행할 수 있는 물질을 찾고자 하는 연구가 진행되고 있다. 특히, 프로폴리스, 꿀, 로열젤리 같은 양봉산물은 이러한 천연 항산화 물질을 많이 함유하고 있는 것으로 알려져 있다(Viuda et al., 2008). 로열젤리는 일벌이 꿀과 화분을 체내로 흡수한 후에 먹이샘(hypopharyngeal gland)과 큰턱샘(mandibular)에서 분비되어 여왕벌유충이 먹이로 공급받는 물질로 오래전부터 효능과 성분에 대하여 관심을 받아왔으며 현재는 건강보조식품으로 각광을 받고 있다. 성분은 수분(50~60%)이 2/3정도로 가장 많고 그 외에 단백질(18%), 탄수화물(15%), 지질(3~6%), 무기염(1.5%), 비타민 그리고 펩타이드로 이루어져 있으며(Caparica and Cristina, 2007), (Fujiwara et al., 1990), (Nagai and Inooue, 2004), 10-hydroxy-2-decenoic acid (10-HDA)와 같은 생리활성 물질은 특히 많이 함유되어 있는 것으로 보고되었다(Butenandt and Rembold, 1957). 로열젤리의 대표적인 효능으로는 항산화, 노화방지, 피부미용 등이 보고되고 있는데 최근에는 10-HDA와 같은 물질은 탁월한 항암작용이 있는 것으로 밝혀져 새로운 지표물질로써 점차 관심을 받고있다. 국내산 로열젤리의 경우 평균 수분함량이 다른 수입산 로열젤리에 비하여 높았고, 특히 10-HDA는 약 1.5~2배가량 많이 함유되어 있다는 연구결과도 보고 되었다(Kim et al., 1989). 하지만 이러한 관심에 비하여 국내산 로열젤리모델에서 항산화효능을 규명하기 위한 free radical 소거능력 및 항산화효소 활성 등에 대한 연구는 아직까지 미흡한 실정이다.
따라서 본 연구에서는 산화적 스트레스로 자극된 인간 간암세포주 HepG2를 사용하여국내산 로열젤리의 농도별 항산화 효과를 조사하였다. 로열젤리의 free radical 소거능을 통한 항산화능력을 측정하기 위하여 1,1-diphenyl-2-pic-rylhydrazyl (DPPH)측정법을 이용하였으며, 항산화 효소인 SOD와 catalase enzymes의 활성을 조사하였다. 또한 HepG2 cell에 산화적 스트레스를 유발시킨 후 과산화지질의 생성량을 측정하여 로열젤리의 free radical 소거능력으로 인한 과산화지 질생성 억제 효과를 확인하였다.
재료 및 방법
로열젤리 시료준비
로열젤리는 포천지역의 일반 농가에서 생산된 원액을 사용하였으며 1mg/ml 농도로 하여 dimethyl sulfoxide (DMSO)에 용해시킨 후 phosphate-buffered saline (PBS)에 희석하여 최종농도 100, 200, 500μg/ml 준비하였다.
세포배양
본 실험에 사용된 인간 간암세포주 HepG2는 American type culture collection (ATCC)에서 구입하였으며, 10% FBS와 penicillin (100nuits/mL), streptomycin(100g/mL)이 함유된 DMEM 배지를 사용하여 배양하였다. 세포배양은 37°C, 5% CO2, 95% humid air로 조절된 배양기(Thermo Fisher Scientific Inc., Pittsburgh, PA)에서 배양하였다.
시료처리 및 산화적 스트레스유발
6-well plate에 HepG2 세포를 3×105 cells/well 농도로 분주하여 24시간 동안 배양한 후, 각각의 well에 H2O2 200μM와 로열젤리 추출물을 처리하여 24시간 동안 배양시켰다. 그 후 0.25% trypsin-EDTA로 세포를 분리하여 원심분리한 후 PBS에 2회 세척 후 protein lysis buffer (50mM Tris-HCl PH 7.5, Triton X-100 1%, 150mM Nacl 0.5%, NP4O 1%, SDC 0.5%, SDS 0.1%)를 처리하여 4°C에서 용해시킨 후 원심분리하여 단백질을 분리하였다. 분리한 단백질을 이용하여 항산화효소 활성을 측정하였으며 단백질 정량을 통하여 결과 값을 보정하였다.
DPPH 라디칼 소거능
로열젤리가 ROS를 유발하는 free radical을 소거하는 능력을 검증하기 위하여 DPPH의 환원력을 이용하여 측정하였다. DPPH radical 소거능력 측정은 Blois의 방법(Blois, 1958)을 변형하여 측정하였다. 각기 다른 농도의 로열젤리에 200μM DPPH 용액 100μL를 첨가하여 상온에서 30분간 반응시킨 후 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 515 nm에서 흡광도를 측정하였다. 각각의 DPPH radical 소거능은 아래와 같이 계산하여 백분율로 나타내었으며 control군의 값을 100으로 보정하여 백분율로 나타내었다. DPPH radical 소거능 (%)=(대조구 흡광도-시료첨가구 흡광도/대조구 흡광도)×100
산화적 손상 측정
산화적스트레스에 의한 지질과산화 생성을 측정하기 위하여 Erdelmeier법을 사용하여 TBARS를 측정함으로써 산화적 손상을 관찰하였다. tris-HCl buffer를 사용하여 세포를 균질 화 시킨 다음 12,000 rpm에서 20분간 centrifuge 시킨 후 그 상등액을 300μL 취하였다. 그 상등액에 동량의TCA를 처리하여 원심분리 시킨 후 다시 상등액을 취하여 2-thiobarbituric acid (TBA) 500μL를 넣어 반응하도록 95°C에서 20분간 가열시켰다. TBA 반응산물을 532 nm에서 흡광도를 측정하였다. 양성대조군으로는 ascorbic acid를 사용하였으며, control군의 값을 100으로 보정하여 백분율로 나타내었다.
항산화효소 활성 측정
항산화작용기전에 관여하는 효소의 활성을 검증하기 위하여 SOD와 catalase효소 활성을 측정하였다. SOD활성은 assay kit-WST (Dojindo, kumamoto, Japan)를 이용하여 측정하였다. 96-well plate에 각기 다른 농도의 로열젤리 sample을 넣은 다음 WST-1 (2-(4-iodophenyl)-3-(4-nitrophenyl)-5-(2,4-disulfophenyl)-2Htetrazolium, mono-sodium salt) 과 xanthine oxidase working solution을 첨가한 후 상온에서 20분동안 배양한 다음 450nm파장에서 흡광도를 측정하였다. Catalase는 catalase assay kit (Biovision Inc., Mountain View, CA, USA)을 이용하여 활성을 관찰하였다. H2O2를 기질로 사용하여 반응되는 변화값을 570nm에서 사용하였다. 양성대조군으로는 ascorbic acid를 사용하였다. 모든 항산화 활성의 결과값은 control값을 100으로 보정하여 백분율로 나타내었다.
통계처리
본 실험결과는 Statistical Package for the Socoal Science (SPSS) version 21.0 프로그램 (SPSS Inc. Chicago, IL, USA)을 이용하여 분석하였다. 모든 측정항목의 결과는 평균 ± 표준편차(mean±SD)로 표시하였고 실험군간 평균의 차이는 one-way ANOVA로 유의성을 확인한 후 Duncan's multiple range test를 이용하여 사후 검증하였으며, P<0.05 수준에서 유의성의 여부를 검증하였다.
결과 및 고찰
항산화능력 측정
ROS 축적에 의한 산화적 스트레스에 대한 일차적인 방어기작인 항산화능력을 검증하기 위하여 DPPH에 의한 free radical 소거능력을 측정하였다. 항산화제가 free radical인 DPPH와 반응하면 DPPH를 DPPHH로 환원시켜 흡광도를 감소시키는 원리를 이용하는 측정법으로 2,2'-azino-bis(3-ethylbenzhiazoline-6-sulphonic acid (ABTS)와 함께 가장 널리 사용되고 있다. Radical 소거능력에서는 ascorbic acid군이 control군에 비해 3배 이상의 높은 소거율을 보였으며 로열젤리 또한 모든 농도에서 control군에 비해 유의적으로 높은 radical 소거율을 보였다. 하지만 ascorbic acid군과 비교하였을 때 500μg/ml농도의 로열젤리에서만이 유의적으로 높은 소거율을 확인할 수 있었으며 100, 200μg/ml 로 열젤리에서는 낮은 소거율을 보였다(Fig. 1). 국내산 로열젤리의 DPPH radical을 이용한 ascorbic acid에 대한 항산화 소거능력에 대한 연구는 아직까지 미흡한 관계로 직접비교는 어렵지만, ascorbic acid와 함께 항산화물질로 잘 알려져 있는 α-tocopherol보다 로열젤리의 DPPH radical 및·OH 소거능이 더 높았다는 연구결과가 보고되었다(한 등, 2009). 이러한 연구결과와 본 연구에서 실험을 통하여 확인된 결과를 바탕으로 기존의 항산화물질 보다도 로열젤리의 항산화능력이 더 뛰어나다고 판단된다. 지금까지는 생 로열젤리나 10-HDA에 대한 연구는 많이 보고되었지만, 추출법에 따른 로열젤리에서의 항산화효과는 거의 연구되지 않았다. 생 로열젤리를 에탄올과 중화과정으로 수용화 했을 때 10-HDA의 수득율이 55% 증가하였다는 연구결과(김 등, 2013)로 비추어 볼 때 추출방법의 차이에 의한 로열젤리의 지표물질인 10-HDA 함량증가 여부를 확인하고 이에 따른 항산화효과도 비교 분석할 필요가 있다고 사료된다. 또한 DPPH는 친수성항산화제에 반응하는 제한적인 측면이 있는 반면 친수성, 소수성 항산화제에 모두 반응하는 ABTS는 DPPH 보다 일반적으로 소거능이 높게 측정된다(Cano et al., 2001), (Amao et al., 2001). 따라서 차후에 진행되는 연구에서 ABTS측정법도 이용한다면 본 실험 결과인 DPPH소거능과 비교하여 로열젤리가 가지고 있는 항산화물질의 성질이 친수성인지 혹은 친수성, 소수성을 모두 지니고 있는지 예상해 볼 수 있을 것이라 사료된다.
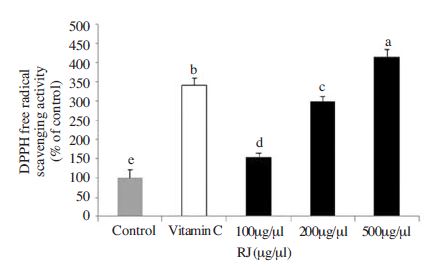
Effects of royal jelly (RJ) on free radical scavenging activity of HepG2 cell stimulated H2O2. cells (3×105) were cultured with vehicle or RJ groups in the presence of 200μM H2O2 for 24h. All data were shown as mean±SD. means with different letters are significantly (P<0.05) by Duncan's multiple range test.
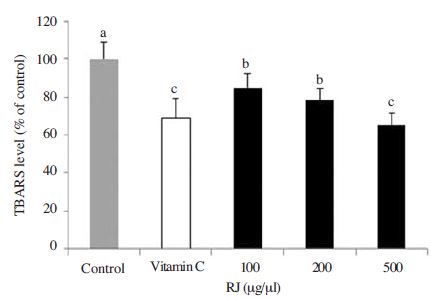
지질과산화 생성억제 측정
산화적스트레스가 지속되거나 과도하면 지질과산화물이 증가하게 되는데 이는 ROS 증가의 원인이 된다. Free radical과 불포화지방산의 산물인 지질과산화물 생성량은 TBARS 농도로 확인하였다. 양성대조군인 ascorbic acid군에서는 산화적 스트레스만 유발시킨 control군에 비하여 TBARS level이30%정도 줄어든 것을 확인할 수 있었다(Fig. 2). 로열젤리군에서는 100μg/ml와 200μg/ml 농도에서의 로열젤리가 control군에 비하여 유의적인 감소를 확인할 수 있었지만, ascorbic acid군에서의 감소량에는 미치지 못하였다. 하지만 500μg/ml에서는 ascorbic acid군과 비슷한 감소량을 확인할 수 있었다(Fig. 2). Free radical 중에서 lipid radical은 불포화지방산과 쉽게 결합하여 초기에 생성된 후 연쇄반응으로 지질과산화물을 형성하는데 항산화작용으로 이러한 초기반응을 차단함으로써 지질과산화물 형성을 조절할 수 있다는 연구결과와(조, 1993), in vitro와 in vivo에서 로열젤리 성분인 펩타이드의 항산화활성이 과산화지질을 감소시켰다는 연구결과(Hang et al., 2008)를 바탕으로 보았을 때 로열젤리를 투여한 군에서 지질과산화물 생성이 농도 의존적으로 감소한 것은 로열젤리가 가지고 있는 항산화능력에 의한 것으로 판단된다. 또한 염증매개물질인 TNF-α, LPL, IL-6 등을 활성화시키는 것으로 알려진 지질과산화(Wellen and Hotamisligil, 2003), (Posadas et al., 2000)를 조절할 수 있다는 연구결과를 볼 때 로열젤리가 최근 증가하고 있는 염증성질환의 예방과 치유효과에도 도움을 줄 수 있을 것이라 사료된다.
항산화효소 활성측정
인체 내에는 대사과정에서 생성된 활성산소가 증가하게 되면 이에 대한 방어기전으로 SOD가 생성되는데(Freeman et al., 1983) 이때 과산화수소를 제거하는 catalase도 함께 생산되어 산화적 손상에 대응한다(Creppy et al., 1990). 본 연구에서는 SOD와 catalase 효소의 항산화 능력을 농도별 로열젤리에서 검증하였다. SOD효소활성 측정에서는 활성이 농도 의존적으로 증가하는 것을 확인할 수 있었다. Ascorbic acid군은 control군에 비해 약 50% 정도의 높은 SOD활성을 보였으며, 모든 농도의 로열젤리도 농도 의존적으로 높은 활성을 나타내었다(Fig. 3a). 양성대조군인 ascorbic acid군와 비교해서는 100μg/ml와 200μg/ml 농도의 로열젤리에서는 차이가 없었지만, 500μg/ml농도의 로열젤리에서는 유의적으로 높은 것을 확인할 수 있었다(Fig. 3a). Catalase효소활성에서도 ascorbic acid군이 control군보다 높은 활성을 확인할 수 있었다(Fig. 3b). 하지만 100μg/ml와 200μg/ml 농도의 로열젤리군에서는 control군과의 유의적인 차이를 확인할 수 없었고 500μg/ml농도의 로열젤리만이 control군에 비해서 높은 활성을 나타내었다(Fig. 3b). 위의 결과로 SOD와 catalse효소활성은 control군과 비교하였을 때 유의적으로 높거나 비슷하게 나타났음을 확인할 수 있었으며 특히 SOD효소의 활성이 모든 농도의 로열젤리에서 높은 것을 확인할 수 있었다.
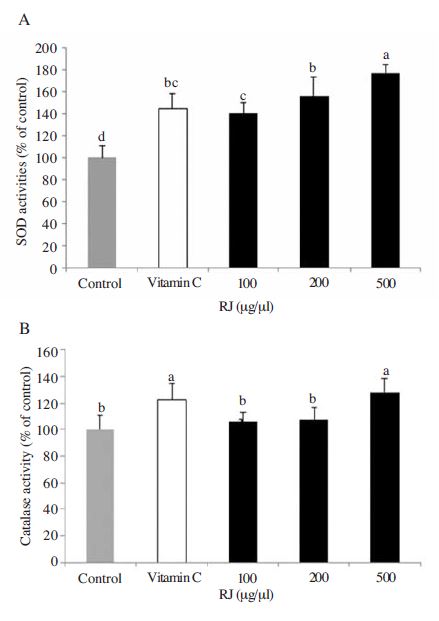
Effects of royal jelly (RJ) on SOD (A) and catalase (B) activity of HepG2 cell stimulated H2O2. cells (3×105) were cultured with vehicle or RJ groups in the presence of 200μM H2O2 for 24 h. All data were shown as mean±SD. means with different letters are significantly (P<0.05) by Duncan's multiple range test.
SOD 효소는 ROS와 같은 산화적스트레스에 노출되어 있을 때 활성화 된다고 알려져 있으며 항산화 물질을 투여하였을 경우 SOD의 활성이 증가되었다는 선행연구결과는(Anderson et al., 1997) 본 연구결과에서 SOD활성이 농도의존적으로 증가하는 경향을 보인 것과 일치함을 알 수 있었다. Catalase의 경우는 다른 경향을 보였는데 500μg/ml농도에서만이 control군에 비해 높은 활성을 나타내었으며 ascorbic acid군과는 비슷하거나 낮을 활성을 확인할 수 있었다. 위의 결과는 항산화물질을 투여하였을 때 항산화효소활성이 증가한다는 연구결과와 일치하지 않았지만 오히려 항산화효소활성이 감소하였다는 상반된 결과도 보고되고 있다(Anderson et al., 1997). 생체는 복잡한 mechanism을 가지고 있기 때문에 여러가지의 항산화효소와 물질의 상호작용으로 산화적스트레스에 대해서 방어하고 있기 때문에 특정효소활성만을 가지고는 생체조직의 항산화활성을 평가할 수 없다. 따라서 보다 다양한 항산화효소나 물질을 지표로 활용함과 동시에 복잡한 항산화 mechanism에 대한 연구가 이루어져야 할 것이다.
적 요
본 연구에서는 H2O2에 의해 산화적 스트레스를 유발시킨 인간 간암세포주 HepG2에 농도별로 처리한국내산 로열젤리의 항산화효과를 알아보기 위하여 free radical 소거능, 과산화지질 생성량, 그리고SOD와 catalase활성 변화를 비교, 분석하였으며 그 결과는 다음과 같다.
1) 국내산 로열젤리는 산화적스트레스로 자극된 HepG2세포에서 농도의존적으로 control군보다 높은 free radical 소거능력을 보였다.
2) 국내산 로열젤리는 산화적스트레스로 자극된 HepG2세포에서 control군보다 농도의존적으로 지질과산화 생성을 감소시켰다.
3) 국내산 로열젤리는 산화적스트레스로 자극된 HepG2세포에서 control군에 비하여 항산화물질인 SOD와 catalase효소의 활성이 높거나 비슷하였으며 특히500μg/ml 이상에서모두높은활성을나타내었다.
결론적으로 국내산 로열젤리는 free radical 소거능력과 SOD, catalase효소의 높은 활성에 기인한 효과적인 활성산소제거로 항산화능력이 탁월한 것으로 확인되었다. 이러한 연구결과를 바탕으로 건강기능식품으로 인식되고 있는 로열젤리에 대한 연구가 다각도에서 폭넓게 이루어져야 한다고 판단된다.
Acknowledgments
본 연구는 농진청 차세대바이오그린21(과제번호: PJ0090662013)에 의해 지원되었습니다.
References
- 김정민, 한상미, 조미란, 이광길, 이명렬, 이만영, 우순옥, 홍인표, 심하식, 최용수, (2013), 알러지 유발 단백질이 제거된 수용성 로열젤리의 생리활성 효과, 한국양봉학회지, 28(1), p19-23.
- 조성희, (1993), 지질과산화와 항산화 영양, 한국지질학회지, 3, p23-32.
- 한상미, 이광길, 여주홍, 우순옥, 권해용, (2009), 봉독채취가 로열젤리의 항산화 및 항당뇨 활성에 미치는 영향, 한국양봉학회지, 24(2), p121-126.
- Amao, M.B., Cano, A., and Acosta, M., (2001), The hydrophilic and lipophilic contribution to total antioxidant activity, Food Chem, 73, p239-244.
- Anderson, H.R., Nielsen, J.B., Nielsen, F., and Grandjean, P., (1997), Antioxidative enzyme activities in human erythrocytes, Clin. Chem, 43, p562-568.
- Bhattacharyya, A., Pathak, S., kundu, M., and Basu, J., (2002), mitogen-activated protein kinases regulate mycobacterium avium-induced tumor necrosis factor-alpha release from macrophages, FEMDS Immunol. Med. Microbiol, 34(1), p73-80.
-
Bidlack, W.R., and Tapel, A.l., (1973), Damage to microsomal membrane by lipid peroxidation, Lipids&, p177-178.
[https://doi.org/10.1007/BF02544631]

-
Blois, M.S., (1958), Antioxidant determinations by the use of a stable free radical, Nature, 181, p1199-1200.
[https://doi.org/10.1038/1811199a0]

- Butenandt, A., and Rembold, H., (1957), Royaljelly of the honeybee. isolation, constitution analysis, and incidence of 10-hydroxy-delta 2-decenoi acid, Hoppe Seylers Physiol. Chem, 308, p284-289.
-
Cano, A., Acosta, v, , Amao, and , M.B., (2001), A method to measure antioxidant activity in organic media: application to lipophilic vitamins, Redox Rep, 5, p365-370.
[https://doi.org/10.1179/135100000101535933]

- Caparica-Santos, C., M Cristina.Marcucci, (2007), Quantitative determination of trans-10-Hydroxy-2-Decenoic Acid (10-HDA) in Brazilian royal jelly and commercial products containing royal jelly, J. Apicultural Res, 46, p149-153.
-
Castro, L., B.A. Freeman, (2001), Reactive oxygen species in human health and disease, Nutrition, 17, p161-165.
[https://doi.org/10.1016/S0899-9007(00)00570-0]

-
Chang, C., and Zheng, R., (2003), Effects of ultraviolet B on epidermal morphology, shedding, lipid peroxide and antioxidant enzymes in Cope's rat snake, J. photochemistry and photobiology B: Biology, 72, p79-85.
[https://doi.org/10.1016/j.jphotobiol.2003.06.001]

-
Creppy, E., Chakor, K., Ficher, M., and Dirheimer, G., (1990), The mycotoxin ochratoxin A is a substrate for phenylalanine hydroxylase in isolated rat hepatocytes in vivo, Toxicology and applied pharmacology, 70, p283-288.
[https://doi.org/10.1007/BF01972987]

-
Evelson, P., Ordonez, C.P., Liesuy, S., and Boveris, A., (1997), Oxidative stress and in vivo chemilumnescence in mouse skin exposed to UVA radiation, Journal of photochemistry and photobiology B:Biology, 38, p215-219.
[https://doi.org/10.1016/S1011-1344(96)07437-4]

-
Fang, Y.Z., Yang, S., and Wu, G., (2002), Free radicals, antioxidants, and nutrition, Nutrition, 18, p872-879.
[https://doi.org/10.1016/S0899-9007(02)00916-4]

- Freeman, B.A., Young, S., and Crapo, J.D., (1983), Liposomemediated augmentation of superoxide dismutase in endothelial cells prevents oxygen injiry, J. Bio. Chem, 258, p12534-12542.
- Fujiwara, S., Imai, M., Fujiwara, T., Yaeshima, T., Kawashima, and Kobayashi, K., (1990), A potent antibacterial protein in royal jelly, Purification and determination of the primary structure of royalisin, J. Biol. Chem, 265, p11333-11337.
-
Guo, H., Ekusa, A., Iwal, K., Yonekura, M., and Takahata, Y., (2008), Royal jelly peptides inhibit lipid peroxidation in vitro and in vivo, j. Nutr. sci Vitaminal, 54, p191-195.
[https://doi.org/10.3177/jnsv.54.191]

- Kang, H.C., Lee, S.H., and Kim, J.B., (2001), Quantification and physicochemical properties of grape seed lipids, J. Korean soc. Agric. chem. Biotechnol, 44, p173-178.
- Kim, J.H., Son, J.H., and Kim, K.H., (1989), A survey of analizing in gredient of royal jelly in korea on majoring 10-HDA, Korean J. Apiculture, 4(1), p34-39.
- Lee, S.J., Bai, K.S., Lee, S., Namkoong, H.J., Na, K.S., Ha, J.A., Han, S.V., Yim, K., Chang, Y., Kwon, G., Lee, S.K., and Kim, Y.M., (2003), Astaxanthin inhibits nitric oxide production and inflammatony gene expression by suppressing IKB kinase-dependent NF-KB activation, Mol. cells, 16, p97-105.
-
Nagai, T., and Inoue, R., (2004), Preparation and functional properties of water extract and alkaline extract of royal jelly, Food Chem, 84, p181-186.
[https://doi.org/10.1016/S0308-8146(03)00198-5]

- Park, S.N., (1997), Skin aging and antioxidants, J. Korean Soc Cosmetic Chem, 23, p75-132.
- peter, V., Poole, C., and Arab, L., (2001), Does tea affect cardiovascular disease? A meta-analysis, Am. J. Epidemiol, 154, p495-503.
-
Posadas, I., Terencio, M.C., Guillen, I., Ferrandiz, M.L., Coloma, J., and Paya, M., (2000), Co-regulation between cyclo-oxygenase-2 and inducible nitric oxide synthase expression in the time-course of murine inflammation, Naunyn Schmiedebergs Atchives of Pharmacology, 361(1), p98-109.
[https://doi.org/10.1007/s002109900150]

- Radi, R., Beckman, J.S., Bush, K.M., and Freeman, B.A., (1991), Peroxynitrite-induced menbrance lipid peroxidation; The cytotoxic potential of superoxide and nitric oxide, Arch. Biochem. Biophys, 288, p481-485.
-
Reddy, B.S., Reddy, R.K., Reddt, B.P., Ramakrishna, S., and Diwan, P.V., (2008), Potential in vitro antioxidative and protective effects of soymida febrifuga on ethanol induced oxidative damage in HepG2 cells, Food Chem. Toxicol, 46, p3429-3442.
[https://doi.org/10.1016/j.fct.2008.08.034]

-
Saito, M., (1998), Interaction between lipid peroxide formation and nutritional status, J .LPN .Soc Nutr. Food Sci, 41, p343-349.
[https://doi.org/10.4327/jsnfs.41.343]

- Sugiyama, T., Takahashi, K., Kuzumaki, A., Tokoro, S., Neri, P., and Mori, H., (2013), Inhibitory mechanism of 10-Hydroxytrans-2-decenoic acid (Royal Jelly Acid) against lipopolysaccharide-and interferon-β-induced nitric oxide production, inflammation, 36(2), p372-378.
- Valko, M., Leibfritz, D., Moncol, J., Cronin, M.T.D., Mazur, M., and Telser, J., (2007), Free radicals and antioxidants in normal physidogical functions and human disease, J. Biochem. cell B, 39, p44-84.
- Vergroeson, A.T., (1997), Physiogical effects of dietary linoleic acid, Nutr. Rev, 35, p1-9.
- Viuda-Martos, Y., Ruiz-Navajas, J., Fernandez-Lopez, and J.A. perez-Alvarez, (2008), Functional properties of honey, propolis and royal jelly, J. Food Sci, 73, p117-124.
-
Wallace, D.C., (1992), Mitochondria genetics:a paradigm for aging and degenerative diseases?, Science, 256, p628-632.
[https://doi.org/10.1126/science.1533953]

-
Wellen, K.E., and Hotamisligil, G.S., (2003), Obesity-induced inflammatory changes in adipose tissue, The Journal of Clinical Investigation, 112(12), p1796-1808.
[https://doi.org/10.1172/JCI200320514]