옥살산을 이용한 꿀벌 안전성과 꿀벌응애류 방제 효율 평가
Abstract
This study investigated the safety of oxalic acid (natural acaricide), on honeybee (Apis mellifera) colonies and its acaricidal effects on honeybee pest mites (Varroa destructor and Tropilaelaps mercedesae). To determine the safety and acaricidal effects of oxalic acid, the impacts of oxalic acid was examined using different treatment methods (i) fumigation and (ii) dripping (trickling), and concentrations (0.7, 3, and 6%). For the fumigation, 1 g of oxalic acid was treated inside the beehive, and the experimental groups were divided by blocking the entrance of the beehive for different durations (1, 5, 10, and 15 min.). For the dripping, oxalic acid-sugar solutions with different concentrations (0.7, 3, and 6%) were prepared and applied to the beehive to measure safety and efficacy of oxalic acid. The safety of honeybees with oxalic acid treatment showed no significant differences between the experimental and control groups for both the fumigation and dripping methods, and had no significant impact on the honeybee colonies. The acaricidal effect of oxalic acid treatment was higher against V. destructor in all experimental groups compared to the control group in the fumigation method. In the dripping method, only the experimental groups with 3 and 6% concentrations showed significant differences and demonstrated acaricidal effects compared to the control group. For T. mercedesae, the low number of detected individuals resulted in no significant effects. Both treatment methods did not show any significant acaricidal effects on V. destructor and T. mercedesae, which exist inside the capped brood cells.
Keywords:
Varroa destructor, Tropilaelaps mercedesae, Oxalic acid서 론
꿀벌응애 (Mesostigmata: Varroaidae, Varroa destructor, Anderson and Trueman, 2000)와 중국가시응애 (Mesostigmata: Laelapidae, Tropilaelaps mercedesae, Anderson and morgan, 2007)는 양봉꿀벌 (Apis mellifera) 성충 외부에 기생하는 기생응애이다. 국내에서는 꿀벌 봉군에 서식하며 직접적인 피해를 유발한다. 꿀벌응애는 꿀벌 번데기의 체액과 성충의 지방체를 흡즙하여 봉군 세력을 약화시킨다 (Ramsey et al., 2019). 꿀벌응애류에 기생당한 일벌 개체들은 성충으로 우화하지 못하고 폐사하거나, 면역, 신경계 기능, 신진대사 등에 관련된 유전자 발현 변형을 일으켜 정상적인 활동을 하지 못한다 (Zanni et al., 2017). 꿀벌응애류는 다양한 꿀벌 병원체들의 매개체가 되어 질병을 발생시키는데 (Mondet et al., 2014), 그중 날개불구바이러스 (DWV: Deformed Wing Virus)는 감염되면 날개불구 증상을 유발한다 (Martin et al., 2012). DWV에 감염된 일벌은 우화 후 날개가 정상 발육하지 못하여 비행하지 못한다. 꿀벌응애와 DWV의 감염이 겨울철 봉군의 수명을 감소시킨다는 보고는 꿀벌응애류 피해의 심각성을 나타낸다 (Dainat et al., 2012). 2021~2022년 사이 국내에서 전국적인 월동 봉군 실종폐사 사건이 발생하였고, 이 사건의 원인 중 하나로 꿀벌응애류가 지목되었다. Kim (2022)은 월동 봉군의 전국적인 실종에 따른 경제적 손실과 양봉산물 생산량 감소로 이어지며 추가로 화분매개 꿀벌의 부족으로 피해 규모가 더 커질 것으로 예상하였다. 이러한 피해를 방지하기 위해 양봉농가들은 다양한 응애류 방제법과 신규 사양관리 기술을 적용하고 있다. 응애류 방제는 화학적, 기계적, 생태적 방제 등으로 나뉜다 (van der Steen and Vejsnæs, 2021). 종합적 해충 방제 (IPM: Integrated pest management)를 통해 시기별로 다양한 방법을 적용해야 효과적인 꿀벌응애류 방제가 이루어진다고 보고하고 있다 (Berry et al., 2022). 화학적 방제는 합성살비제인 플루바리네이트 (fluvalinate), 아미트라즈 (amitraz), 코마포스 (coumaphos) 등을 사용하거나 천연살비제인 개미산 (formic acid), 옥살산 (oxalic acid), 티몰 (thimol), 방향유 (essental oil) 등이 사용되어진다. 국내에서는 처리법이 쉬운 스트립 형태의 플루발리네이트가 많이 사용되고 있으며, 장기간 사용으로 인해 약제 저항성이 발현하였다 (Kim and Lee, 2022). 국외에서도 다양한 합성살비제에 대한 저항성이 보고되었다 (Elzen et al., 1999a, 1999b). 합성살비제는 친유성의 성질로 밀랍에 축적되어 꿀벌응애류에게 장기간 노출되어 저항성을 키우는 문제를 발생시킨다 (Bogdanov et al., 1998; Wallner, 1999). 약제 저항성 발현과 잔류 문제를 해결을 위해 합성살비제보다 상대적으로 안전한 개미산이나 옥살산 사용이 권장되고 있다 (Charriére and Imdorf, 2002). 국외에서는 천연살비제에 대한 다양한 연구를 통해 지역 조건에 맞는 사용법이 개발되었으나 (Rademacher and Harz, 2006), 국내는 천연살비제 사용법에 대한 연구가 부족한 실정이다.
옥살산은 전 세계적으로 꿀벌응애류 방제에 가장 많이 사용되는 유기산이며, 다양한 식물에서 합성되며 벌꿀에도 포함되어 있다 (van der Steen and Vejsnæs, 2021). 옥살산을 이용한 방제는 1980년대부터 양봉농가에 의해 사용되었으며 (Takeuchi and Harada, 1983), 접촉에 의한 꿀벌응애 방제가 가능한 것으로 알려져 있다 (Aliano et al., 2006; Aliano and Ellis, 2008). 오랜 사용에도 불구하고 옥살산에 대한 꿀벌응애류 저항성 발현은 발견되지 않았으며 (Maggi et al., 2017), 밀랍과 벌꿀에 잔류가 적은 것으로 보고되었다 (Bogdanov et al., 2002). 옥살산 꿀벌응애류 방제법은 당액과 혼합하여 봉군 내 벌집 사이에 흘려주는 방식과 고온의 열을 가하여 소문 입구에 훈증 후 밀폐하는 방식이 있다 (Charriére and Imdorf, 2002; Berry et al., 2022). 국외 연구자들의 보고에서 위 두 방식은 꿀벌응애류 방제에 효과적인 방제법으로 알려져 있다 (Gregorc and Planinc, 2001; Charriére and Imdorf, 2002; Akyol and Yeninar, 2009; Jack et al., 2020). 그러나 우리나라의 기상 조건에 맞는 옥살산 이용법에 대한 연구는 현재 미비한 상황이다.
따라서 본 연구는 국내 환경 조건에서 옥살산 흘림법과 훈증법에 대한 꿀벌 안전성과 꿀벌응애류에 대한 방제 효과를 평가하였다. 이를 통해 양봉농가에서 관행적으로 사용되는 처리법을 검증하여 기술 표준화를 기대한다.
재료 및 방법
1. 공시충
실험에는 국립농업과학원 실험양봉장에서 사양관리하는 양봉꿀벌 (Apis mellifera) 봉군을 사용하였다. 옥살산 방제법에 대한 꿀벌 안전성 평가는 벌집 (소비)이 6~7매인 봉군을 사용하였다. 살비 효과 평가는 사전에 번데기방에서 응애류가 검출된 봉군들을 사용하여 한 벌통에 번데기 벌방 (소방)이 200개 이상 포함된 벌집 2매, 일벌은 약 2,300마리로 표준화하여 실험에 사용하였다.
2. 공시약제
실험에 사용된 옥살산 (Sigma aldrich, C2H2O4, ≥99.0%)은 분말형태를 사용하였다. 훈증 처리는 1 g의 옥살산을 한 봉군에 이용하였으며, 전기 가열식 훈증기 ((주)리얼허니)를 사용하였다. 옥살산 1 g을 훈증하는 데 소요되는 시간은 17.3±4.04초 (N=3)로 측정되었다. 흘림 처리는 옥살산 농도는 0.7, 3, 6%를 사용하였으며, 용매는 당액 (1 : 1=물 : 설탕)을 이용하였다.
3. 꿀벌 봉군 세력 측정
실험에 사용된 봉군 세력은 오후 1시부터 3시까지 일벌, 번데기, 애벌레, 알수를 측정하였다. 벌집 한 면을 5 cm2인 정사각형으로 가로 4칸, 세로 8칸 총 32칸으로 나누어, 각 벌집판에 있는 일벌, 번데기, 애벌레, 알이 차지하는 칸을 측정하였다. 한 칸 (5 cm2)은 벌방 100개로 설정하여 번데기, 애벌레, 알수를 측정하였다. 일벌이 100% 벌집에 붙어있는 상태를 2,500마리로 설정하여 측정하였다 (Delaplane et al., 2013).
4. 꿀벌 봉군 안전성 평가
옥살산 훈증 처리에 대한 안전성 평가는 2022년 8월 29일부터 9월 6일까지 진행하였다. 본 실험에서 훈증법의 경우 1 g의 옥살산 가루를 230℃의 훈증기로 훈증시켜 벌통 입구로 옥살산 증기를 투입하여 처리하였다 (Berry et al., 2022). 옥살산 증기 투입은 훈증기에서 옥살산 증기가 나오지 않을 때까지 실시하였다. 옥살산을 훈증시키고 바로 벌통 입구를 막고 (밀폐), 차단한 시간을 달리하여 처리구의 발육단계별 변화를 조사하였다. 밀폐 시간은 1, 5, 10, 15분으로 하였으며, 3반복 실시하였다. 대조구는 옥살산 훈증을 처리하지 않았다. 꿀벌 봉군에 대한 옥살산 훈증의 영향을 평가하기 위해 훈증 처리 전 (8월 29일)에 일벌, 유충, 번데기, 알수를 측정하였고, 훈증 처리 후 1일 (1차, 8월 31일), 2일 (2차, 9월1일), 7일 (3차, 9월 6일)에 조사하였다. 실험 동안 기온은 22.9±3.03℃로 측정되었다.
옥살산 흘림 방제법에 대한 안전성 평가는 2022년 9월 6일부터 9월 13일까지 진행하였다. 흘림법은 옥살산과 당액을 섞어서 봉군 위에서 벌집판 사이에 흘려주어 처리하는 방법이다 (Charriére and Imdorf, 2002). 옥살산의 농도를 달리하여 0 (당액 100%), 0.7, 3, 6%의 옥살산과 당액 혼합액을 주사기에 넣어서 봉군의 소비 사이에 6~7 mL씩 흘렸으며, 총 50 mL 사용하였다. 각 처리구는 처리 전 (9월 6일) 일벌, 번데기, 유충, 알수를 측정하였고, 처리 후 2일 (1차, 22.9.8), 7일 (2차, 9월 13일)에 조사하였다. 실험 동안 기온은 24.1±5.25℃로 측정되었다.
5. 꿀벌응애류 방제 효과 평가
옥살산 훈증 처리 방제 효과는 번데기방 외부와 내부에 대한 효과를 측정하였다. 번데기방 외부의 꿀벌응애류에 대한 효과는 총 응애수 대비 벌통 바닥에 떨어지는 응애수를 통해 평가하였다. 벌통 바닥에 떨어진 꿀벌응애류를 고정하기 위하여 바세린을 바른 비닐을 이용하였다. 처리 후 1일차, 3일차에 비닐을 회수하여 떨어진 응애수를 조사하였다 (Ritter, 1981). 번데기방 내부의 꿀벌응애류에 대한 효과는 처리구들의 번데기방 100개를 무작위로 열어 번데기방 안에 있는 응애를 세고, 수를 조사하여 사망률을 측정하였다 (Dietemann et al., 2013). 그 후 봉군에 남아있는 꿀벌응애류의 수를 조사하기 위해 봉군에 95%의 개미산을 50 mL 투입하여 꿀벌응애류를 사멸하여 전체 개체군을 추정하였다. 실험은 2022년 9월 27일부터 9월 30일까지 하였다. 안전성 평가와 동일한 방법으로 처리하였다. 실험기간 동안 기온은 19.1±5.06℃로 측정되었다.
옥살산 흘림 처리는 안전성 평가와 같은 방법으로 옥살산을 흘림 처리하였고, 벌통 세력의 크기를 고려하여 처리양을 15 mL로 하였다. 떨어진 응애와 번데기방 내부 응애수 조사는 옥살산 훈증과 같은 방법으로 하였다. 실험은 2022년 9월 27일부터 9월 30일까지 진행하였다. 실험 동안 평균기온은 19.1±5.06℃로 측정되었다.
6. 통계처리
각 실험군 데이터 간 차이를 one-way ANOVA (일원배치분산분석)로 분석하였고, 사후검정으로 Tukey‘s HSD를 사용하였다.
결 과
1. 꿀벌 봉군 안전성 평가
(1) 일벌 개체수 변화
옥살산 훈증 일벌 개체수 변화는 Fig. 1과 같다. 훈증 처리 전 무처리구의 일벌수는 평균 4,753±1,911.7 (mean±SD)이었으며, 소문 차단 (밀폐) 1, 5, 10, 15분 처리구의 일벌수는 5,850±1,875.1, 6,248±1,959.5, 7,015±2,599.6, 6,440±2,129.8마리였다. 처리 전 일벌수는 각 처리 간 유의한 차이가 없었다. 처리 후 1일 (1차)에는 무처리구, 밀폐 1, 5, 10, 15분 차단의 일벌수는 4,677±2,873.5, 5,098±2,385.6, 4,140±1,243.9, 6,018±2,137.1, 5,903±1,786.5마리로 유의한 차이가 없었다. 처리 후 2일 (2차)에는 5,298±2,512.2, 5,727±2,413.1, 5,865±1,825.6, 6,501±2,284.0, 5,980±1,882.6마리이며 유의한 차이가 없었다. 처리구 일벌 평균 감소량은 유의한 차이가 있었고 (one-way ANOVA, F(4,10)=9.565, p<0.002),
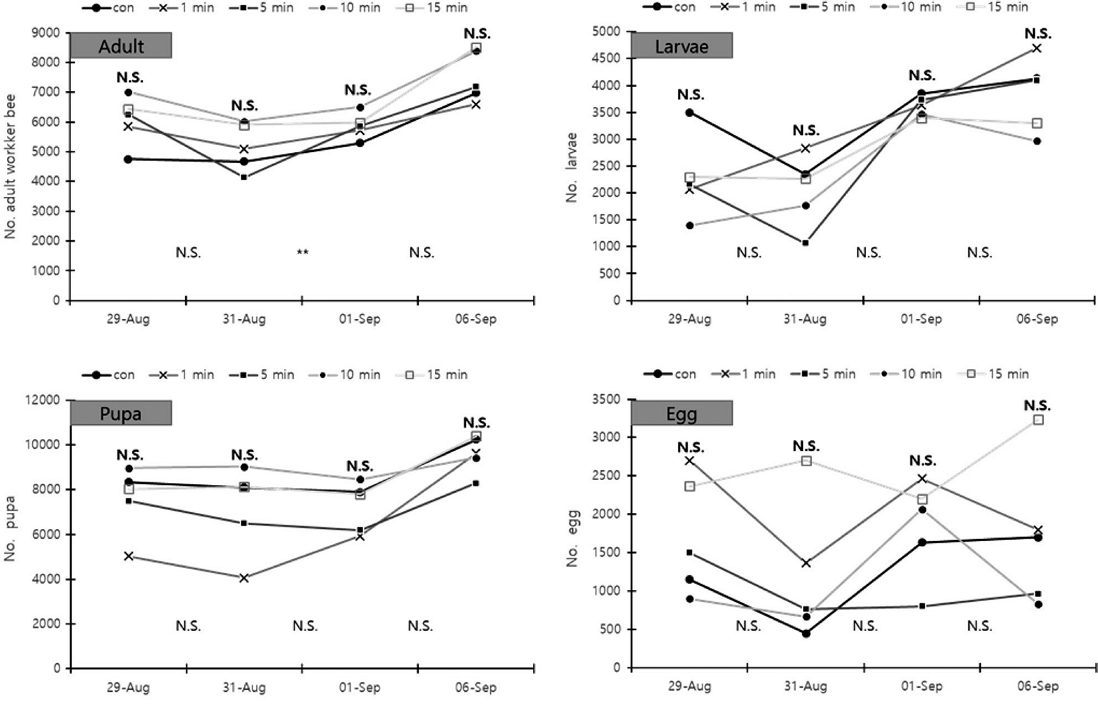
Changes in the number of individual honeybees (adult, larvae, pupa, and egg) according to the time of entrance blockage after fumigation with oxalic acid. The data represents the mean of three replicates. The bold text above the graph indicates the comparison of the number of individuals between experimental groups, while the thin test below the graph indicate the comparion of the decrease amount (N.S.: Non-significant, **: p<0.01).
처리 후 7일 (3차)에는 6,977±3,333.7, 6,593±2727.1, 7,184±3,096.2, 8,387±2,725.4, 8,510±2,893.3마리로 측정되었고 유의한 차이가 없었다.
(2) 유충 개체수 변화
옥살산 훈증 유충 개체수 변화는 Fig. 1과 같다. 훈증 처리 전 유충수는 무처리구, 밀폐 1, 5, 10, 15분 처리 순으로 3,500±0.0, 2,067±1,059.9, 2,167±1,250.3, 1,400±1,216.6, 2,300±854.4마리로 측정되었고 처리 간 유의한 차이가 없었다. 처리 후 1일 (1차)에는 2,350±1,343.5, 2,833±602.8, 1,067±814.5, 1,767±351.2, 2,267±750.6마리로 유의한 차이가 없었다. 처리 후 2일 (2차)에는 3,850±777.8, 3,633±115.5, 3,733±2,413.2, 3,467±1,530.8, 3,400±953.9마리로 유의한 차이가 없었다.
처리 후 7일 (3차)에는 3,500±1,414.2, 4,700±1,058.3, 4,100±1,946.8, 2,967±351.2, 3,300±1,014.9마리로 유의한 차이가 없었다.
(3) 번데기 개체수 변화
옥살산 훈증 번데기 개체수 변화는 Fig. 1과 같다. 훈증 처리 전 번데기방 수 평균은 무처리구, 밀폐 1, 5, 10, 15분 처리 순으로 8,350±3,889.1, 5,033±1,703.9, 7,500±2,066.4, 8,967±3,043.6, 8,033±3,901.7마리로 유의한 차이가 없었다. 처리 후 1일 (1차)에는 8,100±3,252.7, 4,067±2,569.7, 6,500±1,571.6, 9,033±1,792.6, 8,133±3,801.8마리로 유의한 차이가 없었다.
처리 후 2일 (2차)에는 7,900±2,404.2, 5,933±808.3, 6,200±1,153.3, 8,467±1,097.0, 7,800±3,342.2마리로 유의한 차이가 없었다. 처리 후 7일 (3차)에는 10,250±1,626.3, 9,633±2,857.2, 8,300±2,306.5, 9,433±723.4, 10,400±3,315.1마리로 유의한 차이가 없었다.
(4) 알 개체수 변화
옥살산 훈증 알 개체수 변화는 Fig. 1과 같다. 훈증 처리 전 알은 무처리구, 밀폐 1, 5, 10, 15분 처리 순으로 1,150±919.2, 2,700±700.0, 1,500±1,352.8, 900±529.2, 2,366±757.2마리로 유의한 차이가 없었다. 처리 후 1일 (1차)에는 450±212.1, 1,367±832.7, 767±896.3, 667±611.0, 2,700±1,473.1개로 유의한 차이가 없었다. 처리 후 2일 (2차)에는 1,050±212.1, 2,467±450.9, 800±793.7, 2,067±665.8, 2,200±1,510.0마리로 유의한 차이가 없었다. 처리 후 7일 (3차)에는 1,600±707.1, 1,800±800.0, 966±550.8, 833±737.1, 3,233±1,887.7마리로 유의한 차이가 없었다.
(1) 일벌 개체수 변화
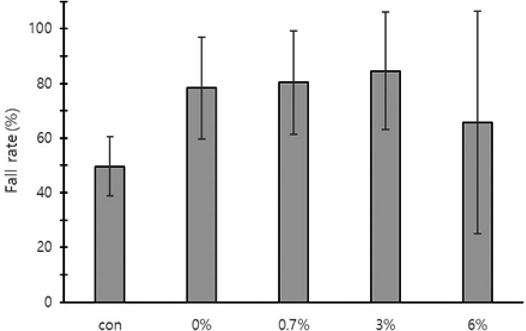
옥살산 흘림 일벌 개체수 변화는 Fig. 2와 같다. 옥살산 흘림 처리 전 일벌수는 0 (당액 100%), 0.7, 3, 6% 처리 순서로 6,900±3,164.1, 8,203±2,697.8, 8,548±2,346.5, 8,295±2,723.0마리로 유의한 차이가 없었다. 처리 후 2일 (1차) 일벌수는 5,942±2,158.6, 6,287±1,569.8, 8,855±2,833.3, 8,663±2,533.5마리로 유의한 차이가 없었다. 처리 후 7일 (2차) 일벌수는 6,869±2,548.8, 7,398±3,637.2, 6,402±1,068.5, 8,740±1,807.4마리로 유의한 차이가 없었다.
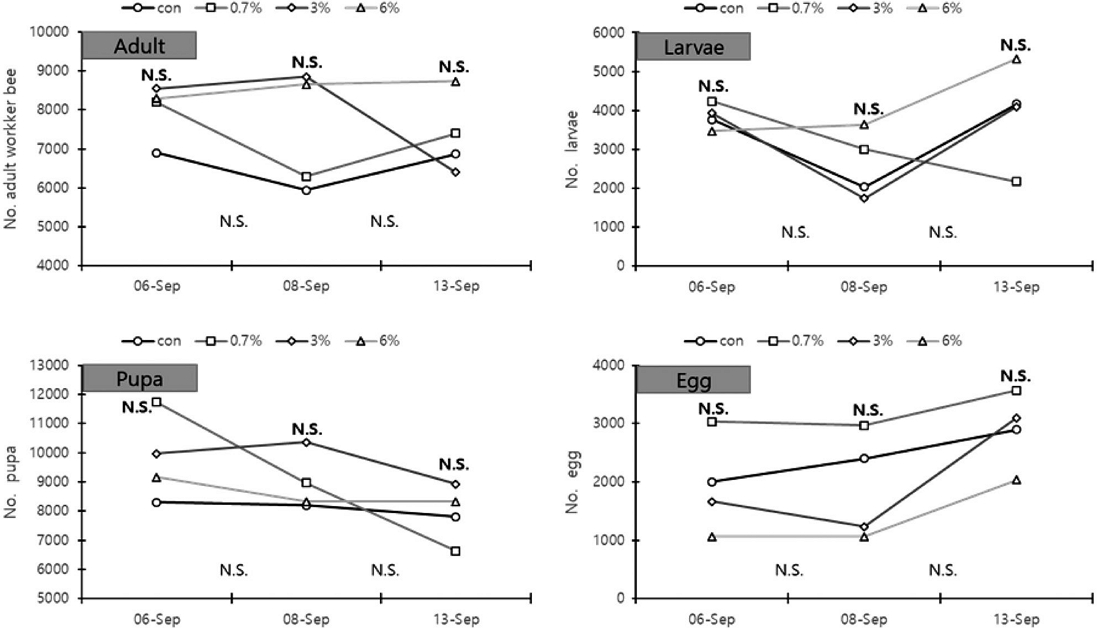
Changes in the number of individual honeybees (adult, larvae, pupa, and egg) after treatment with oxalic acid-sugar solution by dripping (trickling), according to the concentration of oxalic acid. The data represents the mean of three replicates. The bold text above the graph indicates the comparison of the number of individuals between experimental groups, while the thin test below the graph indicate the comparison of the decrease amount (N.S.: Non-significant).
(2) 유충 개체수 변화
옥살산 흘림 유충 개체수 변화는 Fig. 2와 같다. 옥살산 흘림 처리 전 유충수는 0 (당액 100%), 0.7, 3, 6% 처리 순서로 3,767±611.0, 4,233±1,755.9, 3,933±2,064.8, 3,467±960.9마리로 유의한 차이가 없었다. 처리 후 2일 (1차)에는 2,033±1,115.0, 3,000±608.3, 1,733±873.7, 3,633±723.4마리로 유의한 차이가 없었다. 처리 후 7일차 (2차)에는 4,167±838.6, 2,167±2,335.2, 4,100±1,053.6, 5,333±2,500.7마리로 유의한 차이가 없었다.
(3) 번데기 개체수 변화
옥살산 흘림 번데기 개체수 변화는 Fig. 2와 같다. 옥살산 흘림 처리 전 번데기는 0 (당액 100%), 0.7, 3, 6% 처리 순서로 각각 8,300±655.7, 11,733±3,213.0, 9,967±901.8, 9,168±2,010.8마리로 유의한 차이가 없었다. 처리 후 2일 (1차)에는 8,200±721.1, 8,967±3,350.1, 10,367±1,950.2, 8,333±929.2마리로 유의한 차이가 없었다. 처리 후 7일 (2차)에는 7,800±1,997.5, 6,633±3,134.2, 8,933±3,780.7, 8,333±2,730.1마리로 유의한 차이가 없었다.
(4) 알 개체수 변화
옥살산 흘림 알 개체수 변화는 Fig. 2와 같다. 옥살산 흘림 처리 전 알은 0 (당액 100%), 0.7, 3, 6% 처리 순서로 2,000±529.2, 3,033±2,159.5, 1,667±378.6, 1,067±57.7마리로 유의한 차이를 보이지 않았다. 처리 후 2일 (1차)에는 2,400±360.6, 2,967±1858.3, 1,233±416.3, 1,067±850.5마리로 유의한 차이가 없었다. 처리 후 7일 (2차)에는 2,900±264.6, 3,567±814.5, 3,100±1,300.0, 2,033±513.2마리로 유의한 차이가 없었다.
2. 꿀벌응애류 방제 효과
(1) 일벌 성충 기생 꿀벌응애
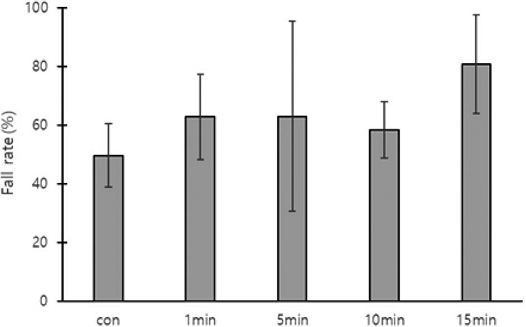
처리 후 1일 (1차)에 시트지로 떨어져 조사된 꿀벌응애 낙하수는 무처리구, 밀폐 1, 5, 10, 15분 순서로 54±22.2, 60±29.4, 128±87.0, 115±107.5, 76±51.8마리로 측정되었다. 처리 후 3일 (2차) 꿀벌응애 평균 낙하수는 87±15.2, 69±21.0, 47±36.7, 129±100.6, 86±15.2마리로 측정되었다. 1차와 2차를 합친 총 낙하수는 140±28.4, 129±50.2, 175±112.0, 244±200.9, 235±169.7마리가 측정되었다. 낙하하지 않고 봉군에 남아있던 평균 꿀벌응애수는 293±160.4, 46±20.6, 29±21.1, 89±13.6, 74±87.7마리로 측정되었고, 1차와 2차에 낙하한 응애수와 봉군에 남아있던 응애수의 합은 433±181.5, 175±70.8, 203±129.3, 333±213.4, 310±249.6마리로 측정되었다 (Fig. 3).
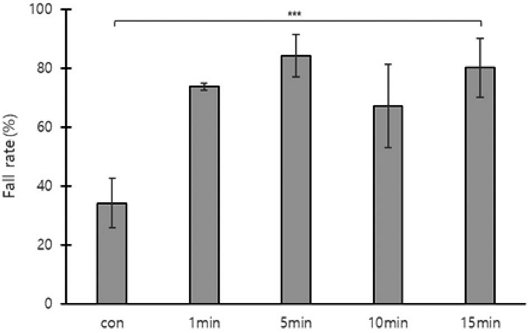
The falling rate of Varroa destructor mites attached to worker bees based on the duration of hive entrance closure after oxalic acid fumigation. *: indicates significant difference (***: p<0.001). The error bars indicate the standard deviation.
1차 꿀벌응애 평균 낙하율은 무처리구, 밀폐 1분, 5분, 10분, 15분 순서로 13±0.7, 33±4.6, 59±19.1, 32±12.1, 41±31.4%로 유의한 차이가 없었다. 2차 낙하율은 22±8.0, 41±5.8, 25±11.9, 36±14.8, 39±23.6%로 유의한 차이가 없었다. 최종 낙하율은 34±8.4, 74±1.3, 84±7.1, 67±14.1%, 80±9.1%로 유의한 차이가 있었다 (one-way ANOVA, F(4,10)=14.151, p=0.0004, Fig. 3).
(2) 일벌 성충 및 벌통 내 방랑 중국가시응애
처리 후 1일 (1차) 중국가시응애 낙하수는 무처리구, 밀폐 1, 5, 10, 15분 순서로 26±12.6, 3±2.3, 8±4.9, 9±9.0, 6±5.0마리로 측정되었다. 처리 후 3일 (2차) 중국가시응애 낙하수는 21±4.7, 6±1.0, 4±2.6, 12±6.2, 11±9.7마리로 측정되었다. 1차와 2차를 합친 총 낙하수는 47±17.0, 9±2.5, 12±2.7, 21±12.0, 17±14.7마리로 측정되었다. 낙하하지 않고 봉군에 남아있던 응애수는 46±4.5, 5±1.7, 16±24.0, 14±6.6, 7±5.9마리로 측정되었다. 전체 응애수는 93±15.5, 14±1.5, 28±27.9, 35±16.7, 24±20.5마리로 측정되었다 (Fig. 4).
The falling rate of Tropilaelaps mercedesae mites attached to worker bees based on the duration of hive entrance closure after oxalic acid fumigation. The error bars indicate the standard deviation.
1차 중국가시응애 낙하율은 무처리구, 밀폐 1, 5, 10, 15분 순서로 27±9.0, 18±16.0, 36±26.9, 24±16.1, 50±43.0%로 유의한 차이가 없었다. 2차 낙하율은 23±3.1, 44±9.6, 27±34.2, 34±7.2, 30±26.3%로 유의한 차이가 없었다. 최종 낙하율은 50±10.8, 63±14.5, 63±14.5, 63±32.4, 58±9.5, 81±16.8%로 유의한 차이가 없었다 (Fig. 4).
(3) 일벌 번데기 내부 기생 꿀벌응애
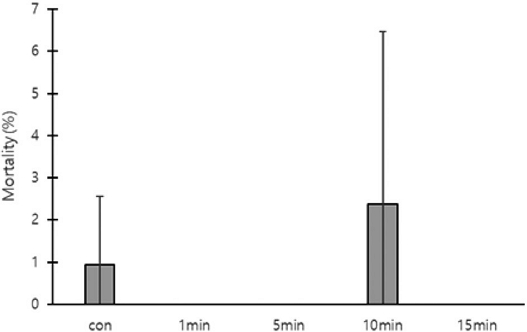
각 처리구 200개의 번데기방에서 발견된 꿀벌응애의 평균 총 개체수, 사망수, 생존수, 사망률을 측정하였다. 무처리구의 총 개체수는 108.0±17.06마리, 사망수 5.3±4.62마리, 생존수 102.7±20.60마리, 사망률 5.4±4.74%로 측정되었다. 밀폐 1분 처리구의 총 개체수는 88.3±91.35마리, 사망수 1.7±2.89마리, 생존수 88.7±91.78마리, 사망률 2.3±3.93%로 측정되었다. 밀폐 5분 처리구의 총 개체수는 28.0±40.73마리, 사망수 1.0±1.00마리, 생존수는 27.0±39.85마리, 사망률은 6.5±8.96%로 측정되었다. 밀폐 10분 처리구의 총 개체수는 84.3±58.88마리, 사망수 10.0±14.73마리, 생존수 74.3±48.21마리, 사망률은 9.9±9.17%로 측정되었다. 소문 차단 15분의 총 개체수는 67.7±84.23마리, 사망수는 0마리, 생존수는 67.7±84.23마리, 사망률은 0%로 측정되었다. 처리구 간 꿀벌응애의 사망률은 유의한 차이가 없었다 (Fig. 5).
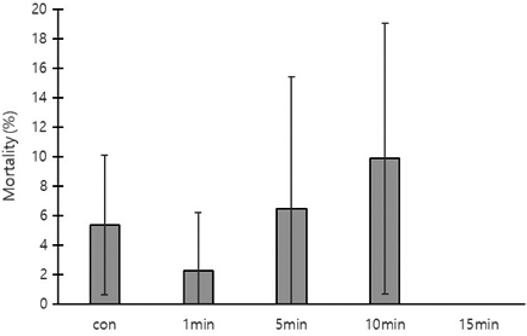
The mortality rate of Varroa destructor inside capped brood cells as affected by the duration of hive entrance closure after oxalic acid fumigation. The error bars indicate the standard deviation.
(4) 일벌 번데기 내부 기생 중국가시응애
각 처리구 200개의 번데기방에서 발견된 중국가시응애의 총 개체수, 사망수, 생존수, 사망률을 측정하였다. 무처리구의 총 개체수는 36.0±8.00마리, 사망수 0.3±0.58마리, 생존수 35.7±8.02마리, 사망률 0.9±1.62%로 측정되었다. 밀폐 1분 처리구의 총 개체수는 6.0±4.58마리, 사망수 0마리, 생존수 6.0±4.58마리, 사망률 0%로 측정되었다. 밀폐 5분 처리구 총 개체수는 3.3±4.04마리, 사망수 0마리, 생존수 3.3±4.04마리, 사망률 0%로 측정되었다. 밀폐 10분 처리구의 총 개체수는 15.3±11.15마리, 사망수는 0.7±1.15마리, 생존수는 14.7±10.02마리, 사망률은 2.4±4.10%로 측정되었다. 밀폐 15분 처리구의 총 개체수는 26.7±28.10마리, 사망수 0마리, 생존수 26.7±28.10마리, 사망률 0%로 측정되었다. 처리 간 중국가시응애의 사망률은 유의한 차이가 없었다 (Fig. 6).
(1) 일벌 성충 기생 꿀벌응애
처리 후 1일 (1차) 꿀벌응애 낙하수는 무처리, 0 (당액 100%), 0.7, 3, 6% 순서로 54±22.2, 28±27.0, 43±25.9, 64±24.1, 114±43.1마리로 측정되었다. 처리 후 3일 (2차) 낙하수는 86±15.2, 155±178.7, 146±65.0, 91±39.2, 32±6.4마리로 측정되었다. 1차와 2차를 합친 총 평균 낙하 꿀벌응애수는 140±28.4, 183±205.7, 189±61.2, 155±62.5, 147±48.3마리가 측정되었다. 낙하하지 않고 봉군에 남아있던 꿀벌응애수는 293±160.4, 94±25.5, 134±79.3, 36±22.9, 44±16.3마리이며, 전체 응애수는 433±181.5, 276±206.7, 323±127.2, 191±84.6, 191±41.7마리였다.
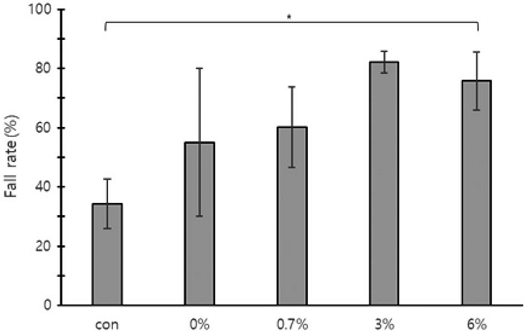
The falling rate of Varroa destructor mites attached to worker bees after oxalic acid-sugar solution dripping (trickling) treatment at different concentrations of oxalic acid. *: indicates significant difference (p<0.05). The error bars indicate the standard deviation.
1차 꿀벌응애 평균 낙하율은 무처리, 0, 0.7, 3, 6% 순서로 13±0.8, 9±3.2, 16±12.7, 35±3.8, 59±10.7%로 유의한 차이를 나타내었다 (one-way ANOVA, F(4,10)=0.323, p<0.001). 2차 낙하율은 22±8.0, 46±22.3, 45±3.0, 48±4.6, 17±0.9%로 유의한 차이가 있었다 (one-way ANOVA, F(4,10)=5.484, p=0.013). 최종 낙하율은 34±8.4, 55±24.9, 60±13.5, 82±3.7, 76±9.8%로 유의한 차이를 보였다 (one-way ANOVA, F(4,10)=5.360, p=0.014).
(2) 일벌 성충 및 벌통 내 방랑 중국가시응애
처리 후 1일 (1차) 중국가시응애 낙하수는 무처리, 0 (당액 100%), 0.7, 3, 6% 순으로 26±12.6, 6±4.6, 8±3.2, 4±3.8, 2±2.6마리였다. 처리 후 3일 (2차) 낙하수는 86±15.2, 155±178.7, 146±65.0, 91±39.2, 32±6.4마리였다. 총 낙하 중국가시응애는 47±17.0, 23±10.1, 19±12.5, 11±6.9, 7±3.5마리로 측정되었다. 낙하하지 않고 봉군에 남아있던 중국가시응애수는 46±4.5, 9±12.7, 5±4.6, 1±1.0, 5±6.9마리이며, 전체 응애수는 93±15.5, 32±21.6, 24±21.6, 12±6.1, 12±4.0마리였다.
The falling rate of Tropilaelaps mercedesae mites attached to worker bees after oxalic acid-sugar solution dripping (trickling) treatment at different concentrations of oxalic acid. The error bars indicate the standard deviation.
The falling rate of Varroa destructor mites inside capped brood cells after oxalic acid-sugar solution dripping (trickling) treatment at different concentrations of oxalic acid. The error bars indicate the standard deviation.
1차 중국가시응애 낙하율은 무처리, 0, 0.7, 3, 6% 순서로 27±9.0, 22±17.9, 40±12.8, 28±24.7, 24±33.8%로 유의한 차이가 없었다. 2차 낙하율은 23±3.0, 57±12.9, 40±13.5, 57±3.3, 42±34.8%로 유의한 차이가 없었다. 최종 낙하율은 50±10.8, 78±18.7, 80±19.0, 85±21.5, 66±40.7%로 유의한 차이가 없었다.
(3) 일벌 번데기 내부 기생 꿀벌응애
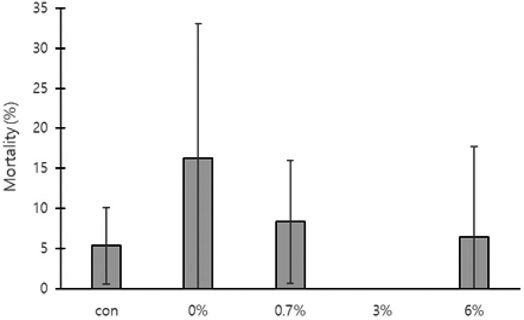
각 처리구별 200개의 번데기방에서 발견된 꿀벌응애의 총 개체수, 사망수, 생존수, 사망률을 측정하였다. 무처리구에서 발견된 꿀벌응애 총 개체수는 108.0±17.06마리, 사망수 5.3±4.62마리, 생존수 102.7±20.60마리, 꿀벌응애 사망률 5.4±4.74%로 측정되었다. 0%에서 발견된 총 응애 개체수는 72.0±49.37마리, 사망수 7.3±7.09마리, 생존수는 64.7±54.99마리, 사망률은 16.3±16.77%로 측정되었다. 0.7%는 총 개체수는 201.3±123.65마리, 사망수 10.7±9.50마리, 생존수 190.7±128.08마리, 사망률은 8.4±7.64%로 측정되었다. 3%의 총 개체수는 1.0±1.00마리, 사망수 0마리, 생존수 1.0±1.00마리, 사망률 0%로 측정되었다. 6%의 총 개체수는 25.7±16.62마리, 사망수 2.7±4.62마리, 생존수 23.0±13.23마리, 사망률 6.5±11.26%로 측정되었다. 처리구 간 사망률은 유의한 차이가 없었다
The falling rate of Tropilaelaps mercedesae mites inside capped brood cells after oxalic acid-sugar solution dripping (trickling) treatment at different concentrations of oxalic acid. The error bars indicate the standard deviation.
(4) 일벌 번데기 내부 기생 중국가시응애
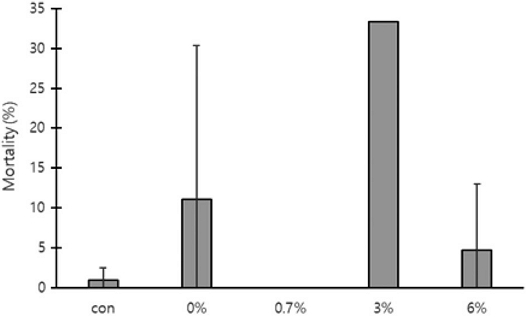
각 처리구별 200개의 번데기방에서 발견된 중국가시응애의 총 개체수, 사망수, 생존수, 사망률을 측정하였다. 무처리의 중국가시응애 총 개체수는 36.0±8.00마리, 사망수 0.3±0.58마리, 생존수 35.7±8.02마리, 사망률 0.9±1.62%로 측정되었다. 0%의 중국가시응애 총 개체수는 19.0±9.64마리, 사망수 1.3±2.31마리, 생존수 17.7±11.24마리, 사망률 11.1±19.23%로 측정되었다. 0.7%의 중국가시응애 총 개체수는 21.0±20.95마리, 사망수 0마리, 생존수 21.0±20.95마리, 사망률 0%로 측정되었다. 3%의 총 개체수는 1.0±1.73마리, 사망수 0.3±0.58마리, 생존수 0.7±1.15마리, 사망률은 2개 봉군에서 중국가시응애가 발견되지 않아 1개 봉군의 사망률만 33.3%로 측정되었다. 6%의 총 개체수는 5.3±1.53마리, 사망수 0.3±0.58마리, 생존수 5.0±1.00마리, 사망률 4.8±8.26%로 측정되었다. 처리구 간 사망률은 유의한 차이가 없었다
고 찰
옥살산 훈증에서는 처리 전후 일벌, 번데기, 애벌레, 알 개체수 변화는 없었으며, 꿀벌에 피해는 없는 것을 알 수 있었다. 본 결과는 Berry et al. (2022) 보고와 일치하였으며, 영국에서 옥살산 훈증이 응애 방제에 효과적인 방법으로 보고하였다 (Al Toufailia et al., 2015). 그러나 다른 결과에서는 옥살산에 장기간 노출 시 유충 발달과 여왕벌 생존에 부정적 영향이 있다고 보고되었고 (Higes et al., 1999), 이상 행동과 수명에도 영향이 적다고 알려졌다 (Schneider et al., 2012). 본 연구에서는 옥살산을 처리 시 다음날 일벌과 알의 수에서 약간 감소되는 경향을 보였으나 무처리와 통계적 유의한 차이는 없었으며, 처리 후 2일부터 증가 추세를 보여주었다. 일벌, 번데기, 애벌레 개체수는 큰 변화 폭을 보이지 않았다. 알 개체수는 다른 단계들에 비하여 낮아진 것으로 보아 처리 직후 여왕벌의 산란에 부정적 영향을 줄 수 있을 것으로 보여진다.
훈증 방제 효과는 꿀벌응애의 경우 무처리보다 다른 그룹에서 유의한 차이를 보이며 효과를 보여주었다. 하지만 처리구 사이, 밀폐한 시간이 다른 그룹 사이에선 유의한 차이를 보이지 않았고, 5분의 처리구에서 가장 높은 낙하율 (84±7.1%)을 보인 것으로 보아 5분 이상 밀폐를 하는 것은 방제 효율에 차이는 없는 것으로 판단된다. 또한 본 연구는 옥살산 1 g의 훈증 결과이며, 국외에서는 벌통당 1 g은 부족하고 2 g을 사용하면 더 효과적이라고 보고하였다 (Rademacher and Harz, 2006). 일벌 번데기 내 방제 효과는 꿀벌응애의 경우 10분 밀폐 처리구에서 9.9%의 사망률을 보였다. 하지만 전반적으로 꿀벌응애의 사망률과 중국가시응애의 사망률이 낮아 옥살산 훈증은 번데기 내부의 꿀벌응애류의 방제 효율이 낮은 것으로 파악되었다.
옥살산 흘림 처리법에서 꿀벌에는 안전한 것으로 나타났다. 꿀벌응애 방제 효과는 3%와 6%는 무처리보다 높은 방제 효율이 나타났다. 해외에서는 6%의 옥살산당액혼합액은 방제 효과는 높으나 꿀벌 안전성이 낮다는 보고가 있다 (Charriére and Imdorf, 2002). 흘림 처리에 대한 일벌 번데기 내 꿀벌응애류 사망률은 무처리구와 처리구들 모두 유의한 차이를 보이지 않았다.
옥살산 방제법은 흘림 처리나 훈증 처리 모두 꿀벌응애의 방제에 효과적인 방제법으로 사용되고 있다. 본 연구에서 옥살산의 두 가지 방제법이 특정 농도 및 방법에서 방제 효과를 보여주었다. 또한 꿀벌 봉군의 개체수의 변화에 대하여 큰 영향을 주지 않는 것을 보여주었다. 하지만 여름철의 옥살산 흘림 처리는 꿀벌에게 독성을 보이며 (Rademacher and Harz, 2006)와 3% 이상 농도의 옥살산을 여름과 가을에 3~4회 봉군에 처리한 후 겨울에 봉군이 약해졌다는 보고 (Charriére and Imdorf, 2002)가 있다. 또한 옥살산이 애벌레에 직접 접촉시 부정적 영향이 나타난다 (Gregorc et al., 2004; Hatjina and Haristos, 2005). 옥살산은 강한 유기산으로 꿀벌과 꿀벌응애류에 살충력을 가진다. 꿀벌응애류 방제를 위해서는 적정 용량과 방식으로 처리해야 꿀벌에 안전성을 확보할 수 있다. 따라서 다양한 환경과 방식으로 사양관리되는 양봉농가 현장에 기초 자료로 사용할 수 있을 것으로 기대한다.
Acknowledgments
본 연구는 농촌진흥청 연구과제 PJ01418006의 연구비로 지원된 결과이며 이에 깊은 감사를 드립니다.
References
-
Akyol, E. and H. Yeninar. 2009. Use of oxalic acid to control Varroa destructor in honeybee (Apis mellifera L.) colonies. Turkish J. Vet. Anim. Sci. 33(4): 285-288.
[https://doi.org/10.3906/vet-0712-16]

-
Al Toufailia, H., L. Scandian and F. L. Ratnieks. 2015. Towards integrated control of varroa: 2) comparing application methods and doses of oxalic acid on the mortality of phoretic Varroa destructor mites and their honey bee hosts. J. Apic. Res. 54(2): 108-120.
[https://doi.org/10.1080/00218839.2015.1106777]

-
Aliano, N. P., M. D. Ellis and B. D. Siegfried. 2006. Acute contact toxicity of oxalic acid to Varroa destructor (Acari: Varroidae) and their Apis mellifera (Hymenoptera: Apidae) hosts in laboratory bioassays. J. Econ. Entomol. 99(5): 1579-1582.
[https://doi.org/10.1093/jee/99.5.1579]

-
Aliano, N. P. and M. D. Ellis. 2008. Bee-to-bee contact drives oxalic acid distribution in honey bee colonies. Apidologie 39(5): 481-487.
[https://doi.org/10.1051/apido:2008030]

-
Berry, J. A., L. J. Bartlett, S. Bruckner, C. Baker, S. K. Braman, K. S. Delaplane and G. R. Williams. 2022. Assessing repeated oxalic acid vaporization in honey bee (hymenoptera: apidae) colonies for control of the ectoparasitic mite Varroa destructor. J. Insect Sci. 22(1): 15.
[https://doi.org/10.1093/jisesa/ieab089]

-
Bogdanov, S., J. D. Charrière, A. Imdorf, V. Kilchenmann and P. Fluri. 2002. Determination of residues in honey after treatments with formic and oxalic acid under field conditions. Apidologie 33(4): 399-409.
[https://doi.org/10.1051/apido:2002029]

-
Bogdanov, S., V. Kilchenmann and A. Imdorf. 1998. Acaricide residues in some bee products. J. Apic. Res. 37(2): 57-67.
[https://doi.org/10.1080/00218839.1998.11100956]

-
Charriére, J. D. and A. Imdorf. 2002. Oxalic acid treatment by trickling against Varroa destructor: recommendations for use in central Europe and under temperate climate conditions. Bee World 83(2): 51-60.
[https://doi.org/10.1080/0005772X.2002.11099541]

-
Dainat, B., J. D. Evans, Y. P. Chen, L. Gauthier and P. Neumann. 2012. Dead or alive: deformed wing virus and Varroa destructor reduce the life span of winter honeybees. Appl. Environ. Microbiol. 78(4): 981-987.
[https://doi.org/10.1128/AEM.06537-11]

-
Delaplane, K. S., J. Van Der Steen and E. Guzman-Novoa. 2013. Standard methods for estimating strength parameters of Apis mellifera colonies. J. Apic. Res. 52(1): 1-12.
[https://doi.org/10.3896/IBRA/1.52.1.03]

-
Dietemann, V., F. Nazzi, S. J. Martin, D. L. Anderson, B. Locke, K. S. Delaplane and J. D. Ellis. 2013. Standard methods for varroa research. J. Apic. Res. 52(1): 1-54.
[https://doi.org/10.3896/IBRA.1.52.1.09]

- Elzen, P. J., J. R. Baxter, M. A. R. L. A. Spivak and W. T. Wilson. 1999a. Amitraz resistance in varroa: new discovery in North America. Am. Bee J. 139(5): 362.
-
Elzen, P. J., F. A. Eischen, J. R. Baxter, G. W. Elzen and W. T. Wilson. 1999b. Detection of resistance in US Varroa jacobsoni Oud. (Mesostigmata: Varroidae) to the acaricide fluvalinate. Apidologie 30(1): 13-17.
[https://doi.org/10.1051/apido:19990102]

-
Gregorc, A. and I. Planinc. 2001. Acaricidal effect of oxalic acid in honeybee (Apis mellifera) colonies. Apidologie 32(4): 333-340.
[https://doi.org/10.1051/apido:2001133]

-
Gregorc, A., A. Pogacnik and I. D. Bowen. 2004. Cell death in honeybee (Apis mellifera) larvae treated with oxalic or formic acid. Apidologie 35(5): 453-460.
[https://doi.org/10.1051/apido:2004037]

-
Hatjina, F. and L. Haristos. 2005. Indirect effects of oxalic acid administered by trickling method on honey bee brood. J. Apic. Res. 44(4): 172-174.
[https://doi.org/10.1080/00218839.2005.11101174]

-
Higes, M., A. Meana, M. Suárez and J. Llorente. 1999. Negative long-term effects on bee colonies treated with oxalic acid against Varroa jacobsoni Oud. Apidologie 30(4): 289-292.
[https://doi.org/10.1051/apido:19990404]

-
Jack, C. J., E. van Santen and J. D. Ellis. 2020. Evaluating the efficacy of oxalic acid vaporization and brood interruption in controlling the honey bee pest Varroa destructor (Acari: Varroidae). J. Econ. Entomol. 113(2): 582-588.
[https://doi.org/10.1093/jee/toz358]

-
Kim, H. K. 2022. The effect of honey bee mites on the winter colony losses. J. Apic. 37(3): 291-299.
[https://doi.org/10.17519/apiculture.2022.09.37.3.291]

-
Kim, Y. H. and S. H. Lee. 2022. Current status of fluvalinate resistance in Varroa destructor in Korea and suggestion for possible solution. J. Apic. 37(3): 301-313.
[https://doi.org/10.17519/apiculture.2022.09.37.3.301]

- Maggi, M. D., N. Damiani, S. R. Ruffinengo, M. C. Brasesco, N. Szawarski, G. A. Mitton and M. J. Eguaras. 2017. The susceptibility of Varroa destructor against oxalic acid: a study case. Bull. Insectology 70(1): 39-44.
-
Martin, S. J., A. C. Highfield, L. Brettell, E. M. Villalobos, G. E. Budge, M. Powell and D. C. Schroeder. 2012. Global honey bee viral landscape altered by a parasitic mite. Science 336(6086): 1304-1306.
[https://doi.org/10.1126/science.1220941]

-
Mondet, F., J. R. de Miranda, A. Kretzschmar, Y. Le Conte and A. R. Mercer. 2014. On the front line: quantitative virus dynamics in honeybee (Apis mellifera L.) colonies along a new expansion front of the parasite Varroa destructor. PLoS Pathog. 10(8): e1004323.
[https://doi.org/10.1371/journal.ppat.1004323]

-
Rademacher, E. and M. Harz. 2006. Oxalic acid for the control of varroosis in honey bee colonies - a review. Apidologie 37(1): 98-120.
[https://doi.org/10.1051/apido:2005063]

-
Ramsey, S. D., R. Ochoa, G. Bauchan, C. Gulbronson, J. D. Mowery, A. Cohen and D. van Engelsdorp. 2019. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proc. Natl. Acad. Sci. 116(5): 1792-1801.
[https://doi.org/10.1073/pnas.1818371116]

-
Ritter, W. 1981. Varroa disease of the honeybee Apis mellifera. Bee World 62(4): 141-153.
[https://doi.org/10.1080/0005772X.1981.11097838]

-
Schneider, S., D. Eisenhardt and E. Rademacher. 2012. Sublethal effects of oxalic acid on Apis mellifera (Hymenoptera: Apidae): changes in behaviour and longevity. Apidologie 43: 218-225.
[https://doi.org/10.1007/s13592-011-0102-0]

- Takeuchi, K. and K. Harada. 1983. Control of Varroa jacobsoni mites with oxalic acid spray. Honeybee Science 4: 113-116.
-
van der Steen, J. and F. Vejsnæs. 2021. Varroa control: A brief overview of available methods. Bee World 98(2): 50-56.
[https://doi.org/10.1080/0005772X.2021.1896196]

-
Wallner, K. 1999. Varroacides and their residues in bee products. Apidologie 30(2-3): 235-248.
[https://doi.org/10.1051/apido:19990212]

-
Zanni, V., D. A. Galbraith, D. Annoscia, C. M. Grozinger and F. Nazzi. 2017. Transcriptional signatures of parasitization and markers of colony decline in Varroa-infested honey bees (Apis mellifera). Insect Biochem. Mol. Biol. 87: 1-13.
[https://doi.org/10.1016/j.ibmb.2017.06.002]