국산 프로폴리스에 의한 파킨슨 방어 효과
Abstract
Parkinson's disease is a representative neurodegenerative disease in recent century. In this study, we confirmed the effect of Korean propolis for the prevention of Parkinson's disease using the SH-SY5Y neuroblastoma cell line. The cytotoxicity concentration of MPP+ as a factor of Parkinson’s disease for the SH-SY5Y cell line was confirmed at 200 μM. In this concentration of MPP+ showed overexpression of α-synuclein protein as a Parkinson's marker and induced apoptosis. And propolis was inhibited apoptosis and α-synuclein expression by MPP+. The cytoprotective effect of propolis for MPP+ toxicity was appeared difference followed by treatment condition. Pre-treatment of propolis has most effectively for inhibition of apoptosis and overexpression of α-synuclein. In addition, pre-treatment with propolis increased the amount of CREB protein expression in which related cognitive function. And activation of apoptosis marker such as PARP and caspase-3 were also effectively inhibited by pre-treatment of propolis. These inactivation of various apoptosis molecules was influenced by SAPK-JNK phosphorylation. Especially, we found that Jak-Stat signaling cascade protein expression was related in MPP+ toxicity and propolis prevention for the first time. Through this study, we showed that propolis was very effectively in Parkinson’s disease prevention and clarified the molecular mechanism by propolis. Therefore, we suggested that propolis can be usefully to prevent neurodegenerative disease.
Keywords:
Propolis extracts, MPP+, Parkinson’s disease, α-synuclein, Pre-treatment서 론
파킨슨병 (Parkinson’s disease, PD)은 대표적인 신경퇴행성 질환으로서 루이소체 (Lewy body)라고 하는 호산구, 세포질 내 단백질성 구조물의 존재와 함께 뇌간흑질세포에서 도파민 분비 세포가 소실되는 것을 특징으로 한다 (Forno, 1996). 뇌간흑질세포의 소실은 중추신경계에 광범위한 신경퇴행을 유발하고 뇌흑질 치밀부에서의 도파민 신경세포가 퇴화되면서 질환의 특징이 나타난다 (Braak et al., 2003). PD의 임상적 특징에는 자율신경계 및 정신과적 문제와 같은 비운동적 증상과 함께, 떨림, 자세 불안정성, 경직을 포함하는 운동 장애가 나타난다 (Fearnley and Lees, 1991). PD에서 나타나는 병리학적 양상에 관여하는 분자 경로는 아직은 모호하지만 환경 요인, 유전적 요인 혹은 두 요인의 조합으로 발생되는 것으로 알려져 있다. 현재까지 PD에서의 도파민 신경세포의 소실에 대한 구체적 원인 및 기전은 밝혀져 있지 않으나 가장 많이 보고된 PD의 원인은 세포 내 활성 산소 증가로 인한 산화 스트레스와 세포 내 주요 소기관 중의 하나인 미토콘드리아의 기능 장애이다 (Pieczenik and Neustadt, 2007). 이 산화 스트레스와 미토콘드리아 장애는 PD에 직접 관여하는 유전자의 기능이 포함되어 있다. 이 중에서 PD의 대표적 마커인 α-synuclein의 A53T 돌연변이는 세포 내에서 비정상적인 α-synuclein의 축적을 유발하며 미토콘드리아의 손상을 유발하는 것으로 알려져 있다 (Martin et al., 2006). 또한 α-synuclein 과발현에 의한 축적은 PD 유발 물질인 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)에 민감하게 작용하는 것으로 알려졌다 (Klivenyi et al., 2006; Nieto et al., 2006). 이러한 PD 발병에 관여하는 유전자는 현재까지 PARK1 (α-synuclein) (Spillantini et al., 1998), PARK2 (Parkin) (Feany and Pallanck, 2003; Dawson, 2006), PARK6 (PINK1) (Valente et al., 2004), PARK7 (DJ-1) (Chen et al., 2005; Goldberg et al., 2005; Kim et al., 2005) 그리고 PARK8 (Leucine-rich repeat kinase 2, LRRK2) (Li and Beal, 2005; Sakaguchi-Nakashima et al., 2007)의 5가지가 정의되어 있다. 이 유전자 중 PARK1에 해당하는 α-synuclein이 PD에 있어 가장 잘 알려진 마커로서 현재까지 α-synuclein의 응집에 대한 연구가 집중되고 있다. 특히 3종의 α-synuclein의 유전자 돌연변이 (A53T, A30P 그리고 E46K) 발생 시 PD 발병에 더 민감한 것으로 알려져 있다 (Singleton et al., 2003).
In vitro 또는 in vivo 연구에서 실험적으로 PD 질병 모델에 가장 널리 사용되는 약제는 MPTP이다 (Cui et al., 2013; Jantas et al., 2014). MPTP는 신경독성 물질로서 인간과 원숭이에서 PD를 유발하며, MPTP에 중독된 인간과 비인간 영장류에서 레보도파에 대한 반응과 약물 치료로 인한 합병증 발생이 PD 환자들에게서 나타나는 것과 동일한 반응을 보였으며, 원숭이와 생쥐에서 고령화가 진행될수록 MPTP에 대한 감수성이 높아지는 것이 확인되었다 (Irwin et al., 1993; Rose et al., 1993). MPTP는 세포의 인지질 이중층막을 쉽게 투과할 수 있는 분자이며, MPTP가 전신투여될 경우 몇 초만에 혈액-뇌 장벽을 통과한다 (Riachi et al., 1989). MPTP는 뇌에 들어가면 실제 신경독으로 작용하는 1-methyl-4-phenylpyridinium (MPP+)로 빠르게 전환된다 (Heikkila et al., 1984). MPTP에서 MPP+로의 전환은 2단계의 과정을 거치는데, 첫 번째로 MPTP는 monoamine oxidase-B (MAO-B)에 의해 촉매되는 산화 과정을 거쳐 중간체인 1-methyl-4-phenyl-2,3-dihydropyridinium (MPDP+)를 생성한다 (Chiba et al., 1984). 뇌에서 MAO-B의 분포를 고려하면 MPTP에서 MPDP+로의 전환은 도파민 분비 뉴런이 아니라 세로토닌 분비 세포에서 발생되는 것으로 보인다 (Kitahama et al., 1991). MPDP+는 불안정한 분자로서 (Chiba et al., 1985; Peterson et al., 1985) 아직 밝혀지지 않은 메커니즘에 의해 활성 독성 분자인 MPP+로 전환되고, 일단 형성된 MPP+는 도파민 분비 뉴런으로 들어가기 전에 세로토닌 분비 세포에서 방출된다. 그러나 MPTP와 달리 MPP+는 낮은 인지질 이중층막 친화성으로 인해 쉽게 확산되지 않고, 대신 MPP+가 세포 내 형성 부위에서 방출되고 인접한 뉴런으로 이동하는 것은 특별한 기능을 담당하는 운반체에 의존하며, Bezard 등과 Javitch 등에 의해 MPP+의 이동은 원형질막의 도파민 수송체에 의존한다는 사실이 밝혀졌다 (Javitch et al., 1985; Bezard et al., 1999). 일단 뉴런 내부로 진입한 MPP+는 미토콘드리아 기질에 빠르게 축적되며, 미토콘드리아 내에서 산화적 인산화를 억제한다 (Nicklas et al., 1985; Singer et al., 1987). 또한 미토콘드리아 내의 MPP+는 tricarboxylic acid cycle 효소인 α-ketoglutarate dehydrogenase를 억제한다 (Mizuno et al., 1987). 또한 MPP+는 미토콘드리아의 ubiquinone oxidoreductase (Complex I)과 결합하여 효소 활성을 억제하는데 (Nicklas et al., 1985; Vyas et al., 1986), 이로 인해 ATP 합성 장애가 발생한다고 현재 추측되고 있다. 실제 MPP+ 축적이 일어난 세포 및 마우스에서 ATP의 수준이 고갈된 것으로 나타났다 (Di Monte et al., 1986; Scotcher et al., 1990). 위와 같은 일련의 과정을 통해 세포 내 ROS 증가와 ATP 레벨의 감소 등으로 세포 사멸이 발생하게 된다.
프로폴리스는 꿀벌이 생산하는 수지성 물질로서 다양한 식물에서부터 유래된 삼출물과 꿀벌의 타액이 혼합되어 만들어진 물질이다. 본래 프로폴리스는 꿀벌이 자신의 벌집을 방어하기 위한 수단으로 생산하는 물질로서 곤충 혹은 미생물 등의 침입자로부터 벌집을 보호하고 손상된 벌집을 수리하는 시멘트 용도로 이용된다 (Burdock, 1998). 고대부터 인류 역시 프로폴리스를 활용했는데, 이집트에서는 미라를 보존하기 위한 재료로 이용했고, 1899년도에 발발한 보어전쟁에서는 상처입은 군인을 치료하는데 프로폴리스를 활용했다는 보고가 있다 (Ramos and Miranda, 2007; Cavalaro et al., 2019; Duca et al., 2019). 프로폴리스는 다양하고도 풍부한 플라보노이드와 폴리페놀 성분을 함유하고 있는데 (de Groot, 2013), 지속적인 연구를 통해 항균, 항산화 그리고 항종양 등과 관련된 생물학적 기능성이 밝혀졌다 (Fernandes Junior et al., 2005; Sforcin, 2007; Zhang et al., 2013). 최근 플라보노이드에 의한 인지기능 개선 연구가 이루어졌다. Yeh 등은 꾸준한 플라보노이드 성분의 섭취가 인지 기능 장애와 관련된 질병의 발병을 저해할 수 있다는 연구 결과를 보고하였고 (Yeh et al., 2021), Kim 등은 프로폴리스가 tau 단백질의 과인산화를 저해하여 알츠하이머의 개선 효과에 대한 가능성을 제시했다 (Kim et al., 2021). 또한 Kim 등은 in vitro에서 프로폴리스가 MPTP 독성에 의한 세포 사멸을 억제할 수 있다는 결과를 보고하였다 (Kim et al., 2022).
이에 본 연구에서는 이전에 보고된 PD에 대한 프로폴리스의 기능성과 관련하여 보다 구체적인 세포 방어 기전을 확인하고자 PD 발병의 실질적인 독성 인자인 MPP+와 프로폴리스를 전·후처리 및 동시처리 조건을 이용하여 프로폴리스의 세포 독성 감소 조건과 그와 연관된 세포 내 단백질 분자의 변화를 검증하였다. 이로 인해 프로폴리스의 PD 발병 억제 효과 및 신경퇴행성 질병 개선에 대한 건강기능식품으로서의 프로폴리스의 기능성을 구체화하고자 한다.
재료 및 방법
1. 프로폴리스 추출
본 실험에 사용된 프로폴리스는 국내 충주 지역의 양봉농가에서 수집된 프로폴리스 원괴 200 g에 2 l의 80% 에탄올 용액을 첨가하여 실온에서 교반하면서 48시간 동안 추출하였다. 이 후 miracloth로 1차 여과한 다음, Whatman No. 2 필터로 여과하여 불순물을 제거하였으며, 감압농축 장치에서 완전히 농축하였다. 농축된 시료에 에탄올 용액을 100 mg/ml의 농도가 되도록 첨가한 후 실험에 사용할 때까지 냉장 보관하였다.
2. Media & Reagents
세포 배양에 사용된 배지는 Gibco (U.S.A.)사의 minimal essential medium (MEM) 배지를 사용하였으며, 세포 외 세균의 성장을 억제하기 위한 penicillin-streptomycin 역시 Gibco사에서 구입하였다. 세포 배양에 필수적인 fetal bovine serum (FBS)은 GenDEPOT (Korea)사에서 구입한 것을 56℃에서 50분간 불활성화한 뒤 배지에 첨가하여 사용하였다. 세포의 PD 유도를 위한 MPP+ iodide는 Sigma (U.S.A.)사에서 구입하였고, MPP+에 대한 세포 독성 평가를 위한 EZ-Cytox plus solution은 DoGenbio (Korea)에서 제품을 구입하였다. Western blotting 실험을 위한 1차 항체 중 phospho-AKT, AKT, PARP, Caspase-3, α-synuclein, Jak2, STAT3, SAPK/JNK, phospho-SAPK/JNK 항체는 Cell Signaling Technology (U.S.A.)에서 구입하였고, CREB와 GAPDH는 Santacruz Biotechnology (U.S.A.)에서 구입하였다.
3. 세포주 배양
실험에 사용된 세포주는 대표적인 신경세포주인 SH-SY5Y 신경아세포종 세포주로서 한국세포주은행에서 구입하여 계대배양하며 실험에 사용하였다. 세포 배양용 배지는 MEM 기본 배지에 100 unit/ml의 penicillin-streptomycin, 10%의 FBS를 첨가하여 사용하였다. 세포는 37℃로 유지되고 5%의 CO2가 공급되는 배양기에서 배양하였다.
4. SH-SY5Y 세포주에 대한 MPP+의 세포 독성 측정
세포에 처리하기 위한 MPP+의 적정 농도를 결정하기 위해 농도에 따른 세포 독성 효과를 검증하였다. 먼저 SH-SY5Y 세포를 96-well plate에 1×104 cells/well이 되도록 접종한 뒤, 24시간 동안 배양시켰다. 배양된 세포에 MPP+는 50, 100, 200, 300, 400 그리고 500 μM의 농도의존적으로 처리하였다. 대조군으로서는 MPP+를 첨가하지 않고 배지만 처리한 그룹으로 설정하였으며, MPP+를 증류수에 용해하였기 때문에 용매 대조군은 설정하지 않았다. MPP+를 처리하고 24시간 후에 EZ-cytox 용액을 배지 부피의 1/10로 처리하여 2시간 동안 배양기에서 반응시켰고, microplate reader에서 450 nm 파장에서 흡광도를 측정하였다. 또한 MPP+의 독성에 대한 세포 형태 변화를 확인하기 위해 EVOS XL Core (Thermo Fisher Scientific, U.S.A.) microscope로 촬영하였다.
5. 프로폴리스 전 · 후 및 동시처리에 따른 MPP+에 대한 세포 독성 비교
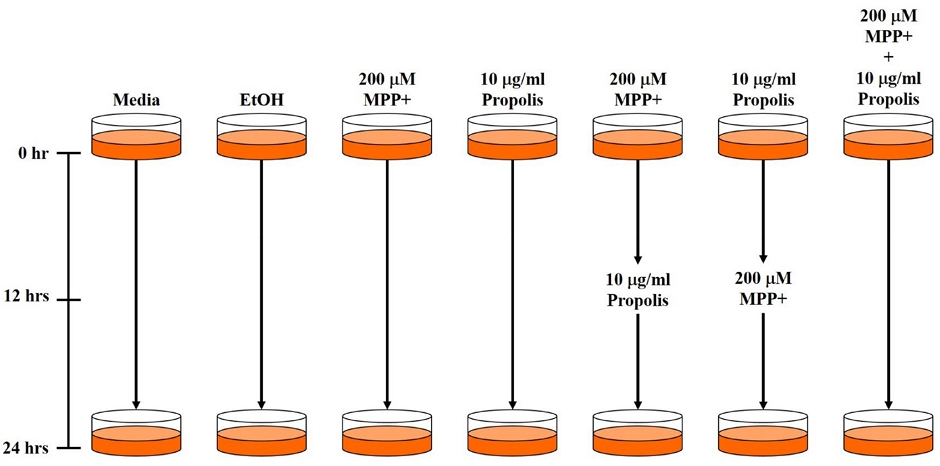
SH-SY5Y 세포주에 프로폴리스와 MPP+를 전·후 및 동시처리 함으로써 세포 보호에 대한 프로폴리스의 효과를 확인하고자 하였다. 이후 Western blotting으로 세포 내 단백질 추출을 위해 100 mm dish를 사용하였다. 100 mm dish에 세포주를 각각 1×107 cells/well로 접종한 후 24시간 동안 배양하고 200 μM의 MPP+와 10 μg/ml의 프로폴리스를 다음의 조건에 따라 세포에 처리하였다. 특히, 다음의 실험 조건에서 ⑤의 경우에는 12시간 동안 MPP+를 먼저 처리하고 이후 프로폴리스를 12시간 동안 처리하였으며, ⑥의 경우에는 프로폴리스를 12시간 동안 전처리하고 MPP+를 이후 12시간 동안 처리하였다. ⑦의 경우에는 MPP+와 프로폴리스를 동시에 처리하고 24시간 동안 반응시켰다. 각각의 실험구 설정을 Fig. 1에 도식화하였다.
처리 후, EZ-Cytox solution을 세포 배지의 1/10 부피로 처리하고 2시간 후 450 nm의 파장에서 흡광도를 측정하였다. 흡광도 측정 후, 세포의 형태를 EVOS XL Core 현미경으로 촬영하였다.
6. Western blotting
세포 독성 평가에 이용된 세포에서 단백질을 추출하였다. 세포 단백질 추출은 1× PBS 용액으로 1회 수세한 후, 200 μl의 RIPA buffer (Invitrogen)를 첨가하고 cell scraper로 세포를 파쇄하여 추출하였다. 이후 17,000 rpm에서 20분간 원심분리하여 깨끗한 상층액을 회수하였고, bicinchronic acid (BCA) 단백질 정량법으로 정량한 뒤, 20 μg의 단백질을 Western blotting에 사용하였다. 5× SDS sample buffer (250 mM Tris-HCl (pH 6.8), 5% 2-Mercaptoethanol, 10% SDS, 0.5% Bromophenol blue, 50% Glycerol)를 1×의 농도가 되도록 첨가하고 100℃에서 10분간 끓여 단백질을 변성시켰다. 각 단백질 시료는 Bio-Rad (U.S.A.)의 4~15% TGX premade gel에 전기영동하였고, transblot (Bio-Rad, U.S.A.) 장치를 이용하여 12 voltage에서 7분간 polyvinylidene fluoride (PVDF) membrane에 transfer하였다. 항체의 비특이적 반응 차단을 위해 1× tris-buffered saline-tween 20 (TBS-T)에 2% non-fat dry milk (with 0.02% sodium azide)를 첨가한 용액으로 실온에서 1시간 반응시켰고, 1차 항체를 실온에서 16시간 동안 반응시켰다. 사용된 1차 항체 중 α-synuclein, Caspase-3, CREB, Jak2, SAPK/JNK, STAT3는 1 : 1,000으로 희석하였고, AKT, PARP는 1 : 2,000으로 희석하였다. Phospho-AKT, phospho-SAPK/JNK는 1 : 500으로 희석하였으며, GAPDH는 1 : 5,000으로 2% non-fat dry milk (with 0.02% sodium azide, in 1× TBS-T)에 희석하여 사용하였다. 항체 반응 후 1× TBS-T 용액으로 membrane을 4회 washing한 다음, 1차 항체 생산 host에 따라 2차 항체인 goat anti-mouse-HRP 또는 goat anti-rabbit-HRP를 5% non-fat dry milk (without sodium azide, in 1× TBS-T)에 1 : 2,000으로 희석하여 실온에서 2시간 동안 반응시켰다. 2차 항체 반응 후, 1× TBS-T 용액으로 membrane을 4회 washing하고 ECL pico detection system (GenDEPOT, Korea)으로 발색 후, ChemiDOC (Bio-Rad, U.S.A.)으로 단백질 변화를 검출하였다
결과 및 고찰
1. MPP+의 세포 독성 평가
Fig. 2에서는 SH-SY5Y 세포주에 대한 MPP+의 세포 독성 결과를 나타내었다. Fig. 2A에서는 MPP+의 lethal dose (LD)는 약 100 μM에서 나타났다. 그러나 Fig. 2B의 세포 형태를 확인하면 100 μM의 농도에서 생존해있는 세포가 다수 존재하고 있기 때문에 본 실험을 진행함에 있어 확실한 세포 독성에 의한 사멸을 나타내야 하기 때문에 MPP+의 농도는 200 μM로 결정하였다. 프로폴리스 처리 농도는 이전 연구에서 이미 결정하였기 때문에 본 연구에서는 따로 실험을 통한 결과를 확인하지 않았다 (Kim et al., 2022).
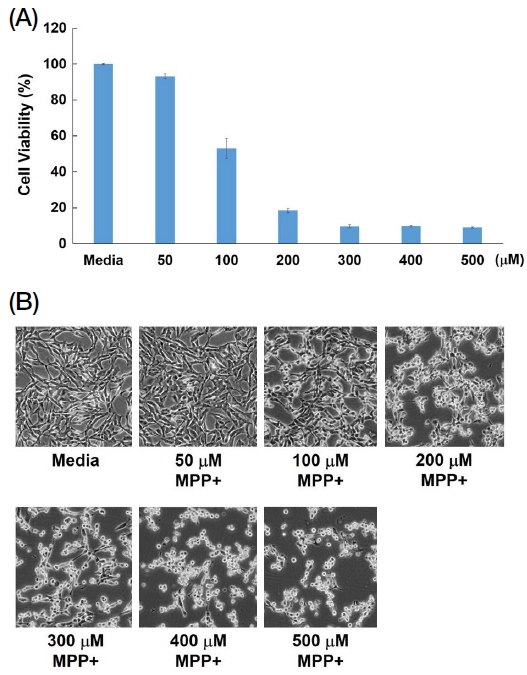
Cytotoxicity of MPP+ for SH-SY5Y. MPP+ were treated on dose-dependent manner. (A) SH-SY5Y cell seeded on to 96-well plate at 1×104 cells/well. MPP+ were incbated for 24 hrs, and then measurement of the optical density by EZ-cytox. Each experiment group repeats for 3-times. (B) SH-SY5Y cell morphology ovserved by EVOS XL core microscope.
2. 프로폴리스 추출물과 MPP+의 전 · 후 및 동시 처리에 따른 세포 형태 및 생존 평가
실험에 적용할 MPP+ 농도를 결정한 후, 프로폴리스 추출물과 MPP+를 세포에 전처리, 후처리 그리고 동시처리의 조건으로 진행하였다. 이 조건을 구분한 것은 PD를 유발하는 세포에 대한 프로폴리스의 세포 보호 효과를 확인하고자 한 것이다. 재료 및 방법에서 서술한 전·후 및 동시처리의 조건으로 진행한 후, 세포 생존률을 평가하였다. Fig. 3A의 결과에서 프로폴리스를 전처리함으로써 세포의 생존률을 2배 이상 증가시킬 수 있음이 나타났다. 프로폴리스 추출물과 MPP+를 동시처리한 경우에도 세포의 생존률을 증가시켰으나 프로폴리스 추출물을 전처리한 결과보다는 생존률이 낮았다. 반면, MPP+가 전처리된 경우에는 MPP+를 단독처리한 것과 유사한 세포 생존률을 보임으로써 프로폴리스 추출물에 의한 효과가 없는 것으로 나타났다. Fig. 3B에서 나타난 세포 형태를 확인하면 200 μM의 MPP+를 처리한 실험군과 MPP+를 전처리한 실험군에서는 대부분의 세포가 사멸되었으나 프로폴리스를 전처리한 실험군에서는 MPP+에 의한 독성이 감소된 것으로 나타났으며, MPP+와 프로폴리스 추출물을 동시에 처리한 실험군에서도 MPP+의 독성이 감소된 것으로 나타났다. 이는 프로폴리스의 전처리가 PD의 발병 저해와 예방에 효과가 있는 것을 나타내며, PD 발병이 시작되어도 프로폴리스 추출물에 의해 진행을 낮출 수 있다는 것을 의미한다.
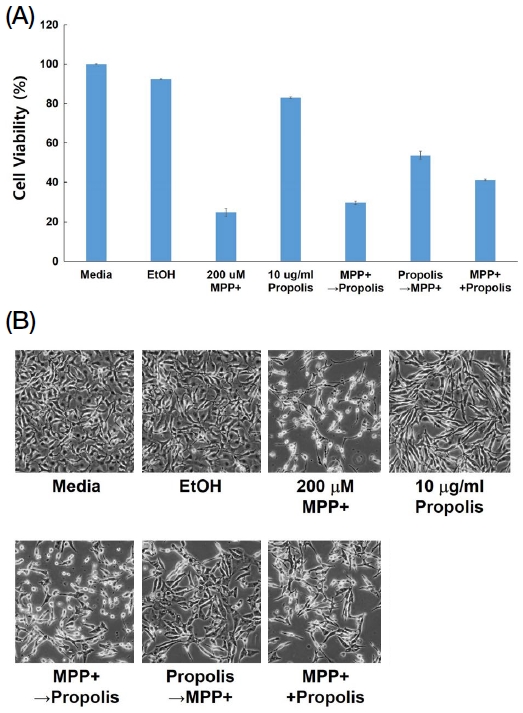
Protection effect of propolis extracts protect the SH-SY5Y cells from MPP+ toxicity. Pre-treatment, post-treatment and simultaneously treatment 200 μM of MPP+ and 10 μL/mL of propolis extracts. Pre-treatment and post-treatment incubation time is 12 hrs, respectively. Total incubation time is 24 hrs. (A) Cell viability measured by EZ-Cytox, (B) Cell morphology observed by EVOX XL core microscopy.
3. 프로폴리스의 세포 독성 저해와 관련된 세포 내 단백질 변화
MPP+는 PD의 발병을 유발하는 신경 독성 물질로서 가장 큰 세포 내의 마커 단백질로 α-synuclein이 알려져 있다. PD 발병 후 세포 내 비정상적으로 형성된 루이소체의 핵심 단백질이며, 병이 진행되면서 운동성 감퇴 뿐만 아니라 인지 기능 저하에도 영향을 끼친다. Fig. 4A의 결과를 보면 MPP+로 인한 α-synuclein의 과발현이 확인되었고, 프로폴리스의 전처리로 인해 α-synuclein의 과발현이 해소되고 있음을 알 수 있다. 프로폴리스 추출물의 전처리에서 α-synuclein 과발현이 가장 많이 해소되었고, MPP+와 동시처리한 부분에서는 MPP+ 단독 처리에 비해 α-synuclein의 발현이 감소된 것을 알 수 있다. 그러나 MPP+를 전처리한 경우에는 α-synuclein의 발현이 감소되지 않았다. 이와 함께 인지 기능에 대한 마커로 알려진 CREB의 경우 MPP+ 처리의 경우 단백질 발현이 크게 감소하는데, 프로폴리스 추출물 처리 시 CREB의 발현이 회복되었고, 프로폴리스 추출물의 전처리가 가장 많은 단백질 발현 회복을 나타냈다.
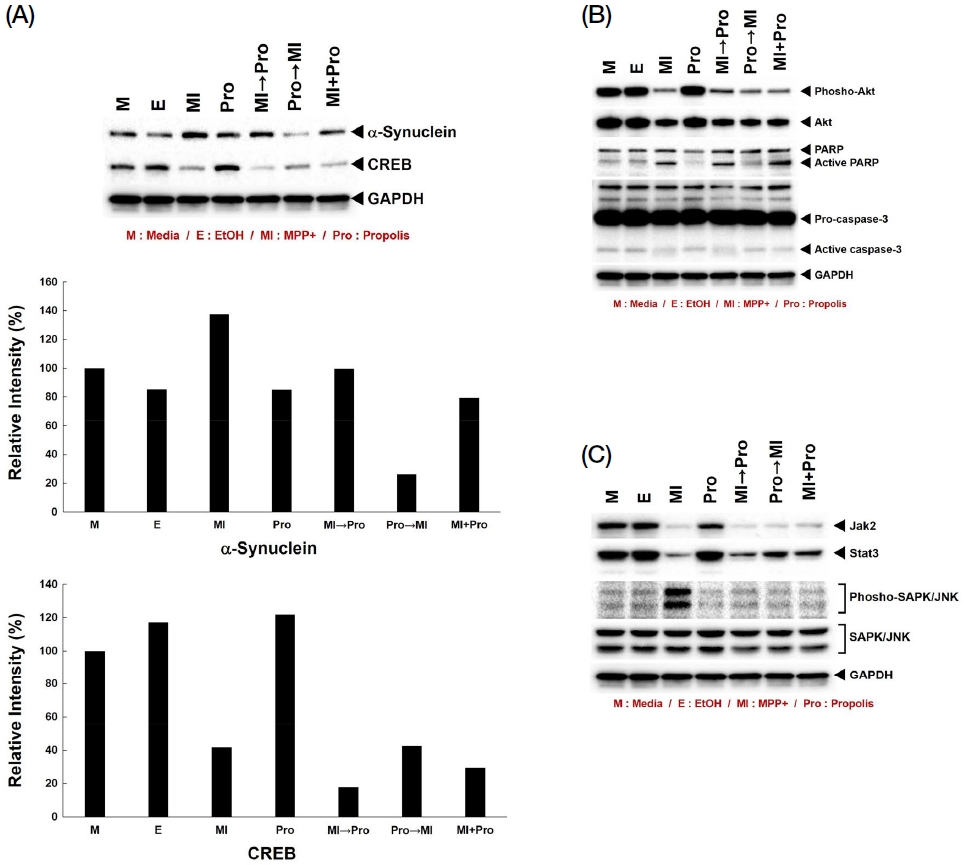
Western blot analysis of PD and cognitive-related proteins, apoptosis and signaling molecules. (A~C) 20 μg of protein lysates were used in this experiments. Primary antibody incubation time is 16 hrs at R.T. All primary antibodies were diluted in 2% non-fat dry milk.
Fig. 4B에서는 세포 사멸에 대한 단백질의 발현을 확인하였다. AKT의 경우 세포 분열과 사멸에 있어 핵심적인 단백질인데, MPP+를 처리하였을 경우 AKT의 발현과 인산화가 모두 감소되는 것이 확인되었다. 그러나 프로폴리스 추출물 처리로 인한 AKT의 발현 및 인산화 회복은 나타나지 않았다. 이는 프로폴리스의 추출물이 AKT 단백질의 양적 조절 및 인산화에는 영향을 끼치지 않는 다른 단백질의 발현과 신호 경로를 통해 세포 방어에 대한 효과를 보이고 있는 것이다. 세포 사멸에 있어 핵심적인 단백질 중의 하나인 PARP의 경우 세포 사멸 신호가 활성화되어 apoptosis가 발생하면 85 kDa의 단편을 생성하는데, MPP+ 처리로 인해 PARP의 단편화가 증가하였고, 이는 MPP+를 전처리한 실험군과 MPP+와 프로폴리스 추출물을 동시에 처리한 부분에서도 같은 결과를 보였다. 그러나 프로폴리스 추출물을 전처리한 경우, PARP의 단편화가 나타나지 않았는데, 이는 프로폴리스 추출물이 세포를 보호하여 apoptosis를 차단한 결과이다. 따라서 PD로 인한 세포 사멸에 대해 프로폴리스 추출물은 전처리에서 가장 효과가 뚜렷하며, 이는 질병의 발병을 예방하는 데 가장 효과적인 것이다. Caspase-3의 경우에도 세포 사멸이 발생하면 pro-caspase-3에서 17, 19 kDa의 단편화가 발생하는데, MPP+ 단독처리군과 전처리군에서는 두 단편이 동시에 활성화되어 나타나는 것이 확인되었다. 반면 이 두 그룹을 제외한 다른 그룹에서는 한 가지의 단편만이 관찰되었는데, 세포 사멸로 인한 두 개의 단편 생성을 억제함으로써 세포 사멸을 차단하는 것으로 보여진다. 그러나 PARP의 경우 동시처리구에서도 활성화되었고, caspase-3의 경우 동시처리구에서는 활성화가 되지 않았다. 이 경우에는 유전자 발현에 직접적으로 영향을 끼치는 PARP에 또 다른 경로의 독성 신호가 영향을 끼치고 있음을 의미한다. 따라서 이 부분은 관련 단백질 신호의 기전을 명확히 살펴봐야 한다.
Fig. 4C에서는 MPP+와 프로폴리스 추출물 처리에 대한 세포 내 신호전달 단백질에 대한 결과이다. 세포 내에서 Jak-Stat 경로는 다른 신호 경로와 별개로 두 단백질 사이에서 주로 이루어지는 신호 경로로서 Jak의 신호를 거쳐 Stat이 바로 핵으로 이동하여 유전자 발현을 조절한다. 본 연구에서 MPP+의 처리로 Jak2의 발현이 크게 감소됨을 확인하였으며, 그에 따라 이루어지는 Stat3의 단백질 발현도 크게 감소됨을 확인하였다. 그러나 프로폴리스 추출물의 처리를 통해 Jak2의 발현에는 큰 영향을 주지 않았지만 Stat3의 경우 프로폴리스 추출물의 전처리에서 단백질 발현이 회복되는 것이 확인되었다. 이는 프로폴리스 추출물이 Jak-Stat 신호 경로에 영향을 주는 것을 의미하며, 특히 핵 안으로 이동하여 유전자 발현을 조절하는 Stat3의 회복은 세포 사멸을 억제할 수 있음을 보여주는 것이다. 세포 내 mitogen activated-proliferation kinase (MAPK) 중에서 stress-activated protein kinase (SAPK/JNK)는 MPP+에 의해 인산화가 크게 증가하는데, 프로폴리스 추출물에 의해 인산화가 감소되는 것이 나타났다. 즉 세포 외부 독성 요소로 인해 활성화된 SAPK/JNK의 인산화를 프로폴리스 추출물이 감소시킴으로써 세포 사멸을 저해하는 것이다. GAPDH는 본 Western blotting 실험의 housekeeping 대조구이다.
PD는 AD와 함께 가장 널리 알려진 신경퇴행성 질환으로서 완치가 어렵고 특히 현대 사회가 고령화에 접어들면서 발병률이 높아지고 있다. 그러나 수많은 연구자들이 PD의 질환에 대한 연구를 지속하고 있지만 아직까지 PD의 치료를 위한 약제는 보편화되지 않았다. 본 연구에서는 생물학적 기능성이 뛰어난 양봉산물인 프로폴리스를 활용하여 PD 질환의 발병을 억제할 수 있음을 확인하였다. 2022년도의 연구에서 이미 프로폴리스의 PD 저해에 대한 세포 기전을 확인하였는데, 이번 연구에서는 그보다 더 구체적으로 프로폴리스 추출물을 활용함으로써 PD 질환을 억제할 수 있는 효과와 세포 기전을 구명하였다. 이는 프로폴리스 활용의 측면에서 이미 수많은 기능성이 알려졌지만 보다 새로운 측면으로 프로폴리스를 활용할 수 있음을 제시한 것이며, 이를 위해 분자생물학적 기전을 추적하였다. 또한 현재 약제가 아닌 건강기능식품으로 활용되고 있는 프로폴리스를 보다 널리 활용될 수 있게 하는 근거를 마련하였다. 본 연구 결과를 바탕으로 PD 예방에 대한 프로폴리스 추출물 내 지표 성분을 확립하고, 프로폴리스 추출물의 새로운 건강기능성 측면을 제시하는 것이 필요할 것이다. 또한 PD 발병 및 질병 완화를 위한 동물 실험을 통해 in vivo에서의 연구 결과를 바탕으로 프로폴리스의 인지 기능 및 신경퇴행성 개선에 대한 직접적인 연구 결과를 마련해야 할 것이다.
Acknowledgments
본 연구는 농촌진흥청 어젠다연구사업 (과제번호: PJ01512905)에 의해 수행되었습니다.
References
-
Bezard, E., C. E. Gross, M. C. Fournier, S. Dovero, B. Bloch and M. Jaber. 1999. Absence of MPTP-induced neuronal death in mice lacking the dopamine transporter. Exp. Neurol. 155: 268-273.
[https://doi.org/10.1006/exnr.1998.6995]

-
Braak, H., K. Del Tredici, U. Rub, R. A. de Vos, E. N. Jansen Steur and E. Braak. 2003. Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiol. Aging 24: 197-211.
[https://doi.org/10.1016/S0197-4580(02)00065-9]

-
Burdock, G. A. 1998. Review of the biological properties and toxicity of bee propolis (propolis), Food Chem. Toxicol. 36: 347-363.
[https://doi.org/10.1016/S0278-6915(97)00145-2]

- Cavalaro, R. I., R. G. D. Cruz, S. Dupont, J. N. L. N. de Moura Bell and T. M. F. S. Vieira. 2019. In vitro and in vivo antioxidant properties of bioactive compounds from green propolis obtained by ultrasound-assisted extraction. Food Chem. 17;4:100054.
-
Chen, L., B. Cagniard, T. Mathews, S. Jones, H. C. Koh, Y. Ding, P. M. Carvey, Z. Ling, U. J. Kang and X. Zhuang. 2005. Age-dependent motor deficits and dopaminergic dysfunction in DJ-1 null mice. J. Biol. Chem. 280: 21418-21426.
[https://doi.org/10.1074/jbc.M413955200]

-
Chiba, K., A. Trevor and N. Castagnoli Jr. 1984. Metabolism of the neurotoxic tertiary amine, MPTP, by brain monoamine oxidase. Biochem. Biophys. Res. Commun. 120: 574-578.
[https://doi.org/10.1016/0006-291X(84)91293-2]

- Chiba, K., L. A. Peterson, K. P. Castagnoli, A. J. Trevor and N. Castagnoli Jr. 1985. Studies on the molecular mechanism of bioactivation of the selective nigrostriatal toxin 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Drug Metab. Dispos. 13: 342-347.
-
Cui, W., Z. Zhang, W. Li, S. Hu, S. Mak, H. Zhang, R. Han, S. Yuan, S. Li, F. Sa, D. Xu, Z. Lin, Z. Zuo, J. Rong, E. D.-L. Ma, T. C. Choi, S. M. Lee and Y. Han. 2013. The anti-cancer agent SU4312 unexpectedly protects against MPP+-induced neurotoxicity via selective and direct inhibition of neuronal NOS. Br. J. Pharmacol. 168: 1201-1214.
[https://doi.org/10.1111/bph.12004]

-
Dawson, T. M. 2006. Parkin and defective ubiquitination in Parkinson’s disease. J. Neural. Transm. Suppl. 70: 209-213.
[https://doi.org/10.1007/978-3-211-45295-0_32]

-
de Groot, A. C. 2013. Propolis: a review of properties, applications, chemical composition, contact allergy, and other adverse effects. Dermatitis. 24: 263-282.
[https://doi.org/10.1097/DER.0000000000000011]

-
Di Monte, D., S. A. Jewell, G. Ekstrom, M. S. Sandy and M. T. Smith. 1986. 1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) and 1-methyl-4-phenylpyridine (MPP+) cause rapid ATP depletion in isolated hepatocytes. Biochem. Biophys. Res. Commun. 137: 310-315.
[https://doi.org/10.1016/0006-291X(86)91211-8]

- Duca, A., A. Sturza, E. A. Moacă, M. Negrea, V. D. Lalescu, D. Lungeanu, C. A. Dehelean, D. M. Muntean and E. Alexa. 2019. Identification of Resveratrol as Bioactive Compound of Propolis from Western Romania and Characterization of Phenolic Profile and Antioxidant Activity of Ethanolic Extracts. Molecules. 16; 24(18). pii: E3368.
-
Feany, M. B. and J. J. Pallanck. 2003. Parkin: a multipurpose neuroprotective agent?. Neuron. 38: 13-16.
[https://doi.org/10.1016/S0896-6273(03)00201-0]

-
Fearnley, J. M. and A. J. Lees. Ageing and Parkinson’s disease: Substantia nigra regional selectivity. Brain 1991, 114: 2283-2301.
[https://doi.org/10.1093/brain/114.5.2283]

-
Fernandes Junior, A., E. C. Balestrin, J. E. Betoni, O. Orsi Rde, L. da Cunha Mde and A. C. Montelli. 2005. Propolis: anti-Staphylococcus aureus activity and synergism with antimicrobial drugs. Mem. Inst. Oswaldo Cruz. 100: 563-566.
[https://doi.org/10.1590/S0074-02762005000500018]

-
Forno, L. S. 1996. Neuropathology of Parkinson’s disease. J. Neuropathol. Exp. Neurol. 55: 259-272.
[https://doi.org/10.1097/00005072-199603000-00001]

-
Goldberg, M. S., A. Pisani, M. Haburcak, T. A. Vortherms, T. Kitada, C. Costa, Y. Tong, G. Martella, A. Tscherter, A. Martins, G. Bernardi, B. L. Roth, E. N. Pothos, P. Calabresi and J. Shen. 2005. Nigrostriatal dopaminergic deficits and hypokinesia caused by inactivation of the familial Parkinsonism-linked gene DJ-1. Neuron. 45: 489-496.
[https://doi.org/10.1016/j.neuron.2005.01.041]

-
Heikkila, R. E., L. Manzino, F. S. Cabbat and R. C. Duvoisin. 1984. Protection against the dopaminergic neurotoxicity of 1-methyl-4-phenyl-1,2,5,6-tetrahydropyridine by monoamine oxidase inhibitors. Nature 311: 467-469.
[https://doi.org/10.1038/311467a0]

- Irwin, I., L. E. DeLanney and J. W. Langston. 1993. MPTP and aging: Studies in the C57BL/6 mouse. Adv. Neurol. 60: 197-206.
-
Jantas, D., A. Greda, S. Golda, M. Korostynski, B. Grygier, A. Roman, A. Pilc and W. Lason. 2014. Neuroprotective effects of metabotropic glutamate receptor group II and III activators against MPP+-induced cell death in human neuroblastoma SH-SY5Y cells: The impact of cell differentiation state. Neuropharmacology 83: 36-53.
[https://doi.org/10.1016/j.neuropharm.2014.03.019]

-
Javitch, J. A., R. J. D’Amato, S. M. Strittmatter and S. H. Snyder. 1985. Parkinsonism-inducing neurotoxin, N-methyl-4-phenyl-1,2,3,6 -tetrahydropyridine: uptake of the metabolite N-methyl-4-phenylpyridine by dopamine neurons explains selective toxicity. Proc. Natl. Acad. Sci. U.S.A. 82: 2173-2177.
[https://doi.org/10.1073/pnas.82.7.2173]

-
Kim, R. H., P. D. Smith, H. Aleyasin, S. Hayley, M. P. Mount, S. Pownall, A. Wakeham, A. J. You-Ten, S. K. Kalia, P. Horne, D. Westaway, A. M. Lozano, H. Anisman, D. S. Park and T. W. Mak. 2005. Hypersensitivity of DJ-1-deficient mice to 1-methyl-4-phenyl-1,2,3,6-tetrahydropyrindine (MPTP) and oxidative stress. Proc. Natl. Acad. Sci. U.S.A. 102: 5215-5220.
[https://doi.org/10.1073/pnas.0501282102]

-
Kim, S.-K., S. M. Han, S. G. Kim, H. Y. Kim, S. Ryu and S. O. Woo. 2021. Inhibition of tau hyperphosphorylation and its molecular mechanism by Korean propolis extracts. J. Apic. 36: 169-176.
[https://doi.org/10.17519/apiculture.2021.09.36.3.169]

-
Kim, S.-K., H. Y. Kim, S. G. Kim, S. M. Han, S. Ryu and S. O. Woo. 2022. The effect of Korean propolis for apoptosis by MPTP-mediated Parkinson’s disease and its molecular mechanism in SH-SY5Y neuroblastoma cells. J. Apic. 37: 83-90.
[https://doi.org/10.17519/apiculture.2022.04.37.1.83]

-
Kitahama, K., R. M. Denney, T. Maeda and M. Jouvet. 1991. Distribution of type B monoamine oxidase immunoreactivity in the cat brain with reference to enzyme histochemistry. Neuroscience 44: 185-204.
[https://doi.org/10.1016/0306-4522(91)90260-U]

-
Klivenyi, P., D. Siwek, G. Gardian, L. Yang, A. Starkov, C. Cleren, R. J. Ferrante, N. W. Kowall, A. Abeliovich and M. F. Beal. 2006. Mice lacking alpha-synuclein are resistant to mitochondrial toxins. Neurobiol. Dis. 21: 541-548.
[https://doi.org/10.1016/j.nbd.2005.08.018]

-
Li, C. and M. F. Beal. 2005. Leucine-rich repeat kinase 2: a new player with a familiar theme for Parkinson’s disease pathogenesis. Proc. Natl. Acad. Sci. U.S.A. 102: 16535-16536.
[https://doi.org/10.1073/pnas.0508350102]

-
Martin, L. J., Y. Pan, A. C. Price, W. Sterling, N. G. Copeland, N. A. Jenkins, D. L. Price and M. K. Lee. 2006. Parkinson’s disease alpha-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. J. Neurosci. 26: 41-50.
[https://doi.org/10.1523/JNEUROSCI.4308-05.2006]

-
Mizuno, Y., T. Saitoh and N. Sone. 1987. Inhibition of mitochondrial alpha-ketoglutarate dehydrogenase by 1-methyl-4-phenylpyridinium ion. Biochem. Biophys. Res. Commun. 143: 971-976.
[https://doi.org/10.1016/0006-291X(87)90346-9]

-
Nicklas, W. J., I. Vyas and R. E. Heikkila. 1985. Inhibition of NADH-linked oxidation in brain mitochondria by 1-methyl-4-phenyl-pyridine, a metabolite of the neurotoxin, 1-methyl-4-phenyl-1,2,5,6-tetrahydropyridine. Life Sci. 36: 2503-2508.
[https://doi.org/10.1016/0024-3205(85)90146-8]

-
Nieto, M., F. J. Gil-Bea, E. Dalfo, M. Cuadrado, F. Cabodevilla, B. Sanchez, S. Catena, T. Sesma, E. Ribe, I. Ferrer, M. J. Ramirez and T. Gomez-Isla. 2006. Increased sensitivity to MPTP in human alpha-synuclein A30P transgenic mice. Neurobiol. Aging 27: 848-856.
[https://doi.org/10.1016/j.neurobiolaging.2005.04.010]

-
Peterson, L. A., P. S. Caldera, A. Trevor, K. Chiba and N. Castagnoli Jr. 1985. Studies on the 1-methyl-4-phenyl-2,3-dihydropyridinium species 2,3-MPDP+, the monoamine oxidase catalyzed oxidation product of the nigrostriatal toxin 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP). J. Med. Chem. 28: 1432-1436.
[https://doi.org/10.1021/jm00148a010]

-
Pieczenik, S. R. and J. Neustadt. 2007. Mitochondrial dysfunction and molecular pathways of disease. Exp. Mol. Pathol. 83: 84-92.
[https://doi.org/10.1016/j.yexmp.2006.09.008]

-
Ramos, A. F. N. and J. L. Miranda. 2007. Propolis: a review of its anti-inflammatory and healing actions. J. Venom. Anim. Toxins Incl. Trop. Dis. 13: 697-710.
[https://doi.org/10.1590/S1678-91992007000400002]

- Riachi, N. J., J. C. LaManna and S. I. Harik. 1989. Entry of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine into the rat brain. J. Pharmacol. Exp. Ther. 249: 744-748.
-
Rose, S., M. Nomoto, E. A. Jackson, W. R. G. Gibb, P. Jaehnig, P. Jenner and C. D. Marsden. 1993. Age-related effects of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine treatment of common marmo-sets. Eur. J. Pharmacol. 230: 177-185.
[https://doi.org/10.1016/0014-2999(93)90800-W]

-
Sakaguchi-Nakashima, A., J. Y. Meir, Y. Jin, K. Matsumoto and N. Hisamoto. 2007. LRK-1, a C. elegans PARK8-related kinase, regulates axonal-dendritic polarity of SV proteins. Curr. Biol. 17: 592-598.
[https://doi.org/10.1016/j.cub.2007.01.074]

-
Scotcher, K. P., I. Irwin, L. E. DeLanney, J. W. Langston and D. Di Monte. 1990. Effects of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine and 1-methyl-4-phenylpyridinium ion on ATP levels of mouse brain synaptosomes. J. Neurochem. 54: 1295-1301.
[https://doi.org/10.1111/j.1471-4159.1990.tb01962.x]

-
Sforcin, J. M. 2007. Propolis and the immune system: a review. J. Ethnopharmacol. 113: 1-14.
[https://doi.org/10.1016/j.jep.2007.05.012]

-
Singer, T. P., N. Castagnoli Jr., R. R. Ramsay and A. J. Trevor. 1987. Biochemical events in the development of parkinsonism induced by 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. J. Neurochem. 49: 1-8.
[https://doi.org/10.1111/j.1471-4159.1987.tb03384.x]

-
Singleton, A. B., M. Farrer, J. Johnson, A. Singleton, S. Hague, J. Kachergus, M. Hulihan, T. Peuralinna, A. Dutra, R. Nussbaum, S. Lincoln, A. Crawley, M,. Hanson, D. Maraganore, C. Adler, M.R. Cookson, M. Muenter, M. Baptista, D. Miller, J. Blancato, J. Hardy and K. Gwinn-Hardy. 2003. α-Synuclein locus triplication causes Parkinson’s disease. Science 302: 841.
[https://doi.org/10.1126/science.1090278]

-
Spillantini, M. G., R. A. Crowther, R. Jakes, M. Hasegawa and M. Goedert. 1998. α-Synuclein in filamentous inclusions of Lewy bodies from Parkinson’s disease and dementia with Lewy bodies. Proc. Natl Acad. Sci. U.S.A. 95: 6469-6473.
[https://doi.org/10.1073/pnas.95.11.6469]

-
Valente, E. M., P. M. Abou-Sleiman, V. Caputo, M. M. Muqit, K. Harvey, S. Gispert, Z. Ali, D. Del Turco, A. R. Bentivoglio, D. G. Healy, A. Albanese, R. Nussbaum, R. Gonzalez-Maldonado, T. Deller, S. Salvi, P. Cortelli, W. P. Gilks, D. S. Latchman, R. J. Harvey, B. Dallapiccola, G. Auburger and N. W. Wood. 2004. Hereditary early-onset Parkinson’s disease caused by mutations in PINK1. Science 304: 1158-1160.
[https://doi.org/10.1126/science.1096284]

-
Vyas, I., R. E. Heikkila and W. J. Nicklas. 1986. Studies on the neurotoxicity of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine: inhibition of NAD-linked substrate oxidation by its metabolite, 1-methyl-4-phenylpyridinium. J. Neurochem. 46: 1501-1507.
[https://doi.org/10.1111/j.1471-4159.1986.tb01768.x]

- Yeh, T.-S., C. Yuan, A. Ascherio, B. Rosner, W. Willett and D. Blacker. 2021. Long-term dietary flavonoid intake and subjective congnitive decline in US men and women. Neurology, Online ahead of print.
- Zhang, J. L., K. Wang and F. L. Hu. 2013. Advance in studies on antioxidant activity of propolis and its molecular mechanism. China Journal of Chinese Materia Medica 38: 2645-2652.