으름덩굴 추출물 처리에 의한 꿀벌 노제마병 감염 억제
Abstract
Nosemosis is a honeybee ( Apis mellifera) disease resulting from the intake of Nosema ceranae, which recently became a major threat to honeybees. N. ceranae is a microsporidian, which acts like a parasite and remains as a spore until the infection, resulting in high management difficulty. Until today, cure and preventative candidates are barely established. In this study, the preventive activity of Akebia quinata extract against nosemosis was done using Trichoplusia ni cell line, BTI-TN5B1-4, as a substitute for the honey bee cell line. Normal T. ni cells exhibited a normal size with round shape. However, after N. ceranae were treated, some cells were abnormally enlarged due to N. ceranae infection. Also, a nucleus of those cells was barely observable under microscope. When A. quinata extract was treated with N. ceranae, those cells did not show such symptoms and most N. ceranae spores were observed outside of the cells. For practical use of A. quinata for nosemosis, an adequate concentration range to prevent nosemosis infection was determined. The lowest concentration where A. quinata had preventative effect was set as a minimum concentration and the concentration which A. quinata extracts had cytotoxicity in the insect cells was set as maximum concentration.
Keywords:
Nosemosis, Nosema ceranae, Apis mellifera, Infection, A. quinata서 론
꿀벌 (Apis mellifera)은 농업 및 과수업에 필수적일 뿐만 아니라 생태계 전체의 수분 매개자로서 매우 중요하다 (Papa et al., 2022). 생태계에서의 기여도를 고려할 때 그들의 경제적 가치는 2000년에는 146억 달러로 추정되었고 (Morse and Calderone, 2000), 이후로도 꾸준히 증가하고 있는 추세이다 (Khalifa et al., 2021). 그러나 이 꿀벌은 현재 많은 병원체에 노출되었고 이로 인한 개체수의 감소도 동시에 많이 일어나고 있다 (Schatz et al., 2021). 최근에는 그들의 군집이 사라지는 꿀벌군집붕괴현상 (CCD)이 빈번하게 일어나고 있으며 이에 대한 연구가 활발히 진행중이다 (Evans et al., 2009; Al-Solami et al., 2022). CCD의 근본적인 원인은 아직 정확하게 알려지지 않았지만 노제마병이 여러가지 주요 원인 중 하나로 예상되고 이에 따라 연구되고 있다 (Ellis et al., 2010).
Nosema ceranae는 미포자충의 일종으로 노제마병을 유발하는 포자형성균이다 (Fries, 2010). N. ceranae를 꿀벌이 섭취하게 되면 꿀벌의 중장 세포에 감염된다. 이후 숙주 내에서 완전히 성장할 때까지 증식하는데, 이로 인해 꿀벌의 대사가 급격히 변화하고 (Mayack and Naug, 2009) 면역관련 유전자의 발현량이 증가한다 (Marín-García et al., 2022). 이 곰팡이는 꿀벌의 내장 세포에서 완전히 자라는데 약 5일이 소요되며, 15일이 지나면 꿀벌은 질병으로 인해 죽기 시작한다.
노제마병의 치료제나 예방법을 찾기 위해 많은 시도가 있었지만 현재까지도 그 결과물은 많지는 않다. Fumagillin의 경우 한때 노제마병을 방제하는 약으로 여겨졌으나, 최근 연구에 따르면 fumagillin은 N. ceranae 방제에 효과가 적을 수도 있으며 fumagillin 저항성이 증가된 N. ceranae가 보고되기도 하여 방제하기가 더 어려워졌다고 할 수 있다 (Fenoy et al., 2009; Huang et al., 2013). 또한 fumagillin은 인간을 포함한 포유류에서 독성을 보이기 때문에 실사용에는 문제가 있을 수 있다 (Van den Heever et al., 2014). 이후 타임 (Thymus vulgaris) 오일 (Porrini et al., 2017), 월계수 (Laurus nobilis) 오일, 오레가노 (Origanum vulgare) 오일 및 유칼립투스 (Eucalyptus spp.) 오일 등에 대해서도 노제마병 방제 효능이 보고되기도 하였으나 아직까지도 그 수는 한정되어 있는 상황이다 (Porrini et al., 2011).
본 실험에서는 으름덩굴 (Akebia quinata) 추출물의 노제마병 방제 효능을 확인하였다. 실험에는 꿀벌 세포주가 아직 발견되지 않았기 때문에 꿀벌의 대안으로 곤충 세포 중 하나인 Trichoplusia ni 세포주인 BTI-TN5B1-4를 사용하였다 (Fries, 1988; Song et al., 2019). A. quinata를 처리한 세포는 N. ceranae를 함께 처리했음에도 불구하고 nosemosis 증상을 보이지 않았다. 추가적으로, A. quinata 추출물 처리 시 세포 독성이 없고 방제 효능을 잃지 않는 범위를 확인하였다.
재료 및방법
1. 시료 준비
A. quinata (제주, 대한민국)는 증류수를 이용하여 3회 세척하였으며 동결 건조하였다. 그중 100 g을 실온에서 1 L의 80% 에탄올에 24시간 동안 추출을 진행하였다. 용매는 50℃에서 저온 항온 순환 수조 (Jeio Tech, Korea)에 연결된 회전 농축기 (EYELA, Japan)를 사용하여 농축을 진행하였고 이후 농축액은 다시 동결건조하여 시료를 준비하였다. 또한 시료는 DMSO에 10 mg/mL로 녹여져 실험에 사용되었다.
2. Nosema ceranae 포자 준비
실험에 사용된 병원균인 N. ceranae는 한국 농촌진흥청에서 노제마병 감염 꿀벌로 전달받았다. 감염된 꿀벌의 내장 조직을 200 μL의 증류수에서 균질화하였고 초기 N. ceranae 포자 현탁액을 얻었다. 포자의 정제를 위하여 25%, 50%, 75%, 90% Percoll을 사용하여 정제했다 (Ge healthcare, USA) (Kim et al., 2017). 포자 농도는 혈구 세포계를 사용하여 계산되었으며, 이후 50% 설탕용액과 포자를 혼합하여 20,000개의 spores/μL의 포자용액을 만들었다.
신생 꿀벌에 N. ceranae 포자를 주입하고 (Milbrath et al., 2013), 꿀벌이 태어난 후 2시간 동안 단식시킨 다음 3 μL N. ceranae 포자용액을 제공하였다 (Malone and Stefanovic, 1999). 꿀벌들은 25℃, 24시간 중 명조건 16시간, 암조건 8시간을 유지하며 사육했다. 14일간 사육 후 꿀벌들은 추후 포자를 다시 얻을 때까지 -70℃에 보관하였다.
3. Trichoplusia ni 세포 준비
실험에 사용한 세포는 Trichoplusia ni인 BTI-Tn-5B1-4를 사용하였다. 이는 N. ceranae에 감염될 수 있다고 알려져있다 (Gisder et al., 2010). 이 곤충 세포는 27℃, Glutamine (Gibco, USA)가 포함된 Express FiveTM SFM (Gibco, USA)에서 키웠다.
4. 포자 처리 및 효능 확인
6-well plate에 2 mL씩 하루 동안 키운 BTI-Tn-5B1-4 세포에 104N. ceranae spores/mL가 되도록 처리를 하였고 A. quinata 추출물을 100 μg/mL의 농도로 처리하여 그 효능을 확인하였다. 대조군으로는 포자를 처리하지 않은 세포와 물질을 처리하지 않고 포자만을 처리한 세포를 사용하였다. 그리고 감염을 확인하기 쉽도록 처리를 한 지 5일 후에 관찰을 하였다. 각 well에 있는 모든 세포들 중 감염이 되었다고 확인된 세포들의 수를 확인하였다.
적정 농도를 확인하기 위해 A. quinata 추출물을 800 μg/mL부터 2배씩 감소시키며 물질을 처리하였다. 5일 후 현미경을 이용하여 감염 여부를 확인하였고 그 특징을 기준으로 추출물의 세포 독성과 효능을 확인하였다.
결 과
1. A. quinata 추출물의 노제마병 방제 효능 확인
대조군으로 사용한 세포 중 어떠한 처리도 하지 않은 BTI-TN5B1-4 세포의 경우 전체적으로 원형의 모양을 보였다 (Fig. 1a). 비정상적으로 커지는 세포는 없었고 일관성 있는 세포의 크기를 보였다. 그리고 대부분의 세포핵이 선명하게 보였다. 일부 세포에서만 특이적으로 길어진 모양을 보이는 경우도 있었지만 이는 5일 동안 배양을 하여 생긴 것으로 본래의 모양이나 크기는 아니었다. 다른 대조군인 N. ceranae만 처리한 BTI-TN5B1-4 세포에서는 정상 세포에 비해 수축된 세포 모양을 보였고 일부는 비정상적으로 비대해졌다 (Fig. 1b). 이러한 현상은 아무것도 처리하지 않은 세포에 비해 그 수가 많았으며 일반 세포에 비해 비대해진 세포는 핵이 명확하지 않고 세포 내부에서도 N. ceranae의 포자가 많이 발견된다. 한편, N. ceranae 및 A. quinata 추출물 100 μg/mL를 처리한 BTI-TN5B1-4 세포는 아무것도 처리하지 않은 대조군과 유사한 세포 모양과 크기, 또 그러한 경향이 보였다 (Fig. 1c). 전체적으로 일반 세포와 비슷한 경향을 보였고 대부분의 N. ceranae 포자는 세포 외부에서만 발견되었다.
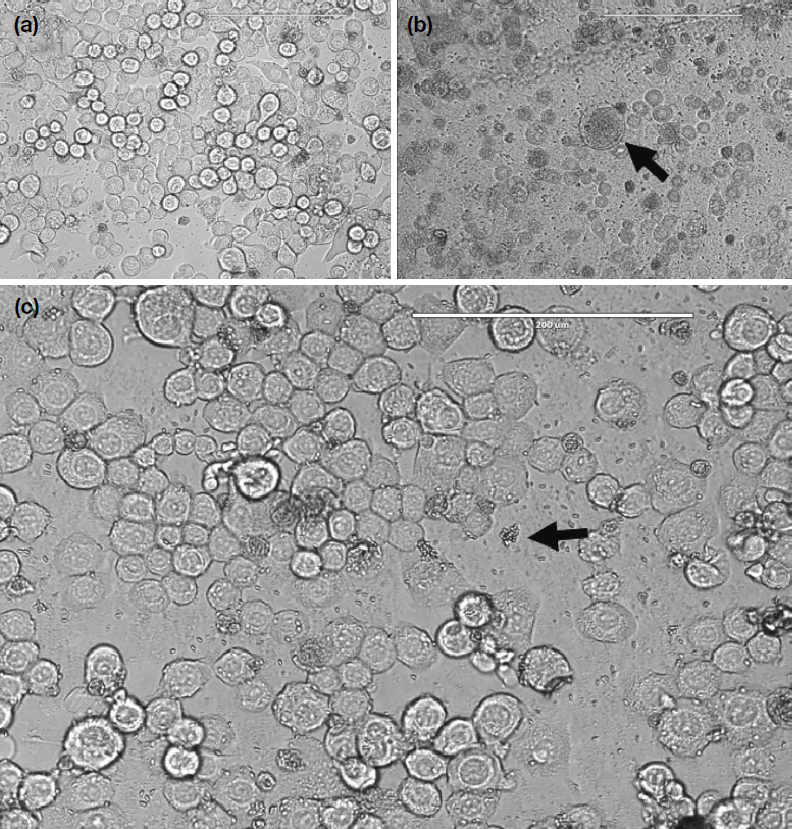
Microscopic image of BTI-TN5B1-4 cells without any treatment. (a) Microscopic image of BTI-TN5B1-4 cells without any treatment. Cells were circular and had similar size with the exception of few cells. (b) Microscopic image of BTI-TN5B1-4 cells treated only with N. ceranae. Cells were shrunk and some cells were enlarged abnormally compared to normal cells. The arrow indicates the abnormal cells. (c) Microscopic image of BTI-TN5B1-4 cells treated with N. ceranae and A. quinata. A. quinata extract were treated at concentration of 100 μg/mL and most of the cells remained uninfected and normal. The arrow indicates the spore of N. ceranae.
2. A. quinata 추출물의 처리 적정 농도
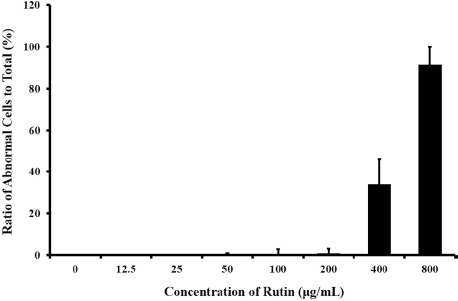
A. quinata 추출물의 적정 농도의 범위를 찾기 위해 초기 처리 농도인 100 μg/mL보다 낮추거나 높여 효능을 확인하였다 (Fig. 2). 100 μg/mL와 그 이상의 농도에서는 A. quinata 추출물이 BTI-TN5B1-4에서 N. ceranae 방제 효능을 보였다. 하지만 그 이하의 농도에서는 감염된 세포들이 관찰되었으며 50 μg/mL의 경우 감염된 세포의 수는 감소하였으나 뚜렷한 방제 효능보다는 미세한 억제 효능만 있었다. 또한 50 μg/mL 미만의 농도에서는 추출물을 처리하지 않는 세포들과 비슷하게 방제 효능이 전혀 보이지 않았다. 이를 통해 100 μg/mL 이상의 농도에서만 추출물의 노제마병 방제 효과가 있었으며 그 이하에서는 노제마병에는 효과가 없음을 확인하였다.
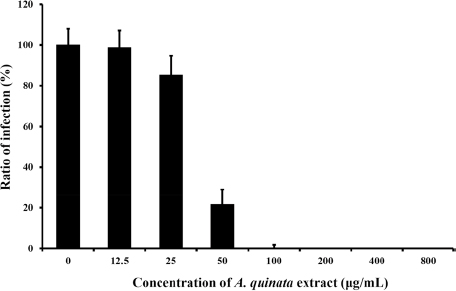
Infection rate of samples to control. Control indicates BTI-TN5B1-4 cells with N. ceranae treatment and without A. quinata extract treatment. Infection rate of the control were set as 100%.
세포 독성이 없는 최고 농도를 찾기 위해 추출물을 800 μg/mL로부터 12.5 μg/mL까지 절반씩 희석하였다 (Fig. 3). 이러한 방법으로 추출물을 처리하였을 때, 200 μg/mL까지는 추출물이 노제마병 방제 효능을 보임과 동시에 어떠한 세포 독성도 나타내지 않았다. 하지만 200 μg/mL 이상의 농도에서는 A. quinata 추출물이 BTI-TN5B1-4 세포에 대해 세포 독성을 보였다. 이를 통해 A. quinata 추출물의 노제마병 방제약으로 사용 시 100 μg/mL에서 200 μg/mL 사이의 농도로 사용해야 함을 확인하였다. 그 범위보다 적을 경우 효능을 갖지 못하고 그 이상인 경우 추출물이 독성을 보이게 된다.
고 찰
본 연구를 통해 노제마병 방제에 도움이 될 수 있는 식물 추출물을 제시하였다. A. quinata 추출물이 N. ceranae의 감염 방제 효능을 가졌음을 확인하였다. A. quinata 추출물을 처리한 세포는 5일 후에도 N. ceranae에 감염되지 않는 것으로 나타났으며, 이는 세포에 추출물을 처리하였을 때 감염 없이 일반 세포와 같은 모습으로 포자에 대해 저항성을 갖는 것으로 보인다. 이로 인해 N. ceranae 포자는 세포 내에 침입하지 못하고 그 주위에서만 관찰되었다.
노제마병이 최근 지속적으로 꿀벌 개체수 감소의 원인으로 지목되는 만큼 A. quinata 추출물의 노제마 방제약으로서 적정 농도도 본 연구에서 확인하였다. 식물 추출물 처리시 적정 농도보다 낮은 경우 효능이 없다는 문제가 있으며 너무 높은 농도에서는 식물 추출물의 일부 물질들에 의해 동물세포에서 세포 독성을 갖게 되어 감염과는 별개로 세포에 악영향을 미친다. A. quinata 추출물의 경우 100 μg/mL 미만의 농도에서는 방제 효능이 없었다. 이는 해당 추출물을 실사용할 경우 100 μg/mL 근처의 농도로 사용해야 하며 너무 낮은 경우 효과를 볼 수 없다는 것을 의미한다. 반대로 200 μg/mL 초과의 농도로 추출물을 처리하였을 때 세포수준에서 세포 독성을 보여 실제로 적용 시 200 μg/mL 이하의 농도에서 처리하는 것이 꿀벌 개체에 문제없이 방제 효능을 가질 수 있음을 의미한다.
A. quinata는 최근 미국을 포함한 많은 서방 국가에서 생태계 혼란종으로 간주되고 있고 동아시아에는 이미 풍부하게 존재한다 (Brunel et al., 2010). 이는 A. quinata를 노제마병 방제에 사용할 시, 서양에서는 토종 식물을 지킬 수 있다는 장점이 있고, 동아시아에서는 이미 풍부한 자원을 경제적인 이익을 창출 할 수 있어 효율적인 해결책으로 제시할 수 있다.
Acknowledgments
위 연구는 농촌진흥청 PJ015763의 지원을 받아 진행되었다.
References
- Al-Solami, H. M., N. A. Alkenani, A. G. Alghamdi, M. M. M. Ahmed, K. Javeed and S.A. Dar. 2022. Influence and Management of Colony Collapse Disorder (CCD) Damaging European Honeybee Apis mellifera. Spec. Ugdym. 2(43): 3117-3130.
-
Brunel, S., G. Schrader, G. Brundu and G. Fried. 2010. Emerging invasive alien plants for the Mediterranean Basin. EPPO Bulletin 40(2): 219-238.
[https://doi.org/10.1111/j.1365-2338.2010.02378.x]

-
Ellis, J. D., J. D. Evans and J. Pettis. 2010. Colony losses, managed colony population decline, and Colony Collapse Disorder in the United States. J. Apic. Res. 49(1): 134-136.
[https://doi.org/10.3896/IBRA.1.49.1.30]

-
Evans, J. D., C. Saegerman, C. Mullin, E. Haubruge, B. K. Nguyen, M. Frazier, J. Frazier, D. Cox-Foster, Y. Chen, R. Underwood, D. R. Tarpy and J. S. Pettis. 2009. Colony collapse disorder: a descriptive study. PLoS One 4(8): e6481.
[https://doi.org/10.1371/journal.pone.0006481]

-
Fenoy, S., C. Rueda, M. Higes, R. Martín-Hernández and C. Del Aguila. 2009. High-level resistance of Nosema ceranae, a parasite of the honeybee, to temperature and desiccation. Appl. Environ. Microbiol. 75(21): 6886-6889.
[https://doi.org/10.1128/AEM.01025-09]

-
Fries, I. 2010. Nosema ceranae in European honey bees (Apis mellifera). J. Invertebr. Pathol. 103: S73-S79.
[https://doi.org/10.1016/j.jip.2009.06.017]

-
Fries, I. 1988. Infectivity and multiplication of Nosema apis Z. in the ventriculus of the honey bee. Apidologie 19(3): 319-328.
[https://doi.org/10.1051/apido:19880310]

-
Gisder, S., K. Hedtke, N. Moöckel, M. C. Frielitz, A. Linde and E. Genersch. 2010. Five-year cohort study of Nosema spp. in Germany: does climate shape virulence and assertiveness of Nosema ceranae?. Appl. Environ. Microbiol. 76(9): 3032-3038.
[https://doi.org/10.1128/AEM.03097-09]

-
Huang, W. F., L. F. Solter, P. M. Yau and B. S. Imai. 2013. Nosema ceranae escapes fumagillin control in honey bees. PLoS Pathog. 9(3): e1003185.
[https://doi.org/10.1371/journal.ppat.1003185]

-
Khalifa, S. A., E. H. Elshafiey, A. A. Shetaia, A. A. A. El-Wahed, A. F. Algethami, S. G. Musharraf, M. F. AlAjmi, C. Zhao, S. H. Masry, M. M. Abdel-Daim and M. F. Halabi. 2021. Overview of bee pollination and its economic value for crop production. Insects 12(8): 688.
[https://doi.org/10.3390/insects12080688]

-
Kim, D. J., H. G. Yun, I. H. Kim, W. S. Gwak and S. D. Woo. 2017. Efficient Method for the Rapid Purification of Nosema ceranae Spores. Mycobiology 45(3): 204-208.
[https://doi.org/10.5941/MYCO.2017.45.3.204]

-
Malone, L. A. and D. Stefanovic. 1999. Comparison of the responses of two races of honeybees to infection with Nosema apis Zander. Apidologie 30(5): 375-382.
[https://doi.org/10.1051/apido:19990503]

-
Marín-García, P. J., Y. Peyre, A. E. Ahuir-Baraja, M. M. Garijo and L. Llobat. 2022. The role of Nosema ceranae (Microsporidia: Nosematidae) in honey bee colony losses and current insights on treatment. Vet. Sci. 9(3): 130.
[https://doi.org/10.3390/vetsci9030130]

-
Mayack, C. and D. Naug. 2009. Energetic stress in the honeybee Apis mellifera from Nosema ceranae infection. J. Invertebr. Pathol. 100(3): 185-188.
[https://doi.org/10.1016/j.jip.2008.12.001]

-
Milbrath, M. O., X. Xie and Z. Y. Huang. 2013. Nosema ceranae induced mortality in honey bees (Apis mellifera) depends on infection methods. J. Invertebr. Pathol. 114(1): 42-44.
[https://doi.org/10.1016/j.jip.2013.05.006]

- Morse, R. A. and N. W. Calderone. 2000. The value of honey bees as pollinators of US crops in 2000. Bee Culture 128(3): 1-15.
-
Papa, G., R. Maier, A. Durazzo, M. Lucarini, I. K. Karabagias, M. Plutino, E. Bianchetto, R. Aromolo, G. Pignatti, A. Ambrogio and M. Pellecchia. 2022. The honey bee Apis mellifera: An insect at the interface between human and ecosystem health. Biology 11(2): 233.
[https://doi.org/10.3390/biology11020233]

-
Porrini, M. P., N. J. Fernández, P. M. Garrido, L. B. Gende, S. K. Medici and M. J. Eguaras.2011. In vivo evaluation of antiparasitic activity of plant extracts on Nosema ceranae (Microsporidia). Apidologie 42: 700-707.
[https://doi.org/10.1007/s13592-011-0076-y]

-
Porrini, M. P., P. M. Garrido, L. B. Gende, C. Rossini, L. Hermida, J. A. Marcángeli and M. J. Eguaras. 2017. Oral administration of essential oils and main components: Study on honey bee survival and Nosema ceranae development. J. Apic. Res. 56(5): 616-624.
[https://doi.org/10.1080/00218839.2017.1348714]

-
Schatz, B., D. Maxime, H. Mickael, G. Benoît, A. Fabrice, S. Colette, G. Maxence and M. Denis. 2021. Pollinator conservation in the context of global changes with a focus on France and Belgium. Acta Oecol. 112: 103765.
[https://doi.org/10.1016/j.actao.2021.103765]

-
Song, H., H. Kim and K. Y. Kim. 2019. Anti-Parasitic Activity of Lespedeza cuneata Extract on Causative Agent of Nosemosis Type C, Nosema ceranae. J. Apic. 34(2): 137-140.
[https://doi.org/10.17519/apiculture.2019.06.34.2.137]

-
Van den Heever, J. P., T. S. Thompson, J. M. Curtis, A. Ibrahim and S. F. Pernal. 2014. Fumagillin: An overview of recent scientific advances and their significance for apiculture. J. Agric. Food Chem. 62(13): 2728-2737.
[https://doi.org/10.1021/jf4055374]