
국내산 화분 (Bee pollen)의 특성 및 영양성분 분석에 관한 연구
Abstract
Pollen is a raw material of royal jelly as well as an essential ingredient for the maintenance and growth of honey bees. It is referred to as a complete food due to its richness in essential and physiologically active substances. However, bee pollens from Korea have not been evaluated properly yet. In this study, we evaluated the bee pollens collected from various areas in Korea (twelve regions) and other countries for the comparison: Korea (B1~B12), Spain (B13), Vietnam (B14) and China (B15). To study their chemical composition, minerals and vitamin C, amino acids, fatty acids, antibiotics, high-performance liquid chromatography (HPLC) were performed for qualitative analysis. As a result, the contents of moisture, crude ash, crude protein, crude fat, and carbohydrate of pollens were 9.17%, 2.54%, 21.69%, 7.96%, and 58.64%, respectively. The amino acid composition, all samples evenly contain 18 types of amino acids such as proline, arginine, glutamic acid, histidine, small amounts of cystine, and glycine. In particular, our data showed that linoleic acid is the highest content of all pollen samples, followed by α-linolenic acid and palmitic acid. Our analyses of nutritional compositions showed that Korean bee pollen (B1~B12) have better compositions in nutrition, as compared to those from Spain (B13), Vietnam (B14), and China (B15). Oxytetracycline, an antibiotic, was not detected in all 15 samples and its stability was confirmed.
Keywords:
Bee pollen, Nutritional compositions, Amino acid, Fatty acid, Korea서 론
벌 화분 (Bee pollen)은 꿀벌들이 꽃에서 화밀을 채취할 때 뒷다리에 꿀과 효소 등을 뭉쳐 수집한 것으로, 일반 꽃 화분보다 영양성분이 풍부하며 꿀벌의 단백질원으로 생명 유지와 성장에 필수적인 물질이자 로열젤리 (royal jelly)의 원료로 이용된다 (Leblanc et al., 2009; Silva et al., 2014). 또한 화분은 탄수화물, 단백질, 지방, 비타민, 무기질 등의 영양성분이 풍부하여 완전식품으로 일컬어지고 있다 (Serra Bonbehí and Escolà Jordà, 1997; Feás et al., 2012).
화분에 대한 기록은 기원전으로 거슬러 올라가 고대 페르시아, 중국, 이집트 등의 고분서와 성경, 코란 등에도 기록되어 있으며, 우리 인류의 역사와 식생활에도 식품으로 애용되어 오고 있다. 즉, 화분의 작은 입자 속에는 생명 유지와 성장에 필요한 영양소들이 골고루 함유되어 있으며, 이들 성분조성은 기원식물의 종류, 생육환경, 혼합 정도 등에 따라 그 함유량이 다르며 이화학 성질 또한 차이가 있는 것으로 알려져 있다 (최, 1982).
뿐만 아니라 동의보감에 따르면 화분은 심혈관계, 순환기계, 소화기계, 비뇨생식기계, 신경정신계 등에 효과가 있는 것으로 기록되어 있으며, 따라서 화분은 생리학적 가치가 매우 높은 식품으로 평가되고 있다 (유, 1988).
현재 화분에 의한 질병 억제 및 치료 등에 관한 연구가 다수 보고되고 있다. 그 이유는 생체산화를 일으키는 활성산소나 자유 라디칼은 DNA, RNA, 단백질, 지질 등과 반응하여 세포 손상을 유발하고 이는 고혈압, 동맥경화, 뇌졸중 등 심혈관계 질환, 암 또는 노화를 진행시키는 것으로 보고되고 있기 때문이다. 또한 현재 노화억제 및 만성퇴행성질환 예방을 위한 건강식품과 관련된 연구가 활발히 진행되고 있으며 (Wiseman and Halliwell, 1996), 특히 화분은 이러한 질병예방 및 치료에 도움이 되는 것으로 알려진 페놀성 화합물 (phenolic compounds), 플라보노이드 (flavonoids), 아스코르빈산 (ascorbic acid), 토코페롤 (tocopherol) 등의 생리활성물질을 많이 함유하고 있는 것으로 보고되어 있다 (Block and Langseth, 1994).
유럽, 남미, 일본 등의 선진국에서는 이미 오래전부터 화분을 포함한 양봉산물에 대한 연구가 활발히 진행되어 왔으며, 가공식품뿐 아니라 의약품으로도 생산 및 개발되어 소비되고 있는 추세이다 (Kroyer and Hegedus, 2001). 최근 화분은 건강보조식품으로 주목받으며 수요가 지속적으로 증가하고 있으나 현재 국내에서 유통 중인 화분의 대부분은 수입산에 의존하고 있는 현실이다. 국내에서 생산되는 화분은 봄철에 수확되는 도토리 화분과 다래 화분이 가장 많으며 소비량이 급격히 증가하는 여름부터는 화분 공급이 부족하여 수입산에 의존하고 있으며, 스페인에서 2016년 317톤, 2017년 상반기에는 372톤이 수입된 것으로 보고되었다 (관세청, 2017).
이처럼 국내 화분 소비량은 꾸준히 증가하고 있으나 국내산 화분의 특성 및 영양성분 등의 과학적인 연구자료는 충분하지 않은 실정이다. 따라서 본 연구는 국내산 화분의 체계적인 연구와 효용 가치를 높이기 위해 과학적인 기초자료를 제공하고자 계획되었으며, 국내 다양한 지역으로부터 수집된 화분의 특성에 대하여 평가하고 일반성분과 무기질 및 비타민 C, 상세 아미노산, 지방산 등을 분석하였다.
재료 및 방법
화분 시료
본 연구에 사용한 화분 시료는 국내산 화분 (B1~B12) 12종, 수입산 화분 (B13~B15) 3종, 총 15종으로 한국양봉협회로부터 제공받았으며 (Table 1, Fig. 1), 각 시료의 상세는 맹검법 (blinded experiment)으로 진행되었다. 화분 시료는 국내산 화분의 경우 2018년도, 수입산 화분의 경우 2017년도에 수집된 것으로 모두 -20℃에서 냉동 보관하면서 연구분석에 사용하였다.

Colors of bee pollen samples. B1, Gyeonggi Namyangju 1; B2, Gyeonggi Namyangju 2; B3, Jeonnam Gochang; B4, Jeonnam Hampyeong; B5, Jeju 1; B6, Jeju 2; B7, Ganwon Yangyang; B8, Ganwon Wonju; B9, Gyeongnam sancheong; B10, Gyeongbuk Uiseong; B11, Chungbuk Yeongdong; B12, Chungnam Geumsan; B13, Spain; B14, Vietnam; B15, China.
일반성분 분석
본 실험에서 사용한 화분 시료의 일반성분 분석은 식품공전 분석방법 (2008)에 의하여 정량하였다. 수분 함량은 105℃로 건조하여 정량하는 상압가열건조법, 회분은 600℃에서 직접 회화법, 조지방 함량은 Soxhlet 추출법으로 diethyl ether로 추출하여 정량하였다. 조단백질은 semimicro-Kjeldhl 법으로 자동 단백질 분석기로 측정하였으며, 질소 환산계수는 6.25를 사용하였다. 화분의 탄수화물의 함량은 100에서 수분, 회분, 조단백질, 조지방 함량을 뺀 값으로 나타내었다.
무기질 및 비타민 분석
무기질 함량은 식품공전 분석방법 (2008)에 따라 분석하였다. 화분 시료를 105℃에서 16시간 건조하여 마쇄한 다음 0.5 g을 취하여 600°C 회화로에서 2시간 회화시킨 후 냉각하였다. 회화된 시료는 microwave (Mars5, Mars6, CEM, USA) 분해 용기에 넣고 질산용액 (HNO3 : H2O=1 : 1) 7 mL을 첨가하여 24시간 분해시킨 후 염산용액 (HCl : H2O=1 : 1)을 가하여 24시간 용해시킨 다음 여과 (Whatman No. 6, Maidstone, England)하여 분석 시료로 이용하였다. 분석 조건은 유도결합 플라즈마 (Inductively Coupled Plasma, PerkinElmer Optima 8300, USA)를 이용하여 정량하였다.
비타민 함량은 식품공전 분석방법 (2008)에 따라 분석하였다. 표준시약은 모두 Sigma사 (St. Louis, Mo, USA)로부터 구입하여 사용하였으며, 시약은 HPLC 등급을 사용하였다. 화분 시료를 5% metaphosphoric acid (Wako) 20 mL로 균질화 (Ultra-Turrax T25, IKA Labo, Germany)하여 총량 50 mL까지 정용한 후, 초음파 추출기로 30분간 추출하고 refrigerated centrifuge (5804R, Eppendorf, Germany) 12,500×g로 10분간 원심분리한 뒤 상등액을 취하여 0.45 μm 필터로 여과한 후 시험용액으로 사용하였다. 비타민 C의 분석은 HPLC (NANOSPACE SI-2, SHISEIDO, Japan)와 PDA Detector를 사용하였다.
아미노산 분석
화분 시료의 아미노산 조성 분석은 식품공전 분석방법 (2008)에 따라 화분을 약 5~20 g을 취해 80℃에서 예비 건조하여 450~550℃에서 회화한 다음 얻어진 회분을 0.02 N 염산 10 mL를 가하여 상온에서 3~5시간 반응시키고 반응액을 여과 (Whatman NO. 5A)한 후 50 mL Volumetric flask에 정확히 정용하여 시험용액으로 사용하였다. 18종의 아미노산 함량은 표준용액 (AA-S-18, Sigma, Japan)을 기준으로 계산하였으며, 실험에 사용된 HPLC의 분석 조건은 Table 2와 같다.
지방산 분석
화분의 지방산 분석은 식품공전 분석방법 (2008)에 따라 실시하였다. 검체를 균질화하고 chloroform과 diethyl ether로 추출한 지방을 녹인 다음 액체 질소로 농축하였다. 농축물에 boron trifluoride와 toluene을 첨가하고 100℃ 오븐에서 가열 후 실온에서 냉각하였다. 이후 물과 hexane을 첨가하고 분리된 상층액을 취하여 시험용액으로 사용하였으며, 실험에 사용된 HPLC 분석 조건은 Table 3과 같다.
항생제 분석
항생제 분석은 식품공전 분석방법 (2008)에 따라 시행되었다. 화분 시료 15개에 대한 항생제 oxytetracycline 성분의 검출 여부를 확인하기 위하여HPLC를 이용한 분석방법을 실시하였으며, 표준물질 등에 관한 사항, 해당 시험에 사용한 농도의 표기는 모두 free base로 기재하였다. 냉동 보관 (-20℃) 중이던 시료를 상온에 1시간 방치 후 다음과 같이 전처리를 실시하였다. 화분 분말시료 약 0.2 g을 취하여 conical tube에 옮기고 추출 용매로 0.1 N HCl in methanol mixture 2 mL를 첨가하였다. Sinccator (400 W)에서 1시간 동안 추출하여 원심분리 후 상층액 일정량을 취하여 원심분리 (13,000 rpm, 5 min, 4°C)를 실시한 후 시료 15 μL를 HPLC에 주입하였다. 실험에 사용된 HPLC 분석 조건은 Table 4와 같다.
결과 및 고찰
일반성분 분석
화분 시료 15개에 대한 일반성분을 분석한 결과 Table 5와 같다. 전체 화분 시료 15개의 수분 함량은 평균 9.17±4.36%로, 국내산 (B1~B12) 및 수입산 (B13~B15) 화분의 수분 함량은 각각 평균 9.30±4.89%, 8.65±1.12%로 국내산 (B1~B12) 화분의 수분 함량이 수입산 (B13~B15) 화분보다 높은 수분 함량을 나타내었다. 특히 국내에서 수집된 제주 1 (B5)은 21.05%로 가장 높은 함량을 나타내었으며, 이어서 경기 남양주 1 (B1) 17.18%, 경기 남양주 2 (B2) 9.58%, 전북 고창 (B3) 9.15%의 순으로 높은 함량을 나타내었다. 반면 수입산 스페인 (B13) 화분은 8.78%, 중국 (B15) 화분은 7.48%로, 국내에서 수집된 화분에 비해 현저히 낮은 수분 함량을 나타내었다.
기존 연구에서 보고된 국내산 화분의 수분 함량은 벼 화분 23.7% (홍 등, 2016), 도토리 화분 11.7% (홍 등, 2013), 송 화분 10.4% (이 등, 1997)로, 본 연구결과와 유사하였으며 국외 연구에서 보고된 화분 내 수분 함량은 스페인산, 포르투갈산 화분이 각각 7.0%, 6.0% (Nogueira et al., 2012), 중국산 화분이 7.5% (Yang et al., 2013)로 본 연구 내 수입산 (B13~B15) 화분의 결과와 유사하였다. 화분의 일반적인 수분 함량은 20% 미만으로 기원식물체, 채집 시기, 밀원의 조건, 꿀 함유 상태에 따라 다르며, 특히 꿀벌이 화분을 수집하기 위해 이용하는 꿀의 수분 함량 (40~60%)에 영향을 많이 받으므로 차이를 나타내는 것으로 보고되고 있다 (Stanley and Linskens, 1974).
화분 시료 15개에 대한 회분 함량은 평균 2.54±0.54%이며, 국내산 (B1~B12) 및 수입산 (B13~B15) 화분의 회분 함량은 각각 평균 2.45±0.34%, 2.91±1.09%로 유사한 결과를 나타내었으며, 베트남 (B14)과 중국 (B15) 화분은 각각 3.74%, 3.32%로 다소 높은 함량을 나타내었고, 스페인 (B13) 화분은 1.67%로 가장 낮은 회분 함량을 나타내었다. 기존 연구에서 보고된 국내산 화분의 회분 함량은 도토리 화분에서는 2.6% (홍 등, 2013), 다래 화분 2.3% (홍 등, 2015)로 본 연구결과와 유사한 함량을 나타내었다. 국외 연구에서 보고한 화분의 회분 함량은 이탈리아산과 스페인산 화분이 각각 1.8%, 1.6% (Gardana et al., 2018), 중국산 화분이 3.6% (Yang et al., 2013)로 본 연구결과와 유사한 것으로 확인하였다.
화분 시료 15개에 대한 조단백질 함량을 분석한 결과 평균 21.69±3.3%로 나타났으며, 국내산 (B1~B12) 및 수입산 (B13~B15) 화분의 조단백질 함량은 각각 평균 21.87±2.73%, 20.98±1.06%로, 국내산 화분 (B1~B12)이 수입산 화분 (B13~B15)보다 더 높은 조단백질 함량을 나타내었으며, 특히 국내 경남 산청 (B9)에서 수집된 화분은 매우 높은 조단백질 함량 (26.71%)을 나타내었다. 이어서 강원 원주 (B8) 25.62%, 경기 남양주 2 (B2) 24.85%, 경기 남양주 1 (B1) 23.08%의 순으로 높은 함량을 나타내었다. 반면 수입산 스페인 (B13) 화분의 조단백질 함량은 15.50%로 가장 낮은 함량을 나타내었다.
기존 연구에서 보고한 국내산 화분의 조단백질 함량을 살펴보면, 녹차 화분 26.1% (장, 2018), 벚나무 화분 24.6% (김과 손, 1990), 도토리 화분 21.4% (이 등, 1997)로 본 연구결과와 유사하였으며, 벼 화분 15.66% (홍 등, 2016), 송 화분 14.0% (이 등, 1997) 보다는 월등히 높은 함량임을 확인하였다. 국외 연구에서 보고된 화분의 조단백질 함량은 스페인산 12.3% (Gardana et al., 2018), 중국산 27.3% (Yang et al., 2013)로, 본 연구에서 시료로 사용한 스페인 (B13) 화분 15.50%, 중국 (B15) 화분 27.31%와 매우 유사한 결과임을 확인하였다. 화분은 기원이 식물체임에도 불구하고 조단백질 함유량이 15~27%로 매우 높아 건강에 이점이 있을 것으로 판단된다.
화분 시료 15개에 대한 조지방 함량은 평균 7.96±2.83%이며, 국내산 (B1~B12) 및 수입산 (B13~B15) 화분의 조지방 함량은 각각 평균 8.30±3.06%, 6.59±1.07%로 국내산 (B1~B12) 화분이 1.3배 높은 함량을 나타내었다. 특히 전남 함평 (B4)에서 수집된 화분의 경우 13.94%로 가장 높은 함량을 나타내었으며, 이어서 강원 양양 (B7) 12.37%, 충남 금산 (B12) 10.49%, 경북 영동 (B11) 10.33% 순으로, 반면 수입산 (B13~B15) 화분은 현저히 낮은 조지방 함량을 나타내었으며 특히, 중국 (B15) 화분은 5.36%로 매우 낮은 조지방 함량을 나타내었다.
기존 연구에서 보고된 국내산 화분의 조지방 함량을 살펴보면, 도토리 화분 11.8% (홍 등, 2013), 다래 화분 8.7% (홍 등, 2015)로 본 연구의 국내산 (B1~B12) 화분 결과와 유사하였으며, 송 화분 3.0% (이 등, 1997), 유채 화분 3.2% (김과 손, 1990)보다는 높은 함량을 나타내었다. 국외 연구에서 보고된 조지방 함량은 스페인산 6.0% (Gardana et al., 2018) 중국산 5.3% (Yang et al., 2013)로 본 연구 시료로 사용한 스페인 (B13) 화분 7.09%와 중국 (B15) 화분 5.36%와 유사한 것으로 확인되었다.
마지막으로 화분 시료 15개에 대한 탄수화물 함량을 분석한 결과 전체 평균 58.64±4.55%이며, 국내산 (B1~B12)과 수입산 (B13~B15) 화분의 탄수화물 함량은 각각 평균 58.09±4.40%, 60.86±5.44%로 유사한 함량을 나타내어 국·내외 시료들 간의 차이는 크지 않은 것으로 확인되었다. 국내산 (B1~B12) 화분의 경우 경북 의성 (B10)에서 수집된 화분이 63.88%로 가장 높은 탄수화물 함량을 나타내었으며, 이어서 강원 원주 (B8), 경북 영동 (B11), 제주 2 (B2) 화분은 각각 61.77%, 61.49%, 61.11% 순으로 높은 함량을 나타내었다. 수입산 (B13~B15) 화분은 베트남 (B14) 59.09%, 중국 (B15) 56.53%로 앞서 나열한 국내산 화분과 유사한 함량을 나타내었다. 국내산 (B1~B12) 화분의 탄수화물 함량 범위는 52~63%로 분포하고 있었으며 기존 연구에서 보고된 벼 화분 53.71% (홍 등, 2016)와 유사하였으며 도토리 화분 47.9% (홍 등, 2013), 다래 화분 48.1% (홍 등, 2015)보다는 높은 것으로 확인되었다. 국외 연구에서 보고된 화분의 탄수화물 함량은 중국산 화분이 59.4% (Yang et al., 2013)로 본 연구 시료인 중국산 (B15) 화분 56.63%와 유사하였으며, 스페인산 화분은 37.7% (Noueira et al., 2012)로 본 연구 시료로 사용한 스페인 (B13) 화분 66.96%와 비교하여 현저히 낮은 함량을 나타내었다.
화분은 단일 종류가 아니며 꿀벌에 의하여 여러 종류의 꽃으로부터 수집된 물질이므로 시료 간의 성분 차이가 발생되는 것으로 판단되며, 화분의 탄수화물 함량은 지리적 기원의 영향 및 환경적 상황과 관련되거나 다른 식물 성분으로부터 기인되는 것으로 사료된다 (Herbert et al., 1978). 본 연구 시료 15개에 대한 일반성분 조성은 국내산 (B1~B12) 화분이 수입산 (B13~B14) 화분보다 수분, 조단백질, 조지방, 탄수화물 등의 함량에서 상대적으로 높은 함유량임을 확인하였다. 따라서 본 연구결과는 국내 다양한 지역으로부터 생산되는 화분의 식생 및 품질을 판정하는 데 있어 유용하게 이용될 수 있을 것으로 사료된다.
무기질 및 비타민 C 함량
무기질은 필수 아미노산과 같이 체내에서 합성되지 않는 물질로 생체의 유지를 위해서 반드시 필요한 미량 영양소로 분류되며, 신체 골격 형성, 삼투압 유지, 신경 및 근육 기능 유지, 에너지 대사 등 다양한 체내 기능을 가지는 것으로 알려져 있다 (Blumfeld et al., 2013).
화분 내 함유되어 있는 대표 무기질 4종 및 비타민 C 함량을 분석한 결과 Table 6과 같다. 본 연구에서 분석한 화분 시료 15개에 대한 무기질은 칼륨 (K) 594.08 mg/100 g과 인 (P) 470.51 mg/100 g이 가장 많이 함유되어 있으며, 나트륨 (Na)이 11.44 mg/100 g으로 가장 낮은 함유량을 나타내었다. 국내산 (B1~B12) 화분은 체내 에너지 대사에 관여하는 칼륨 (K)이 가장 많이 함유되어 있었으며, 특히 제주 2 (B6)에서 수집된 화분이 705.09 mg/100 g으로 가장 높은 칼륨 (K) 함량을 나타내었고, 이어서 경남 산청 (B9) 677.46 mg/100 g, 경기 남양주 2 (B2) 662.30 mg/100 g, 강원 원주 (B8) 575.24 mg/100 g 순으로 높은 함량을 나타내었다.
화분 시료에 대한 칼슘 (Ca)의 함량을 분석한 결과 평균 132.39 mg/100 g으로 나타났다. 국내산 (B1~B12) 및 수입산 (B13~B15) 화분의 칼슘 (Ca) 함량을 비교해 볼 때 각각 평균은 137.30 mg/100 g, 112.74 mg/100 g으로 국내산 (B1~B12) 화분이 수입산 (B13~B15) 화분보다 평균 1.2배 이상 높게 함유되어 있었다.
특히 국내 강원 원주 (B8)에서 수집된 화분 (305.37 mg/100 g)의 Ca 함량이 스페인 (B13) 화분 (64.55 mg/100 g) 보다 5배 이상 높게 함유되어 있음을 확인하였다. 이어서 제주 2 (B6) 210.76 mg/100 g, 경기 남양주 1 (B1) 210.33 mg/100 g, 경남 산청 (B9) 167.09 mg/100 g 순으로 높은 칼슘 (Ca) 함량을 나타내었으나, 수입산 (B13~B15) 화분의 경우 현저히 낮은 칼슘 (Ca) 함량을 나타내었다. 기존 연구에서 보고된 화분의 무기질 함유량을 살펴보면, 국내산 벼 화분 (홍 등, 2016)과 국외 스페인 화분 (Serra Bonbehí and Escolà Jordà, 1997)이 칼륨 (K)-인 (P)-칼슘 (Ca) 순으로 함유되어 이는 본 연구결과와 유사한 것으로 확인되었다.
본 연구에서 분석한 화분의 칼슘 (Ca) 함량은 국내산 (B1~B12) 화분이 수입산 (B13~B15) 화분보다 월등히 높은 함량을 나타내었으며, 특히 강원 원주 (B8)에서 수집된 화분의 경우 305.37 mg/100 g으로 기존에 보고된 녹차 화분 121.84 mg/100 g (장, 2018), 벼 화분 89.68 mg/100 g (홍 등, 2016)보다 매우 높은 함량을 나타내었다.
화분 시료 15개에 대한 K/Na 비는 평균 51.93이며, 국내산 (B1~B12) 및 수입산 (B13~B15) 화분의 K/Na 비는 각 52.78, 49.45로 국내산 (B1~B12) 화분이 높은 결과를 나타내었다. 화분의 K/Na 비는 꿀벌 먹이의 주요한 요인으로 작용하는 것으로 보고되고 있다 (Wesh and Marston, 1983). 그리고 화분 시료 15개에 대한 Ca/P 비는 평균 0.28이며, 국내산 (B1~B12) 및 수입산 화분 (B13~B15)은 각각 평균 0.31, 0.21로 국내산 (B1~B12) 화분이 높은 결과를 나타내었다. 기존 연구에서 보고된 Ca/P 비는 국내산 도토리 화분에서 0.23 (이 등, 1997), 벼 화분은 0.26 (홍 등, 2016)으로 수입산 (B13~B15) 화분이 다소 낮은 경향을 나타내었으며 인 (P)에 비해 칼슘 (Ca)이 매우 적게 함유된 것으로 확인되었다. 화분의 미량원소는 밀원의 식생에 따라 차이가 있으며 그 구성은 다양하게 분포하는 것으로 알려져 있다 (Stanley and Linskens, 1974).
마지막으로 화분 시료에 15개에 대한 비타민 C 함량은 평균 45.62 mg/100 g이었고, 국내산 (B1~B12) 및 수입산 (B13~B15) 화분의 비타민 C 함량은 각각 평균 55.47 mg/100 g, 6.22 mg/100 g으로 나타났다. 즉, 국내산 (B1~B12) 화분의 경우 비타민 C가 매우 높게 함유되어 있었으며, 이는 수입산 (B13~B15) 화분보다 약 9배 이상 높은 수준으로 확인되었다. 특히 국내 충남 금산 (B12)에서 수집된 화분의 비타민 C 함유량은 103.38 mg/100 g으로 가장 높은 함량을 나타내었으며, 이어서 강원 양양 (B7) 94.65 mg/100 g, 전북 고창 (B3) 87.43 mg/100 g, 경북 영동 (B11) 82.53 mg/100 g 순으로 높은 함유량을 나타내었다. 반면 수입산 (B13~B15) 화분은 스페인산 (B13) 4.24 mg/100 g, 베트남산 (B14) 5.22 mg/100 g, 중국산 (B15) 9.20 mg/100 g으로 매우 낮은 함량을 나타내었으며, 특히 충남 금산 (B12) 화분의 비타민 C 함유량 (103.38 mg/100 g)이 가장 높았으며 이는 스페인 (B13) 화분과 비교하여 볼 때 24배 이상 높은 함유량을 나타내었다.
비타민 C는 대표적인 수용성 비타민으로 강력한 환원제로 작용하며 식품에 함유되어 있는 다른 영양소와 비교되는 특성을 나타내므로 영양의 지표로도 사용된다. 또한 산화 스트레스와 관련된 혈관 기능 장애를 회복시키며 대표적 항산화 물질로 신체를 활성산소로부터 보호하는 성분이다 (Padayatty et al., 2003). 본 연구 분석을 통해 국내산 화분의 무기질 및 비타민 C 성분에 대한 영양학적 가치를 확인하였으며, 국내 다양한 지역으로부터 수집된 화분의 지역별 특성을 확인하였다. 추후 국내산 화분은 식품소재 및 원료로 유용하게 이용될 수 있을 것으로 사료된다.
아미노산 구성 및 함량
아미노산은 체내 단백질의 기본 구성단위이자 각종 신진대사의 촉매제로 작용하며 인체조직의 재생과 회복에 관여한다 (Sakami and Harrington, 1963). 화분 시료 15개에 대한 상세 아미노산 조성을 분석한 결과 Table 7과 같다. 각 화분 (B1~B15) 시료 내에는 glutamic acid를 비롯한 18종의 아미노산이 존재하며, 특히 valine, leucine, isoleucine, methionine, lysine, phenylalanine, tryptophan, threonine 등 필수 아미노산 8종이 모두 함유되어 있음을 확인하였다. 그 함유량은 proline이 평균 765.34 mg/100 g으로 가장 많이 함유되어 있으며, 이어서 arginine (122.43 mg/100 g), glutamic acid (82.65 mg/100 g) 순으로 분포되어 있음을 확인하였다. 반면 glycine (8.04 mg/100 g), cystine (1.14 mg/100 g) 등은 소량 함유되어 있었다.
국내산 (B1~B12) 화분의 아미노산 조성은 proline, arginine, glutamic acid, histidine 순으로 많이 함유되어 있었으며, 수입산 (B13~B15) 화분은 proline, glutamic acid, alanine, leucine 순으로 함유되어 있었다. 기존 연구의 보고에 따르면 일반적으로 화분에는 모든 필수 아미노산이 함유되어 있으며, 그 함량은 식물의 종에 따라 기인하며 차이가 있는 것으로 알려져 있다 (Leblanc et al., 2000).
본 연구에서 분석한 국내산 (B1~B12) 화분은 대부분의 아미노산 조성에서 수입산 (B13~B15) 화분보다 월등히 높은 함량을 나타내었으며, 특히 뇌의 기능을 활성화시키는 glutamic acid (Gollnitz and Wiechert, 1967)의 경우 국내산 (B1~B12) 및 수입산 (B13~B15) 화분 각각 평균 88.80 mg/100 g, 58.08 mg/100 g으로 국내산 (B1~B12) 화분이 1.5배 높은 함량을 나타내었다. 특히 경기 남양주 1 (B1)에서 수집한 화분이 180.53 mg/100 g으로 가장 높은 glutamic acid 함량을 나타내었으며 이는 스페인 (B13) 화분 32.75 mg/100 g보다 6배 이상 높은 것으로 확인되었다.
필수 아미노산은 체내에서 합성이 되지 않는 아미노산으로 식품 단백질의 영양학적 가치를 평가하는 데 가장 중요한 척도로 알려져 있다 (Sakami and Harrington, 1963). 본 연구결과 국내 다양한 지역에서 수집된 화분은 필수 아미노산을 포함한 18종의 아미노산이 대부분 함유되어 있으며 그 함량 또한 매우 높으므로 양질의 단백질을 함유하고 있음을 증명하였다.
지방산 조성 및 함량
지방산은 지방의 가수분해물이며 hydrocarbon chain에 carboxyl group을 가지는 화합물을 일컫는데, hydrocarbon chain에 이중결합 (C=C)의 유무에 따라 포화지방산과 불포화지방산으로 나뉜다. 포화지방산은 체내에서 생합성되며 동물성 지방에 주로 함유되어 있는 물질로 알려져 있으나 식물성 팜유나 코코넛유에도 다량으로 존재한다 (Verllo-rowell et al., 2016).
화분 시료 15개에 대한 지방산 조성을 분석한 결과 Table 8과 같다. 본 연구결과 필수 지방산인 linoleic acid와 α-linolenic acid가 모두 함유되어 있었으며, 그 함량은 linoleic acid 2.23 g/100 g, α-linolenic acid 1.90 g/100 g으로 총 지방산 중 가장 많은 함량을 나타내었다. 국내산 (B1~B12) 화분의 지방산 조성을 살펴보면 linoleic acid (2.58 g/100 g), α-linolenic acid (1.96 g/100 g), palmitic acid (1.63 g/100 g), oleic acid (1.05 g/100 g) 순으로 함유되어 있으며, 특히 전남 함평 (B4) 화분의 경우 linoleic acid (5.22 g/100 g), α-linolenic acid (2.77 g/100 g), oleic acid (2.50 g/100 g) 순으로 가장 높은 함량을 나타내었다. 수입산 (B13~B15) 화분의 지방산 조성은 α-linolenic acid (1.65 g/100 g), palmitic acid (1.28 g/100 g), linoleic acid (0.81 g/100 g), oleic acid (0.32 g/100 g) 순으로 함유되어 있었으며 국내산 (B1~B12) 화분보다 현저히 낮은 지방산 함량을 나타내었다.
화분의 총 불포화지방산 (MUFA+PUFA)을 비교하면 국내에서 수집된 전남 함평 (B4) 화분의 경우 10.56 g/100 g으로 가장 높았으며, 베트남 (B14) 화분은 2.27 g/100 g으로 매우 낮은 함량을 나타내었다. 국내산 (B1~B12) 및 수입산 (B13~B15) 화분의 포화지방산에 대한 다가불포화지방산의 비율 (PUFA/SFA)은 각각 2.24 g/100 g, 1.71 g/100 g으로 국내산 (B1~B12) 화분이 수입산 (B13~B15) 화분보다 높게 나타났다.
기존에 보고된 국산 화분의 지방산 조성은 도토리 화 분의 경우 linoleic acid (39.3%), oleic acid (24.1%), palmitic acid (18.5%)의 함량이 가장 많은 것으로 보고되어 있으며, 다래 화분의 경우 linolenic acid (31.7%), oleic acid (24.7%), palmitic acid (17.3%) 순으로 분포하였다 (이 등, 1997). 이는 본 연구결과인 국내산 (B1~B12) 화분의 지방산 조성과 유사하였다. 기존에 보고된 국외 화분의 지방산 조성은 중국산 유채 화분 (Xu et al., 2009)에서 linolenic acid (38.7%), palmitic acid (20%), linoleic acid (13%) 순으로 분포하였으며, 이는 본 연구결과의 수입산 중국 (B15) 화분의 지방산 조성과 유사하였다. 따라서 화분의 지방산 함량은 밀원식물에 따라 차이가 있으며 불포화지방산인 linoleic acid, linolenic acid, oleic acid와 포화지방산인 palmitic acid가 주로 함유되어 있는 것으로 확인되었다.
항생제 (옥시테트라사이클린, Oxytetracycline)
지금까지 알려진 꿀벌 부저병의 방제는 비화학적 방법에 의한 방제와 화학적 방법에 의한 방제로 나눌 수 있다. 비화학적 방법에 의한 방제는 부저병의 발생 봉군을 격리시키거나 소각하는 것으로 질병의 확산방지, 비 감염 봉군에 대한 예방 차원에서 사용될 수 있는 방법이다. 반면, 화학적 방법에 의한 방제는 oxytetracycline 등과 같은 항생제를 처리하는 것이다. 그러나 잦은 항생제 사용은 양봉산물 내 항생제 잔류 (Kochansky et al., 2001; Piccini, 2001; Mutinelli, 2003) 및 내성 균주의 확산 (Eguaras et al., 2005) 등의 문제가 있는 것으로 보고되고 있다 (Aronstein and Hayes, 2004).
이에 본 연구에서는 화분 내 항생제인 oxytetracycline 검출 여부를 추가로 검증하여 화분 시료의 안전성을 평가하고자 하였으며, 그 결과 Table 9와 같다. 본 연구에 사용된 15개의 모든 화분 시료에서 항생제 oxytetracycline 성분은 불검출 (not detected)되었다.
HPLC 분석결과 화분 시료 중 항생제 성분인 oxytetracycline의 검출 여부는 HPLC 분석법을 이용하여 실시하였으며, 표준성분으로써 oxytetracycline은 표준용액에서 retention time (min)이 약 7.4 min에 검출됨을 확인하였다 (Fig 2, B). Blank 시료 대비 표준용액에서의 oxytetracycline의 특이성을 확인하였으며, 다만 일부 화분 추출물에서 표준성분 oxytetracycline이 검출되는 시간과 겹치는 peak x (약 7.2~7.4분)가 확인되어 다른 검출 조건에서 oxytetracycline의 UV spectrum과 일치 여부를 대조하였다. 그 평가 결과는 서로 다른 UV spectrum으로서 확인되는 바, peak x는 표준성분 oxytetracycline과 동일한 성분이 아님을 확인하였다. 따라서, 분석이 진행된 화분 추출물 모든 시료에서는 oxytetracycline 항생제 성분은 불검출 (not detected)된 것으로 확인되었다.
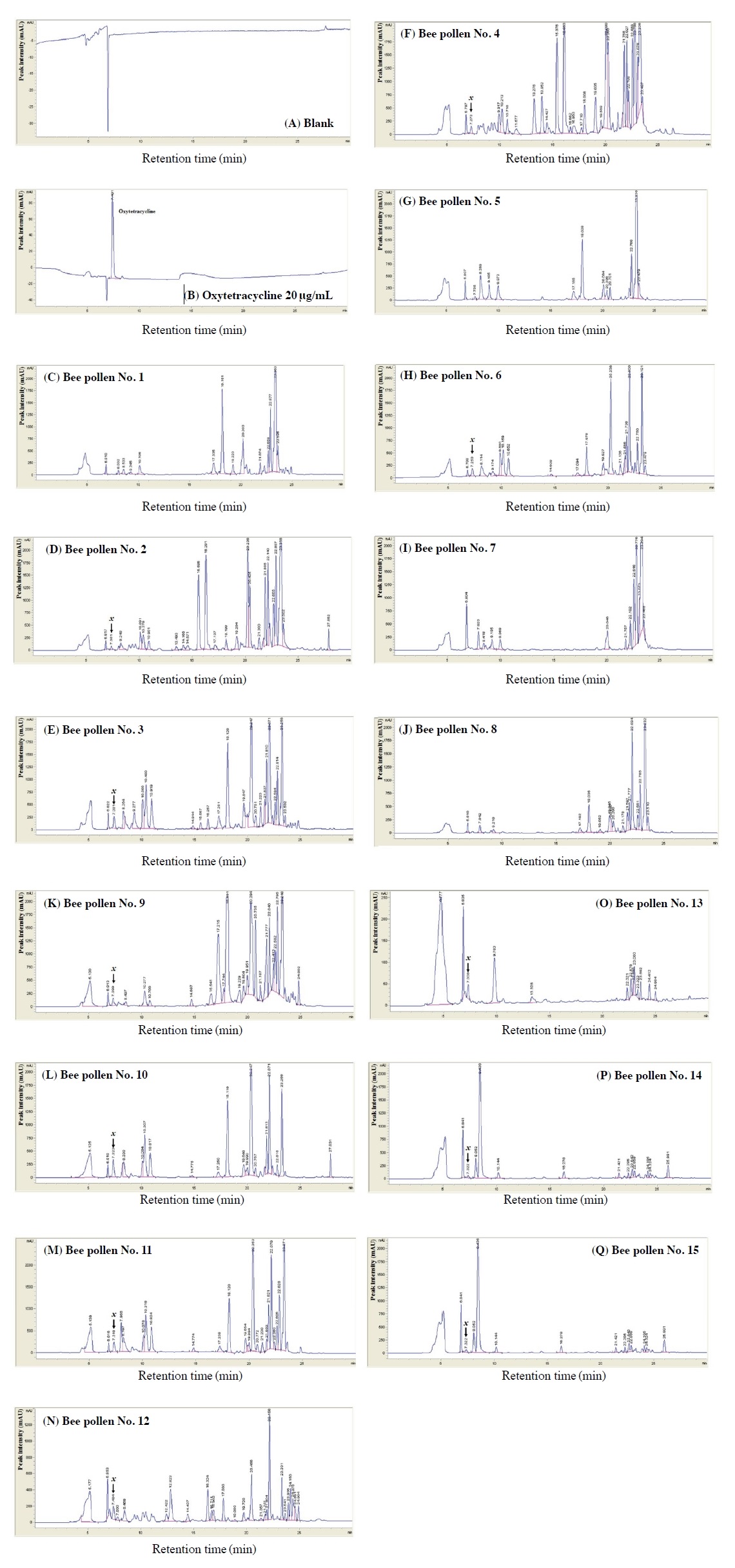
HPLC chromatograms on the detection of oxytetracycline in the blank (A), the standard solution (B) and the bee pollen extract (C~Q, 15 samples). Unknown peak x were detected in some bee pollen extracts at Rt 7.2~7.4 min. Bee pollens were extracted in methanol containing 0.1 N HCl and eluented by Capcellpak MGII C18 column (4.6×150 mm ID, 3 μm) at UV 280 nm.
현재 국내산 화분의 식품공전의 항생제 잔류허용기준은 정해져 있지 않으며 지금까지 꿀벌의 부저병 방제에 관한 많은 연구가 이루어져 왔으나 화분을 수집하는 꿀벌에 적용 시 안전성에 관한 문제가 계속 야기되어 왔다. 본 연구에서는 국내·외 보편적으로 많이 사용되고 있는 항생제인 oxytetracycline의 검출 여부를 확인하였으며 15개 화분 시료에서 모두 불검출 (not detected)되었고 이에 안전성을 확인하였다.
적 요
벌 화분 (Bee pollen)은 생리활성물질이 풍부한 완전식품으로 알려져 있다. 본 연구는 2017~2018년 수집된 국내산 (B1~B12) 및 수입산 (B13~B15) 화분의 일반성분, 무기질 및 비타민 C, 상세 아미노산 및 지방산 등의 성분분석을 통하여 영양학적 가치를 평가하였다. 화분 시료 (B1~B15)에 대한 일반성분 조성을 분석한 결과, 수분, 회분, 단백질, 지방, 탄수화물이 각각 평균 9.17%, 2.54%, 21.69%, 7.96%, 58.64%로 나타났다. 화분의 무기질 조성과 함유량은 K-P-Ca-Na 순으로 분포하였으며, 특히 강원 원주 (B8)에서 수집된 화분의 Ca 함량 (305.37 mg/100 g)은 스페인 (B13) 화분 (64.55 mg/100 g)보다 5배 이상 높은 함량을 나타내었다. 그리고 비타민 C의 함량은 충남 금산 (B12)에서 수집된 화분이 103.38 mg/100 g으로 가장 높은 함량을 나타내었으며 스페인 (B13)에서 수집된 화분 (4.24 mg/100 g) 보다 24배 이상 높은 함량을 나타내었다. 아미노산 조성은 필수 아미노산 8종을 포함한 총 18종의 아미노산이 존재하였으며, 국내산 (B1~B12) 화분은 proline, arginine, glutamic acid, histidine 등의 순으로 분포하였다. 지방산 함량은 필수 지방산인 linoleic acid와 α-linolenic acid가 가장 많이 함유되어 있었으며, 꿀벌의 항생제로 사용되는 oxytetracycline은 15개 화분 시료에서 모두 불검출되었다. 본 연구는 국내 다양한 지역으로부터 화분을 수집하고 이에 대하여 분석함으로써 국내산 화분에 대한 특성 및 영양성분의 우수성을 확인하였다.
Acknowledgments
본 연구는 한국양봉자조금위원회의 지원에 의하여 수행되었으며 이에 감사드립니다.
References
- 김재길, 손재형, (1990), 화분립 파쇄에 따른 이화학적 성분조성의 변화, 한국양봉학회지, 5, p23-30.
- 관세청, (2017), 수출입통계, 대전. 한국.
- 이부용, 최희돈, 황진봉, (1997), 국내산 화분 및 화분 추출물의 성분 분석, 한국식품과학회지, 29, p869-875.
- 유영수, (1998), 동의보감에 나타나는 꽃가루의 효능에 관한 연구, 한국양봉학회지, 3, p26-47.
- 장재선, (2018), 한국 녹차 화분의 화학적 조성과 기능성 연구, 한국식품영양학회지, 30, p89-93.
- 최승윤, (1982), 양봉학, 서울대학교 출판부, 서울.
- 한국식품공전, (2008), 한국식품의약품안전처.
- 한명륜, 이수정, 김명환, (2004), High impact planetary mill 공정을 이용한 송화분의 세포벽 파쇄 기술, 단국대학교 신소재 연구논문집., 12, p43-54.
- 홍인표, 우순옥, 한상미, 김세건, 장혜리, 이만영, 최용수, 김혜경, 이명렬, (2016), 벼화분의 영양학적 가치 및 항산화활성, 한국양봉학회지, 31, p219-225.
- 홍인표, 우순옥, 한상미, 김세건, 장혜리, 최용수, 김혜경, 이명렬, 이만영, (2015), 동결건조를 이용한 다래화분의 영양성분 추출 효과, 한국양봉학회지, 30, p87-94.
- 홍인표, 우순옥, 한상미, 여주홍, 조미란, 주완택, 심하식, 최용수, 김혜경, 이명렬, 이만영, (2014), 도토리화분과 다래화분의 형태 및 항산화 활성, 한국양봉학회지, 29, p137-142.
- 홍인표, 우순옥, 한상미, 이미경, (2017), 메밀화분의 성분 특성 및 항산화 활성, 한국양봉학회지, 32, p261-268.
- 홍인표, 이만영, 우순옥, 심하식, 최용수, 한상미, 김혜경, 변규호, 이명렬, 하남규, (2013), 도토리 화분 (꽃가루)의 물리적 처리에 의한 성분 변화, 한국양봉학회지, 28, p217-221.
-
Aronstein, K. A., and G. W. Hayes, (2004), Antimicrobial activity of allicin against honey bee pathogens, J. Apic. Res., 43, p57-59.
[https://doi.org/10.1080/00218839.2004.11101111]

- Block, G., and L. Langseth, (1994), Antioxidant vitamins and disease prevention, Food Technol., 48, p80-84.
-
Blumfield, M. L., A. J. Hure, L. Macdonald-Wicks, R. Smith, and C. E. Collins, (2013), A systematic review and meta-analysis of micronutrient intakes during pregnancy in developed countries, Nutr. Rev., 71, p118-132.
[https://doi.org/10.1111/nure.12003]

- Das, H., M. Naika, and A. S. Bawa, (2011), Extraction and HPLC determination of oxytetracycline in milk, Hen’s egg and broiler meat, Intl, J. BioRes., 10, p45-52.
- Eguaras, M. J., S. Fuselli, L. Gende, R. Fritz, S. R. Ruffinengo, G. Clement, A. Gonzalez, P. N. Bailac, and M. I. Ponzi, (2005), An in vitro evaluation of Tagetes minuta essential oil for the control of the honeybee pathogens Paenibacillus larvae and Ascosphaera apis, and the parasitic mite Varroa destructor, J. Essent. Oil Res., 17, p336-340.
-
Feás, X., P. M. Vázquez-Tato, L. Estevinho, J.A. Seijas, and A. Iglesias, (2012), Organic Bee Pollen: Botanical Origin, Nutritional Value, Bioactive Compounds, Antioxidant Activity and Microbiological Quality, Mol., 17, p8359-8377.
[https://doi.org/10.3390/molecules17078359]

-
Gardana, C., C. D. Bo, M. C. Quicazán, A. R. Corrrea, P. Simonetti, (2018), Nutrients, phytochemicals and botanical origin of commercial bee pollen from different geographical areas, J. Food Compos. Anal., 73, p29-38.
[https://doi.org/10.1016/j.jfca.2018.07.009]

- Genersch, E., E. Forsgren, J. Pentikainen, A. Ashiralieva, S. Rauch, J. Kilwinski, and I. Fries, (2006), Reclassification of Paenibacillus larvae subsp. pulvifaciens and Paenibacillus larvae subsp. larvae as Paenibacilluslarvae without subspecies differentiation, Int. J. Syst. Evol. Microbiol., 56, p501-511.
- Gollnitz, G., and P. Wiechert, (1967), Brain metabolism and glutamic acid, Padiatr. Grenzgeb., 6, p307-328.
- Herbert Jr., E. W., and H. Shimanuki, (1978), Chemical composition and nutritive value of bee collected and bee stored pollen, Apidologie., 9, p33-40.
- Hussien, E. M., (2013), Development and validation of an HPLC method for tetracycline-related USP monographs, Biomed. Chromatogr., 28, p1278-1283.
- Khadim, M. I., (1981), Oral manifestations of malnutrition I. The effect of vitamins, J. Pak. Med. Assoc., 31, p44-48.
-
Kochansky, J., D. Knox, M. Feldlaufer, and J. Pettis, (2001), Screening alternative antibiotics against oxytetracycline-susceptible and-resistant Paenibacillus larvae, Apidologie., 32, p215-222.
[https://doi.org/10.1051/apido:2001123]

-
Kroyer, G., N. Hegedus, (2001), Evaluation of bioactive properties of pollen extracts as functional dietary food supplement, Innovative Food Sci. Emerging Technol., 2, p171-174.
[https://doi.org/10.1016/s1466-8564(01)00039-x]

-
LeBlanc, B. W., O. K. Davis, S. Boue, A. DeLucca, and T. Deeby, (2009), Antioxidant activity of Sonoran Desert bee pollen, Food Chem., 115, p1299-1305.
[https://doi.org/10.1016/j.foodchem.2009.01.055]

-
Marnett, L. J., (1999), Lipid peroxidation-DNA damage by malondialdehyde, Mutat. Res., 424, p83-95.
[https://doi.org/10.1016/s0027-5107(99)00010-x]

- Miliauskasa, G., P. R. Venskutonisa, and T. A. Beek van, (2004), Screening of radical scavenging activity of some medicinal and aromatic plant extracts, Food Chem., 85, p231-237.
-
Morais, M., L. Moreira, X. Feás, L. M. Estevinho, (2011), Honeybee-collected pollen from five Portuguese Natural Parks: Palynological origin, phenolic content, antioxidant properties and antimicrobial activity, Food Chem. Toxicol., 49, p1096-1101.
[https://doi.org/10.1016/j.fct.2011.01.020]

- Mutinelli, F., (2003), European legislation governing the authorisation of veterinary medical products with particular reference to the use of drugs for the control of honey bee diseases, Apiacta., 38, p156-168.
-
Nogueira, C., A. Iglesias, X. Feás, and L. M. Estevinho, (2012), commercial Bee Pollen with Different Geographical Origins: A Comprehensive Approach, Int. J. Mol. Sci., 13, p11173-11187.
[https://doi.org/10.3390/ijms130911173]

- Padayatty, S. J., A. Katz, Y. Wang, P. Eck, O. Kwon, J. h. Lee, S. Chen, C. Corpe, A. Dutta, S. K. Dutta, and M. Levine, (2003), Vitamin C as Antioxidant: Evaluation of Its Role in Disease Prevention, J. Am. Coll. Nutr., 22, p18-35.
-
Piccini, C., and P. Zunino, (2001), American foulbrood in Uruguay: isolation of Paenibacillus larvae larvae from larvae with clinical symptoms and adult honeybees and susceptibility to oxytretracycline, J. Invertebr. Pathol., 78, p176-177.
[https://doi.org/10.1006/jipa.2001.5055]

- Sakami, W., and H. Harrington, (1963), Amino acid metabolism, Annu. Rev. Biochem., 32, p355-398.
- Serra Bonvehí, J., and R. Escolà` Jordà, (1997), Nutrition composition and microbiological quantity of honeybee-collected pollen in Spain, J. Agric. Food Chem., 45, p725-732.
-
Silva, B. M., P. B Andrade, P. Valentão, F. Ferreres, R. M. Seabra, M. A. Ferreira, (2004), Quince (Cydonia oblonga Miller) fruit (pulp, peel and seed) and jam: antioxidant activity, J. Agric. Food Chem., 52, p4705-4712.
[https://doi.org/10.1021/jf040057v]

- Stanley, R. G., and H. F. Linskens, (1974), Pollen Biology, Chemistry and Management, Springer Verlag, New York.
- Todd, F. E., and O. Bretherick, (1942), The composition of pollens, J. Econ. Entomol., 35, p312-317.
-
Verallo-Rowell, V. M., S. S. Katalbas, and J. P. Pangasinan, (2016), Natural (mineral, vegetable, coconut, essential) oils and contact dermatitis, Curr. Allergy Asthma Rep., 16, p51.
[https://doi.org/10.1007/s11882-016-0630-9]

- Wesh, S. O., and R. M. Marston, (1983), Nutritional Bioavailability of Zin, Washington, D.C., American Chemical Society.
-
Wiseman, H., and B. Halliwell, (1996), Damage to DNA by reactive oxygen and nitrogen species: role in inflammatory disease and progression to cancer, Biochem. J., 313, p17-329.
[https://doi.org/10.1042/bj3130017]

-
Xu, X., L. P. Sun, J. Dong, and H. C. Zhang, (2009), Breaking the cells of rape bee pollen and consecutive extraction of functional oil with supercritical carbon dioxide, Innovative Food Sci. Emerging Technol., 10, p42-46.
[https://doi.org/10.1016/j.ifset.2008.08.004]

-
Yang, K., D. Wu, X. Ye, D. Liu, J. Chen, and P. Sun, (2013), Characterization of Chemical Composition of Bee Pollen in China, J. Agric. Food Chem., 61, p708-718.
[https://doi.org/10.1021/jf304056b]

