국내 선발 서양종 꿀벌 (A. mellifera) 교배종의 로열젤리 생산성과 형태학적 특성
Abstract
We evaluated the productivity of royal jelly (RJ) and morphometric characteristics in cross-bred of honeybees. The present study compared the productivity of RJ of the FD with Jangwon line honeybees. The FD and Jangwon (superior line for honey product) colonies showed high rates of larvae acceptance over 80%. The FD exhibited higher RJ production (316 mg/cup) than Jangwon (269 mg/cup). The FD also produced more RJ per colony than the Jangwon. The RJ produced in FD contained more water, lipid, glucose, and essential amino acids such as valine, isoleucine, lysine than those of RJ in the Jangwon colony. In addition, the 10-hydroxy-2-decenoic acid (10-HDA) content was higher in the FD colony (2.75%) than that of the Jangwon colony (1.89%). According to the morphological measurement, body length, number of hamuli, head width, and femur length showed differences between colonies. The discriminant function analysis revealed that 98.6% of original grouped cases were classified correctly. The results of the present study suggest that the new hybrid FD colony can be expected to have higher production of RJ with a high quality and further research on the honey production is also needed to find the new traits of the FD.
Keywords:
Apis mellifera, Morphometry, Royal jelly, 10-HDA서 론
서양종 꿀벌 (A. mellifera)은 군집을 이루는 사회성 곤충으로 일벌은 연령에 따라 업무분담이 매우 체계적으로 조직화되어 있다 (Michener, 1974). 일벌은 5~15일령에 꿀과 화분을 섭취하여 장내에서 소화·흡수한 후, 머리부의 하이두선 (hypopharyngeal gland)과 큰턱샘 (mandibular salivary gland)에서 점성이 강한 유백색의 크림상 물질인 로열젤리를 분비하여 여왕벌과 어린 일벌의 유충 먹이로 이용된다 (Haydak, 1970). 벌통 내부 일을 하는 어린 일벌의 로열젤리 분비선인 하인두선은 매우 발달하여 있으나, 벌통 밖으로 나가 채집하는 외역일을 하는 일벌들의 하인두선은 크기가 위축되고 로열젤리 대신 α-glucosidase, glucose oxidase 등의 효소를 분비하게 된다 (Lass and Crailsheim, 1996).
로열젤리의 주요성분은 수분 (60~70%), 단백질 (9~18%), 지방 (4~8%), 탄수화물 (11~23%), 비타민, 무기질, 10-hydroxy-2-decenoic acid (10-HDA) 등 다양한 생리활성 물질들이 함유되어 있으며 (Viuda-Martos et al., 2008), 항암작용, 항산화 활성, 혈류개선 등의 효과가 있어 의약품, 건강식품, 화장품 등의 산업에 활용되어 세계적으로 널리 유통되고 있다 (Ramadan and Al-Ghamdii, 2012; Fratini et al., 2016).
중국은 A. mellifera ligustica를 1910년대 일본에서 처음 수입하였으며, 1960년대부터 중국 남동부에 위치한 절강성에서 로열젤리 생산 우수 봉군을 선별하여 계속적으로 육성하여 ‘Zhenongda No.1’을 개발하였다 (Chen et al., 2002). 꿀벌 육종개발을 통해, 중국의 로열젤리 생산량은 1980년대 이후부터 매년 200톤에서 3500톤으로 빠르게 증가하였으며 (ASAC, 2011), 전 세계 로열젤리 유통량의 90% 이상을 차지하고 있다 (Zheng et al., 2011). 또한, 로열젤리 생산량의 절반 정도를 미국, 일본, 유럽 등의 나라로 수출하고 있다.
로열젤리 생산성 우수계통 꿀벌의 유전적 특성을 규명하기 위하여 형태학적, 세포학적, 그리고 생화학적 마커 등을 활용한 다양한 유전체 정보, 단백질 유전정보, 생태학적 정보 등이 보고되고 있다 (Chen and Li, 2009; Nie et al., 2017).
최근 농촌진흥청과 예천곤충 연구소에서 삼원교배종의 수밀력이 우수한 꿀벌계통을 육성하여 ‘장원벌’이라는 신품종을 개발하여 양봉농가에 보급하였다 (Lee et al., 2014). 또한, Kim et al. (2017)은 장원벌의 계통판별과 육종에 활용할 수 있는 유전자 마커를 개발하기 위하여 Single Nucleotide Polymorphism (SNP) 분석을 통해 장원벌 부계계통을 100% 구분할 수 있는 마커 AmD9을 개발하였다.
국내에서 로열젤리 생산성 우수계통 육성에 관한 연구는 Kim et al. (2017)이 서양종 꿀벌 (A. mellifera) 순계 2 계통에 대한 로열젤리 생산성과 하인두선에서 분비하는 Major Royal Jelly Protein (MRJP)의 발현량을 비교하는 연구를 처음 보고하였으나, 계속적인 육종연구가 필요한 실정이다.
본 연구는 로열젤리 생산성 우수 계통을 선별하기 위하여 국내에서 보존·육성 중인 서양종 꿀벌 (A. mellifera) 계통 중 황색계 F 계통과 흑색계 D 계통을 교배한 FD의 로열젤리 생산성을 평가하기 위하여 장원벌과 비교하였다.
재료 및 방법
실험봉군 구성
로열젤리 생산성 우수품종 개발을 위하여 국립농업과학원 꿀벌육종실에서 보존·육성 중인 서양종 꿀벌 (A. mellifera) 계통 중 F 계통 (황색계)과 D 계통 (흑색계)을 교배한 FD을 실험군으로 하였다. 대조군은 수밀력이 우수한 장원벌을 사용하였다. 각각의 시험봉군은 활성이 우수한 봉군으로 3개씩 구성하였다.
로열젤리 생산성 평가
교배조 FD의 로열젤리 생산성을 평가하기 위하여 각각의 봉군을 단상 6매, 계상 5매의 벌로 봉세를 일정하게 보정한 후, 2주간 유지시켰다. 부화한 지 24시간 이내의 유충을 인공여왕벌방 (왕안)에 이충한 후, 72시간 봉군에서 생산한 로열젤리의 무게를 측정하였다. 로열젤리 생산틀은 1봉군당 66개의 왕완을 사용하였고, 접수율은 왕안에 로열젤리가 정상적으로 분비된 방을 계수하여 계산하였다. 로열젤리 생산은 9월 10일부터 10월 8일까지 8회 실시하였다.
로열젤리의 이화학적 성분분석
로열젤리의 수분함량은 105℃ 상압가열건조법, 조지방 함량은 에테르 추출법을 이용하여 분석하였다. 단백질은 Semimicro-Kjeldahl 법으로 분해한 후, 자동단백질 분석 장치 (Kjeltec 8400, FOSS, Sweden)를 이용하여 증류, 적정과정을 거쳐 분석하였다. 당류분석은 HPLC (Nanospace SI-2, Shiseido, Japan)를 이용하여 RI detector (RI-201H, Shodex, Japan)로 분석하였다. 아미노산은 이온교환 크로마토그래피법을 이용한 Ninhydrin 반응법으로 분석하였다. 아미노산의 분석조건은 Table 1에 나타내었다.
10-HDA 분석
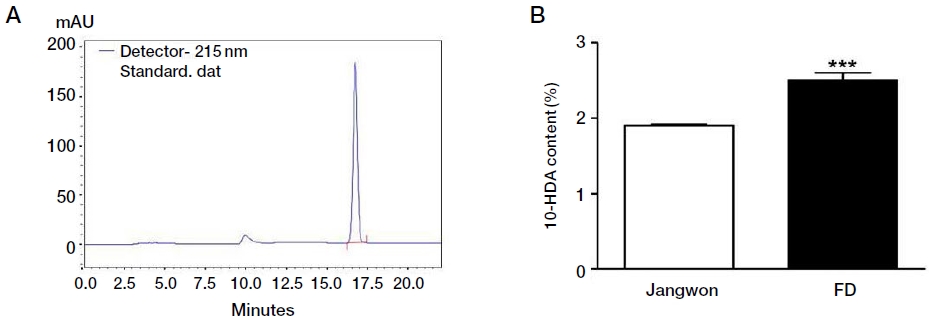
로열젤리 1 g에 메탄올 40 mL을 넣고 sonicator를 이용하여 30분간 추출한 후, 0.2 μm syring filter로 여과하여 10배 희석하여 시료로 사용하였다. 10-HDA 표준품 (Nacalai tesque, Japan)은 메탄올에 녹여 농도별로 희석하여 HPLC (Shiseido SP20, Japan)를 이용하여 표준검량곡선을 작성한 후 시료의 10-HDA 함량을 계산하였다. HPLC 분석조건은 C18 컬럼 (Shiseido Capcell PaK C18 UG120, 5 μm, 4.5×250 mm)을 장착하여 유속 0.6 mL/min, 시료 주입량 5 μL, 컬럼온도 40℃, 검출파장 215 nm로 설정하였고, 물과 메탄올을 50 : 50으로 혼합한 용액을 이동상으로 하여 23분간 분석하였다 (Retention time 17 min).
꿀벌의 형태학적 분석
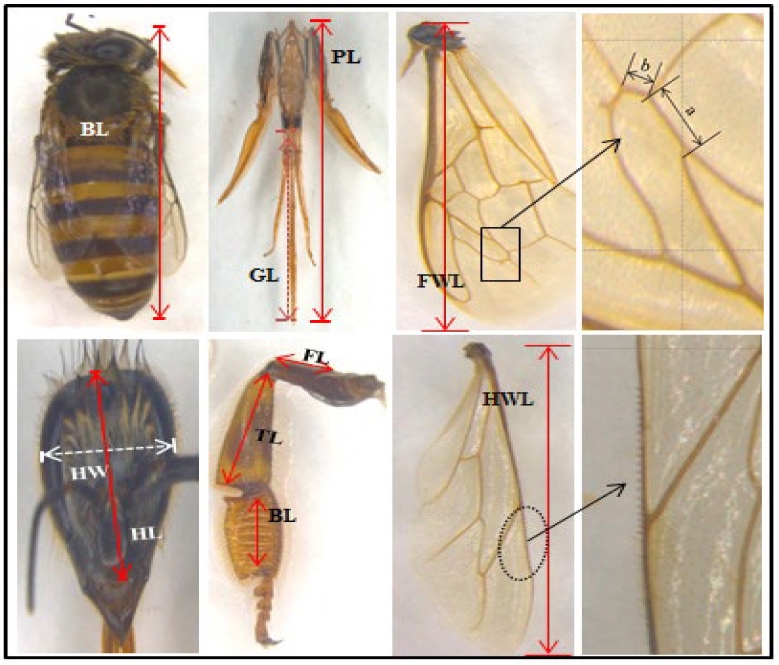
꿀벌의 형태학적 특성을 분석하기 위하여 각각의 실험봉군에서 35마리의 일벌을 채집하여 이산화탄소로 마취한 후, 70% 에탄올 용액에 보관하였다. Ruttner (1988)의 방법을 참고하여 꿀벌의 각 부위를 Fig. 1과 같이 적출하여 현미경이미지 프로그램 (Leica LAS V. 4.10)을 이용하여 크기를 측정하였다. 꿀벌의 화분바구니면적 (corbicular area)은 Milne and Pries (1984)의 방법을 따라 계산하였다.
통계분석
통계처리는 IBM SPSS ver. 25.0을 이용하였다. 그룹간의 평균비교는 독립표본 t-Test로 분석하여 p<0.05에서 유의성을 검정하였다.
결과 및 고찰
로열젤리 접수율 및 생산량
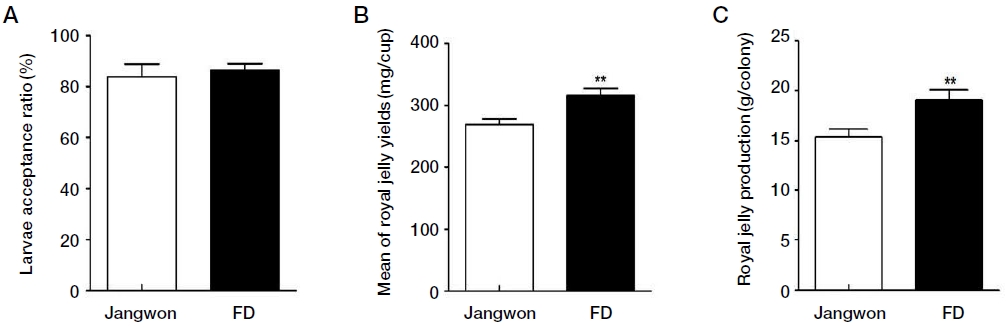
농촌진흥청 국립농업과학원에서 보존·육성 중인 서양종 꿀벌 황색계통과 흑색계통의 교배조 FD와 삼원교배종인 장원벌을 대조군으로 하여 로열젤리 생산평가를 실시하였다. 실험봉군의 로열젤리 접수율과 로열젤리 생산량은 Fig. 2에 나타내었다. 로열젤리 평균 접수율은 장원벌 83.8%, 교배조 FD 86.4%로 높은 접수율을 나타냈으며, 그룹 간 차이는 없었다 (Fig. 2A). 1왕대 당 생산한 로열젤리의 평균 수거량은 교배조 FD가 316 mg/cup으로 장원벌 269 mg/cup 보다 17.4% 증가되었다 (Fig. 2B, p<0.01). 각 실험봉군의 벌통에서 생산하는 로열젤리의 전체 생산량은 장원벌 15.4 g/colony, 교배조 FD 17.6 g/colony로 교배조 FD에서 로열젤리 생산량이 유의적으로 증가하였다 (p<0.01).
로열젤리의 이화학적 성분
각 봉군에서 생산한 로열젤리의 이화학적 성분분석 결과를 Table 2에 나타내었다. 로열젤리의 수분함량은 장원벌이 62.48±0.41%로 교배조 FD 66.84±3.15% 보다 유의적으로 낮았다 (p<0.001). 로열젤리는 수분함량 (60% 이상)과 수분활성도 (water activity)가 0.92 이상으로 높지만, 미생물에 대한 안정성은 매우 높다 (Sabatini et al., 2009). 로열젤리 단백질 중 90% 이상이 수용성 단백질이며, 기능성 펩타이드와 9개의 주요 로열젤리 단백질 (major royal jelly proteins, MRJPs)로 구성되었다. MRJPs는 꿀벌유충의 질소원으로 사용되고, 항미생물 작용으로 유충을 보호하며 (Christian, 2018), 면역작용, 항염증효과, 항암효과, 항산화 활성 등 다양한 생리활성을 갖는다 (Ramanathana et al., 2018).
로열젤리의 지방함량은 장원벌 1.53±0.33%, 교배조 FD 4.47±0.28%로 교배조 FD에서 생산한 로열젤리가 장원벌의 로열젤리보다 현저히 높은 지방을 함유하였다 (p<0.001). 로열젤리의 당류, fructose, glucose, sucrose를 분석한 결과, 교배조 FD에서 생산한 로열젤리의 glucose 함량이 장원벌에서 생산한 로열젤리보다 1% 정도 함량이 높았으며 (p<0.001), sucrose 함량은 장원벌에서 생산한 로열젤리가 5.46±0.04%로 교배조 FD에서 생산한 로열젤리의 sucrose 함량 (1.38±0.29%)보다 유의적으로 높았다 (p<0.001). 두 실험봉군에서 생산한 로열젤리의 이화학적 성분은 ISO 국제표준화기구에서 규정하는 범위를 충족하였으나, 장원벌에서 생산한 로열젤리는 식품의약품안전처에서 규정하는 식품규격 중 수분함량 (65.5~68.5%)의 기준에는 미치지 못하였다 (Kanelis et al., 2015).
로열젤리의 아미노산 함량
각 봉군에서 생산한 로열젤리의 유리아미노산 15종을 분석하여 Table 3에 나타내었다. 로열젤리의 아미노산 분석결과, 검출량이 많은 아미노산은 asparate, glutamate, leucine, lysine 순으로 나타났다. 필수아미노산 valine, isoleucine, lysine은 교배조 FD에서 유의적으로 함량이 높았으며 (p<0.05), tyrosine의 함량도 교배조 FD에서 높게 나타났다 (p<0.001). 로열젤리는 저장기간 동안 methionine과 glutamine의 함량이 현저히 감소되어 로열젤리의 품질평가 지표로 활용될 수 있다 (Wu et al., 2009).
10-HDA 함량
로열젤리에 함유된 특이 지방산인 10-HDA는 로열젤리와 로열젤리 함유식품의 품질평가 지표물질로 이용되고 있다 (Bloodworth, et al., 1995). HPLC분석조건에서 로열젤리의 10-HDA는 17분에 검출되었다 (Fig. 3A). ISO 국제표준화기구에서 규정하는 로열젤리의 10-HDA 함량기준은 1.4% 이상이다 (Kanelis et al., 2015). 각 실험봉군에서 생산한 로열젤리의 10-HDA 함량은 장원벌 1.89%, 교배조 FD 2.75%이었으며, 교배조 FD에서 생산한 로열젤리의 10-HDA 함량이 현저히 높은 것을 확인할 수 있었다 (p<0.001).
형태학적 특성 분석
장원벌과 교배조 FD의 형태학적 특성을 측정하여 12가지 항목을 Table 4에 나타내었다. 장원벌은 몸길이, 머리길이, 훅개수가 교배조 FD보다 유의적으로 길었으며, 교배조 FD는 머리폭, 넓적다리 길이가 장원벌보다 길었다 (p<0.05). 화분채집 공간인 corbicular area는 그룹 간 통계적 유의성은 나타나지 않았다. 꿀벌의 수밀력은 몸길이와 corbicular area와 양의 관계를 갖는다고 보고된 바 있어 (Milne and Pries, 1984), 교배조 FD의 수밀력을 장원벌과 비교하여, 로열젤리 생산성뿐 아니라, 수밀력에 대한 평가자료를 확보하는 것이 필요할 것으로 사료되어진다.
형태분석 항목을 이용하여 실험봉군의 판별분석 (discriminant analysis)을 실시하였다. Table 5에 나타난 바와 같이, 원래 집단에서 98.6%가 올바르게 분류되었다. 장원벌은 100% 정확하게 분류되었고, 교배조 FD는 34마리 중 1마리 (2.9%)가 장원벌로 분류되어 97.1%의 정확도로 분류되었다.
적 요
로열젤리 생산성 우수 계통을 선별하기 위하여 국내에서 보존·육성 중인 서양종 꿀벌 순계계통 중 F 계통과 D 계통을 교배한 FD의 로열젤리 생산성을 장원벌과 비교하였다. 80% 이상의 높은 접수율을 보인 가운데, 1왕대 당 로열젤리 생산량은 교배조 FD 316 mg/cup으로 장원벌 269 mg/cup 보다 17.4% 증가하였다. 봉군의 로열젤리 생산량은 교배조 FD가 17.6 g/colony, 장원벌 15.4 g/colony로 교배조 FD의 로열젤리 생산량이 높았다. 교배조 FD에서 생산한 로열젤리의 수분, 지방, glucose, 필수아미노산인 valine, isoleucine, lysine의 함량이 장원벌에서 생산한 로열젤리보다 높게 나타났다. 로열젤리의 지표성분으로 활용되는 10-HDA 함량도 FD 계통 2.75%, 장원벌 1.89%로 교배조 FD가 현저히 높았다. 수밀력이 우수한 장원벌과 교배조 FD의 형태를 비교분석한 결과, 몸길이, 훅개수는 장원벌이 높았으며, 머리폭, 대퇴골 길이는 교배조 FD가 길었다. 본 연구에서 새로 개발한 교배조 FD는 로열젤리 생산성이 우수하고, 고품질 로열젤리 생산이 가능한 것으로 나타났다.
Acknowledgments
본 연구는 농촌진흥청 기관고유사업 (PJ012036012018) 지원에 의해 이루어진 것입니다.
References
- Apicultural Science Association of China, (2011), China’s bee products market review of 2010 and prospect for 2011, ASAC, Beijing, China.
- Bloodworth, B. C., C. S. Harn, and C. T. Hock, (1995), Liquid chromatographic determination of trans-10-hydroxy-2-decenoic acid content of commercial products containing royal jelly, J. AOAC Int., 78, p1019-1023.
-
Chen, J., and J. K. Li, (2009), Comparative analyses of proteome complement between worker bee larvae of high royal jelly producing bees (A. m. ligustica) and carniolian bees (A. m. carnica), Agric. Sci. China, 8, p1219-1227.
[https://doi.org/10.1016/s1671-2927(08)60332-6]

-
Chen, S., S. Sum, and X. Lin, (2002), An introduction to high-yielding royal jelly production methods in China, Bee World, 83, p69-77.
[https://doi.org/10.1080/0005772x.2002.11099543]

- Christian, W. W. Pirk, (2018), Honeybee evolution: Royal jelly proteins helps queen larvae to stay on top, Curr. Biol., 28, pR342-R366.
-
Fratini, F., G. Cilia, S. Mancini, and A. Felicioli, (2016), Royal Jelly: An ancient remedy with remarkable antibacterial properties, Microbiol. Res., 192, p130-141.
[https://doi.org/10.1016/j.micres.2016.06.007]

- Haydak, M. H., (1970), Honey bee nutrition, Ann. Rev. Entomol., 15(1), p143-156.
- Kanelis, D., C. Tananaki, V. Liolios, M. Dimou, G. Goras, M. A. Rodopoulou, E. Karazafiris, and A. Thrasyvoulou, (2015), A suggestion for royal jelly specifications, Arh. Hig. Rada. Toksikol., 66, p275-284.
-
Kim, H. K., M. L. Lee, M. Y. Lee, and Y. S. Choi, (2017), Identification of a single nucleotide polymorphism (SNP) marker for the detection of enhanced honey production in honeybee, J. Apicult., 32, p147-154.
[https://doi.org/10.17519/apiculture.2017.09.32.3.147]

- Lass, A., and K. Crailsheim, (1996), Influence of age caging upon protein metabolism, hypopharyngeal glands and trophallactic behavior in the honeybee (Apis mellifera L.), Insect. Soc., 43, p347-358.
-
Lee, M. L., M. Y. Lee, H. S. Sim, Y. S. Choi, H. K. Kim, G. H. Byoun, I. S. Kim, and C. R. Kwon, (2014), Characteristics of superior triple crossed honeybee (Apis mellifera L.): Honey collection, hibernation, hygienic behavior, J. Apicult., 29, p257-262.
[https://doi.org/10.17519/apiculture.2014.11.29.4.257]

- Michener, C. D., (1974), The Social Behavior of the Bees, Harvard University Press, Cambridge, Massachusetts.
-
Milne, C. P. Jr., and K. J. Pries, (1984), Honeybee corbicular size and honey production, J. Apic. Res., 23, p11-14.
[https://doi.org/10.1080/00218839.1984.11100601]

-
Nie, H., X. Liu, J. Pan, W. Li, Z. Li, S. Zhang, S. Chen, X. Miao, N. Zheng, and S. Su, (2017), Identification of genes related to high royal jelly production in the honey bee (Apis mellifera) using microarray analysis, Genet. Mol. Biol., 40, p781-789.
[https://doi.org/10.1590/1678-4685-gmb-2017-0013]

-
Ramadan, M. F., and A. Al-Ghamdi, (2012), Bioactive compounds and healthpromoting properties of royal jelly: A review, J. Funct. Foods, 4, p39-52.
[https://doi.org/10.1016/j.jff.2011.12.007]

- Ramanathana, A. N. K. G., A. J. Naira, and V. S. Sugunan, (2018), A review on royal jelly proteins and peptides, J. Funct. Foods, 44, p255-264.
- Ruttner, F., (1988), Biogeography and taxonomy of honey bees, p251, Springer-Verlag.
-
Sabatini, A. G., G. L. Marcazzan, M. F. Caboni, S. Bogdanov, and L. B. Almeida-Murandian, (2009), Quality and standardisation of royal jelly, J. ApiProd. ApiMed. Sci., 1, p1-6.
[https://doi.org/10.3896/ibra.4.01.1.04]

-
Viuda-Martos, M., Y. Ruiz-Navajas, J. Fernández-López, and J. A. Pérez-Álvarez, (2008), Functional properties of honey, propolis, and royal jelly, J. Food Sci., 73, pR117-R124.
[https://doi.org/10.1111/j.1750-3841.2008.00966.x]

- Wu, L., Zhou, J., Xue, X., Li, Y., and Zhao, J., (2009), Fast determination of 26 amino acids and their content changes in royal jelly during storage using ultra-performance liquid chromatography, J. Food Comp. Anal., 22, p242-249.
-
Zheng, H. Q., W. T. Wei, and F. L. Hu, (2011), Beekeeping industry in China, Bee World, 88, p41-44.
[https://doi.org/10.1080/0005772x.2011.11417406]