
실내 월동 온도 조건에 의한 양봉꿀벌의 월동 능력과 면역 관련 유전자 발현 분석
Abstract
Honey bees, Apis mellifera, in Korea experience every four seasons. They respond to each season with different strategies to maintain their colony in ideal condition. Winter is the most harsh season to honey bees but they should endure the cold weather for the next year’s life. Attempt to overwinter indoor already have been made but the detailed information is still lacking. To understand the honey bee physiology according to the wintering temperature, we placed the colonies in the two different regions (inland and island) and warehouses where the temperatures are different (1°C and 4°C) for wintering. The colonies wintering in 4°C and 1°C warehouse showed less decreased rate of the colony weight (10.71~13.19%) than that of the colonies wintering in outdoor (13.93~14.63%). Transcriptional expression pattern of the immune-related genes in honey bee during winter season was investigated. Most of the cellular and humoral immune-related genes down-regulated during wintering season and up-regulated after wintering is over. On the other hand, expression of the defensin 1 was gradually up-regulated during wintering season and down-regulated after wintering is over.
Keywords:
Honey bee, Apis mellifera, Wintering, Immune-related gene서 론
꿀벌은 전 세계적으로 다양한 양봉 산물의 제공과 더불어 약 75%에 해당하는 경제 작물의 화분 매개를 담당하는 인류에게 매우 중요한 곤충 자원이며 국내에서도 지속적으로 양봉 농가의 수가 증가하고 있다. 해충 및 질병의 발생, 기후 변화 등에 의한 봉군의 피해는 매년 농가에 피해를 유발하기 때문에 봉군 피해 감소를 위하여 먹이, 온도, 습도, 해충, 질병 등 봉군의 생태와 관련된 요인에 대한 다양한 관리법들이 개선 및 개발되고 있다. 봉군 관리 기술은 꿀 채취, 로열젤리 채취, 꽃가루 채취, 여왕벌 생산 등 각각의 목적에 최적화된 봉군 상태 유지에도 필요하지만, 이를 위해서는 기본적으로 최상의 봉군 상태 유지를 위한 계절별, 상황별 사육 기술이 바탕이 되어야 한다. 사계절이 뚜렷한 국내의 기본적 봉군 관리를 위한 주요 행사로는 월동 (11월~2월), 봄 벌 깨우기 (1~2월), 혹서기 (7월~8월), 월동 준비 (10~11월)가 있다. 이 중에서도 대부분의 지역에서 영하권의 기온을 보이는 겨울 시기를 버티는 월동은 꿀벌의 생활사에서 매우 중요한 행사이다.
꿀벌의 월동에 있어 가장 중요한 요소는 온도이다. 월동기간 동안 벌들은 봉군 내에 서로 빼곡히 모여 봉구를 형성하고 열을 발생하여 30℃ 이상의 온도를 유지한다 (Southwick, 1985; Stabentheiner et al., 2010). 봉구는 외부의 기온에 따라 신축하게 되는데, 이상 기후 현상에 의하여 단기간 내에 오르내리는 기온 변화는 봉구를 다발적으로 신축하게 하고 봉군 폐사의 확률을 높인다. 항온 저온 시설을 이용한 꿀벌의 월동은 봉구의 신축을 최소화하여 월동기간 봉군의 열손실을 감소할 수 있고, 이는 일벌의 개체수 유지에 도움이 될 것으로 생각된다. 월동기간 개체군이 높은 밀도로 유지된 봉군은 새로운 한 해를 위한 일벌의 육아 및 먹이 활동을 안정적으로 수행하여 세력이 강한 봉군으로 성장하고, 결과적으로 한 해의 양봉 농사를 결정 짓는 요인으로 작용할 수 있기 때문에 항온 저온 창고를 이용한 실내 월동의 필요성이 대두되고 있다. 봉군 외부 온도 변화 정도를 감소시킬 수 있는 저온창고 내 월동법이 고안되었지만 (최 등, 2001) 현재까지 온도, 습도 등의 요인에 대한 연구는 부족한 실정이다.
곤충은 후천 면역 시스템 (Adaptive immune system) 없이 잘 발달한 세포성 면역 (Humoral immunity)과 체액성 면역 (Cellular immunity)으로 구성된 내재 면역 시스템 (Innate immune system)으로 기생충, 바이러스, 박테리아 등에 대응한다 (Lavine and Strand, 2002; Evans et al., 2006).
곤충의 내재 면역 시스템 중 체액성 면역은 외부 침입 물질에 다양하게 반응하는 Toll, immune deficiency (IMD), c-Jun N-terminal kinases (JNK) and Janus kinase-signaling transducer and activator of transcription (JAK/STAT) pathway에 의하여 조절되고, defensin 1 (Def1)과 hymenoptaecin과 같은 항생물질의 발현을 담당한다 (Evans et al., 2006).
세포성 면역은 혈구 (Haemocytes)에 의하여 조절되며 phagocytosis, nodulation, encapsulation과 같은 반응을 한다 (Strand and Pech, 1995). Nodulation과 encapsulation은 melanization을 수반하는데 (Söderhäll and Cerenius, 1998) pro-phenoloxidase (PPO)가 촉매 역할을 한다 (Shiao et al., 2001; Lourenço et al., 2005).
꿀벌은 초봄부터 늦여름 사이에 태어나 내역과 외역을 담당하며 약 30~40일을 사는 여름벌 (Summer bees)과 늦여름부터 초가을 사이에 태어나 겨울을 보내는 동안 봉군 내부의 온도를 유지하고 새로운 봄을 맞이하여 육아를 담당하며 약 80~160일을 생존하는 겨울벌 (Winter bees)이 각각 다른 생리적 특징으로 서로 다른 계절을 담당한다 (Maurizio and Hodges, 1950; Fukuda and Sekiguchi, 1966; Mattila et al., 2001). 겨울을 생존하기 위한 꿀벌의 전략으로 대부분의 생리 활성을 떨어뜨리고, Def1, PPO, eater 등 대부분의 면역관련 유전자 역시 겨울벌에서 여름벌보다 발현이 억제된다 (Steinmann et al., 2015).
Juvenile hormone (JH)과 Vitellogenin (Vg)은 꿀벌 생리에 중요한 역할을 담당한다. 꿀벌 JH 발현의 증가는 Vg 발현을 억제하고 (Pinto et al., 2000; Amdam et al., 2005), 이들의 상호 보완적인 조절은 꿀벌의 생식, 계급 분화, 수명, 발달, 행동 등과 관련이 있으며 꿀벌의 나이와 계절벌에 따라서 발현의 차이가 나타난다 (Engels et al., 1990; Huang and Robinson, 1995; Amdam et al., 2003a; Amdam et al., 2003b; Corona et al., 2007; Steinmann et al., 2015).
본 연구에서는 항온 저온 창고를 활용한 양봉꿀벌 (Apis mellifera) 월동의 이점을 확인하고자, 항온 저온 창고 내에서 실내 월동한 봉군 및 노지에서 야외 월동한 봉군의 무게를 조사하여 월동 능력을 비교하였다. 또한 각 월동 조건별 봉군의 생리 상태를 비교하기 위해서 월동기간 중 꿀벌 시료를 채집하였고 면역 관련 유전자의 발현을 비교하였다.
재료 및 방법
1. 꿀벌 월동 지역 선정
항온 저온 창고 월동은 위도 꿀벌 격리 육종장 (전라북도 부안군 위도면; GPS: 35.591300, 126.279048)의 저온 창고를 이용하였고, 대조군인 야외 월동 지역으로는 위도 꿀벌 격리 육종장과 국립농업과학원 양봉장 (전라북도 완주군 이서면; GPS: 35.829912, 127.039290)으로 선정하였다.
2. 월동 봉군 및 조건
저온 창고 및 야외 월동 지역별 각각 소비 5~6매로 세력이 유사한 일곱 개의 봉군이 사용되었다. 위도 꿀벌 격리 육종장의 저온 창고에서 각각 1℃, 4℃의 온도와 상대습도 약 55~60%의 조건으로 월동하였다. 저온 창고 및 야외 월동 봉군 모두 2020년 11월 24일부터 2021년 3월 2일까지 총 99일 동안 월동을 하였다.
3. 월동 중 봉군별 일벌 시료 채집 및 봉군 무게 조사
월동기간 중 약 2주에 한 번 봉군의 무게를 기록하였고, 봉군별 일벌 시료를 채집하여 -80℃ 급속냉동고에 보관하였다.
4. 유전자 발현 비교를 위한 real-time PCR
각 유전자의 전사체 발현 정도를 측정하기 위하여 qPCR을 수행하였다. 조건별 채집 일벌 샘플 50마리를 막자사발과 액체질소를 이용하여 균질화하고 RNA extraction kit (QIAGEN, Hilden, Germany)로 total RNA를 추출하였다. 잔여 genomic DNA 제거를 위하여 추출한 total RNA에 DNaseI (TAKARA Korea Biomedical Inc., Seoul, Korea)을 처리하였다. 이 후 2.5 μg의 total RNA를 amfiRivert Platinum cDNA synthesis enzyme (GenDEPOT, TX, USA)로 cDNA 합성에 사용하였다.
실험에 사용한 꿀벌 면역 유전자로 catalase (NM_0011 78069.1), superoxide dismutase (Sod, NM_001178027.1), PPO (AY242387.2), Def1 (NM_001011616.2), defensin 2 (Def2), hymenoptaecin (U15956.1), abaecin (NM_0010 11617.1), apidaecin을, 수명 관련 유전자는 Vg 그리고 JH 발현의 지표가 되는 methyl farnesoate epoxidase (mfe, XM_623572)를 사용하였다.
각 유전자 특이적인 PCR primer를 합성하여 qPCR에 사용하였다 (Table 1). qPCR에는 AccuPower 2X GreenStar qPCR Master Mix (BIONEER, Daedeok, Korea)를 사용하였고, 95℃ 10분, 40 반복의 95℃ 15초, 58℃ 1분의 온도 프로그램으로 QuantStudio5 (Thermo Fisher Scientific, MA, USA)에서 유전자의 증폭이 수행되었다. Reference 유전자로 actin related protein 1 (ARP1, NM_001185146.1)을 사용하였다.
5. 통계분석
그룹 간의 평균 봉군 무게 비교를 위하여 Prism 6.0 (GraphPad, SanDiego, USA) 프로그램으로 각 그룹별 채집한 샘플에 대하여 t 검정 (T-test)으로 분석하였고 p<0.05에서 유의성을 검정하였다.
결 과
1. 월동 조건별 봉군의 무게 변화
월동 지역 및 실내 월동 온도에 따라 월동기간 중 봉군의 상태 변화를 판단하기 위하여 봉군 무게를 측정하였다. 4℃ 저온 창고에서 월동한 봉군은 월동 전 평균 19.97±1.51 kg에서 월동 후 평균 17.83±1.38 kg으로 (t(12)=2.8, p=0.017) 평균 2.14±0.3 kg이 감소하여 10.71%의 무게 감소율을 보였다 (Fig. 1). 1℃ 저온 창고에서 월동한 봉군은 월동 전 평균 18.84±1.38 kg에서 월동 후 평균 16.35±1.39 kg으로 (t(12)=3.4, p=0.0057) 평균 2.49±0.17 kg이 감소하여 13.19%의 무게 감소율을 보였다 (Fig. 1). 저온 창고 월동의 대조군인 실외 월동 실험군 중 국립농업과학원 양봉장 (전북 완주군 이서면)에서 월동한 봉군은 월동 전 평균 19.20±1.16 kg에서 월동 후 평균 16.39±1.02 kg으로 (t(12)=4.8, p=0.0004) 평균 2.81±0.76 kg이 감소하여 14.63%의 무게 감소율을 보였으며 위도 꿀벌 격리육종장 (전북 부안군 위도면)에서 월동한 봉군의 경우 월동 전 평균 20.22±1.15 kg에서 월동 후 평균 17.41±1.14 kg으로 (t(12)=4.6, p=0.0006) 평균 2.82±0.36 kg이 감소하여 13.93%의 무게 감소율을 보였다 (Fig. 1). 종합하면 야외 (완주, 위도) 월동 봉군과 1℃ 저온 창고 월동 봉군의 무게 감소율은 순서대로 14.63%, 13.93%, 13.19%로 유의미한 차이를 보이지 않았지만, 4℃ 저온 창고 월동 봉군의 월동 중 무게 감소율은 10.71%로 다른 월동 시험군 대비 유의미하게 낮은 무게 감소율을 보였다.
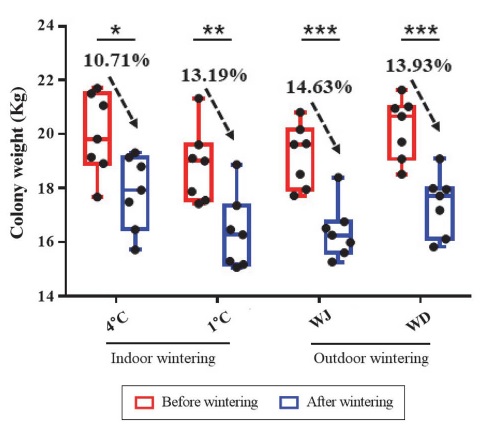
Changes of the honey bee colony weight during wintering depending on the wintering condition. Colonies weight were measured before wintering (Nov. 24, 2020) and after wintering (Mar. 02, 2021). 4℃: Honey bees wintering in the warehouse where the temperature is 4°C. 1°C: Honey bees wintering in the warehouse where the temperature is 1°C. WJ: Honey bees wintering in Jeollabuk-do Wanju-gun. WD: Honey bees wintering in Wido island. Statistics performed by unpaired t-test, comparing each group of colony weights measured before wintering to that of measured after wintering. *p>0.05, **p>0.01, ***p>0.001.
2. 월동 조건별 꿀벌 면역 및 수명 관련 유전자 발현 변화
월동 조건에 따른 꿀벌 봉군 면역력을 판단하기 위하여 월동기간별 일벌의 주요 면역 관련 유전자의 상대적 발현양을 비교하였다.
세포성 면역 시스템에 관여하는 sod, catalase, PPO 전사체의 발현은 월동 중 억제되었고, 월동 종료 후 약 2주가 지난 시점에서 재발현 되었다 (Fig. 2).
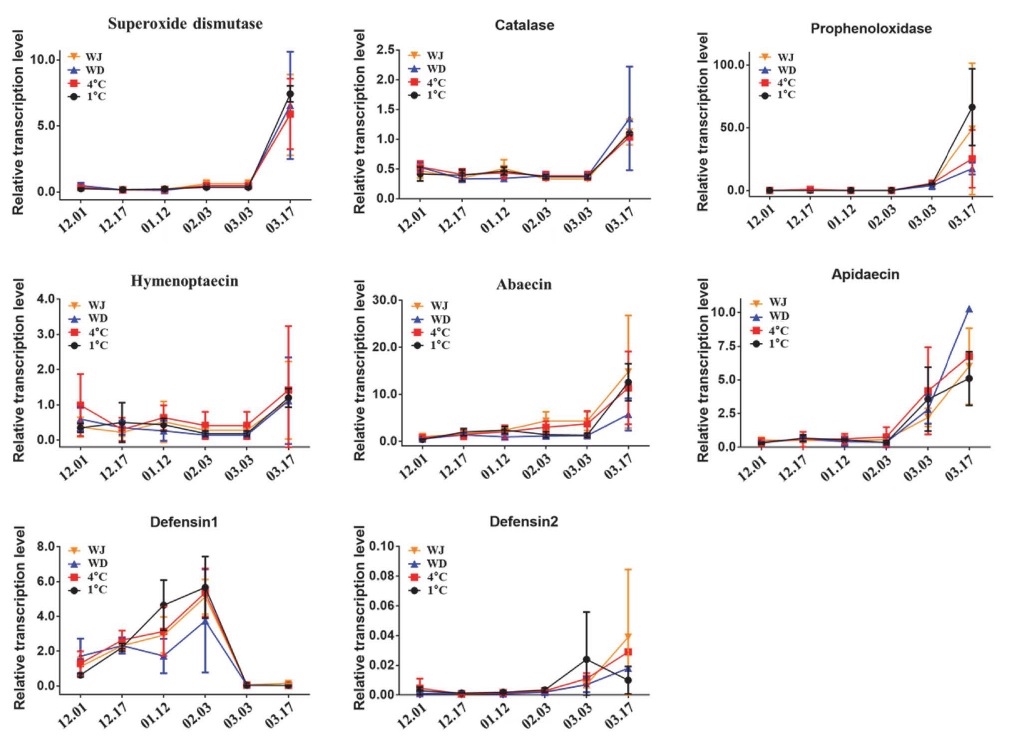
Transcriptional expression level of honey bee immune-related genes. X-axis is the sample collection dates during the winter season of 2020~2021. WJ: Honey bees wintering in Jeollabuk-do Wanju-gun. WD: Honey bees wintering in Wido island. 4°C: Honey bees wintering in the warehouse where the temperature is 4°C. 1°C: Honey bees wintering in the warehouse where the temperature is 1°C.
혈림프 활성 (Hemolymph activity)을 갖는 항균 펩티드 (Antimicrobial peptide; AMPs)의 경우 Def1을 제외한 나머지 펩티드의 유전자인 Def2, Hymenoptaecin, Abaecin, Apidaecin의 발현이 월동 중 억제되었으며 월동이 종료되는 3월경 재개되었다. Def1은 월동 중 발현이 점차적으로 증가한 뒤 월동이 종료되는 3월부터 발현이 억제되며 다른 항균 펩티드의 발현과 반대되는 패턴을 보였다 (Fig. 2).
꿀벌의 수명과 관련있는 Vg 전사체는 월동 중 오르내리는 발현 패턴을 보였으며 월동이 종료되는 3월에 발현이 억제되었다. 꿀벌 JH의 발현을 나타낼 수 있는 대체 유전자인 mfe 전사체의 발현은 Vg와 반대로 월동 중 억제상태를 유지한 뒤 월동이 끝나는 3월에 발현을 재개하였다 (Fig. 3).
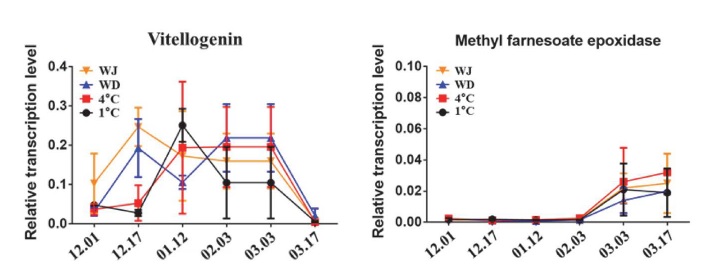
Transcriptional expression level of the honey bee lifespan-related genes. X-axis is the sample collection dates during the winter season of 2020~2021. WJ: Honey bees wintering in Jeollabuk-do Wanju-gun. WD: Honey bees wintering in Wido island. 4°C: Honey bees wintering in the warehouse where the temperature is 4°C. 1°C: Honey bees wintering in the warehouse where the temperature is 1°C.
고 찰
1. 월동 조건별 봉군의 무게 변화
월동기간 꿀벌은 열 손실을 최소화하고 온도를 유지하기 위하여 봉구를 형성한다. 월동기 봉군 중심부의 온도는 최저 약 12℃, 최고 약 33.5℃를 오가며 평균 약 21.3℃의 온도를 유지하는데, 이때 봉구를 형성하여 열 손실을 최소화하고 (Southwick, 1985) 근육을 떨어 열을 발생한다 (Stabentheiner et al., 2010). 외부 온도의 변화가 심하면 봉구의 수축과 이완의 반복이 증가하여 월동을 위한 열 유지에 어려움을 겪게 된다 (Fahrenholz et al., 1989). 외국의 실외 월동 봉군 폐사율이 약 8~22%로 보고된 바 있으며 (Pederson et al., 1996), 국내에서도 지역별 차이가 있었으나 10~15%의 월동기 폐사율이 조사되었다 (최 등, 1999). 실내 월동 봉군의 폐사율은 실외 월동 봉군의 폐사율보다 약 10%가 낮은 것으로 확인되었지만 항온 조절 장치 없이 2~9℃ 사이를 오가는 실내에서 수행된 결과였다 (최 등, 1999). 본 연구에서는 항온 조절 장치가 있는 실내 저온 창고를 이용하였고 1℃ 및 4℃에서 월동한 봉군의 무게 변화율을 비교한 결과 각각 13.19%, 10.71%로 4℃의 항온 저온 창고에서 월동한 봉군의 무게 감소율이 1℃의 그것보다 낮은 것을 토대로 4℃ 항온 저온 창고 월동 효율이 더 좋은 것으로 판단하였다. 또한 1℃ 항온 저온 창고에서 월동한 봉군의 무게 감소율 (13.19%)은 야외 월동 봉군의 무게 감소율 (국립농업과학원: 14.63%, 위도 꿀벌격리육종장: 13.93%)보다 각각 1.44%, 0.74% 낮음을 보이며 야외 월동이 실내 월동보다 월동 효율은 적으나 1℃ 이하의 저온 월동은 무의미할 것으로 판단된다.
2. 월동과 꿀벌 면역
곤충은 내제 면역계 (Innate immune system)와 적응 면역계 (Adaptive immune system) 모두를 가지고 있는 고등 척추동물과 달리 내제 면역계만을 보유하고 있다 (Reviewed by Larsen et al., 2019). 곤충의 외피층을 이용한 물리적 장벽을 포함하는 내제 면역 시스템 (Innate immune system)은 세포성 (Cellular) 면역 시스템과 체액성 (Humoral) 면역 시스템으로 구성되며 외부 병원균, 곰팡이, 바이러스, 화학물질 등에 대응한다. 꿀벌은 초파리 및 학질모기와 유사한 면역 시스템을 가지고 있으나, 약 2/3 정도 적은 수준의 면역 유전자 개수를 보이며, 이는 사회성에 의한 사회적 방어 (Social difense) 때문으로 추측된다 (Cremer et al., 2007). 꿀벌 면역과 관련된 대표 유전자들의 월동기간 중 발현 변화를 조사한 결과 세포성 면역 시스템의 하나인 melanization을 조절하는 PPO 유전자 (Lu et al., 2014)와 활성산소 (Reactive oxygen species; ROS)에 의한 산화 피해를 줄이는데 일차 항산화 효소 (Primary antioxidant enzyme)로 기능하는 Sod와 Catalase 유전자 (Corona and Robinson, 2006; Heck et al., 2010; Buettner, 2011)의 발현은 지속적으로 억제가 되었으며 설탕물 및 대용화분 공급으로 월동이 종료된 이후 3월 중순에 재발현됨을 확인하였다 (Fig. 2). 이는 기온 감소에 따른 월동의 시작으로 꿀벌 대사의 대부분이 억제되었기 때문으로 예측되며 3월 봄의 시작으로 월동이 종료됨에 따라 활동을 재개하며 그 발현이 증가한 것으로 생각된다. 이와 유사하게 꿀벌의 체액성 면역을 담당하는 항균성 펩타이드 (Antimicrobial peptide; AMPs) 중 Def1을 제외한 Def2, hymenoptaecin, abaecin, apidaecin 유전자 모두의 발현이 월동 중 억제되었고 월동에 깨어나는 3월에 발현이 재개되었으며 월동에 의한 꿀벌 대사의 억제 및 재개에 따른 결과로 추측된다. 하지만 Def1 유전자의 경우 월동이 시작되면 점차적으로 발현이 증가하다가 월동이 끝나는 시점에서 발현이 급격히 억제되며 다른 AMPs와 반대되는 발현 패턴을 보였다. Def1은 꿀벌의 턱밑샘 (Mandibular gland)와 침샘 (Salivary gland)에서 합성되고 (Lopez et al., 2003; Klaudiny et al., 2005) 꿀과 로열젤리로 분비되어 (Qu et al., 2008; Kwakman et al., 2010) 봉군의 단체 면역 (Social immunity) 형성에 관여하는 반면 Def2는 지방체 (Fat body)의 지방세포 (Adipocyte)와 혈림프 (Hemolymph)에서 합성되어 개별 면역 (Individual immunity)에 관여한다 (Casteels et al., 1989; Klaudiny et al., 2005). 월동기 생체 활성의 억제로 Def2를 포함한 대부분의 AMPs 유전자의 발현은 억제되었지만, 봉군 유지를 위한 최소한의 면역 시스템으로 봉군에 보관중인 꿀을 먹으며 꿀에 포함되어있는 Def1을 이용 및 합성하기 때문에 월동 중 Def1 유전자의 발현이 유지되는 것으로 생각된다.
항온 저온 창고를 이용한 실내 월동의 결과 창고의 온도에 의한 꿀벌 면역 관련 유전자의 발현에 유의미한 차이가 확인되지는 않았으나, 개체별 면역에 관여하는 면역은 억제되고 봉군 전체를 위한 사회성 면역 시스템에 관여하는 Def1이 꿀벌의 월동에 매우 중요하게 작용하는 것으로 판단된다.
3. 월동과 꿀벌의 수명
본 실험에 사용된 mfe 유전자는 대부분의 곤충 juvenile hormone (JH) 생합성의 마지막 단계인 methyl farnesoate의 산화를 촉매하는 효소의 역할을 하고 (Helvig et al., 2004; Claudianos et al., 2006), 꿀벌 mfe 유전자의 발현과 JH 발현양의 양의 상관관계로 mfe 유전자의 발현이 JH의 발현양을 나타내는 지표로 사용할 수 있기 때문에 (Bomtorin et al., 2014) 월동기간 중 일벌의 JH 발현양 파악을 위한 유전자로 mfe를 사용하였다.
Vg와 JH은 상호작용하여 산란, 계급 분화 (Labor division), 수명 등 꿀벌의 다양한 생리 조절에 관여한다 (Amdam et al., 2003a; Amdam et al., 2003b; Amdam et al., 2004; Corona et al., 2007; Nelson et al., 2007; Ament et al., 2008). 일벌에서 탈피 2주 미만의 내역봉은 높은 Vg, 이후의 외역봉은 낮은 Vg의 발현을 보이고 JH는 Vg와 반대로 발현되며 음의 상관관계를 보인다 (Hartfelder and Engels, 1998). 또한 Vg 단백질의 발현이 늦가을과 초겨울에 높고, 늦겨울에 낮은 기존의 실험 결과 (Fluri et al., 1977; Huang and Robinson, 1995)와 유사하게 본 실험에서 Vg 유전자는 월동기간 상대적으로 높은 발현을 보였고 월동이 끝나는 시점에 그 발현이 억제되었다. 반대로 JH 유전자는 월동기간 발현이 억제되었고, 월동이 끝나는 시점에 발현이 재개되었는데, 이는 약 3~4개월의 월동 기간을 버텨야하는 월동 벌 수명의 장기화와 연관된 것으로 짐작된다.
Acknowledgments
본 연구는 농촌진흥청 연구과제 PJ01476105의 연구비로 지원된 결과이다.
References
- 최광수, 이종원, 강보석, 이석건. 2001. 서양종꿀벌의 실내 월동에 관한 연구: II. 1997~1998 용인지방에 있어서 서양종꿀벌의 실내 월동. J. Apic. 16(2): 83-88.
- 최광수, 최영연, 이석건, 이현우, 이진해, 이종원, 심용구, 조상균, 강보석, 1999. 봉군 월동 기술 확립에 관한 연구. 농림부.
-
Amdam, G. V., K. Norberg, A. Hagen and S. W. Omholt. 2003a. Social exploitation of vitellogenin. Proc. Nati. Acad. Sci. 100(4): 1799-1802.
[https://doi.org/10.1073/pnas.0333979100]

-
Amdam, G. V. and S. W. Omholt. 2003b. The hive bee to forager transition in honeybee colonies: the double repressor hypothesis. J. Theor. Biol. 223(4): 451-464.
[https://doi.org/10.1016/S0022-5193(03)00121-8]

-
Amdam, G. V., Z. L. P. Simões, A. Hagen, K. Norberg, K. Schrøder, Ø. Mikkelsen, T. B. L. Kirwood and S. W. Omholt. 2004. Hormonal control of the yolk precursor vitellogenin regulates immune function and longevity in honeybees. Exp. Gerontol. 39(5): 767-773.
[https://doi.org/10.1016/j.exger.2004.02.010]

-
Amdam, G. V., A. L. T. Aase, S. C. Seehuus, M. K. Fondrk, K. Norberg and K. Hartfelder. 2005. Social reversal of immunosenescence in honey bee workers. Exp. Gerontol. 40(12): 939-947.
[https://doi.org/10.1016/j.exger.2005.08.004]

-
Ament, S. A., M. Corona, H. S. Pollock and G. E. Robinson. 2008. Insulin signaling is involved in the regulation of worker division of labor in honey bee colonies. Proc. Nati. Acad. Sci. 105(11): 4226-4231.
[https://doi.org/10.1073/pnas.0800630105]

-
Bomtorin, A. D., A. Mackert, G. C. C. Rosa, L. M. Moda, J. R. Martins, M. M. G. Bitondi, K. Hartfelder and Z. L. P. Simões. 2014. Juvenile hormone biosynthesis gene expression in the corpora allata of honey bee (Apis mellifera L.) female castes. PloS One 9(1): e86923.
[https://doi.org/10.1371/journal.pone.0086923]

-
Buettner, G. R. 2011. Superoxide dismutase in redox biology: the roles of superoxide and hydrogen peroxide. Anticancer Agents Med. Chem. (Formerly Curr. Med. Chem. Anticancer Agents). 11(4): 341-346.
[https://doi.org/10.2174/187152011795677544]

-
Casteels, P., C. Ampe, F. Jacobs, M. Vaeck and P. J. T. E. J. Tempst (1989). Apidaecins: antibacterial peptides from honeybees. EMBO Rep. 8(8): 2387-2391.
[https://doi.org/10.1002/j.1460-2075.1989.tb08368.x]

-
Claudianos, C., H. Ranson, R. M. Johnson, S. Biswas, M. A. Schuler, M. R. Berenbaum, R. Feyereisen and J. G. Oakeshott. 2006. A deficit of detoxification enzymes: pesticide sensitivity and environmental response in the honeybee. Insect Mol. Biol. 15(5): 615-636.
[https://doi.org/10.1111/j.1365-2583.2006.00672.x]

-
Corona, M. and G. E. Robinson. 2006. Genes of the antioxidant system of the honey bee: annotation and phylogeny. Insect Mol. Biol. 15(5): 687-701.
[https://doi.org/10.1111/j.1365-2583.2006.00695.x]

-
Corona, M., R. A. Velarde, S. Remolina, A. Moran-Lauter, Y. Wang, K. A. Hughes and G. E. Robinson. 2007. Vitellogenin, juvenile hormone, insulin signaling, and queen honey bee longevity. Proc. Nati. Acad. Sci. 104(17): 7128-7133.
[https://doi.org/10.1073/pnas.0701909104]

-
Cremer, S., S. A. Armitage and P. Schmid-Hempel. 2007. Social Immunity. Curr. Biol. 17(16): R693-R702.
[https://doi.org/10.1016/j.cub.2007.06.008]

-
Danihlík, J., M. Škrabišová, R. Lenobel, M. Šebela, E. Omar, M. Petřivalský, K. Crailsheim and R. Brodschneider. 2018. Does the pollen diet influence the production and expression of antimicrobial peptides in individual honey bees?. Insects 9(3): 79.
[https://doi.org/10.3390/insects9030079]

- Engels, W., H. Kaatz, A. Zillikens, Z. P. Simoes, A. Trube, R. Braun and F. Dittrich. 1990. Honey bee reproduction: vitellogenin and caste-specific regulation of fertility. Adv. Invert. Reprod. 5: 495-502.
-
Evans, J. D., K. Aronstein, Y. P. Chen, C. Hetru, J. L. Imler, H. Jiang, M. Kanost, G. J. Thompson, Z. Zou. and D. Hultmark. 2006. Immune pathways and defence mechanisms in honey bees Apis mellifera. Insect Mol. Biol. 15(5): 645-656.
[https://doi.org/10.1111/j.1365-2583.2006.00682.x]

-
Fahrenholz, L., I. Lamprecht and B. Schricker. 1989. Thermal investigations of a honey bee colony: thermoregulation of the hive during summer and winter and heat production of members of different bee castes. J. Comp. Physiol. B. 159(5): 551-560.
[https://doi.org/10.1007/BF00694379]

-
Fluri, P., H. Wille, L. Gerig and M. Luscher. 1977. Juvenile hormone, vitellogenin and haemocyte composition in winter worker honeybees (Apis mellifera). Experientia. 33(9): 1240-1241.
[https://doi.org/10.1007/BF01922354]

- Fukuda, H. and K. Sekiguchi. 1966. Seasonal change of the honeybee worker longevity in Sapporo, North Japan, with notes on some factors affecting the life-span. Jpn. J. Ecol. 16(5): 206-212.
-
Hartfelder, K. and W. Engels. 1998. 2 Social insect polymorphism: hormonal regulation of plasticity in development and reproduction in the honeybee. Curr. Top. Dev. Biol. 40: 45-77.
[https://doi.org/10.1016/S0070-2153(08)60364-6]

-
Hu, Y. T., T. C. Wu, E. C. Yang, P. C. Wu, P. T. Lin and Y. L. Wu. 2017. Regulation of genes related to immune signaling and detoxification in Apis mellifera by an inhibitor of histone deacetylation. Sci. Rep. 7(1): 1-14.
[https://doi.org/10.1038/srep41255]

-
Heck, D. E., M. Shakarjian, H. D. Kim, J. D. Laskin and A. M. Vetrano. 2010. Mechanisms of oxidant generation by catalase. Ann. N. Y. Acad. Sci. 1203: 120.
[https://doi.org/10.1111/j.1749-6632.2010.05603.x]

-
Helvig, C., J. F. Koener, G. C. Unnithan and R. Feyereisen. 2004. CYP15A1, the cytochrome P450 that catalyzes epoxidation of methyl farnesoate to juvenile hormone III in cockroach corpora allata. Proc. Nati. Acad. Sci. 101(12): 4024-4029.
[https://doi.org/10.1073/pnas.0306980101]

-
Huang, Z. Y. and G. E. Robinson. 1995. Seasonal changes in juvenile hormone titers and rates of biosynthesis in honey bees. J. Comp. Physiol. B. 165(1): 18-28.
[https://doi.org/10.1007/BF00264682]

-
Klaudiny, J., Š. Albert, K. Bachanová, J. Kopernický and J. Šimúth. 2005. Two structurally different defensin genes, one of them encoding a novel defensin isoform, are expressed in honeybee Apis mellifera. Insect Biochem. Mol. Biol. 35(1): 11-22.
[https://doi.org/10.1016/j.ibmb.2004.09.007]

-
Kwakman, P. H., A. A. T. Velde, L. de Boer, D. Speijer, M. J. Christina Vandenbroucke-Grauls and S. A. Zaat. 2010. How honey kills bacteria. FASEB J. 24(7): 2576-2582.
[https://doi.org/10.1096/fj.09-150789]

- Larsen, A., F. J. Reynaldi and E. Guzman-Novoa. 2019. Fundaments of the honey bee (Apis mellifera) immune system. Review. Rev. Mex. Cienc. Pecu. 10(3): 705-728.
-
Lavine, M. D. and M. R. Strand. 2002. Insect hemocytes and their role in immunity. Insect Biochem. Mol. Biol. 32(10): 1295-1309.
[https://doi.org/10.1016/S0965-1748(02)00092-9]

-
Lopez, L., G. Morales, R. Ursic, M. Wolff and C. Lowenberger. 2003. Isolation and characterization of a novel insect defensin from Rhodnius prolixus, a vector of Chagas disease. Insect Biochem. Mol. Biol. 33(4): 439-447.
[https://doi.org/10.1016/S0965-1748(03)00008-0]

-
Lourenço, A. P., M. S. Zufelato, M. M. G. Bitondi and Z. L. P. Simões. 2005. Molecular characterization of a cDNA encoding prophenoloxidase and its expression in Apis mellifera. Insect Biochem. Mol. Biol. 35(6): 541-552.
[https://doi.org/10.1016/j.ibmb.2005.01.013]

-
Lu, A., Q. Zhang, J. Zhang, B. Yang, K. Wu, W. Xie, Y. Luan, and E. Ling. 2014. Insect prophenoloxidase: the view beyond immunity. Front. Physiol. 5: 252.
[https://doi.org/10.3389/fphys.2014.00252]

-
Maori, E., Y. Garbian, V. Kunik, R. Mozes-Koch, O. Malka, H. Kalev, N. Sabath, I. Sela and S. Shafir. 2019. A transmissible RNA pathway in honey bees. Cell Rep. 27(7): 1949-1959.
[https://doi.org/10.1016/j.celrep.2019.04.073]

-
Maurizio, A. and F. E. D. Hodges. 1950. The influence of pollen feeding and brood rearing on the length of life and physiological condition of the honeybee preliminary report. Bee World. 31(2): 9-12.
[https://doi.org/10.1080/0005772X.1950.11094617]

-
Mattila, H. R., J. L. Harris and G. W. Otis. 2001. Timing of production of winter bees in honey bee (Apis mellifera) colonies. Insectes Soc. 48(2): 88-93.
[https://doi.org/10.1007/PL00001764]

-
Nelson, C. M., K. E. Ihle, M. K. Fondrk, R. E. Page Jr and G. V. Amdam. 2007. The gene vitellogenin has multiple coordinating effects on social organization. PLoS Biol. 5(3): e62.
[https://doi.org/10.1371/journal.pbio.0050062]

- Pedersen, J., G. Pedersen and E. Pedersen. 1996. Outside wintering of single brood chamber hives revisited. Am. Bee J. 136(3): 181-186.
-
Pinto, L. Z., M. M. Bitondi and Z. L. Simoes. 2000. Inhibition of vitellogenin synthesis in Apis mellifera workers by a juvenile hormone analogue, pyriproxyfen. J. Insect Physiol. 46(2): 153-160.
[https://doi.org/10.1016/S0022-1910(99)00111-0]

-
Qu, N., J. Jiang, L. Sun, C. Lai, L. Sun and X. Wu. 2008. Proteomic characterization of royal jelly proteins in Chinese (Apis cerana cerana) and European (Apis mellifera) honeybees. Biochem. (Mosc.) 73(6): 676-680.
[https://doi.org/10.1134/S0006297908060072]

-
Söderhäll, K. and L. Cerenius. 1998. Role of the prophenoloxidase-activating system in invertebrate immunity. Curr. Opin. Immunol. 10(1): 23-28.
[https://doi.org/10.1016/S0952-7915(98)80026-5]

-
Southwick, E. E. 1985. Allometric relations, metabolism and heart conductance in clusters of honey bees at cool temperatures. J. Comp. Physiol. B. 156(1): 143-149.
[https://doi.org/10.1007/BF00692937]

-
Stabentheiner, A., H. Kovac and R. Brodschneider. 2010. Honeybee colony thermoregulation-regulatory mechanisms and contribution of individuals in dependence on age, location and thermal stress. PLoS One. 5(1): e8967.
[https://doi.org/10.1371/journal.pone.0008967]

-
Strand, M. R. and L. L. Pech. 1995. Immunological basis for compatibility in parasitoid-host relationships. Annu. Rev. Entomol. 40(1): 31-56.
[https://doi.org/10.1146/annurev.en.40.010195.000335]

-
Steinmann, N., M. Corona, P. Neumann and B. Dainat. 2015. Overwintering is associated with reduced expression of immune genes and higher susceptibility to virus infection in honey bees. PloS One. 10(6): e0129956.
[https://doi.org/10.1371/journal.pone.0129956]

-
Shiao, S. H., S. Higgs, Z. Adelman, B. M. Christensen, S. H. Liu and C. C. Chen. 2001. Effect of prophenoloxidase expression knockout on the melanization of microfilariae in the mosquito Armigeres subalbatus. Insect Mol. Biol. 10(4): 315-321.
[https://doi.org/10.1046/j.0962-1075.2001.00268.x]

