
사람 간암세포주 HepG2에서 수벌번데기 (Apis mellifera L.) 추출물의 증식억제효과
Abstract
In recent years, edible insects have caught the attention of researchers, because of their potential as an alternative source of food and nutraceuticals. Based on the record of use for edible and medicinal purpose, drone pupa was approved as a new food ingredient in 2021. To investigate the possibility of antiproliferative effect for malignancy, we observed the viability of HepG2 cells by treating the extract. When the extract was treated in HepG2 cells at 10 mg/mL and 5 mg/mL for 24 hours, the cell viability was 49.33 and 66.98%, respectively. Detection nucleosomes in cytoplasmic fractions showed that drone pupa extract induced apoptosis in HepG2. Western blotting was used to evaluate apoptosis-related protein expression such as Bcl-2, Bcl-xL, Bax, caspase 3. Our result suggest that drone pupa extract have apoptosis-induced activity in HepG2 cancer cell.
Keywords:
Drone pupa extract, Apoptosis, HepG2서 론
식용 곤충은 전 세계적으로 풍부한 영양성분을 함유하고 있는 미래의 식량으로 특히 단백질 대체제로 주목받고 있으며 최근 과거 약용으로 사용된 기록을 바탕으로 식용 곤충의 약리적 효과에 대한 과학적 근거 마련을 위한 연구가 진행되고 있다 (Lim and Byun, 2021; Qian et al., 2022). 국내 식품원료로 허가된 곤충으로 메뚜기, 누에, 백장감, 쌍별 귀뚜라미, 갈색거저리, 흰점박이꽃무지유충, 장수풍뎅이 유충, 아메리카왕거저리, 수벌번데기가 있으며 이들은 영양학적으로 높은 단백질과 지방을 함유하고 있으며 항산화, 항균, 항염증, 항알러지, 항혈전, 항암, 미백과 같은 여러 생리활성을 갖는다는 보고가 있다 (Lee et al., 2013; Sung et al., 2016; Lee et al., 2017; Im et al., 2018; Cho et al., 2019; Choi et al., 2019b; Hwang et al., 2019; Kim et al., 2019b, 2020; Seo et al., 2019; Shin et al., 2020; D’Antonio et al., 2021; Jeong et al., 2021; Kim et al., 2021).
2021년 9월에 통계청에서 발간, 배포된 2020년 우리나라 사망원인통계 자료에 따르면 호흡기질환, 심장질환, 뇌혈관질환과 같은 순환기 계통 질환과 암이 주된 사망원인으로 나타났으며 전체 사망자의 27%는 암으로 사망, 암 사망률은 인구 10만 명당 160.1명으로 2019년보다 1.2%가 증가한 것으로 나타났다 (Statistics Korea, 2021). 암은 미국에서도 사망원인 2위에 올라있는 질환으로 암세포의 세포분열을 멈추거나 죽게하는 programmed cell death (apoptosis)의 기전에 문제가 있음을 미국립암연구소는 지적하고 있다 (Siegel et al., 2022).
Programmed cell death (apoptosis)는 caspases라고 불리는 cysteine-aspartic proteases의 활성에 의해 매개되는 세포사이며 이 효소는 apoptosis의 형태적, 생화학적 특성을 갖게 한다. 예를 들면 phosphatidylserine externalization, chromatin condensation, DNA fragmentation, apoptotic body들의 생성이다 (Gabler et al., 2004; Elmore, 2007). 암세포의 비정상적인 programmed cell death 기전을 정상화하는 것은 암 예방 및 치료의 표적이 될 수 있으며 다양한 종양세포에서 세포사멸을 유도하는 항암제에 관련 연구들이 보고되고 있다 (Suo et al., 2015; Ji et al., 2016; Zhao et al., 2016; Chen et al., 2020; Liu et al., 2021; Rodriguez et al., 2021).
수벌번데기는 벌목에 속한 꿀벌 종인 Apis mellifera L. strain에서 생산한 식용곤충으로 현재 식품원료로 허가되어 다양한 식품 제형에 적용가능하게 되었다. 수벌번데기의 주요 영양성분은 51.8%의 조단백, 15.9% 탄수화물과, 26.2%의 조지방으로 구성되어 있다. 이들은 미량원소 및 비타민 등을 함유하며 중금속과 같은 유해물질로부터 안전한 우수한 식품원료로 평가되었다 (Kim et al., 2018; Choi et al., 2019a; Kim et al., 2019a). 수벌번데기의 높은 단백질함량에는 다양한 아미노산을 포함하고 있으며 또한 지방 역시 다양한 불포화지방산을 함유하는 것으로 나타났다 (Kim et al., 2018). 지금까지 수벌번데기는 항당뇨, 간보호, 면역기능향상에 도움을 주는 활성이 보고된 바 있다 (Kim et al., 2019b, 2020; Kim et al., 2021, 2022). 이러한 생리활성을 보이는 수벌번데기가 암세포의 비정상적인 세포사멸기전을 정상적으로 유도할 수 있는지 알아보기 위하여 사람 hepatocarcinoma cell line 인 HepG2 세포를 대상으로 apoptosis 유도 및 그 관련 기전에 대해 알아보고자 하였다.
재료 및 방법
1. 수벌번데기 추출물
수벌번데기 분획 추출물은 수벌번데기 동결건조 분말 시료 70% 에탄올을 용매로 하여 수벌번데기 동결건조분말 100 g에서 6.8 g의 에탄올 추출물을 얻었다. 이 추출물은 헥산, 에틸아세테이트, 부탄올 순서로 분획하여 각각 2.3 g, 0.296 g, 0.824 g의 추출물과 3.29 g의 물층을 감압농축하여 얻었다. 이들 중 물층을 사용하였다 (Kim et al., 2021).
2. 세포배양
본 실험에서 사용한 HepG2 세포는 사람 hepatocarcinoma cell로 10% fetal bovine serum (GIBCO)와 1×penicillin-streptomycin (GIBCO)를 첨가한 MEM (GIBCO)을 사용하여 37℃, 5% CO2의 조건에서 배양하여 사용하였다.
3. 세포독성
수벌번데기 분획물의 세포독성을 확인하기 위하여 10% fetal bovine serum (GIBCO)와 1×penicillin-streptomycin (GIBCO)를 첨가한 MEM (GIBCO)을 사용하여 37℃, 5% CO2의 조건에서 유지 배양하였던 HepG2 세포를 1×104 cells로 96 well plate에 분주하여 16시간 동안 세포를 배양시켰다. 수벌번데기 분획 추출물 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 0.005, 0.001, 0.0005 mg/mL 농도로 처리하여 24, 48, 72, 96시간 동안 배양하였다. 각 well 당 EZ-Cytox (DoGenBio Co., Ltd.) solution을 10 μL씩 첨가하고 3시간 동안 37℃, 5% CO2 조건에서 반응시킨 후 microplate reader를 이용하여 450 nm에서 흡광도를 측정하였다.
4. 뉴클레오좀 검출
Sandwich enzyme immunoassay 원리에 따른 Cell death detection ELISA kit (Roche)를 사용하여 apoptosis가 유도되었을 때 유도되는 조각난 nucleosome을 사이토졸에서 검출하는 실험을 진행하였다. 1×104 cell/well로 96 well plate에 HepG2 cell을 분주하여 16시간 동안 배양시킨 후 수벌번데기 추출물을 10 mg/mL으로 처리하여 4, 8, 16, 24시간 동안 배양하였다. 세포에 트립신 처리하여 원심분리하여 모은 세포 pellet에 200 μL lysis buffer를 넣고 30분간 방치하였다. 그 후 200 g로 10분 동안 원심분리하여 얻은 상층액을 모아 kit에서 제공한 방법대로 ELISA assay를 수행하였다.
5. 세포사멸관련 유전자 발현 변화 분석
HepG2 cell을 2×105/well 세포를 6 well plate에 분주하고 16시간 동안 배양하였다. 이후 수벌번데기 분획 추출물을 10 mg/mL 농도로 4, 8, 16, 24 h 처리한 후 RIPA buffer를 사용하여 cell lysate를 제조한 후 BCA assay를 통해 lysate의 단백질 정량을 실시하였다. 각 시료는 4~15% Tris Glycine (TGX) gel에 10 μg씩 loading하고 1×SDS running buffer (0.025 M Tris, 0.192 M Glycine, 0.1% SDS, pH 8.6)로 100 V로 2 hrs 동안 전기영동하였다. 전기영동이 끝난 후 Turbo blotter (Bio-Rad) 기기를 사용하여 2.5 mV로 7분간 전기를 흘려 PVDF membrane으로 이동시킨 후 2% skim milk blocking buffer로 2시간 동안 membrane을 blocking하였다. 1차 antibody (Bax, Biolegend; Bcl-xL, Cell Signaling Technology; Cytochrome c, BD pharmingen; Caspase 3, Cell signaling Technology; GAPDH, Cell signaling Technology)를 넣고 상온에서 2시간 동안 반응시킨 후 1×TTBS로 15분간 3회 membrane을 세척하였다. 2차 antibody IgG-HRP (Cell Signaling Technology)를 첨가하여 1시간 반응시킨 후 1×TTBS 용액으로 15분간 3회 세척하였다. 마지막으로 membrane에 Western Q (GeneDEPOT) solution을 처리하여 ChemiDocTM XRS (Bio-rad)을 사용하여 apoptosis-related protein의 양적 변화를 확인하였다.
6. 통계처리
모든 실험에 대한 결과는 3반복하여 평균 및 표준편차로 표기하였고 통계 분석은 각 시료 간의 유의적 변화를 t-test로 분석, 판정하였다 (*p<0.05, **p<0.01, ***p<0.001).
결 과
1. HepG2 cell에서 수벌번데기 분획 추출물의 cell viability
수벌번데기 추출물을 HepG2 세포주에 처리하였을 때 세포독성을 알아보기 위하여 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 0.005, 0.001, 0.0005 mg/mL의 농도를 1×104 cell에 처리하여 96시간까지 반응시켰다. 그 결과 수벌번데기 추출물을 처리하지 않은 실험군과 비교하였을 때 10 mg/mL와 5 mg/mL 농도로 수벌번데기 추출물을 처리하였을 때 처리 시간에 의존적으로 생존력이 떨어지는 것으로 나타났다 (Fig. 1).

Effect of drone pupa extract on cell viability in HepG2, human hepatocarcinoma cell. HepG2 cells were seeded on 96 well plates at a density of 1×104/well. After sixteen hours, HepG2 cells were treated with serial concentration of water fraction of drone pupa extract, and were incubated for 24, 48, 72, 96 hrs. And then each well was added with 10 μL of EZ-Cyto reagent and incubated for 3hrs at 37℃. The results represent the mean±standard deviation. The experiment was performed in triplicate. *p<0.05, **p<0.01, ***p<0.001, compared with the control group.
2. 수벌번데기 분획 추출물에 의한 HepG2 세포에서 유도된 cell death
HepG2 세포에 10 mg/mL의 수벌번데기 분획 추출물에 의해 유도된 cell death의 형태가 apoptosis인지 알아보기 위하여 cytosolic nucleosome을 검출하였다. 이를 위하여 Roche사의 Cell death detection ELISA kit를 사용하였다. 그 결과 수벌번데기 추출물을 처리하지 않은 대조군 (NC) 대비 시간이 지남에 따라 nucleosome의 양이 증가됨을 확인하였다. 또한 제조사에서 제공하는 양성대조군을 통해 반응이 정상적으로 일어났음을 확인하였다. 이 결과로 수벌번데기 분획 추출물에 의해 유도된 cell death는 apoptosis임을 알 수 있었다 (Fig. 2).
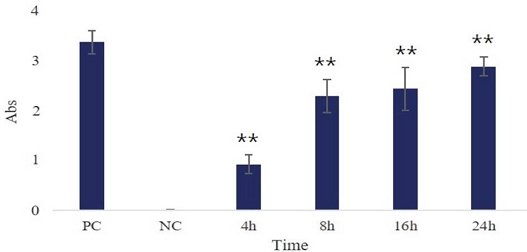
Detection of nucleosomes in cytoplasmic fractions at different treated times. HepG2 cells were seeded on 96 well plate at a density of 1×104/well. After sixteen hours, HepG2 cells were incubated at various treated time with fraction of drone pupa extract (10 mg/mL) or without drone pupa extract at 37℃. After cell lysis, the cytoplasmic fractions of samples were prediluted with incubation buffer and performed the immunoassay. This experiment was performed according to the method provided by the manufacturer. All experiments were performed in triplicate. *p<0.05, **p<0.01, ***p<0.001, compared with the control group. PC indicated positive control provided by kit. NC indicated culture in medium only.
3. 수벌번데기 추출물에 의한 HepG2 세포의 Bcl-2 family protein 발현 변화와 caspase 3 활성
HepG2 세포에 수벌번데기 추출물 처리 4, 8, 16, 24시간 후 apoptosis 유도 관련 유전자의 발현양 변화를 western blot을 통해 알아보았다. 그 결과 Bcl-xL 유전자는 수벌번데기 추출물을 처리하지 않은 HepG2 세포대조군 대비 수벌번데기 추출물 처리군에서 발현된 유전자 검출량이 감소되는 경향을 보였다. Bax 유전자의 경우 수벌번데기 추출물 처리군에서 발현된 유전자 검출량이 증가하는 양상을 보였고 Cytochrome c는 수벌번데기 추출물 처리군에서 시간에 따라 Cytochrome c 유전자 검출량이 증가하는 양상을 나타냈다. 또한 caspase 3는 8시간 이후 apoptosis를 유도할 수 있는 활성화된 형태의 19, 17 kDa의 밴드가 나타나는 것을 볼 수 있었다. 각 유전자 검출의 대조군으로 GAPDH를 사용하였다 (Fig. 3).
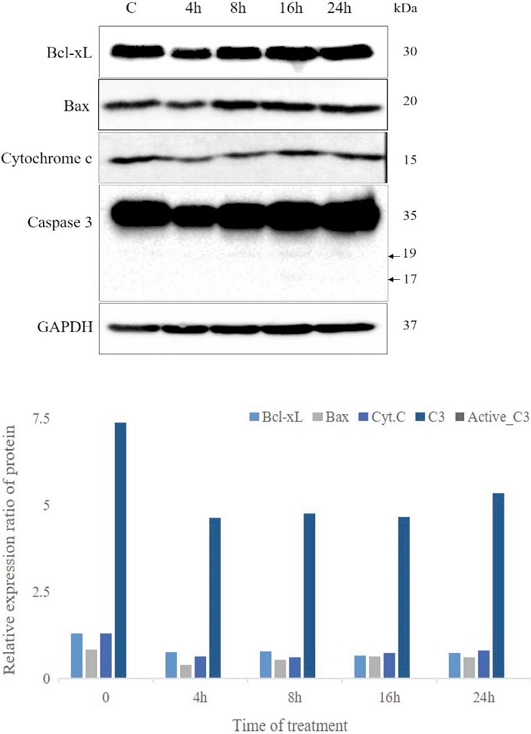
Effect of drone pupa extract on HepG2 cells. HepG2 cells were treated with 10 mg/mL of water fraction of drone pupa extract for the indicated time and whole cell extracts were analyzed by immunoblotting. (A) The change of expression levels of Bcl- Bcl-xL, Bax, Caspase 3, Cytochrome c were analyzed by western blot. (B) Bcl-xL, Bax, Cytochrome c, Caspase 3 expression in (A) was quantified by Image LabTM software. GAPDH was used to normalize relative expressions among groups.
고 찰
풍부한 영양성분을 바탕으로 생리활성 효과에 대한 주목을 받고 있는 식용 곤충 중 하나인 수벌번데기는 그 추출물을 이용한 항당뇨, 항산화효과, 항염증효과 및 간보호효과에 대한 연구를 통해 수벌번데기의 생리활성에 대한 과학적 근거를 마련하고자 노력하고 있다 (Kim et al., 2020; Kim et al., 2021, 2022). 근래 식용곤충들에 대한 다양한 약리적 효능에 대한 연구가 꾸준히 진행되고 있는 가운데 이들의 apoptosis 유도 및 그 기전에 관한 보고가 있었다 (Hwang et al., 2019; Wu et al., 2020; Lim and Byun, 2021).
Apoptosis는 세포의 발생, 노화, 세포 수를 일정하게 유지하는 항상성 기전으로 면역반응 같은 방어 기전에 혹은 질병에 노출된 세포에서 일어난다. 이러한 apoptosis 조절에 이상은 암, autoimmune lymphoproliferative syndrome, AIDS, ischemia, Parkinson’s, Alzheimer’s, Huntington’s disease, Amyotrophic lateral sclerosis와 같은 neurodegenerative disease에 중요 병인으로 작용한다 (Gabler et al., 2004; Elmore, 2007). 이 질병들은 모두 apoptosis 기전의 이상으로 너무 과하게 일어나거나 그렇지 못한 경우이다. 암은 후자로 apoptosis가 정상적으로 일어나지 못해 생기는 질병으로 최근 암세포의 apoptosis를 유도하는 다양한 물질에 대한 연구가 계속되고 있다 (Jiang et al., 2013; Raza et al., 2016; Chen et al., 2020; Liu et al., 2021; Rodriguez et al., 2021). 우리나라는 최근까지 사망원인으로 암이 높은 수치를 차지하고 있으며 암 사망률은 간암이 폐암 다음으로 높다. 일부 간보호효과가 보고된 수벌번데기 추출물을 간암세포주에 처리하였을 때 암세포 증식억제효과를 통해 암 발생 예방 및 치료의 가능성을 알아보고자 하였다.
Apoptosis는 에너지를 소비하는 일련의 복잡하고 정교한 분자기전으로 cysteine-aspartic proteases인 caspases의 활성에 의해 일어난다 (Elmore, 2007). 이 효소는 chromatin을 잘라 다양한 크기의 DNA 단편을 생성한다. 이 DNA 단편은 mono-, oligonucleosmes 형태로 전기영동을 수행할 시 DNA ladder로 보이는 apoptosis의 대표적 특징 중 하나이다. 이에 수벌번데기 추출물을 사람 간암세포주인 HepG2에 처리하여 세포사멸이 유도되는 추출물의 농도를 찾았다. 이 세포사의 기전이 apoptosis인지 아닌지 알아보기 위해 apoptosis의 대표적 특징인 DNA의 단편이 생기는지 확인하기 위해 세포질 내 mono-, ligonucleosomes을 검출할 수 있는 ELSIA assay를 실시하였다. 이 방법은 apoptosis가 유도되었을 때 나타나는 현상인 phosphatidylserine externalization을 확인하는 FACS 분석이나 chromatin condensation, apoptotic body을 확인하는 현미경을 이용한 형태적 관찰이나 전기영동을 통한 DNA fragmentation보다 쉽고 정확하게 알아볼 수 있는 방법으로 수벌번데기 추출물이 HepG2 세포에 처리되어 시간이 지남에 따라 nucleosome의 검출양이 통계적으로 유의하게 증가함을 통해 수벌번데기 추출물이 apoptosis를 유도한다는 것을 알 수 있었다 (Fig. 2). 지금까지 알려진 바에 의하면 apoptosis은 2가지 pathway를 통해 일어난다. 그중 하나는 extrinsic, death receptor pathway이고 다른 하나는 intrinsic, mitochondrial pathway이다. 이들 pathway는 독립적이지 않고 서로 연관되어 반응물질들이 일렬의 신호전달에 서로 상호적 영향을 줄 수 있다 (Jiang et al., 2013; Raza et al., 2016). 수벌번데기 추출물이 간암세포주에 유도한 apoptosis는 어떤 pathway를 통하는지 알아보기 위하여 western blot를 수행하여 관련 유전자들의 발현 및 활성 여부를 알아보았다. Apoptosis 과정은 proteolytic 활성을 갖는 10개의 주된 caspases의 상호작용으로 일렬의 반응이 빠르게 유도되는데 그 마지막 실행자 역할을 하는 것은 caspase 3로 이 효소의 활성은 apoptosis가 유도되었다는 또 다른 증거가 된다. Intrinsic pathway는 mitochondria와 관련된 pathway이며 Bcl-2 family 유전자와 관련 있다. Bcl-2 family에는 apoptosis 기전에 관여하는 25개의 유전자들이 존재하며 이들은 크게 apoptosis을 유도하는 유전자들과 억제하는 유전자들로 존재한다. Apoptosis를 억제하는 대표적인 유전자로 Bcl-2와 Bcl-xL 등이 있으며 apoptosis를 유도하는 유전자로 Bax, Bak, Bad 등이 있다 (Elmore, 2007; Jiang et al., 2013). 이들 중 본 실험에서는 Bcl-xL과 Bax의 변화를 알아보았다. 수벌번데기 추출물로 유도된 apoptosis는 Bax 유전자의 발현이 시간에 따라 증가하는 경향을 보였고 Bcl-xL의 발현은 감소 경향을 나타내었으며 cytochrome c는 증가하는 경향을 보였다. 이와 같은 결과는 mitochondria membrane의 potential을 변화시켜 cytochrome c의 release를 유도, caspase 3를 활성화하여 apoptosis를 유도한다는 일렬의 과정을 추정할 수 있게 하였다. 일반적으로 apoptosis가 유도되었는지 아닌지 알아보기 위한 방법은 DNA 단편화, caspases의 활성화, 미토콘드리아 막작용, cytochrome c의 분비 여부로 특정할 수 있다. 본 연구에서는 수벌번데기 추출물을 간암세포주에 처리하여 DNA 단편화가 일어났음을 확인하였고 caspase 3의 활성화된 형태를 확인하였고 Bcl-2 family 유전자들의 일부에서 발현 변화가 유도되는 결과를 얻을 수 있었다. Apoptosis를 유도하는 신호와 실행자는 다양하게 존재한다 (Nepal and Park, 2013; Wang et al., 2017; Tanaka et al., 2020; Wu et al., 2020). 본 실험은 그 다양한 신호 물질들 중 일부를 통해 수벌번데기 추출물이 암세포의 성장을 억제하는 활성이 있음을 추정할 수 있게 하였다. 앞으로 다른 신호 물질의 관여 여부 확인이 필요하며 또한 좀 더 다양한 암세포에 적용하여 그 세포에서 apoptosis 유도 여부, 그리고 이에 따른 pathway에 대한 지속적인 연구는 추후 항암활성을 갖는 물질로 활용될 수 있는 근거를 마련하게 될 것이다. 앞으로 수벌번데기 추출물이 암억제 활성을 갖는 의약소재로 활용될 수 있기를 기대한다.
Acknowledgments
본 연구는 국립농업과학원 농업과학기반기술연구사업 (과제번호: PJ01512902)에 의하여 수행되었습니다.
References
-
Chen, Y., C. Hong, X. Chen and Z. Qin. 2020. Demethoxycurcumin increases the sensitivity of cisplatin-resistant non-small lung cancer cells to cisplatin and induces apoptosis by activating the caspase signaling pathway. Oncol. Lett. 20(5): 209.
[https://doi.org/10.3892/ol.2020.12072]

-
Cho, H. T., K. S. Sim, Y. Kim, M. H. Chang, T. Kim, S. H. Lee, D. H. Lee and J. H. Kim. 2019. Anti-diabetic actitivy of edible insect Gryllus bimaculatus extracts in insulin-deficient diabetic mice. J. Korean Soc. Food Sci. Nutr. 48(10): 1165-1171.
[https://doi.org/10.3746/jkfn.2019.48.10.1165]

-
Choi, H. M., S. M. Han, H. Y. Kim, S. O. Woo, S. G. Kim, K. W. Bang and H. J. Moon. 2019a. Investigation of heavy metals from honeybee drone pupa (Apis mellifera L.) as an ingredient for novel foods. J. Apic. 34(3): 273-277.
[https://doi.org/10.17519/apiculture.2019.09.34.3.273]

-
Choi, I. H., R. Yu, Y. J. Lim, G. S. Choi, S. U. Choi, J. I. Hwang, J. S. Son and T. H. Chung. 2019b. Antithrombiotic efficacy of Protaetia brevitarsis extract. J. Environ. Sci. Int. 28(7): 639-643.
[https://doi.org/10.5322/JESI.2019.28.7.639]

-
D’Antonio, V., M. Serafini and N. Battista. 2021. Dietary modulation of oxidative stress from edible insects: A mini-review. Front. Nutr. 8: 642551.
[https://doi.org/10.3389/fnut.2021.642551]

-
Elmore, S. 2007. Apoptosis: A Review of programmed cell death. Toxicol. Pathol. 35(4): 495-519.
[https://doi.org/10.1080/01926230701320337]

-
Gabler, C., N. Blank, T. Hieronymus, M. Schiller, J. H. M. Berden, J. R. Kalden and H. M. Lorenz. 2004. Extranuclear detection of histones and nucleosomes in activated human lymphoblasts as an early event in apoptosis. Ann. Rheum. Dis. 63(9): 1135-1144.
[https://doi.org/10.1136/ard.2003.011452]

-
Hwang, B. B., M. H. Chang, J. H. Lee, W. Heo, J. K. Kim, J. H. Pan, Y. J. Kim and J. H. Kim. 2019. The edible insect Gryllus bimaculatus protects against gut-derived inflammatory responses and liver damage in mice after acute alcohol exposure. Nutrients 11(4): 857.
[https://doi.org/10.3390/nu11040857]

-
Im, A. R., W. K. Yang, Y. C. Park, S. H. Kim and S. Chae. 2018. Hepatoprotective effects of insect extracts in an animal model of nonalcoholic fatty liver disease. Nutrients 10(6): 735.
[https://doi.org/10.3390/nu10060735]

-
Jeong, W. Y., A. N. Kim, Y. Choi, N. Kim, M. S. Jeong and C. Kim. 2021. Physiochemical characteristics and antioxidative activities of Tenebrio Molitor larvae hydrolysates with different extraction methods. Korean J. Community Living Sci. 32(4): 599-610.
[https://doi.org/10.7856/kjcls.2021.32.4.599]

-
Ji, Y., Z. Dai, G. Wu and Z. Wu. 2016. 4-hydroxy-2-nonenal induces apoptosis by activating ERK1/2 signaling and depleting intracellular glutathione in intestinal epithelial cells. Sci. Rep. 6: 32929.
[https://doi.org/10.1038/srep32929]

-
Jiang, L., M. Luo, D. Liu, B. Chen, W. Zhang, L. Mai, J. Zeng, N. Huang, Y. Huang, X. Mo and W. Li. 2013. BAD overexpression inhibits cell growth and induces apoptosis via mitochondrial-dependent pathway in non-small cell lung cancer. Cancer Cell Int. 13(1): 53.
[https://doi.org/10.1186/1475-2867-13-53]

-
Kim, H. Y., S. O. Woo, S. G. Kim, K. W. Bang, H. M. Choi, H. Y. Moon and S. M. Han. 2019a. Analysis of oxidative stability in drone pupae (Apis mellifera L.). J. Apic. 34(1): 63-66.
[https://doi.org/10.17519/apiculture.2019.04.34.1.63]

-
Kim, H. Y., S. O. Woo, S. G. Kim, K. W. Bang, H. M. Choi, H. Y. Moon and S. M. Han. 2019b. Anti-inflammatory activites of drone pupae (Apis mellifera L.) in macrophage. J. Apic. 34(3): 255-259.
[https://doi.org/10.17519/apiculture.2019.09.34.3.255]

-
Kim, H. Y., S. O. Woo, S. G. Kim, H. M. Choi, H. Y. Moon and S. M. Han. 2020. Antioxidant and antihyperglycemic effects of honeybee drone pupae (Apis mellifera L.) extracts. J. Apic. 35(1): 33-39.
[https://doi.org/10.17519/apiculture.2020.04.35.1.33]

-
Kim, S. G., S. O. Woo, K. W. Bang, H. R. Jang and S. M. Han. 2018. Chemical composition of drone pupa of Apis mellifera and its nutritional evaluation. J. Apic. 33(1): 17-23.
[https://doi.org/10.17519/apiculture.2018.04.33.1.17]

-
Kim, S., S. G. Kim, H. Y. Kim, S. O. Woo, H. M. Choi, H. J. Moon and S. M. Han. 2021. Detection of alcohol dehydrogenase activity in extract of drone pupa. J. Apic. 36(3): 189-194.
[https://doi.org/10.17519/apiculture.2021.09.36.3.189]

-
Kim, S., S. G. Kim, H. Y. Kim, S. O. Woo, H. M. Choi, H. J. Moon and S. M. Han. 2022. Effect of drone pupa on the secretion of inerleukin-1beta, Tumor necrosis factor-alpha, and Interleukin-6 in the human monocytic cell line U937. J. Apic. 37(1): 59-66.
[https://doi.org/10.17519/apiculture.2022.04.37.1.59]

- Lee, H. J., M. Seo, I. W. Kim, J. H. Lee, J. A. Hwang and M. A. Kim. 2017. The anti-inflammatory and antiallergic effects of Allomyrina dichotoma larva hot water extract. J. Life Sci. 27(10): 1130-1136.
-
Lee, H. W., J. H. Ahn, M. Kim, H. Y. Weon, J. Song, S. J. Lee and B. Y. Kim. 2013. Diversity and antimicrobial activity of actinomycetes from fecal sample of Rhinoceros beetle larvae. Korean J. Microbiol. 49(2): 156-164.
[https://doi.org/10.7845/kjm.2013.3041]

-
Lim, H. J. and E. H. Byun. 2021. Evaluation of anti-cancer activity of Gryllus bimaculatus water extract on non-small cancer lung cell via apoptosis. Prev. Nutr. Food Sci. 26(4): 453-458.
[https://doi.org/10.3746/pnf.2021.26.4.453]

-
Liu, M., C. Zhang, X. Xu, X. Zhao, Z. Han, D. Liu, R. Bo, J. Li and Z. Liu. 2021. Ferulic acid inhibits LPS-induced apoptosis in bovine mammary epithelial cells by regulating the NF-kB and Nrf2 signalling pathways to restore mitochondrial dynamics and ROS generation. Vet. Res. 52(1): 104.
[https://doi.org/10.1186/s13567-021-00973-3]

-
Nepal, S. and P. H. Park. 2013. Activation of autophagy of globular adiponectin attenuates ethanol-induced apoptosis in HepG2 cells: involvement of AMPK/FoxO3A axis. Biochem. Biophy. Acta 1833(10): 2111-2125.
[https://doi.org/10.1016/j.bbamcr.2013.05.013]

-
Qian, L., P. Deng, F. Chen, Y. Cao, H. Sun and H. Liao. 2022. The explanation and utilization of functional substances in edible insects: a review. Food Prod. Process. and Nutr. 4: 11.
[https://doi.org/10.1186/s43014-022-00090-4]

-
Raza, H., A. John and J. Shafarin. 2016. Potentiation of LPS-induced apoptotic cell death in human hepatoma HepG2 cells by aspirin via ROS and mitochondrial dysfunction: protection by N-acetyl cysteine. PLos ONE 11(7): e0159750.
[https://doi.org/10.1371/journal.pone.0159750]

-
Rodriguez, I., E. Saavedra, H. del Rosario, J. Perdomo, J. Quintana, F. Prencipe, P. Oliva, R. Romagnoli and F. Estévez. 2021. Apoptosis pathways triggered by a potent antiproliferative hybrid chalcone on human melanoma cells. Int. J. Mol. Sci. 22(24): 13462.
[https://doi.org/10.3390/ijms222413462]

- Seo, M., H. J. Lee, J. H. Lee, M. Baek, I. W. Kim, S. Y. Kim, J. S. Hwang and M. A. Kim. 2019. Erratum to “a study of the anti-inflammatory effect of protein derived from Tenebrio moliter larvae”. J. Life Sci. 29(10): 1171.
- Shin, Y. P., J. H. Lee, I. W. Kim, M. Seo, M. A. Kim, H. J. Lee, M. Baek, S. H. Kim and J. S. Hwang. 2020. Anti-inflammatory activity of antimicrobial peptide zophobacin 1 derived from the Zophobas atratus. J. Life Sci. 30(9): 804-812.
-
Siegel, R. L., K. D. Miller, H. E. Fuchs and A. Jemal. 2022. Cancer statistics, 2022. CA Cancer J. Clin. 72: 7-33.
[https://doi.org/10.3322/caac.21708]

-
Statistics Korea. 2021. 2020 Cause of death statistics, Statistics Korea, Daejeon, Korea.
[https://doi.org/10.1787/bd274241-en]

-
Sung, G. A., M. H. Kim and S. N. Park. 2016. Anti-inflammatory and whitening effects of Protaetia brevitarsis seulensis extracts by oriental conversion methods. J. Soc. Cosmet. Sci. Korea 42(4): 421-432.
[https://doi.org/10.15230/SCSK.2016.42.4.421]

-
Suo, H., P. Sun, C. Wang, D. Peng and X. Zhao. 2015. Apoptotic effects of insect tea in HepG2 human hepatoma cells. CyTA - J. Food 14(2): 169-175.
[https://doi.org/10.1080/19476337.2015.1076521]

-
Tanaka, M., A. Sato, Y. Kishimoto, H. Mabashi-Asazuma, K. Kondo and K. Iida. 2020. Gallic acid inhibits lipid accumulation via AMPK pathway and suppresses apoptosis and macrophage-mediated inflammation in hepatocyte. Nutrients 12(5): 1479.
[https://doi.org/10.3390/nu12051479]

-
Wang, J., D. Yang, Q. Luo, M. Qiu, L. Zhang, B. Li, H. Chen, H. Yi, X. Yan, S. Li and J. Sun. 2017. APG-1252-12A induces mitochondria-dependent apoptosis through inhibiting the antiapoptotic proteins Bcl-2/Bcl-xL in HL-60 cells. Int. J. Oncol. 51(2): 563-572.
[https://doi.org/10.3892/ijo.2017.4028]

-
Wu, R., Q. Ding, H. Lu, H. Tan, N. Sun, K. Wang, R. He, L. Luo, H. Ma and Z. Li. 2020. Caspase-3-mediated cytotoxicity of mealworm larvae (Tenebrio molitor) oil extract against human hepatocellular carcinoma and colorectal adenocarcinoma. J. Ethnopharmacol. 250: 112438.
[https://doi.org/10.1016/j.jep.2019.112438]

-
Zhao, Q., Y. U. Kim, I. H. Han and J. M. Yun. 2016. Inhibition of cell proliferation and induction of apoptosis by ethanolic extract of Lespedeza cuneate G. Don in human colorectal cancer HT-29 cells. J. Korean Soc. Food Sci. Nutr. 45(6): 911-917.
[https://doi.org/10.3746/jkfn.2016.45.6.911]
