꿀벌응애 (Varroa destructor) 감염 비율이 양봉꿀벌 (Apis mellifera) 월동 폐사에 미치는 영향
Abstract
Recent incidents of honey bee (A. mellifera) losses during overwintering have become increasingly common in domestic beekeeping. The primary cause of honey bee losses during overwintering is attributed to varroa mite (V. destructor), and it is known that damages can escalate significantly when multiple factors act in combination. Effective control of varroa mite requires relevant knowledge, particularly ecological information that influences honey bee colonies. Therefore, this study aims to evaluate the impact of varroa mite infection levels on overwintering success rates and post-overwintering development of honey bee colonies. To achieve this, honey bee colonies were subjected to levels of varroa mite infection across treatment groups from December 2023 to February 2024. We were then compared for parameters such as strength of honey bee colonies, detected number of varroa mites, and colony weight. As a result, it is evident that the overall average cumulative number of dead bodies was highest in the group with over 10% varroa mite infection, at 40.1±53.0. The average cumulative number of detected varroa mites were also highest in the group with over 10% varroa mite infection, at 2.0±3.1. Post-overwintering success rates were 80% in the control group, 100% in the group with less than 5% varroa mite infection, and 20% in the group with over 10% varroa mite infection. Overall, negative effects on the honey bee colonies were observed in the group with over 10% varroa mite infection. Based on the results of this study, it is considered that they can serve as predictive baseline data for honey bee overwintering success and post-overwintering colony development, according to the level of varroa mite infection.
Keywords:
Varroa mite, Colony losses, Post-overwintering, Varroa mite population, Honey bee death서 론
꿀벌 (Apis sp.)은 자연과 농업생태계에서 대부분의 작물 및 야생 식물이 번식하는 데 도움을 준다 (Abrol, 2012; Aryal et al., 2020; Papa et al., 2022). 또한, 꿀벌은 생물 다양성을 유지하는 생태계 공생 시스템의 중요한 부분을 차지한다 (Paudel et al., 2015; Papa et al., 2022). 이와 함께 인간 사회에서 직간접적으로 상당한 경제적 영향력을 미치며, 그 가치와 중요성은 오늘날까지 지속적으로 연구되고 있다 (Southwick and Southwick, 1992; Khalifa et al., 2021). 그러나 최근 발생하는 이상기온과 여러 가지 꿀벌을 위협하는 요인들로 인해 꿀벌이 봉군을 유지하는 데 상당한 어려움을 겪고 있으며, 경제적 피해도 매년 증가하고 있다 (Conte and Navajas, 2008; Hristov et al., 2020; Laurino et al., 2020). 2006년 미국에서는 양봉꿀벌 (A. mellifera)이 갑자기 절멸하거나 사라지는 현상인 봉군붕괴현상 (Colony collapse disorder; CCD)이 발생하였고 (Ellis et al., 2015), 국내에서도 2022년 월동 봉군 폐사 및 실종 현상이 일어났다 (Jung and Bae, 2022; Lee et al., 2022). 많은 연구자들은 이러한 현상의 원인을 파악하고자 노력하였는데, 여러 요인들 중 가장 대표적 원인으로 꿀벌응애 (Varroa destructor)를 지목하고 있다 (Downey and Winston, 2001; Kim and Lee, 2022; Stahlmann-Brown et al., 2022; Tang et al., 2023). 꿀벌응애는 양봉꿀벌과 재래꿀벌 (A. cerana) 등에 기생하며, 종족을 번식시키는 생활사를 갖는 생물이다 (Traynor et al., 2020; Kim, 2022). 꿀벌이 꿀벌응애에 감염되면 봉군에 여러 가지 문제가 발생하게 된다. 꿀벌응애의 원 기주는 재래꿀벌이었으나 1900년대 초 산업화에 의해 꿀벌 종 간 서식처 경계가 없어져 양봉꿀벌로 기주전환되었다 (Beaurepaire et al., 2015; Kaise and Hoshiba, 2023). 국내에서는 양봉꿀벌 사육봉군수가 재래꿀벌 사육봉군수보다 상대적으로 크기 때문에 양봉농가의 피해가 크게 보고되고 있다. 꿀벌응애 문제는 해를 거듭하며 지속적으로 발생하고 있으며, 이에 대한 대책 수립이 시급한 상황이다.
꿀벌응애가 양봉꿀벌에 발생시키는 문제는 다양하다. 첫 번째로 양봉꿀벌의 체액을 흡즙하는 과정에서 여러 가지 병원균을 매개하는 벡터 (vector, 운반자)가 된다 (Manley et al., 2020; Posada-Florez et al., 2020). 다양한 바이러스를 매개하는데 대표적으로 Deformed Wing Virus (DWV)와 Black Queen Cell Virus (BQCV) 등이 있다. DWV는 성충 일벌의 날개에 문제를 일으켜 정상적인 날개 운동을 어렵게 한다 (Ryabov et al., 2020). 정상적인 날개 운동이 불가능한 성충은 외역활동을 할 수 없게 되고, 봉군 내부 온도 조절 능력에 문제가 발생하게 된다. BQCV의 경우 여왕벌의 산란 능력과 수명에 영향을 주는 바이러스로서 봉군의 세력을 감소시키거나 붕괴까지도 유발할 수 있다 (Naggar and Paxton, 2020). 두 번째 문제로는 꿀벌 개체별로 수명과 면역력을 감소시켜 전체 봉군에 영향을 주게 된다 (Bourgeois et al., 2016). 앞서 언급한 바이러스에 감염되지 않더라도 성충의 수명이 줄어들거나 여러 가지 질병에 취약하게 된다 (Noel et al., 2020). 성충의 수명이 줄어들게 되면 봉군 내부 환경 유지가 어려워지고, 결국엔 봉군 개체수 감소 현상이 나타날 수 있다 (Messan et al., 2021; Kim, 2022). 마지막으로 꿀벌응애에 감염된 꿀벌은 다른 환경 요인들과 복합적으로 작용하여 더 큰 문제를 야기한다. 예를 들어 이상기후현상에 의하여 꿀벌 봉군의 세력이 감소하고, 온도와 습도 및 먹이 공급에 차질이 생긴 상태에서 꿀벌응애 감염까지 겹치게 된다면, 봉군 내 항상성 유지는 거의 불가능하게 되고 결국에는 폐사로 이어질 가능성이 높아진다 (Bruckner et al., 2021; Schwartz et al., 2021). 또한, 국내 노지에서 대중적으로 사용되는 네오니코티노이드계 살충제 등에 노출된 꿀벌은 꿀벌응애 감염과 결합되면서 생리적 및 봉군 항상성 유지에 영향을 받아 세력이 약화될 수 있다 (Annoscia et al., 2020; Son et al., 2023). 이후, 연중 가장 혹독한 시기인 겨울에 위와 같은 문제가 지속되면서 봉군이 절멸하거나 실종되는 상황이 발생하게 된다 (Insolia et al., 2022).
국내 양봉농가에서는 꿀벌응애를 방제하기 위해 여러 가지 방법을 사용한다. 몇 년 전까지만 하더라도 아미트라즈, 쿠마포스, 플루발리네이트 등 합성 살충 성분을 사용하였다 (Bahreini et al., 2020; Benito-Murcia et al., 2021). 대부분의 양봉농가에서는 이 약제들을 봉군에 충분히 처리하고 월동에 들어가게 된다. 그러나 이 성분들은 양봉꿀벌에도 영향을 주며, 결정적으로 꿀벌응애가 해당 성분들에 저항성을 갖게 되었다 (Higes et al., 2020; Rinkevich, 2020). 결국에는 해당 약제들을 사용하더라도 꿀벌응애의 방제 효율은 낮아지고 밀도 조절량은 감소하였다. 게다가, 양봉꿀벌에만 부정적 영향을 미쳐 봉군 세력이 약화되는 경우가 발생하게 된다 (Gashout et al., 2020; Begna and Jung, 2021.). 이를 해결하기 위한 대응책으로 양봉 관련 업계에서는 천연물을 통해 꿀벌응애를 방제하기 시작하였다. 개미산 또는 옥살산 등을 사용하여 꿀벌응애의 기문을 막아 질식시켜 방제하는 형태이다 (Cauia and Cauia, 2022). 다만 이러한 방제 방법 역시 양봉꿀벌에도 영향을 미치며, 양봉꿀벌 봉군에 과도하게 사용한 경우 봉군 세력 감소 현상이 일어나게 된다 (Genath et al., 2020). 실질적으로 꿀벌응애의 밀도를 효과적으로 조절하기 위한 완벽한 방법은 존재하지 않으며, 지속적인 봉군 관리와 함께 다양한 방제법을 적절하게 사용해야 한다. 양봉꿀벌 봉군 내 꿀벌응애의 효과적인 방제와 성공적인 월동 기술을 개발하기 위해서는 꿀벌응애의 밀도와 생태 및 두 종 간 개체군 영향 연구가 필요하다.
따라서, 본 연구에서는 양봉꿀벌 봉군의 월동 폐사와 월동 전 꿀벌응애 밀도 간의 관계를 평가하는 것을 목적으로 하였다. 이를 수행하기 위해 월동 전 꿀벌응애 감염 강도에 따라 월동 중 발생하는 양봉꿀벌 사충수를 조사하였다. 또한, 양봉꿀벌 사체에서 검출된 꿀벌응애의 수를 그룹별로 비교하였고, 봉군의 소문 앞에서 관찰된 양봉꿀벌 사체의 수와 검출된 꿀벌응애 사이의 상관성을 분석하였다. 마지막으로 월동 이후 꿀벌응애 감염 정도에 따라 봄철 꿀벌 개체 및 봉군의 발육 규모를 평가하였다.
재료 및 방법
1. 실험 지역 및 공시충
실험은 전라북도 완주군 이서면 국립농업과학원 시험양봉장 (35°49ʹ49.3ʺN, 127°02ʹ14.7ʺE)에서 2023년 12월부터 2024년 3월까지 수행되었다. 실험 봉군 선정은 2023년 10월 하순 월동 산란이 종료된 봉군을 선택하였다. 실험에 사용된 양봉꿀벌 봉군은 그룹별로 5개씩 모두 15개로 평균 5±1.5매에 해당하는 세력으로 조절하였다. 모든 벌통은 나무로 만들어진 일반적인 형태이며, 바닥판은 벌통 뒤에서 슬라이딩 식으로 뽑을 수 있게 만들어져 있다. 처리는 3개의 그룹으로 나누어서 진행하였는데, 월동 전 젤 형태의 개미산 처리 기간을 달리하여 꿀벌응애 밀도를 조절하였다. 양봉꿀벌 봉군에서 꿀벌응애 감염율이 30%가 넘어가게 되면, 월동을 시작하기 전에 폐사가 되기 때문에 월동 전에 일반적 감염 수준 중 최대인 10%를 처리 기준으로 설정하였다 (Kim, 2016). 3개 그룹은 각각 꿀벌응애 10% 이상 감염 그룹과 5% 미만 감염 그룹, 대조구 (꿀벌응애 완전 방제)로 설정하였다. 각 그룹의 꿀벌응애 감염률 평가는 Macedo et al. (2002)가 발표한 방법으로 수행하였다. 이 방법에 따라 10% 이상 감염 그룹의 감염률은 평균 16.4±2.7%이고, 5% 이하 감염 그룹은 5.6±2.7%, 대조구는 0.1±0.3%로 나타났다.
2. 양봉꿀벌 사충수 및 꿀벌응애 검출 모니터링
2023년 12월 6일부터 모든 시험 봉군은 월동을 시작하였다. 월동 시작과 함께 매주 1회, 소문 앞 양봉꿀벌 사체 (Dead Honey bee Body; DHB)를 수거하였다. 각 봉군의 소문 앞에는 양봉꿀벌이 사체를 멀리 옮기지 못하도록 차단 케이지를 설치하여 사체가 최대한 소문 앞에 남게 조절하였다. 차단 케이지는 나무와 철망을 이용하여 직접 제작하였다. 철망의 사이즈는 양봉꿀벌 성충은 단독으로 쉽게 출입할 수 있으나, 사체를 가지고 통과하지 못하는 사이즈로 제작되었다. 수거된 양봉꿀벌 사체는 실험실에 가져와 붙어있는 꿀벌응애 (Detected Varroa Mite; DVM)를 계수하고 기록하였다. 이후 양봉꿀벌의 월동은 2024년 2월 29일에 종료되었다. 월동 종료 직후 꿀벌응애 10% 이상 감염 그룹 내 5개 봉군을 대상으로 각 봉군당 발생한 양봉꿀벌 누적 사충수 대비 검출된 꿀벌응애 수를 비교하였다.
3. 꿀벌응애 밀도 및 봉군 발육 조사
월동 전과 후에 꿀벌응애 밀도를 조사하였다. 조사는 벌통 바닥판에 떨어진 꿀벌응애를 계수하는 방법으로 하였다. 또한, 월동 전과 월동이 끝난 후 각 처리별 봉군을 대상으로 봉군 무게를 측정하였다. 무게는 월동 직전 한 번과 주 1회씩 두 번, 월동 직후 한 번으로 총 4회 측정되었다. 월동 후 봉군 세력을 측정하였는데, 2024년 3월 22일까지 총 3회 측정하였다. 폐사된 봉군의 세력은 0으로 하여 계산하였다. 양봉꿀벌 봉군 세력은 Delaplane et al. (2013)의 방법을 이용하여, 성충과 번데기방 수를 계수한 뒤 기록하였다. 봉군 세력은 월동이 끝나고, 한 달간 매주 1회 계수하였으며, 그룹별 평균 봉군 발달 정도를 계산하였다.
4. 자료 분석
월동 중 처리 그룹 간 양봉꿀벌 벌통 소문 앞 평균 DHB 수와 DVM 수는 모두 정규성을 나타냈으며, One-way ANOVA로 95% 신뢰구간 수준에서 검정하였다. 그리고 Tukey’s HSD test로 사후검정하였다. 또한, 전체 월동 기간 중 그룹 간 평균 누적 DHB 수와 DVM 수도 동일한 방법으로 검정하였다. 월동 기간 중 DVM 수와 DHB 수 사이의 관계는 선형회귀를 통해 분석하였다. 각 변수는 정규성이 없어 로그 변환을 하고 분석하였다. 월동 후 처리 그룹 간 양봉꿀벌 벌통 평균 무게는 One-way ANOVA 비교하고, Tukey’s HSD test로 사후검정하였다. 처리 그룹 간 평균 봉군 세력 (성충 수와 번데기방 수)은 모두 정규성을 나타내지 않아 비모수검정인 Kruskal-Wallis test를 수행하여 95% 신뢰구간 수준에서 비교하였고, Bonferroni test를 통해 사후검정되었다.
결 과
1. 월동 중 벌통 소문 앞 양봉꿀벌 사충수
전체 시험 봉군에서 월동 중 벌통 소문 앞 DHB는 총 4,377마리가 발생하였다. 월동 전부터 월동 종료일 후까지 각 그룹별 DHB의 평균을 비교한 결과 (Table 1), 2023년 12월 20일 외에는 통계적 차이를 나타내지 않았다. 해당 일에는 10% 이상 감염 그룹이 가장 많은 사충수를 보였고, 5% 미만 감염 그룹과 차이가 있었지만 대조군과는 통계적 차이가 없었다. 전체 월동 기간 동안 발생한 처리군별 벌통 소문 앞 평균 누적 DHB를 비교한 결과 (Fig. 1) 꿀벌응애 10% 이상 감염 그룹에서 40.1±53.0마리로 가장 높았다. 통계적으로 10% 이상 감염 그룹은 대조군과 차이가 없었고, 5% 미만 감염 그룹과 차이가 있었다.

Comparison of the mean number of dead honey bee (Apis mellifera) bodies (DHB) (mean±SD) found at the entrance of the beehive by each varroa mite (Varroa destructor) treatment groups during the overwintering season from 2023 to 2024. The comparison of group means was conducted using the one-way ANOVA (P<0.05). The post-hoc test utilized the Tukey’s HSD test
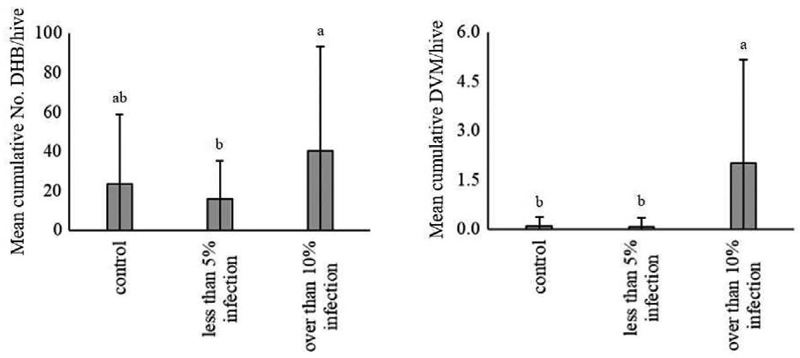
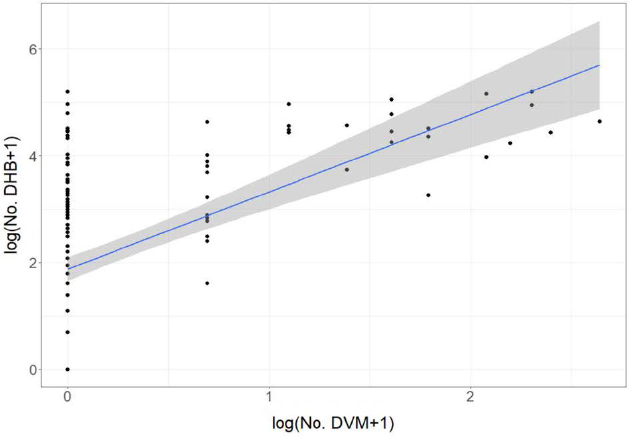
Mean accumulated number of dead honey bee (Apis mellifera) bodies (DHB) per hive at beehive entrances and mean cumulative detected varroa mite (Varroa destructor) (DVM) per beehive by treatment group, throughout the overwintering season. The error bars represent the standard deviation. The mean differences between groups were tested using a one-way ANOVA (P<0.05), followed by post-hoc utilized the Tukey’s HSD test.
2. 월동 중 꿀벌응애 검출수 및 꿀벌응애 검출에 따른 양봉꿀벌 사충수
전체 시험 봉군에서 월동 중에 벌통 소문 앞에 발생한 양봉꿀벌 사체에서 DVM은 총 120마리가 검출되었다. 그룹별 평균 DVM을 비교한 결과 2024년 2월 10일을 제외한 모든 조사일에서 차이가 없었다 (Table 2). 해당 일자에 10% 이상 감염 그룹에서 가장 높은 2.6±1.9마리를 나타냈으며, 대조군과 5% 미만 감염 그룹에서는 검출되지 않았다. 평균 누적 DVM의 경우 꿀벌응애 10% 이상 감염 그룹이 2.0±3.1마리로 가장 높게 나타났으며, 나머지 두 그룹과 통계적으로 유의한 차이를 나타냈다 (Fig. 1). DHB와 월동 기간 중 발생한 DVM 사이를 직선회귀한 결과 (Fig. 2) 꿀벌응애 검출이 높을수록 벌통 소문 앞 양봉꿀벌 사충수가 증가하는 경향이 있었다 (log (No. DHB+1)=1.8756+1.4478×log (No. DVM+1)). 선형회귀모델은 30.48%로 설명되며, 통계적으로 유의하였다 (P<0.001).

Comparison of detected varroa mite (Varroa destructor) (DVM) mean counts (mean±SD) in each treatment group on dead honey bee (Apis mellifera) bodies at colony entrances from 2023 to 2024. The comparison of group means was conducted using the one-way ANOVA (P<0.05). The post-hoc test utilized the Tukey’s HSD test
3. 월동 후 봉군 세력과 생존율
월동이 종료된 후 각 그룹별로 월동성공률은 대조구가 80%, 5% 미만 감염 그룹은 100%, 10% 이상 감염 그룹은 20%로 나타났다. 대조구 중 하나의 봉군에서 2024년 1월 31일에 여왕벌의 시체가 벌통 소문 앞에서 관찰되었다. 꿀벌응애 10% 이상 감염 그룹 내에서 월동 중 발생한 양봉꿀벌 누적 사충수에서 검출된 꿀벌응애 누적 검출수의 비율을 계산한 결과 (Table 3), 폐사하지 않은 1번 봉군이 가장 낮은 비율을 나타냈다. 월동 전과 월동 종료 직후 처리 그룹별 평균 봉군 무게를 비교한 결과 (Fig. 3), 월동 전에는 모든 봉군의 무게 차이가 통계적으로 유의하지 않았으나, 월동 종료 직후 평균 봉군 무게에서 차이를 나타냈다. 5% 미만 꿀벌응애 감염 그룹이 21.8±1.3 kg으로 가장 무거웠으며, 대조군 17.9±9.1 kg, 10% 이상 감염 그룹은 5.5±11.1 kg 순으로 나타났다. 월동 종료부터 각 처리별 평균 봉군 세력을 비교한 결과 (Fig. 4), 성충 수의 경우 꿀벌응애 10% 이상 감염 그룹이 621.0±1292.8마리로 가장 낮았으며, 통계적으로 유의하였다. 대조군과 5% 미만 감염 그룹은 차이가 없었다. 번데기방의 경우도 10% 이상 감염 그룹이 243.3±581.1마리로 가장 낮았으며, 통계적으로 유의하였고, 대조군과 5% 미만 감염 그룹 간 차이는 나타나지 않았다.

Rate of cumulative detected varroa mite (Varroa destructor) (DVM) counts per number of dead honey bee (Apis mellifera) bodies (DHB) in groups of varroa mite over than 10% infection during overwintering
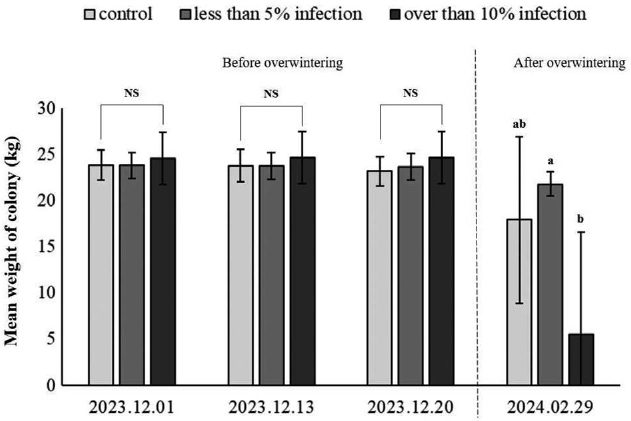
Average weight of honey bee (Apis mellifera) colony before and after overwintering, by varroa mite (Varroa destructor) infection treatment groups. The error bars represent the standard deviation. The mean differences between groups were tested using a one-way ANOVA (P<0.05), followed by post-hoc utilized the Tukey’s HSD test.
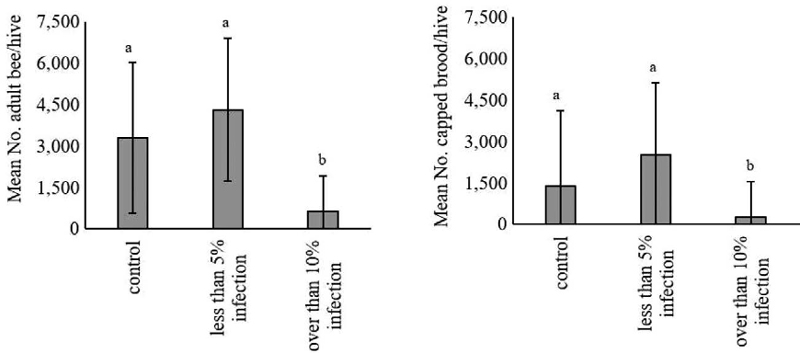
Comparison of honey bee (Apis mellifera) colony strength (mean No. adult bees and mean No. capped broods) by treatment group surveyed until March 22nd in 2024, at the end of the overwintering season. The error bars represent the standard deviation. Each groups mean was compared using the Kruskal-Wallis test (P<0.05), followed by post-hoc tested the Bonferroni test.
4. 월동 후 꿀벌응애 밀도
월동 전과 월동이 종료된 후 벌통 바닥판에서 조사된 꿀벌응애는 총 584마리로 나타났다. 월동 전 조사의 경우 꿀벌응애가 총 333마리가 검출되었으며, 월동 종료 후에는 251마리로 확인되었다. 각 벌통 바닥판에서 확인되는 꿀벌응애 밀도를 조사하고, 각 처리 그룹별로 비교한 결과 (Table 4), 월동 전에는 꿀벌응애 10% 이상 감염 그룹이 23.5±19.8마리로 가장 높게 나타났으며, 통계적으로 유의하였다. 그러나 월동 후의 바닥판 꿀벌응애 밀도를 비교한 결과 꿀벌응애 10% 이상 감염 그룹이 38.7±54.8마리로 가장 높기는 하였으나, 통계적으로 유의하지는 않았다.

Comparison of varroa mite (Varroa destructor) density (mean±SD) on beehive bottom boards by each treatment groups, detected before and after the overwintering season. The means number of varroa mites each treatment groups were compared using the Kruskal-Wallis test (P<0.05), followed by post-hoc testing with the Bonferroni test
고 찰
월동 전 꿀벌응애 감염 정도에 따라 월동 중 양봉꿀벌 사충수를 조사한 결과 꿀벌응애 10% 이상 감염 그룹에서 월동 중에 지속적으로 양봉꿀벌의 사충수가 높게 나타났으며, 결국 누적 사충수도 다른 처리 그룹 대비 가장 높은 것을 확인하였다. 현재까지 많은 연구자들은 꿀벌 봉군 손실에 대한 주요 원인으로 꿀벌응애를 지목하고 있는데, 월동 전 꿀벌응애의 밀도가 상당히 중요하다고 알려져 있다 (Giacobino et al., 2014; Seeley and Smith, 2015; Gregorc and Sampson, 2019; Hristov et al., 2020). 그렇기 때문에, 연구자들은 월동에 들어가기 전 꿀벌응애의 밀도를 조절하는 것이 건강한 봉군 관리의 핵심이 될 수 있다고 제언한다 (Giacobino et al., 2016).
대조구와 꿀벌응애 5% 미만 감염 그룹의 경우 월동 중 양봉꿀벌 사충수가 큰 차이를 나타내지 않았다. 꿀벌응애 감염 정도가 5% 미만 정도로만 되도록 조절을 하더라도 월동 중 봉군에 미치는 피해를 크게 감소시킬 수 있을 것으로 예상되지만, 추가로 구체적인 연구도 필요해 보인다. 완전 방제의 경우 개미산 처리를 상대적으로 오랜 기간 처리 하였는데, 이러한 부분은 오히려 양봉꿀벌에 부정적인 영향을 끼칠 우려가 있다. 실제로 월동 중 양봉꿀벌 사충수는 대조구가 꿀벌응애 5% 미만 감염 그룹보다 상대적으로 높은 수치를 나타냈다. Ostermann and Currie (2004)의 경우 양봉꿀벌 봉군에 개미산을 처리할 때 꿀벌응애의 밀도에 따라 적용되는 약효가 다를 수 있고, 양봉꿀벌에도 부정적인 영향을 줄 수 있다고 하였다. 본 연구에서는 약제의 위해성에 관하여 자세하게 다루지 않았으나 개미산이 꿀벌응애에 효과적이면서도 양봉꿀벌에 영향을 줄 수 있으니 사용에 주의해야 할 필요가 있다 (Underwood and Currie, 2003).
월동 전 꿀벌응애 감염 정도에 따라 월동 중 양봉꿀벌 사체에서 검출된 꿀벌응애의 수를 매주 비교한 결과 2024년 1월 10일을 제외한 모든 조사일에서 통계적으로 차이는 없었다. 2024년 1월 10일에만 통계적인 차이를 보인 원인에 대해 명확한 이유를 검증하기에는 본 연구의 결과로는 한계가 있다. 다만, 이전에 연구된 사례 등을 참고하여 국내 기후 특성상 급격한 온도 변화 (Lee et al., 2022)와, 질병 등 기타 여러 요인들과 꿀벌응애의 복합적인 영향도 의심해 볼 수 있다 (Beyer et al., 2018; Neov et al., 2019). 월동 중 양봉꿀벌 사체에서 검출된 꿀벌응애의 수가 각 봉군의 양봉꿀벌 사충수와의 상관성을 분석한 결과 검출된 꿀벌응애의 수가 많을수록 양봉꿀벌 사체가 증가하는 경향을 보였다. 이는, 월동 중 소문 앞 사봉이 눈에 띄게 증가한다면 꿀벌응애 피해를 의심해 볼 필요가 있다. 이전에 발표된 관련 연구에서도 월동 중 벌통 소문 앞에 쌓이는 양봉꿀벌 사충수는 꿀벌응애 피해와 관련이 있다고 한다 (Doke et al., 2015; Zee et al., 2015). 물론 다른 요인들이 존재하기는 하나, 꿀벌응애와 복합적으로 문제를 발생시켜 봉군에 위협을 줄 수 있으며 (Desai and Currie, 2016), 봉군 관리자는 소문 앞 꿀벌 사체 관리를 수행할 필요가 있다.
월동 종료 후 양봉꿀벌 봉군의 월동 성공률은 대조구가 80%, 꿀벌응애 5% 미만 감염 그룹이 100%, 꿀벌응애 10% 이상 감염 그룹이 20%로 나타났다. 대조구는 한 개의 봉군에서 알 수 없는 이유로 여왕벌이 사망하여 폐사하였고, 꿀벌응애 10% 이상 감염 그룹은 월동 중에 4개 봉군이 폐사하였다. 또한, 모든 처리 그룹은 월동 전에 비슷한 봉군 무게로 측정되었지만, 월동 종료 후 꿀벌응애 10% 이상 감염 그룹에서 가장 낮은 평균 봉군 무게를 나타냈다. 꿀벌응애의 감염율이 높았던 그룹의 폐사율이 가장 높았는데, 이와 비슷한 연구에서도 꿀벌응애의 개체군이 클수록 양봉꿀벌 성충 겨울벌의 수명에 부정적인 영향을 초례한다고 알려져 있다 (Dooremalen et al., 2012). 또한, 꿀벌응애 10% 이상 감염 그룹에서 시험 봉군별로 월동 중 소문 앞 양봉꿀벌 누적 사충수 대비 검출된 누적 꿀벌응애 수를 비교한 결과 폐사하지 않은 1번 봉군이 가장 낮은 비율을 나타냈다. 이전 연구에 따르면 꿀벌응애에 감염된 봉군이라도 봉군의 세력이 좋고, 건강하다면 꿀벌응애 저항성도 증가할 수 있다고 한다 (Buchler et al., 2010; Eynard et al., 2020). 또한, 양봉꿀벌이 사망하면 기생하던 꿀벌응애도 같이 사망하기 때문에 다른 꿀벌로 집중되지 않는다고도 알려져 있으며 (Fries and Perez-Escala, 2001), 이와 관련된 추가적인 연구가 필요해 보인다.
월동 종료 후 봄철 성충의 수 및 번데기방의 수는 꿀벌응애 10% 이상 감염 그룹에서 가장 낮았다. 월동 종료 후 남아있는 양봉꿀벌의 세력은 봄철 봉군 발달에 필수적인 요소이다 (DeGrandi-Hoffman et al., 2023). 양봉꿀벌이 월동에 큰 피해없이 성공하려면 월동에 들어가기 전 꿀벌응애의 밀도를 집중적으로 조절해야 한다 (Akyol and Yeninar, 2011). 또한, 대조구와 꿀벌응애 5% 미만 감염 그룹은 차이가 없었는데, 대조구에서 폐사 봉군이 한 개 나왔던 것을 미루어 보았을 때 5% 미만 정도가 양봉꿀벌에 피해를 주지 않는 선에서 적당한 방제 강도가 될 것으로 본다. 꿀벌응애 5% 미만 정도의 감염률은 꿀벌응애 완전 방제 정도와 함께 봄철 양봉꿀벌이 발달하는 데 있어 상대적으로 안정적인 상황을 보였으며, 추후 외부 온도 등 다른 요인과의 결합을 통한 통합적인 연구도 필요할 것으로 본다.
적 요
월동 전 꿀벌응애 감염 정도에 따른 양봉꿀벌 봉군 월동 성공률과 월동 중 발생하는 사충수를 분석한 결과 꿀벌응애 10% 이상 감염 그룹에서 월동 중 가장 높은 양봉꿀벌 사충수가 확인되었다. 또한, 월동 성공률이 20%로 가장 낮았으며, 봉군 세력도 꿀벌응애 10% 이상 감염 그룹이 가장 낮았다. 대조구와 꿀벌응애 5% 미만 그룹은 모든 변수에서 차이가 나타나지 않았다. 최종적으로 꿀벌응애 검출수가 높을수록 양봉꿀벌 사충수가 증가하는 경향이 있었다. 본 연구의 결과로 양봉꿀벌의 성공적인 월동을 위해 꿀벌응애 최소 밀도 조절량에 대한 기초 정보로 사용할 수 있을 것으로 사료된다.
Acknowledgments
본 연구는 농촌진흥청 연구과제 (PJ01418006)의 지원으로 수행되었다.
References
-
Abrol, D. P. 2012. Honeybee and crop pollination. Poll Biol 85-110.
[https://doi.org/10.1007/978-94-007-1942-2_5]

-
Akyol, E. and H. Yeninar. 2011. The effects of Varroa (Varroa destructor) infestation level on wintering ability and survival rates of honeybee (Apis mellifera L.) colonies. J ANIM VET ADV 10: 1427-1430.
[https://doi.org/10.3923/javaa.2011.1427.1430]

-
Annoscia, D., G. D. Prisco, A. Becchimanzi, E. Caprio, D. Frizzera, A. Linguadoca, F. Nazzi and F. Pennacchio. 2020. Neonicotinoid Clothianidin reduces honey bee immune response and contributes to Varroa mite proliferation. Nat. Commun. 11(1): 5887.
[https://doi.org/10.1038/s41467-020-19715-8]

-
Aryal, S., S. Ghosh and C. Jung. 2020. Ecosystem services of honey bees; Regulating, provisioning and cultural functions. J. Apic. 35(2): 119-128.
[https://doi.org/10.17519/apiculture.2020.06.35.2.119]

-
Bahreini, R., M. Nasr, C. Docherty, O. D. Herdt, S. Muirhead and D. Feindel. 2020. Evaluation of potential miticide toxicity to Varroa destructor and honey bees, Apis mellifera, under laboratory conditions. Sci. Rep. 10(1): 21529.
[https://doi.org/10.1038/s41598-020-78561-2]

-
Beaurepaire, A. L., T. A. Truong, A. C. Fajardo, T. Q. Dinh, C. Cervancia and R. F. A. Moritz. 2015. Host specificity in the honeybee parasitic mite, Varroa spp. In Apis mellifera and Apis cerana. PLoS One 10(8): e0135103.
[https://doi.org/10.1371/journal.pone.0135103]

-
Begna, T. and C. Jung. 2021. Effects of sequential exposures of sub-lethal doses of amitraz and thiacloprid on learning and memory of honey bee foragers, Apis mellifera. J. Asia-Pac. Entomol. 24(2): 77-83.
[https://doi.org/10.1016/j.aspen.2021.03.012]

-
Benito-Murcia, M., C. Bartolome, X. Maside, J. Bernal, J. L. Bernal, M. J. D. Nozal, A. Meanam, C. Botias, R. Martin-Hernandez and M. Higes. 2021. Residual tau-fluvalinate in honey bee colonies is coupled with evidence for selection for Varroa destructor resistance to pyrethroids. Insects 12(8): 731.
[https://doi.org/10.3390/insects12080731]

-
Beyer, M., J. Junk, M. Eickermann, A. Clermont, F. Kraus, C. Georges, A. Reichart and L. Hoffmann. 2018. Winter honey bee colony losses, Varroa destructor control strategies, and the role of weather conditions: Results from a survey among beekeepers. Res. Vet. Sci. 118: 52-60.
[https://doi.org/10.1016/j.rvsc.2018.01.012]

-
Bourgeois, A. L., T. E. Rinderer, L. I. D. Guzman and B. Holloway. 2016. Molecular genetic analysis of Varroa destructor mites in brood, fallen injured mites, and worker bee longevity in honey bees. J. Apic. Res. 54(4): 328-334.
[https://doi.org/10.1080/00218839.2016.1160635]

-
Bruckner, S., L. Straub, P. Neumann and G. R. Williams. 2021. Synergistic and antagonistic interactions between Varroa destructor mites and neonicotinoid insecticides in male Apis mellifera honey bees. Front. Ecol. Evol. 9: 756027.
[https://doi.org/10.3389/fevo.2021.756027]

-
Buchler, R., S. Berg and Y. L. Conte. 2010. Breeding for resistance to Varroa destructor in Europe. Apidologie 41(3): 393-408.
[https://doi.org/10.1051/apido/2010011]

-
Cauia, E. and D. Cauia. 2022. Improving the varroa (Varroa destructor) control strategy by brood treatment with formic acid - A pilot study on spring applications. Insects 13(2): 149.
[https://doi.org/10.3390/insects13020149]

-
Conte, Y. L. and M. Navajas. 2008. Climate change: impact on honey bee populations and diseases. Rev. Sci. Tech. 27(2): 499-510.
[https://doi.org/10.20506/rst.27.2.1819]

-
DeGrandi-Hoffman, G., V. Corby-Harris, H. Graham, E. Watkins-deJong, M. Chambers and L. Snyder. 2023. The survival and growth of honey bee (Hymenoptera: Apidae) colonies overwintered in cold storage: the effects of time and colony location. J. Econ. Entomol. 116(4): 1078-1090.
[https://doi.org/10.1093/jee/toad103]

-
Delaplane, K. S., J. V D. Steen and E. Guzman-Novoa. 2013. Standard methods for estimating strength parameters of Apis mellifera colonies. Apic. Res. 52(10): 1-12.
[https://doi.org/10.3896/IBRA/1.52.1.03]

-
Desai, S. D. and R. W. Currie. 2016. Effects of wintering environment and parasite-pathogen interactions on honey bee colony loss in north temperate regions. PLoS One 11(7): e0159615.
[https://doi.org/10.1371/journal.pone.0159615]

-
Doke, M. A., M. Frazier and C. M. Grozinger. 2015. Overwintering honey bees: biology and management. Curr. Opin. Insect Sci. 10: 185-193
[https://doi.org/10.1016/j.cois.2015.05.014]

-
Dooremalen, C. V., L. Gerritsen, B. Comelissen, J. J. M. V. D. Steen, F. V. Langevelde and T. Blacquiere. 2012. Winter survival of individual honey bees and honey bee colonies depends on level of Varroa destructor infestation. PLoS One 7(4): e36285.
[https://doi.org/10.1371/journal.pone.0036285]

-
Downey, D. L. and M. L. Winston. 2001. Honey bee colony mortality and productivity with single and dual infestations of parasitic mite species. Apidologie 32: 567-575.
[https://doi.org/10.1051/apido:2001144]

-
Ellis, J. D., J. D. Evans and J. Pettis. 2015. Colony losses, managed colony population decline, and colony collapse disorder in the United States. J. Apic. Res. 49(1): 134-136.
[https://doi.org/10.3896/IBRA.1.49.1.30]

-
Eynard, S. E., C. Sann, B. Basso, A. Guirao, Y. L. Conte, B. Servin, L. Tison, A. Vignal and F. Mondet. 2020. Descriptive analysis of the varroa non-reproduction trait in honey bee colonies and association with other traits related to varroa resistance. Insects 11(8): 492.
[https://doi.org/10.3390/insects11080492]

-
Fries, I. and S. Perez-Escala. 2001. Mortality of Varroa destructor in honey bee (Apis mellifera) colonies during winter. Apidologie 32(3): 223-229.
[https://doi.org/10.1051/apido:2001124]

-
Gashout, H. A., E. Guzman-Novoa, P. H. Goodwin and A. Correa-Benitez. 2020. Impact of sublethal exposure to synthetic and natural acaricides on honey bee (Apis mellifera) memory and expression of genes related to memory. J. Insect Physiol. 121: 104014.
[https://doi.org/10.1016/j.jinsphys.2020.104014]

-
Genath, A., S. Sharbati, B. Buer, R. Nauen and R. Einspanier. 2020. Comparative transcriptomics indicates endogenous differences in detoxification capacity after formic acid treatment between honey bees and varroa mites. Sci. Rep. 10(1): 21943.
[https://doi.org/10.1038/s41598-020-79057-9]

-
Giacobino, A., N. B. Cagnolo, J. Merke, E. Orellano, E. Bertozzi, G. Masciangelo, H. Pietronave, C. Salto and M. Signorini. 2014. Risk factors associated with the presence of Varroa destructor in honey bee colonies from east-central Argentina. Prev. Vet. Med. 115(3-4): 280-287.
[https://doi.org/10.1016/j.prevetmed.2014.04.002]

-
Giacobino, A., A. Molineri, N. B. Cagnolo, J. Merke, E. Orellano, E. Bertozzi, G. Masciangelo, H. Pietronave, A. Pacini, C. Salto and M. Signorini. 2016. Key management practices to prevent high infestation levels of Varroa destructor in honey bee colonies at the beginning of the honey yield season. Prev. Vet. Med. 131: 95-102.
[https://doi.org/10.1016/j.prevetmed.2016.07.013]

-
Gregorc, A. and B. Sampson. 2019. Diagnosis of varroa mite (Varroa destructor) and sustainable control in honey bee (Apis mellifera) colonies - A review. Diversity 11(12): 243.
[https://doi.org/10.3390/d11120243]

-
Higes, M., R. Martin-Hernandez, C. S. Hernandez-Rodriguez and J. Gonzalez-Cabrera. 2020. Assessing the resistance to acaricides in Varroa destructor from several Spanish locations. Parasitol. Res. 119(11): 3595-3601.
[https://doi.org/10.1007/s00436-020-06879-x]

-
Hristov, P., R. Shumkova, N. Palova and B. Neov. 2020. Factors associated with honey bee colony losses: A mini-review. Vet. Sci. 7(4): 166.
[https://doi.org/10.3390/vetsci7040166]

-
Insolia, L., R. Molinari, S. R. Rogers, G. R. Williams, F. Chiaromonte and M. Calovi. 2022. Honey bee colony loss linked to parasites, pesticides and extreme weather across the United States. Sci. Rep. 12(1): 20787.
[https://doi.org/10.1038/s41598-022-24946-4]

-
Jung, C. and Y. H. Bae. 2022. Production and characteristics of winter generation honey bees, Apis mellifera: Discussion with overwintering failure. J. Apic. 37(3): 265-274.
[https://doi.org/10.17519/apiculture.2022.09.37.3.265]

-
Kaise, S. and H. Hoshiba. 2023. Revisiting the history of parasite conversion of Varroa destructor to Apis mellifera - the parasitic shift occurred as early as 1898? Bee World 100: 71-74.
[https://doi.org/10.1080/0005772X.2023.2270841]

-
Khalifa, S. A. M., E. H. Elshafiey, A. A. Shetaia, A. A. A. El-Wahed, A. F. Algethami, S. G. Musharraf, M. F. AlAjmi, C. Zhao, S. H. D. Masry, M. M. Abdel-Daim, M. F. Halabi, G. Kai, Y. A. Naggar, M. Bishr, M. A. M. Diab and H. R. El-Seedi. 2021. Overview of bee pollination and its economic value for crop production. Insects 12(8): 688.
[https://doi.org/10.3390/insects12080688]

- Kim, D. 2016. A study of competitive interactions of two ectoparasitic mite, Varroa destructor (Mesostigmata: Varroidae) and Tropilaelaps mercedesae (Mesostigmata: Laelapidae) of honeybee, Apis mellifera (Hymenoptera: Apidae). Andong National University, Andong, South Korea.
-
Kim, H. 2022. The effect of honey bee mites on the winter colony losses. J. Apic. 37(3): 291-299.
[https://doi.org/10.17519/apiculture.2022.09.37.3.291]

-
Kim, Y. H. and S. H. Lee. 2022. Current status of fluvalinate resistance in Varroa destructor in Korea and suggestion for possible solution. J. Apic. 37(3): 301-313.
[https://doi.org/10.17519/apiculture.2022.09.37.3.301]

-
Laurino, D., S. Lioy, L. Carisio, A. Manino and M. Porporato. 2020. Vespa velutina: An alien driver of honey bee colony losses. Diversity 12(1): 5.
[https://doi.org/10.3390/d12010005]

-
Lee, S., S. Kim, J. Lee, J. Kang, S. Lee, H. J. Park, J. Nam and C. Jung. 2022. Impact of ambient temperature variability on the overwintering failure of honeybees in South Korea. J. Apic. 37(3): 331-347.
[https://doi.org/10.17519/apiculture.2022.09.37.3.331]

-
Macedo, P. A., J. Wu and M. D. Ellis. 2002. Using inert dusts to detect and assess varroa infestations in honey bee colonies. J. Apic. Res. 41(1-2): 3-7.
[https://doi.org/10.1080/00218839.2002.11101062]

-
Manley, R., B. Temperton, M. Boots and L. Wilfert. 2020. Contrasting impacts of a novel specialist vector on multihost viral pathogen epidemiology in wild and managed bees. Mol. Ecol. 29(2): 380-393.
[https://doi.org/10.1111/mec.15333]

-
Messan, K., M. R. Messan, J. Chen, G. DeGrandi-Hoffman and Y. Kang. 2021. Population dynamics of varroa mite and honeybee: Effects of parasitism with age structure and seasonality. Ecol. Model. 440: 109359.
[https://doi.org/10.1016/j.ecolmodel.2020.109359]

-
Naggar, Y. A. and R. J. Paxton. 2020. Mode of transmission determines the virulence of black queen cell virus in adult honey bees, posing a future threat to bees and apiculture. Viruses 12(5): 535.
[https://doi.org/10.3390/v12050535]

-
Neov, B., A. Georgieva, R. Shumkova, G. Radoslavov and P. Hristov. 2019. Biotic and abiotic factors associated with colonies mortalities of managed honey bee (Apis mellifera). Diversity 11(12): 237.
[https://doi.org/10.3390/d11120237]

-
Noel, A., Y. L. Conte and F. Mondet. 2020. Varroa destructor: how does it harm Apis mellifera honey bees and what can be done about it? Emgerg. Top. Life Sci. 4(1): 45-57.
[https://doi.org/10.1042/ETLS20190125]

-
Ostermann, D. J. and R. W. Currie. 2004. Effect of formic acid formulations on honey bee (Hymenoptera: Apidae) colonies and influence of colony and ambient conditions on formic acid concentration in the hive. J. Econ. Entomol. 97(5): 1500-1508.
[https://doi.org/10.1603/0022-0493-97.5.1500]

-
Papa, G., R. Maier, A. Durazzo, M. Lucarini, I. K. Karabagias, M. Plutino, E. Bianchetto, R. Aromolo, G. Pignatti, A. Ambrogio, M. Pellecchia and I. Negri. 2022. The honey bee Apis mellifera: An insect at the interface between human and ecosystem health. Biology 11(2): 233.
[https://doi.org/10.3390/biology11020233]

-
Paudel, Y. P., R. Mackereth, R. Hanley and W. Qin. 2015. Honey bee (Apis mellifera L.) and pollination issues: Current status, impacts, and potential drivers of decline. J. Agric. Sci. 7(6): 93-109.
[https://doi.org/10.5539/jas.v7n6p93]

-
Posada-Florez, F., E. V. Ryabov, M. C. Heerman, Y. Chen, J. D. Evans, D. E. Sonenshine and S. C. Cook. 2020. Varroa destructor mites vector and transmit pathogenic honey bee viruses acquired from an artificial diet. PLoS One 15(11): e0242688.
[https://doi.org/10.1371/journal.pone.0242688]

-
Rinkevich, F. D. 2020. Detection of amitraz resistance and reduced treatment efficacy in the varroa mite Varroa destructor, within commercial beekeeping operations. PLoS One 15(1): e0227264.
[https://doi.org/10.1371/journal.pone.0227264]

-
Ryabov, E. V., K. Christmon, M. C. Heerman, F. Posada-Florez, R. L. Harrison, Y. Chen and J. D. Evans. 2020. Development of a honey bee RNA virus vector based on the genome of a deformed wing virus. Viruses 12(4): 374.
[https://doi.org/10.3390/v12040374]

-
Schwartz, K. R., H. Minor, C. Magro, J. McConnell, J. Capani, J. Griffin and H. Doebel. 2021. The neonicotinoid imidacloprid alone alters the cognitive behavior in Apis mellifera L. and the combined exposure of imidacloprid and Varroa destructor mites synergistically contributes to trial attrition. J. Apic. Res. 60(3): 431-438.
[https://doi.org/10.1080/00218839.2020.1866233]

-
Seeley, T. D. and M. L. Smith. 2015. Crowding honeybee colonies in apiaries can increase their vulnerability to the deadly ectoparasite Varroa destructor. Apidologie 46: 716-727.
[https://doi.org/10.1007/s13592-015-0361-2]

-
Son, M., J. Kim, D. Kim, C. Lee, P. N. Akongte, D. Oh, Y. Choi and B. Park. 2023. Effects of clothianidin pesticide application on the strength of honey bee colonies and stress-related genes in the vicinity of rice fields in the Republic of Korea. Diversity 15(12): 1217.
[https://doi.org/10.3390/d15121217]

-
Southwick, E. E. and L. Southwick, Jr. 1992. Estimating the economic value of honey bee (Hymenoptera: Apidae) as agricultural pollinators in the United States. J. Econ. Entomol. 85(3): 621-633.
[https://doi.org/10.1093/jee/85.3.621]

-
Stahlmann-Brown, P., R. J. Hall, H. Pragert and T. Robertson. 2022. Varroa appears to drive persistent increases in New Zealand colony losses. Insects 13(7): 589.
[https://doi.org/10.3390/insects13070589]

-
Tang, J., C. Ji, W. Shi, S. Su, Y. Xue, J. Xu, X. Chen, Y. Zhao and C. Chen. 2023. Survey results of honey bee colony losses in winter in China (2009-2021). Insects 14(6): 554.
[https://doi.org/10.3390/insects14060554]

-
Traynor, K. S., F. Mondet, J. R. de Miranda, M. Techer, V. Kowallik, M. A. Y. Oddie, P. Chantawannakul and A. McAfee. 2020. Varroa destructor: A complex parasite, crippling honey bees worldwide. Trends Parasitol. 36(7): 592-606.
[https://doi.org/10.1016/j.pt.2020.04.004]

- Underwood, R. M. and R. W. Currie. 2003. The effects of temperature and dose of formic acid on treatment efficacy against Varroa destructor (Acari: Varroidae), a parasite of Apis mellifera (Hymenoptera: Apidae). Exp. Appl. Acarol. 29: 303-313.
-
Zee, R. V. D., A. Gray, L. Pisa and T. D. Rijk. 2015. An observational study of honey bee colony winter losses and their association with Varroa destructor, neonicotinoids and other risk factors. PLoS One 10(7): e0131611.
[https://doi.org/10.1371/journal.pone.0131611]