
여왕벌 부재 뒤영벌 (Bombus terrestris) 봉군에서 일벌의 산란 행동 및 일벌이 낳은 수벌의 생식 특성
Abstract
In bees, workers are capable of reproduction in the event of the queen’s death or at a certain stage of colony development. In this case, workers lay haploid eggs, which produce only males. However, little is known about the oviposition characteristics of bumblebee ( Bombus terrestris) workers under different rearing temperatures and colony sizes, as well as the reproductive traits of worker-produced males. In this study, we investigated the oviposition behavior of B. terrestris workers in queenless laboratory colonies under different temperature (27°C or 32°C) and population (15 or 30 workers in a rearing box) conditions. Additionally, we examined the reproductive traits of worker-produced males. We observed oviposition by one worker in the treatments with 15 workers and by two workers in the treatments with 30 workers at both 27°C and 32°C. Compared to treatments with 15 workers, treatments with 30 workers at both 27°C and 32°C were associated with a higher number of oviposition events and more eggs per egg cell. Workers at 32°C exhibited a higher number of egg cells, whereas workers at 27°C exhibited a higher number of eggs per egg cell. The mating duration of worker-produced males with queens was shorter for males from the treatment at 32°C with 30 workers compared to those from the treatment at 27°C. The number of sperm within the seminal vesicles of worker-produced males was higher in the 27°C treatment than in the 32°C treatment, resulting in a higher number of sperm within the spermathecae of queens after mating. These findings indicate that in queenless colonies, worker reproduction in B. terrestris is influenced by temperature and population conditions, and that worker-produced males mated with queens and transferred sperm into the spermathecae of queens.
Keywords:
Bumblebee, Bombus terrestris, Reproduction, Worker, Male서 론
뒤영벌 (Bumblebee)은 농업생태계뿐만 아니라 자연생태계에서 중요한 화분매개곤충이다(Velthuis and van Doorn, 2006; Klein et al., 2007). 뒤영벌은 온대와 아한대 지역에 주로 분포하며 한냉 기후에 적응해온 진사회성 곤충으로 전 세계에 약 239종이 보고되고 있다 (Williams, 1998). 꿀벌 (Honeybee)과 마찬가지로 뒤영벌은 여왕벌, 일벌 및 수벌로 이루어진 봉군을 형성한다 (Duchateau and Velthuis, 1988; Free, 1993). 그러나 뒤영벌은 1년에 1세대로 가을철에 수벌과 교미를 끝낸 신여왕벌만이 땅속에 들어가 6~7 개월간 휴면하며, 이듬해 봄에 땅속 서식처에 산란을 하는 생활사를 가진다 (Heinrich, 1979; Duchateau and Velthuis, 1988). 최근 뒤영벌과 꿀벌 같은 화분매개곤충은 인간 활 동에 의한 서식지 감소와 무분별한 농약 사용 및 기후변화 등으로 종 다양성과 개체수가 점차 감소하고 있는 것으로 나타났다 (Goulson et al., 2008; Dolezal et al., 2016; Martinet et al., 2021b).
서양뒤영벌 (Bombus terrestris)에서 잘 알려진 것처럼, 뒤영벌의 봉군 내에서 여왕벌의 지배력과 산란은 유약호 르몬(Juvenile hormone)의 생합성 속도와 밀접하게 연관되어 있다 (Bloch et al., 2000; Shpigler et al., 2014). 알라타체 (Corpora allata)에서 분비되는 유약호르몬은 생식선 자극호르몬 (Gonadotropic hormone)으로 작용하여 지방체 (Fat body)에서 난황단백질 (Vitellogenin)의 합성과 발육 중인 난모세포의 발달을 촉진함으로써 암컷의 생식력을 조절한다 (Riddiford, 2008, 2012). 뒤영벌의 여왕벌은 아래턱샘 (Mandibular glands)에서 생성되는 페로몬을 통해 일벌의 알라타체를 억제함으로써 일벌의 산란을 저지한다 (Röseler et al., 1981; Bloch et al., 1996; Cnaani et al., 2000). 만약 일벌이 알을 낳아도 여왕벌의 뒤푸르샘 (Dufour’s glands)에서 분비되는 것으로 추정되는 여왕페로몬 (Queen pheromone)을 통해 여왕벌 알과 일벌의 알은 구별되어 여왕벌과 일벌이 선택적으로 일벌이 산란한 알은 섭취를 통해 제거한다(Ayasse et al., 1999; Ayasse and Jarau, 2014). 하지만 여왕벌이 노쇠되어 봉군의 통솔력 약해지거나 죽으면 일부 나이가 많은 일벌의 난소가 발달하여 산란하기 시작한다 (Ayasse et al., 1995; Bloch and Hefetz, 1999; Bloch et al., 2000; Alaux et al., 2007; Lopez-Vaamonde et al., 2007; Boomsma, 2009). 이렇게 일벌에 의해 산란된 알은 수정되지 않은 반수체 알 (Haploid egg) 로 수벌이 출현한다 (Lopez-Vaamonde et al., 2004).
뒤영벌의 생활사 중에서 여왕벌과 수벌의 교미는 중요한 과정이다 (Yoon et al., 2016). 서양뒤영벌의 교미는 우화 5~10일의 여왕벌과 우화 5~20일 사이의 수벌에서 활발하게 일어나며 (Röseler, 1985), 성적 성숙시기는 여왕벌의 경우 우화 6~8일, 수벌은 우화 6~10일이라고 보고되었다 (Yoon et al., 2016). 또한 호박벌 (Bombus ignitus)의 경우, 교미에 적합한 성적 성숙시기는 여왕벌은 우화 9~12일, 수벌은 우화 6~9일로 보고되었다(Yoon et al., 2018). 서양뒤영벌의 교미시간은 약 36.2분 (Lee et al., 2002), 호박벌은 약 23.0분으로 조사되었다 (Yoon et al., 1999). 호박벌 여왕벌이 산란한 수벌의 정자수는 우화 당일부터 우화 9일까지 서서히 많아지다가 9일에 44.4만 개로 피크를 이루고, 그 이후로는 서서히 감소한다고 보고하였다(Yoon et al., 2018). 뒤영벌은 교미 시 수벌의 정자 중 10% 미만이 여왕벌의 수정낭으로 이동해 저장된다 (Röseler, 1973; Duchateau and Mariën, 1995; Baer and Schmid-Hempel, 2000). 대표적 사회성 곤충인 꿀벌 (Apis mellifera)은 다혼성으로 교미를 통해 저장된 정자는 약 470만 개로 알을 수정하는 데 필요한 정자수 100~160만 개보다 훨씬 많은 수를 저장한다 (Page and Metcalf, 1982; Laidlaw and Page, 1984; Page, 1986; Haberl and Tautz, 1998; Franck et al., 1999; Baer, 2005).
최근 기후변화로 인한 기온 상승 및 폭염의 증가는 주변 온도 변화에 특히 민감한 곤충에게 열 스트레스를 준다 (Deutsch et al., 2008; Kingsolver et al., 2013). 뒤영벌은 온도가 상승하면 그에 대응하기 위해 날개 부채질로 온도를 내리는 행동을 하며, 온도가 높을수록 날개 부채질을 하는 일벌의 비율이 증가하였다 (Sepúlveda et al., 2024). 하지만 뒤영벌은 개체군이나 종간의 CTmax (최대 임계 온도)에 거의 변이가 없으며 (Oyen et al., 2016; Oyen and Dillon, 2018; Pimsler et al., 2020; Christman et al., 2022; Gonzales et al., 2022), 폭염과 같은 고온에 대한 열 내성 관련 적응 능력이 부족하다는 것이 밝혀졌다 (Oyen and Dillon, 2018; Quinlan et al., 2023; Sepúlveda and Goulson, 2023). 또한 열 스트레스에 노출된 여러 뒤영벌 종에서 수벌의 경우 생식력에 부정적인 영향을 받았으며, 특히 추위에 적응한 종인 Bombus jonellus와 Bombus magnus의 수벌은 40℃의 고온에 노출된 후 정자 생존력이 크게 감소하는 것으로 나타났다 (Martinet et al., 2021a; Campion et al., 2023; White and Dilon, 2023). 이처럼 뒤영벌 여왕벌의 산란, 교미 특성 및 여왕벌이 산란한 수벌의 정자수와 교미 시기 등에 대한 연구는 많이 되어 있지만, 기후변화 등 여러 요인에 의해 여왕벌이 죽을 경우 남아있는 봉군의 크기와 온도에 따른 일벌의 산란 특성과 일벌이 낳은 수벌의 교미 특성에 관한 연구는 미흡한 실정이다.
따라서 본 연구에서는 여왕벌 부재 봉군에서 일벌의 산란 특성을 구명하기 위하여 적온인 27℃와 기후변화에 의한 고온 조건인 32℃에서 아울러 여왕벌 부재 시 남아있는 봉군의 크기에 따라 일벌의 개체수가 15마리 또는 30마리 봉군의 크기에서 서양뒤영벌 일벌의 산란 행동을 조사하였다. 또한, 일벌의 산란에 의해 출현된 수벌의 생식 특성은 수벌의 우화 시기 및 충체 크기 조사와 함께 출현된 수벌의 정자수와 교미에 의해 여왕벌 수정낭에 정자 전달을 조사하였다.
재료 및 방법
1. 실험 곤충 및 사육
실험 곤충은 국립농업과학원에서 분양 받은 13세대 서양뒤영벌 (Bombus terrestris)을 동아대학교 응용생물공학과 곤충분자생물학 및 생명공학연구실에서 계대 사육하여 사용하였다. 사육은 온도 27℃ 또는 32℃, 습도 65±5%, 암조건에서 실시하였다 (Yoon et al., 2004). 사육상자는 산란용 (10.5×14.5×6.5 cm), 봉군형성용 (21.0×21.0×15.0 cm) 및 봉군숙성용 (24.0×27.0×18.0 cm) 상자로 나누어서 단계별로 사육에 이용하였다. 먹이로는 0.2%의 Sorbic acid가 첨가된 40% 설탕물 (Yoon et al., 2005a)과 신선한 잡화분 (Yoon et al., 2005b)을 40% 설탕물과 혼합하여 화분단자로 만들어 충분히 공급하였다.
2. 여왕벌 부재 뒤영벌 봉군에서 사육 온도와 일벌 개체수에 따른 일벌의 산란
여왕벌 부재 뒤영벌 봉군에서 일벌의 산란 특성을 알아보기 위하여 일벌을 대상으로 실험 온도 및 개체수별 산란 행동, 난괴 (Egg cell)의 크기, 난괴수 및 난괴당 알수 등을 조사하였다. 실험용 일벌은 32℃에서 사육한 DAU 2세대로 뒤영벌 숙성기 봉군에서 20~25일 된 일벌을 수집하여 27℃와 32℃ 실험용으로 사용하였다. 실험 온도는 27℃와 32℃로 설정하였고, 개체수는 각각의 온도별로 일벌 15마리 또는 30마리로 실험구당 5반복으로 하였다. 봉군형성용 (21.0×21.0×15.0 cm) 상자를 이용하여 습도 65±5%, 암조건의 항온기 (Multi Room Incubator DS-14CLHP-4H, 다솔과학, 화성시, 대한민국)에서 일벌의 산란 특성을 조사하였다. 실험구별 일벌의 산란 횟수는 매일 형성된 난괴의 수를 30일 동안, 실험구당 4~5반복으로 조사하였다. 난괴당 알수는 실험구당 4~7반복으로 수행하였다. 난괴 및 알의 크기 등은 2일 된 난괴를 사육상자에서 분리하여, 핀셋으로 덮여진 부분을 제거한 후, 현미경 (Nikon SMZ800N, Nikon Corporation, Tokyo, Japan) 하에서 관찰하였으며 부속 소프트웨어 (i-Solution Lite, IMT i-Solution lnc, Burnaby, Canada)를 이용하여 크기를 측정하였다. 알의 무게는 디지털 저울 (Mettler Ae 260, Delta Range®, Metter Toledo, Columbus, Ohio, USA)을 이용하여 측정하였다.
3. 뒤영벌 일벌의 산란에 의해 출현된 수벌의 교미 및 정자수
일벌의 산란에 의해 출현된 수벌의 우화일수 및 크기는 27℃와 32℃의 30마리구에서 출현한 수벌을 대상으로 우화일수를 계산하였고, 충체 크기는 우화 직후의 수벌을 산란용 상자 (10.5×14.5×6.5 cm)로 옮겨 27℃와 32℃에 5~7일간 둔 후 조사하였다. 수벌의 두폭, 체폭, 체장 및 체중을 측정하기 위하여, 먼저 수벌을 탄산가스에 30초간 처리한 후 (Yoon et al., 2008) 상기 현미경 (Nikon SMZ800N)과 부속 소프트웨어 (i-Solution Lite)를 이용하여 두폭, 체폭을 측정하였다. 체장은 버니어 켈리퍼스 (CD-15CP, Mitutoyo Corp, Kawasaki, Japan)를 이용하여 측정하였다. 체중 측정은 디지털 저울 (Mettler Ae 260)을 사용하였다.
일벌이 낳은 수벌의 교미 여부를 확인하기 위하여 수벌은 27℃와 32℃의 30마리구에서 우화 5~7일의 일벌이 낳은 수벌을 사용하였고, 여왕벌은 32℃에서 출현한 우화 9~11일째의 DAU 2세대 여왕벌을 교미 실험에 사용하였다. 여왕벌과 수벌을 1 : 1의 비율로 교미용 상자 (50×50×60 cm)에 넣어 교미를 시켰다. 교미환경은 23℃, 65% R. H., 14 L, 1,000 lux 이상으로 하였다 (Yoon et al., 2003). 교미상자 안에는 화분단자와 40% 설탕물을 공급하였다. 교미시간을 측정하기 위해서 교미가 시작되면 산란용 상자 (10.5×14.5×6.5 cm)로 옮겨서 교미시간을 측정하였다. 조사수는 27℃와 32℃구당 각각 8마리, 7마리로 하였다. 교미 전후의 정자수 조사 또한 우화 5~7일째의 일벌이 낳은 수벌을 사용하였다. 수벌의 정자는 복부에서 저정낭 (Seminal vesicle)을 분리하여 정자를 수집하였다 (Yoon et al., 2014). 수집된 정자는 1.5 mL의 튜브 (Eppendorf tube)에서 PBS 완충액 (Phosphate buffered saline) 100 μL에 혼합하였다. 이 혼합액 중에서 10 μL를 피펫으로 헤모사이토미터 (Hemocytometer)에 떨어뜨려 400배 배율로 현미경 (Optinity 4K HD Camera KCX-80LA, Olympus Corporation, Tokyo, Japan) 하에서 수벌 한 마리당 헤모사이토미터 5~7칸의 정자수를 조사하였다. 교미 전후의 수벌의 정자수 조사를 위하여 27℃ 처리구에서 교미 전 10마리, 교미 후 6마리, 32℃에서 교미 전 11마리, 교미 후 8마리의 수벌을 사용하였다. 여왕벌 수정낭 내 정자수를 측정하기 위해 27℃와 32℃ 처리구에서 교미한 우화 9~11일째의 여왕벌을 사용하였다. 여왕벌의 수정낭 내 정자수는 교미 1일 후 수정낭을 해부하고 PBS 완충액 20 μL에 혼합하여 위의 수벌의 정자수 조사와 같은 방법으로 실험하였다.
4. 통계 처리
본 실험의 결과는 평균±표준편차로 나타내었다. 모든 통계분석은 SPSS PASW 22.0 통계 패키지 (IBM, Chicago, USA)를 이용하였다. 난괴 크기, 수벌의 출현일, 수벌의 크기 (두폭, 체폭, 체장, 체중), 교미시간 및 여왕벌의 수정낭 내 정자수는 t-test로 유의성을 검정하였다. 난괴수, 난괴당 알수, 일벌이 낳은 수벌의 정자수 비교는 one-way ANOVA test (일원배치 분산분석)로 분석하였으며, 유의성이 확인된 항목에 대해 사후검정은 Tuckey’s HSD로 하였다.
결 과
1. 여왕벌 부재 뒤영벌 봉군에서 사육 온도와 일벌 개체수에 따른 일벌의 산란
여왕벌 부재 시 일벌의 산란은 온도 (27℃ 또는 32℃) 및 일벌 개체수 (봉군당 15마리 또는 30마리)에 따른 특성을 조사하였다. 실험 15일째 조사 결과, 27℃ (C27)구에 비해 32℃ (C32)구에서 그리고 15마리 (15W)구보다 30마리 (30W)구에서 더 많은 난괴가 관찰되었다 (Fig. 1A). 또한 27℃와 32℃의 일벌 30마리구에서 2마리 이상의 일벌이 산란하는 것을 확인하였다 (Fig. 1의 C32-30W, C27-30W). 온도 및 개체수별 일벌이 형성한 2일째의 난괴 크기를 조사한 결과 (Fig. 1B)는 단경 4.74~4.79 mm, 장경 5.24~5.41 mm, 높이 4.71~5.51 mm, 두께 0.53~0.56 mm로 27℃와 32℃ 간에 통계적 유의성은 보이지 않았다 실험시작 30일 동안 온도 및 일벌 개체수별로 난괴수를 조사한 결과 (Fig. 1C)는 C27-15W에서 평균 9.8개, C27-30W는 평균 22.0개, C32-15W는 평균 14.4개, C32-30W는 평균 24.4개로, 온도가 높고 일벌 개체수가 많을수록 난괴의 수가 많은 것으로 나타났다 (F3, 15=6.86, p=0.004). 그러나 30마리구에서 난괴수는 온도보다는 개체수에 더 영향을 받는 것으로 나타났다 (온도, F1, 17=0.63, p=0.439; 개체수, F1, 17=18.44, p=0.0001).
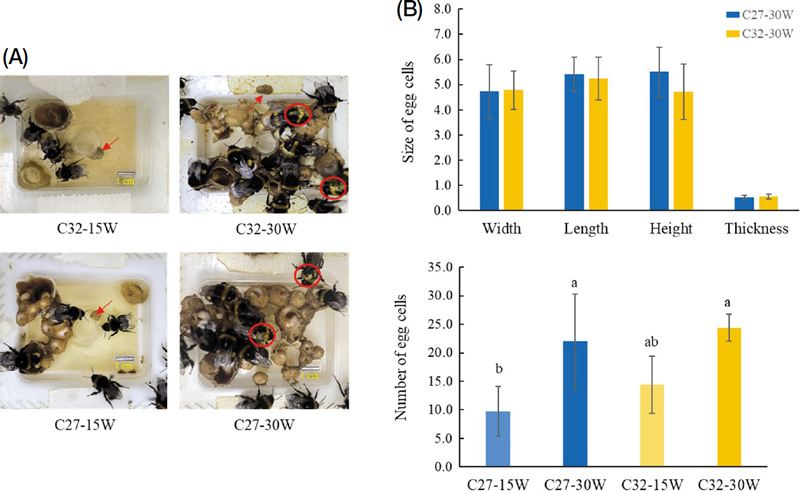
Oviposition of workers under different temperature and population conditions. Observed for 30 days following treatment initiation. The B. terrestris workers, in the absence of the queen, were reared at 27℃ (C27) or 32℃ (C32) with 15 workers (15W) or 30 workers (30W) in a cage. (A) Representative images of egg-laying workers, photographed 15 days after treatment. Egg-laying workers and egg cells are indicated by circles and arrows, respectively. Size bar, 1 cm. (B) Size of egg cells (n=6~7). (C) Number of egg cells (n=4 for C27-15W and 5 for C27-30W, C32-15W, and C32-30W; p=0.004). Different letters indicate significant differences among the treatments.
온도 및 일벌 개체수에 따른 난괴당 알수를 조사한 결과 (Fig. 2A, B)는 C27-15W에서 평균 4.8개, C27-30W는 평균 10.3개, C32-15W는 평균 3.4개, C32-30W는 평균 8.5개로 통계적 유의성을 보였다 (F3, 18=8.45, p=0.001). 온도에 있어서 27℃는 32℃보다 난괴수는 적고, 난괴당 알수는 많았지만 통계적으로는 차이를 보이지는 않았다 (F1, 20=1.77, p=0.198). 일벌 개체수의 경우, 30마리구가 15마리구보다 약 2배 이상 알수가 많은 것으로 관찰되었다 (F1, 20=23.12, p=0.0001). 이러한 결과로 볼 때, 난괴수와 난괴당 알수는 온도보다는 개체수에 더 영향을 받는 것으로 나타났다.
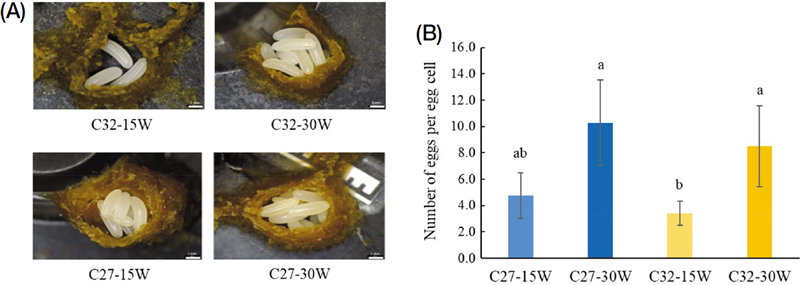
Number of eggs per egg cell laid by workers under different temperature and population conditions. Observed for 30 days following treatment initiation. The B. terrestris workers, in the absence of the queen, were reared at 27℃ (C27) or 32℃ (C32) with 15 workers (15W) or 30 workers (30W) in a cage. (A) Representative images of eggs within the egg cell. Size bar, 1 mm. (B) Number of eggs per egg cell (n=4 for C27-15W, 7 for C27-30W, 5 for C32-15W, and 6 for C32-30W; p=0.006). Different letters indicate significant differences among the treatments.
2. 여왕벌 부재 시 뒤영벌 일벌의 산란에 의해 출현된 수벌의 교미
일벌이 산란한 알로부터 수벌의 출현일수를 조사한 결과 (Fig. 3A), 32℃ 처리구에서는 약 25.8일, 27℃에서는 약 28.0일로 32℃ 처리구에서 약 2일 정도 짧았으나 온도에 따른 통계적 유의성은 보이지 않았다. 27℃와 32℃ 처리구에서 일벌의 산란에 의해 출현된 수벌의 크기를 비교한 결과 (Fig. 3B), 두폭은 4.27~4.39 mm, 체폭은 5.57~5.74 mm로 차이를 보이지 않았지만 체장 (16.60~18.25 mm)과 체중 (292.38~369.80 mg)에서는 통계적으로 유의하였다 (체장: p<0.05, 체중: p<0.0001).
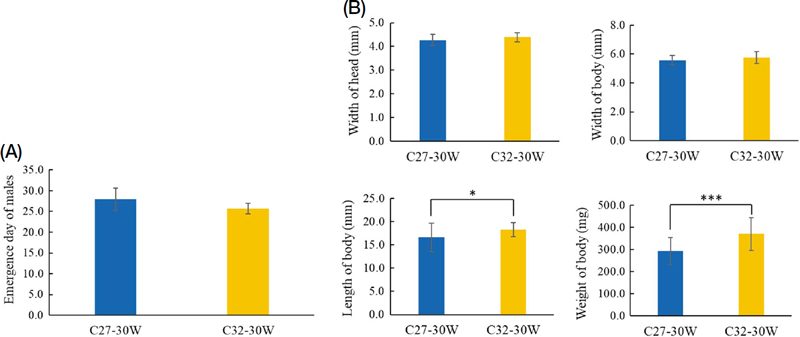
Emergence of males under different temperature conditions. Observed at 27℃ (C27) or 32℃ (C32) with 30 workers (30W) in a cage. (A) Emergence day of males (n=3 for C27-30W and 4 for C32-30W). (B) Width of head, width of body, length of body, and weight of body of worker-produced males (n=19 for C27-30W and 33 for C32-30W). Data are presented as the mean±SD. *, p<0.05; ***, p<0.001.
일벌이 낳은 수벌의 교미 여부를 확인하기 위하여, 우화 9~11일째의 여왕벌을 27℃와 32℃ 처리구에서 우화 5~7일째의 일벌이 낳은 수벌과 교미 실험을 수행하였다. 그 결과, 일벌이 낳은 수벌은 정상적으로 여왕벌과 교미를 하였으며 (Fig. 4A), 교미시간은 27℃ 처리구에서 일벌이 낳은 수벌의 경우 평균 46.3분, 32℃에서 일벌이 낳은 수벌은 평균 25.7분으로 나타나 통계적으로 유의하였다 (p<0.05) (Fig. 4B).
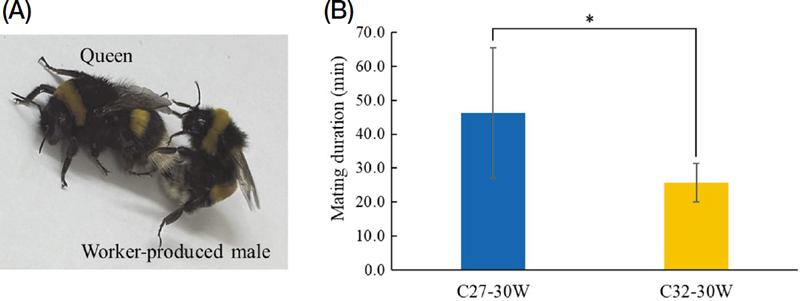
Mating of worker-produced males. (A) Representative image of mating between the queen and a worker-produced male. (B) Mating duration of worker-produced males with queens (n=8 for C27-30W and 10 for C32-30W. Data were recorded at a mating temperature of 23℃ using worker-produced males from C27-30W or C32-30W. Data are presented as the mean±SD. *, p<0.05.
일벌이 낳은 수벌의 정자수는 교미 전과 후로 구분하여 조사하였다 (Fig. 5A). 교미 전 수벌의 저정낭 내 정자수는 27℃ 처리구에서의 수벌은 약 510,593개, 32℃의 수벌은 약 405,488개로 조사되었고, 교미 후 수벌의 정자수는 27℃ 처리구에서 약 390,714개, 32℃의 수벌은 약 321,121개로 조사되었다. 온도별로 보면, 27℃ 처리구에서 일벌이 낳은 수벌의 정자수가 32℃의 수벌에 비해 약 1.3배 많은 것으로 나타났다 (F3, 230=44.26, p=0.0001). 또한, 일벌이 낳은 수벌과 교미한 여왕벌의 수정낭 내 정자수를 조사하였다 (Fig. 5B). 27℃ 처리구에서 일벌이 낳은 수벌과 교미한 여왕벌의 수정낭 내 정자수는 약 20,724개로 32℃의 수벌과 교미한 여왕벌의 수정낭 내 정자수 (약 14,977개)보다 약 1.4배 높게 나타났다 (p<0.0001).
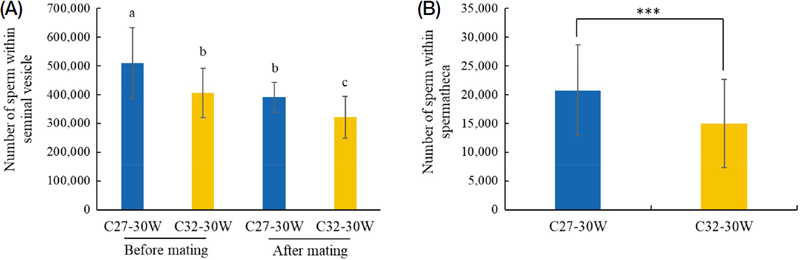
Transfer of sperm from worker-produced males to the spermathecae of queens through mating. (A) Number of sperm within seminal vehicles of worker-produced males before (n=10 for C27-30W and 11 for C32-30W) and after (n=6 for C27-30W and 8 for C32-30W) mating. (B) Number of sperm within spermathecae of queens after mating (n=8 for C27-30W and 7 for C32-30W). In (A, B), data were recorded at a mating temperature of 23℃ using worker-produced males from C27-30W or C32-30W. Different letters indicate significant differences among the treatments. Data are presented as the mean±SD. ***, p<0.001.
고 찰
서양뒤영벌 (B. terrestris)에서 여왕벌이 죽거나 특정한 봉군 발달 단계에서 일어나는 일벌의 산란은 이미 알려져 있다 (Bloch and Hefetz, 1999). 또한 뒤영벌은 기온 상승과 폭염 등 기후변화에 따른 고온에 의해 개체수 및 종 다양성 감소에 직접적인 영향을 받고 있다 (Oyen and Dillon, 2018; Martinet et al., 2021b; Quinlan et al., 2023; Sepúlveda and Goulson, 2023). 서양뒤영벌의 최적발육온도는 27~28℃로 보고되었고 (Wysocka-Owczarek, 2006; Roman and Szczesna, 2008), 32℃에서는 서양뒤영벌의 행동에 영향을 받는다고 보고하였다 (Kwon and Saeed, 2003). 따라서 본 연구에서는 온도 조건 (적온 27℃ 또는 고온 32℃)과 일벌 개체수 (15마리 또는 30마리) 조건에서 여왕벌 부재 시 서양뒤영벌 일벌의 산란 특성과 일벌이 낳은 수벌의 교미 특성을 조사하였다.
본 연구에서 조사한 서양뒤영벌 일벌이 형성한 난괴의 크기는 온도 및 개체수별 차이가 거의 없었다. 반면 호박벌 (B. ignitus)에서 보고된 여왕벌의 난괴 크기 (Yoon et al., 1999)에 비해 본 연구의 일벌이 형성한 난괴는 단경과 장경에서 1.5배 작고, 높이는 1.5배 높았다. 본 연구실의 서양뒤영벌 여왕벌이 형성한 구형에 가까운 난괴의 크기에 비해 일벌이 형성한 난괴는 유사한 형태를 보였으나 크기는 다소 작았고 높이 솟은 형태를 보였다. 이는 본 연구에서 보여진 서양뒤영벌 일벌의 난괴 내 산란된 알의 적은 수와 불규칙적인 배열과 연관이 있을 수도 있다고 여겨진다. 일반적으로 호박벌 여왕벌 (Yoon et al., 1999)과 서양뒤영벌 여왕벌의 난괴 내 알은 수평으로 가지런히 산란된다. 한편, 서양뒤영벌 일벌은 27℃ 처리구보다 32℃에서, 15마리구보다 30마리구에서 더 많은 난괴를 형성하였다. 이러한 결과는 서양뒤영벌 여왕벌의 온도별 난괴수 보고 (Gurel and Gosterit, 2008)에서 보여진 것처럼 본 연구의 일벌에서도 높은 온도의 32℃ 처리구에서 난괴수가 많아지는 것을 확인하였다. 따라서 고온이 여왕벌 부재 시 서양뒤영벌 일벌의 산란 행동을 촉진한다고 여겨진다. 또한 일벌 개체수별 비교에서는 일벌 30마리구가 15마리구보다 약 2배 정도 많은 난괴를 형성하였는데, 이는 2마리 이상의 일벌 산란에 기인되었다고 보여진다.
서양뒤영벌 일벌이 형성한 난괴 내 알수는 27℃ 처리구가 32℃에 비해 더 많았다. 또한 일벌 개체수별 난괴당 알수 비교에서는 27℃와 32℃에서 30마리구가 15마리구에 비해 약 2배 이상 많았다. 본 연구의 결과는 27℃와 32℃ 처리구의 30마리구에서 난괴당 알수는 서양뒤영벌 여왕벌이나 호박벌 여왕벌이 만든 난괴당 알수와 비슷하였으나 (Yoon et al., 1999) 일벌 15마리구에서는 현저하게 적었다. 이러한 결과를 종합할 때, 온도에 따른 일벌의 산란 행동 특징으로 고온인 32℃ 처리구 일벌은 27℃ 일벌에 비해 난괴당 알의 수를 줄이는 대신 더 많은 난괴를 형성하였다. 이와 같은 행동은 고온에 대한 적응 또는 회피 행동의 가소반응 (Plastic response)으로 여겨진다. 한편, 일벌 개체수에 따른 특징으로 30마리구가 15마리구에 비해 약 2배 이상의 많은 난괴수와 난괴당 알수를 보였는데, 이는 30마리구에서 15마리구 봉군보다 많은 일벌수에 의해 유리한 봉군 관리에 기인하였다고 여겨진다. 본 연구에서 흥미로운 결과로 여왕벌 부재 시 봉군 내 나이가 많은 우세한 일벌 중 한 마리가 산란을 하는 것으로 (Free, 1955) 알려진 바와 달리, 30마리구에서 2마리 이상의 일벌 개체가 산란하는 것을 확인하였으므로 봉군의 밀도가 더 높은 상황이라면 더 많은 일벌이 산란할 가능성이 있으며 추후 일벌 개체수 크기에 따른 산란량의 변화와 산란하는 개체수를 추가로 조사해야 할 것이다.
본 연구에서 27℃와 32℃ 처리구에서의 15마리구는 30마리구에 비해 수벌의 출현이 현저히 낮았다. 수벌 출현수가 15마리구에서 낮은 이유로 일벌 개체수 부족에 따른 육아 관리의 부족에 기인되었다고 여겨진다. 특히 27℃ 처리구는 32℃ 처리구에 비해 발육 속도가 느려 본 실험의 관찰 기간 동안 일벌이 낳은 수벌을 얻기가 어려웠다. 서양뒤영벌 일벌의 산란에 의한 수벌의 출현일 비교는 32℃ 처리구가 27℃보다 약 2.2일 짧게 나타나 온도가 높아짐에 따라 발육 경과일수가 단축됨을 알 수 있었다. 이러한 결과는 다른 곤충에서도 유사한 특징을 보이는데, 열대거세미나방 (Spodoptera frugiperda)의 경우 알에서 성충까지 발육기간이 27℃에서는 28.4일, 32℃에서는 24.0일이 소요되었다 (Moon et al., 2022).
서양뒤영벌 일벌이 낳은 수벌의 교미시간 조사 결과는 27℃ 처리구에서 출현한 수벌이 32℃의 수벌보다 약 20분 정도 길었다. 서양뒤영벌의 실내 평균 교미시간은 약 36.2분이었고 (Lee et al., 2002), 호박벌의 교미시간은 약 23.0분이었다 (Yoon et al., 1999). 기존에 보고된 서양뒤영벌의 교미시간에 비해 27℃ 처리구에서 일벌이 낳은 수벌은 약 10분 정도 길었고, 32℃의 수벌은 약 11분 정도 짧았다. 그 결과 일벌이 낳은 수벌의 교미시간은 처리온도에 영향을 받은 것으로 보여진다. 한편 본 연구에서 서양뒤영벌 일벌이 낳은 수벌의 정자수는 27℃ 처리구에서의 수벌은 약 51만 개, 32℃의 수벌은 약 40만 개로 서양뒤영벌 여왕벌에 의해 출현한 수벌의 정자수 약 40만~60만 개 (Röseler, 1973; Duchateau and Mariën, 1995; Baer and Schmid-Hempel, 2000)와 호박벌 여왕벌에 의해 출현한 우화 6일째 수벌의 정자수 약 40만 개 (Yoon et al., 2018)와 비교할 때, 일벌이 낳은 수벌과 여왕벌에 의해 출현한 수벌의 정자수는 큰 차이가 없음을 확인할 수 있었다. 그러나 본 연구에서 일벌이 낳은 수벌의 정자수는 사육 온도에 따른 차이를 보였다. 27℃ 처리구에서의 수벌에 비해 고온인 32℃ 처리구의 수벌에서 정자수가 약 21% 감소하였고, 교미 후 여왕벌의 수정낭으로 전달된 정자수 역시 27℃보다 32℃가 약 28% 감소되었다. 이는 뒤영벌 종에서 고온 스트레스가 수벌의 생식에 부정적인 영향을 미치며, 정자의 생존력 감소 결과 (Martinet et al., 2021a; Campion et al., 2023; White and Dilon, 2023)를 고려할 때, 본 연구의 32℃ 처리구에서 일벌이 낳은 수벌은 정자수에 영향을 받은 것으로 보였지만, 서양뒤영벌의 봉군 크기에서 300~1,000마리 정도의 전체 성충 우화수 (Plowright and Jay, 1966; Heinrich, 1979; Duchateau, 1991; Ono and Wada, 1996; Lee et al., 2004)를 고려할 때, 27℃와 32℃ 수벌이 교미 후 여왕벌의 수정낭으로 전달한 정자수는 봉군 발달에 영향이 없을 것으로 판단된다.
결론적으로, 본 연구의 결과는 여왕벌 부재 시 온도 및 개체수에 따른 서양뒤영벌 일벌의 산란 특성과 일벌이 낳은 수벌의 교미 특성을 나타낸다. 여왕벌 부재 시 일벌의 산란 행동은 고온 및 개체수에 영향을 받았으며, 일벌이 낳은 수벌의 교미 행동 역시 고온에 영향을 보였다. 그러나 일벌의 산란 행동은 고온에 대해 가소반응을 보였고, 일벌이 낳은 수벌은 여왕벌과 교미 후 수정낭으로 정자를 전달하였다. 이러한 결과는 기후변화 등 여러 요인에 의한 여왕벌 부재 시 일벌을 이용한 수벌의 생산으로 유전형질 확보가 가능함을 시사한다. 아울러 방화 활동을 할 수 있는 뒤영벌 수벌의 특징을 이용하여 육종용, 소규모 채종용 화분매개자로 일벌이 낳은 수벌을 활용할 수 있을 것으로 여겨진다 (Yoon et al., 2009).
적 요
뒤영벌에서 일벌은 여왕벌이 폐사하거나 봉군 발달의 특정 단계에서 번식할 수 있다. 이 경우 일벌은 수벌만 생산하는 반수체 알을 낳는다. 본 연구는 여왕벌 부재 시 온도 (적온 27℃ 또는 고온 32℃) 및 개체수 (봉군당 일벌 15마리 또는 30마리) 처리 조건에 따른 서양뒤영벌 (B. terrestris) 일벌의 산란 특성과 일벌이 낳은 수벌의 교미 특성을 조사하였다. 그 결과, 27℃와 32℃ 처리구의 15마리구는 1마리의 일벌이, 30마리구에서는 2마리 이상의 일벌이 산란하는 것을 관찰하였다. 27℃와 32℃ 처리구의 15마리구와 30마리구를 비교했을 때, 개체수가 많은 실험구에서 산란 횟수와 난괴당 알수가 많았다. 또한, 32℃에서의 일벌은 난괴수의 증가를 보인 반면 27℃에서의 일벌은 난괴당 알수의 증가를 보였다. 여왕벌과 일벌이 낳은 수벌의 교미시간은 32℃ 처리구의 수벌이 27℃의 수벌에 비해 짧았다. 일벌이 낳은 수벌의 저정낭 내 정자수는 32℃ 처리구의 수벌보다 27℃의 수벌에서 많았고, 이는 교미 후 여왕벌의 수정낭 내 정자수와 관련되었다. 이러한 결과들은 여왕벌 부재 시 서양뒤영벌 일벌의 산란 행동은 온도와 개체수에 영향을 받았고, 일벌이 낳은 수벌은 여왕벌과 교미를 통해 정자를 여왕벌의 수정낭에 전달하였음을 나타낸다.
Acknowledgments
본 연구는 농촌진흥청 연구과제 (RS-2023-00232335)의 지원으로 수행되었다.
References
-
Alaux, C., M. Boutot, P. Jaisson and A. Hefetz. 2007. Reproductive plasticity in bumblebee workers (Bombus terrestris) - reversion from fertility to sterility under queen influence. Behav. Ecol. Sociobiol. 62: 213-222.
[https://doi.org/10.1007/s00265-007-0455-6]

-
Ayasse, M. and S. Jarau. 2014. Chemical ecology of bumble bees. Annu. Rev. Entomol. 59(1): 299-319.
[https://doi.org/10.1146/annurev-ento-011613-161949]

-
Ayasse, M., J. Birnbaum, J. Tengo, A. V. Doorn, T. Taghizadeh and W. Francke. 1999. Caste- and colony-specific chemical signals on eggs of the bumble bee, Bombus terrestris L. (Hymenoptera: Apidae). Chemoecology 9: 119-126.
[https://doi.org/10.1007/s000490050042]

-
Ayasse, M., T. Marlovits, J. Tengo, T. Taghizadeh and W. Francke. 1995. Are there pheromonal dominance signals in the bumblebee Bombus hypnorum L. (Hymenoptera, Apidae)? Apidologie 26(3): 163-180.
[https://doi.org/10.1051/apido:19950301]

-
Baer, B. 2005. Sexual selection in Apis bees. Apidologie 36(2): 187-200.
[https://doi.org/10.1051/apido:2005013]

-
Baer, B. and P. Schmid-Hempel. 2000. The artificial insemination of bumblebee queens. Ins. Soc. 47: 183-187.
[https://doi.org/10.1007/PL00001699]

-
Bloch, G. and A. Hefetz. 1999. Regulation of reproduction by dominant workers in bumblebee (Bombus terrestris) queenright colonies. Behav. Ecol. Sociobiol. 45: 125-135.
[https://doi.org/10.1007/s002650050546]

-
Bloch, G., D. W. Borst, Z. Y. Huang, G. E. Robinson and A. Hefetz. 1996. Effects of social conditions on juvenile hormone mediated reproductive development in Bombus terrestris Workers. Physiol. Entomol. 21(4): 257-267.
[https://doi.org/10.1111/j.1365-3032.1996.tb00863.x]

-
Bloch, G., D. W. Borst, Z. Y. Huang, G. E. Robinson, J. Cnaani and A. Hefetz. 2000. Juvenile hormone titers, juvenile hormone biosynthesis, ovarian development and social environment in Bombus terrestris. J. Insect Physiol. 46: 47-57.
[https://doi.org/10.1016/S0022-1910(99)00101-8]

-
Boomsma, J. J. 2009. Lifetime monogamy and the evolution of eusociality. Phil. Trans. R. Soc. B. 364(1533): 3191-3207.
[https://doi.org/10.1098/rstb.2009.0101]

-
Campion, C., A. Rajamohan and M. E. Dillon. 2023. Sperm can’t take the heat: short-term temperature exposures compromise fertility of male bumble bees (Bombus impatiens). J. Insect Physiol. 146: 104491.
[https://doi.org/10.1016/j.jinsphys.2023.104491]

-
Christman, M. E., L. R. Spears, J. P. Strange, W. D. Pearse, E. K. Burchfield and R. A. Ramirez. 2022. Land cover and climate drive shifts in Bombus assemblage composition. Agric. Ecosyst. Environ. 339: 108113.
[https://doi.org/10.1016/j.agee.2022.108113]

-
Cnaani, J., G. E. Robinson, G. Bloch, D. Brost and A. Hefetz. 2000. The effect of queen-worker conflict in the caste determination in the bumblebee Bombus terrestris. Behav. Ecol. Sociobiol. 47: 346-352.
[https://doi.org/10.1007/s002650050675]

-
Deutsch, C. A., J. J. Tewksbury, R. B. Huey, K. S. Sheldon, C. K. Ghalambor, D. C. Haak and P. R. Martin. 2008. Impacts of climate warming on terrestrial ectotherms across latitude. Proc. Natl. Acad. Sci. USA. 105(18): 6668-6672.
[https://doi.org/10.1073/pnas.0709472105]

-
Dolezal, A. G., S. D. Hendrix, N. A. Scavo, M. A. Harris, M. J. Wheelock, M. E. O’Neal and A. L. Toth. 2016. Honey bee viruses in wild bees: Viral prevalence, loads and experimental inoculation. PLoS ONE 11(11): e0166190.
[https://doi.org/10.1371/journal.pone.0166190]

-
Duchateau, M. J. 1991. Regulation of colony development in bumblebees, Bombus terrestris. J. Ethol. 7: 141-151.
[https://doi.org/10.17660/ActaHortic.1991.288.17]

-
Duchateau, M. J. and H. H. W. Velthuis. 1988. Development and reproductive strategies in Bombus terrestris colonies. Behaviour 107(8): 186-207.
[https://doi.org/10.1163/156853988X00340]

-
Duchateau, M. J. and J. Mariën. 1995. Sexual biology of haploid and diploid males in the bumblebee Bombus terrestris. Ins. Soc. 42: 255-266.
[https://doi.org/10.1007/BF01240420]

-
Franck, P., H. Coussy, Y. Le Conte, M. Solignac, L. Garnery and J. M. Cornuet. 1999. Microsatellite analysis of sperm admixture in honeybees. Insect Mol. Biol. 8: 419-421.
[https://doi.org/10.1046/j.1365-2583.1999.83131.x]

-
Free, J. B. 1955. The behaviour of egg-laying workers of bumblebee colonies. Br. J. Anim. Behav. 3(4): 147-153.
[https://doi.org/10.1016/S0950-5601(55)80053-6]

- Free, J. B. 1993. Insect pollination of crops. 2nd ed., Academic Press, London. pp. 684.
-
Gonzales, V. H., K. Oyen, M. L. Aguilar, A. Herrera, R. D. Martin and R. Ospina. 2022. High thermal tolerance in high-elevation species and laboratory reared colonies of tropical bumble bees. Ecol. Evol. 12(12): e9560.
[https://doi.org/10.1002/ece3.9560]

-
Goulson, D., G. C. Lye and B. Darvill. 2008. Decline and conservation of bumblebees. Annu. Rev. Entomol. 53(1): 191-208.
[https://doi.org/10.1146/annurev.ento.53.103106.093454]

- Gurel, F. and A. Gosterit. 2008. Effects of temperature treatments on the bumblebee (Bombus terrestris L.) colony development. Akdeniz Üniversitesi Ziraat Fakültesi Dergisi 21: 75-78.
-
Haberl, M. and D. Tautz. 1998. Sperm usage in honey bees. Behav. Ecol. Sociobiol. 42: 247-255.
[https://doi.org/10.1007/s002650050436]

- Heinrich, B. 1979. Bumblebee economics. Harvard University Press. Cambridge, Massa. pp. 245.
-
Kingsolver, J. G., S. E. Diamond and L. B. Buckley. 2013. Heat stress and the fitness consequences of climate change for terrestrial ectotherms. Funct. Ecol. 27(6): 1415-1423.
[https://doi.org/10.1111/1365-2435.12145]

-
Klein, A. M., B. E. Vaissière, J. H. Cane, I. Steffan-Dewenter, S. A. Cunningham, C. Kremen and T. Tscharntke. 2007. Importance of pollinators in changing landscapes for world crops. Proc. R. Soc. B 274(1608): 303-313.
[https://doi.org/10.1098/rspb.2006.3721]

-
Kwon, Y. J. and S. Saeed. 2003. Effect of temperature on the foraging activity of Bombus terrestris L. (Hymenoptera: Apidae) on greenhouse hot pepper (Capsicum annuum L.). Appl. Entomol. Zool. 38(3): 275-280.
[https://doi.org/10.1303/aez.2003.275]

-
Laidlaw, H. H. and R. E. Page. 1984. Polyandry in honeybees (Apis mellifera L.): sperm utilization and intracolony genetic relationships. Genetics 108(4): 985-997.
[https://doi.org/10.1093/genetics/108.4.985]

- Lee, S. B., H. J. Yoon, I. K. Park and N. G. Ha. 2004. The hive development and formation on indoor rearing of Korean domestic bumblebees, Bumbus ignitus and Bumbus ardens ardens (Hymenoptera : Apidae). Kor. J. Apic. 19(2): 109-116.
- Lee, S. B., Y. I. Mah, H. J. Yoon, I. K. Park and T. W. Bae. 2002. The mating in the field and the indoor condition of Korea endigenous bumblebee, Bombus ignites, Queen. Kor. J. Apic. 17(2): 103-112.
-
Lopez-Vaamonde, C., J. W. Koning, W. C. Jordan and A. F. G. Bourke. 2004. A test of information use by reproductive bumblebee workers. Anim. Behav. 68(4): 811-818.
[https://doi.org/10.1016/j.anbehav.2004.01.007]

-
Lopez-Vaamonde, C., R. M. Brown, E. R. Lucas, J. J. M. Pereboom, W. C. Jordan and A. F. G. Bourke. 2007. Effect of the queen on worker reproduction and new queen production in the bumble bee Bombus terrestris. Apidologie 38: 171-180.
[https://doi.org/10.1051/apido:2006070]

-
Martinet, B., E. Zambra, K. Przybyla, T. Lecocq, A. Anselmo, D. Nonclercq, P. Rasmont, D. Michez and E. Hennebert. 2021a. Mating under climate change: impact of simulated heatwaves on the reproduction of model pollinators. Funct. Ecol. 35(3): 739-752.
[https://doi.org/10.1111/1365-2435.13738]

-
Martinet, B., S. Dellicour, G. Ghisbain, K. Przybyla, E. Zambra, T. Lecocq, M. Boustani, R. Baghirov, D. Michez and P. Rasmont. 2021b. Global effects of extreme temperatures on wild bumblebees. Conserv. Biol. 35: 1507-1518.
[https://doi.org/10.1111/cobi.13685]

- Moon, H. C., M. K. Choi, S. J. Jang, J. H. Lee, J. H. Kim and H. G. Chon. 2022. The effect of temperature on the development of Spodoptera frugiperda (Lepidoptera: Noctuidae). Kor. J. Appl. Entomol. 61(2): 349-356.
- Ono, M. and T. Wada. 1996. The word of bumblebees-Biological foundation and application. Corporation. Plant Prevent Association. 132p.
-
Oyen, K. J. and M. E. Dillon. 2018. Critical thermal limits of bumblebees (Bombus impatiens) are marked by stereotypical behaviors and are unchanged by acclimation, age or feeding status. J. Exp. Biol. 221(8): jeb165589.
[https://doi.org/10.1242/jeb.165589]

-
Oyen, K. J., S. Giri and M. E. Dillon. 2016. Altitudinal variation in bumble bee (Bombus) critical thermal limits. J. Therm. Biol. 59: 52-57.
[https://doi.org/10.1016/j.jtherbio.2016.04.015]

-
Page, R. E. Jr. 1986. Sperm utilization in social insects. Annu. Rev. Entomol. 31: 297-320.
[https://doi.org/10.1146/annurev.en.31.010186.001501]

-
Page, R. E. Jr. and R. A. Metcalf. 1982. Multiple mating, sperm utilization and social evolution. Am. Nat. 119(2): 263-282.
[https://doi.org/10.1086/283907]

-
Pimsler, M. L., K. J. Oyen, J. D. Herndon, J. M. Jackson, J. P. Strange, M. E. Dillon and J. D. Lozier. 2020. Biogeographic parallels in thermal tolerance and gene expression variation under temperature stress in a widespread bumble bee. Sci. Rep. 10: 17063.
[https://doi.org/10.1038/s41598-020-73391-8]

-
Plowright, R. C. and S. C. Jay. 1966. Rearing bumblebee colonies in captivity. J. Apic. Res. 5(3): 155-165.
[https://doi.org/10.1080/00218839.1966.11100149]

-
Quinlan, G. M., C. Feuerborn, H. M. Hines and C. M. Grozinger. 2023. Beat the heat: thermal respites and access to food associated with increased bumble bee heat tolerance. J. Exp. Biol. 226(17): jeb245924.
[https://doi.org/10.1242/jeb.245924]

-
Riddiford, L. M. 2008. Juvenile hormone action: a 2007 perspective. J. Insect Physiol. 54(6): 895-901.
[https://doi.org/10.1016/j.jinsphys.2008.01.014]

-
Riddiford, L. M. 2012. How does juvenile hormone regulate control insect metamorphosis and reproduction? Gen. Comp. Endocrinol. 179(3): 477-484.
[https://doi.org/10.1016/j.ygcen.2012.06.001]

- Roman, A. and N. Szczesna. 2008. Assessment of the flying activity of the buff-tailed bumblebee (Bombus terrestris L.) on greenhouse-grown tomatoes. J. Apic. Sci. 52(1): 93-101.
-
Röseler, P. F. 1973. Die anzahl der spermien im receptaculum seminis von hummelkőniginnen (Hymenoptera, Apoidea, Bombinae). Apidologie 4(3): 267-274.
[https://doi.org/10.1051/apido:19730303]

-
Röseler, P. F. 1985. A technique for year-round rearing of Bombus terrestris (Apidae, Bombini) colonies in captivity. Apidologie 16(2): 165-170.
[https://doi.org/10.1051/apido:19850206]

-
Röseler, P. F., I. Röseler and C. G. J. Van Honk. 1981. Evidence for inhibition of corpora allata activity in workers of Bombus terrestris by a pheromone from the queen’s mandibular glands. Experientia 37(4): 348-351.
[https://doi.org/10.1007/BF01959856]

-
Sepúlveda, Y. and D. Goulson. 2023. Feeling the heat: Bumblebee workers show no acclimation capacity of upper thermal tolerance to simulated heatwaves. J. Therm. Biol. 116: 103672.
[https://doi.org/10.1016/j.jtherbio.2023.103672]

-
Sepúlveda, Y., E. Nicholls, W. Schuett and D. Goulson. 2024. Heatwave-like events affect drone production and brood-care behaviour in bumblebees. PeerJ 12: e17135.
[https://doi.org/10.7717/peerj.17135]

-
Shpigler, H., E. Amsalem, Z. Y. Huang, M. Cohen, A. J. Siegel, A. Hefetz and G. Bloch. 2014. Gonadotropic and physiological functions of juvenile hormone in bumblebee (Bombus terrestris) workers. PLoS ONE 9(6): e100650.
[https://doi.org/10.1371/journal.pone.0100650]

-
Velthuis, H. H. W. and A. V. Doorn. 2006. A century of advances in bumblebee domestication and the economic and environmental aspects of its commercialization for pollination. Apidologie 37(4): 421-451.
[https://doi.org/10.1051/apido:2006019]

-
White, S. A. and M. E. Dillon. 2023. Climate warming and bumble bee declines: the need to consider sub-lethal heat, carry-over effects, and colony compensation. Front. Physiol. 14: 1251235.
[https://doi.org/10.3389/fphys.2023.1251235]

- Williams, P. H. 1998. An annotated checklist of bumble bees with an analysis of patterns of description (Hymenoptera: Apidae, Bombini). Bull. Nat. Hist. Mus. Lond. (Ent.) 67(1): 79-152.
- Wysocka-Owczarek, M. 2006. Ocena efektywnooeci trzmieli. Owoce Warzywa Kwiaty 9: 8-10.
- Yoon, H. J., Y. I. Mah, M. Y. Lee, I. G. Park and M. Bilinski. 1999. Ecological characteristics of Bombus ignitus Smith in Korea. Kor. J. Appl. Entomol. 38(2): 101-107.
- Yoon, H. J., S. E. Kim, S. B. Lee and I. G. Park. 2003. Effect of CO2-treatment on oviposition and colony development of the bumblebee, Bombus ignites. Kor. J. Appl. Entomol. 42(2): 139-144.
- Yoon, H. J., S. E. Kim, Y. S. Kim and S. B. Lee. 2004. Colony developmental characteristics of the bumblebee of the bumblebee queen, Bombus ignitus by the first oviposition day. Int. J. Indust. Entomol. 8(2): 139-143.
- Yoon, H. J., S. E. Kim, S. B. Lee and K. Y. Seol. 2005a. The effect of antiseptic and sugar solution on colony development of the bumblebees, Bombus ignitus and B. terrestris. Int. J. Indust. Entomol. 11(1): 43-48.
- Yoon, H. J., S. E. Kim, K. Y. Lee, S. B. Lee and I. G. Park. 2005b. Oviposition and colony development of the bumblebees, Bombus ignitus and B. terrestris. depending on different pollen. Int. J. Indust. Entomol. 11(2): 99-105.
- Yoon, H. J., S. E. Kim, K. Y. Kim, S. B. Lee and I. G. Park. 2008. Copulation environment favorable for colony development of the european bumblebee, Bombus terrersis. Int. J. Indust. Entomol. 16(1): 7-13.
- Yoon, H. J., S. H. Park, S. S. Hong, K. Y. Lee, S. B. Lee and I. G. Park. 2009. Pollination method for small scale radishand plum with the bumblebee, Bombus terrestris workers and male. Kor. J. Apic. Entomol. 24(2): 109-113.
-
Yoon, H. J., K. Y. Lee and Y. H. Cho. 2014. The optimal method and solution for collecting sperm of bumblebee male. Kor. J. Apic. 29(4): 271-277.
[https://doi.org/10.17519/apiculture.2014.11.29.4.271]

-
Yoon, H. J., K. Y. Lee, M. J. Shin and S. Y. Kim. 2016. Sexual maturity and mating ability of the bumblebees, Bombus terrestris. Kor. J. Apic. 31(4): 305-313.
[https://doi.org/10.17519/apiculture.2016.11.31.4.305]

- Yoon, H. J., K. Y. Lee and H. J. Ko. 2018. Sexual maturity time of reproductive organ development and mating in the Korean native bumblebee, Bombus ignitus. Kor. J. Appl. Entomol. 57(4): 329-337.