여름철 양봉꿀벌 봉군에서 꿀벌응애 (Varroa destructor)와 중국가시응애 (Tropilaelaps mercedesae)에 대한 개미산과 옥살산의 방제 효과 평가
Abstract
Varroa destructor and Tropilaelaps mercedesae are the major parasitic mites affecting the European honey bee (Apis mellifera). This study was conducted in summer season of July at two locations in Korea-Andong and Gunwi-to evaluate the efficacy of 60% formic acid and vaporized oxalic acid against these mites. A total of 40 colonies with similar pre-treatment mite densities and normal brood-rearing activity were selected. Treatments were applied three times at one-week intervals, and mite fall was assessed by counting the number of fallen mites on white boards placed on the hive floors. Additionally, to assess the infestation rate within the capped brood, we performed brood uncapping. Overall, the control efficacy was higher for V. destructor than for T. mercedesae. Among the treatments, formic acid showed the highest control efficacy against both mite species. In Gunwi, formic acid treatment reduced brood infestation rates of both mite species in Gunwi and of T. mercedesae in Andong. Both treatments led to a reduction in brood area which implied the possible side effects to honey bees, with a particularly significant decrease observed in the formic acid-treated colonies in Andong during summer season.
Keywords:
Parasitic mites, Varroa destructor, Tropilaelaps mercedesae, Organic acid, Efficacy서 론
꿀벌 (Genus Apis)은 다양한 농작물에 화분 매개 서비스를 제공하며 (Calderone, 2012), 전 세계적으로 작물에게 중요한 화분매개곤충으로 평가받고 있다 (Garibaldi et al., 2013). 꿀벌은 식물의 꽃을 방문하고 꽃가루를 전달함으로써 생물 다양성 유지 및 식량 생산에도 큰 기여를 하고 있다 (Calderone, 2012). 전 세계 농작물의 70% 이상이 꿀벌 등 화분매개 곤충에게 의존한다 (Klein et al., 2007; Gallai et al., 2009; Jung and Shin, 2022). 생태계에 중요한 역할을 하는 꿀벌이 2006년 미국에서 대규모로 사라지는 현상이 나타났다 (van Engelsdorp et al., 2007). 미국뿐만 아니라 전 세계적으로 꿀벌 감소 문제가 지속적으로 나타나고 있다 (Laurent et al., 2015). 꿀벌 폐사의 주된 요인으로 외부 기생성 응애류, 영양 부족, 여왕벌 폐사 및 농약 피해 등이 지목되고 있다 (Johnson et al., 2010; Francis et al., 2013; Smith et al., 2013; de Jongh et al., 2022; Lee et al., 2022). 이러한 요인들이 단독으로 작용하기보다 복합적으로 상호작용하여 문제를 야기하는 것으로 알려져 있다 (Oldroyd, 2007). 국내에서는 2022년 월동 시 꿀벌 봉군 폐사와 소실 등 꿀벌 감소 문제가 나타났고 (Jung and Bae, 2022; Lee et al., 2022), 이에 대한 원인 분석과 대책 마련의 필요성이 대두되고 있다.
꿀벌응애 (Varroa destructor, Anderson and Trueman, 2000)나 중국가시응애 (Tropilaelaps mercedesae, Anderson and Morgan, 2007)와 같은 꿀벌 외부 기생성 응애는 꿀벌 군집 붕괴의 주요 원인으로 보고된다 (Rosenkranz et al., 2010). 꿀벌응애는 꿀벌 번데기의 혈림프와 지방체를 섭식하며 (Ramsey et al., 2019), 병원체를 전염시켜 꿀벌 군집의 붕괴에 영향을 미친다 (Dainat et al., 2009; Truong et al., 2023). 아시아에 분포하는 재래꿀벌 (Apis cerana)이 꿀벌응애의 원기주이었으며 (Oudemans, 1904; Delfinado, 1963), 양봉꿀벌이 아시아로 도입되면서 1960년대경 꿀벌응애 일부 집단이 양봉꿀벌로 기주이동이 이루어졌다. 현재는 전 세계적으로 분포하고 있다 (Delfinado, 1963; Matheson, 1995; Anderson and Roberts, 2013). 중국가시응애는 아시아 거대 꿀벌인 Apis dorsata 및 Apis laboriosa에서 발견이 되었으나 (Burgett et al., 1983; Oldroyd and Wongsir, 2009), 1970년대 이후 양봉꿀벌로 기주 이동을 하여 피해가 커지고 있다 (Delfinado and Baker, 1961).
꿀벌응애가 꿀벌의 유충, 번데기, 그리고 성충에 기생하면 꿀벌의 체중, 비행 기능과 학습 능력 및 수명 등이 감소된다 (De Jong et al., 1982; Schatton-Gadelmayer and Engels, 1988; Duay et al., 2002; Shen et al., 2005; Kralj et al., 2007; Rosenkranz et al., 2010; Roth et al., 2020). 기생 과정에 바이러스와 세균의 전파하는 데, 현재까지 알려진 18종의 꿀벌 바이러스 중 6종 이상을 매개한다 (Chen and Siede, 2007; Boecking and Genersch, 2008). 특히 날개기형바이러스 (DWV)가 대표적이다 (Khongphinitbunjong et al., 2016). 꿀벌응애는 꿀벌 번데기 기간에 번식하는데, 소방 내부로 들어가 60~70시간 후에 산란을 시작한다 (Martin, 1994; Garrido and Rosenkranz, 2003; Jung 2009). 첫 산란 후 30시간 간격으로 산란을 계속하게 된다 (Ifantidis, 1983). 꿀벌 번데기가 성충이 되어 출방할 때, 꿀벌에 편승하여 번식한 꿀벌응애도 함께 나오게 된다 (Jung, 2015). 중국가시응애는 꿀벌응애와 유사한 생활사를 가지고 있으나, 30시간 간격으로 산란을 하는 꿀벌응애와 달리, 24시간 간격으로 산란을 한다 (Woyke, 1987a). 그리고 꿀벌응애는 성충에 편승하는 기간이 길지만 중국가시응애는 성충에 편승기간이 매우 짧고 방랑생활을 한다 (Woyke, 1987a; Jung et al., 2014).
외부 기생성 응애류의 피해를 줄이기 위해서 양봉농가들은 합성화합물과 천연물을 이용한 화학적 방제, 생태적 방제, 기계적 방제 등 다양한 방제법을 적용하고 있다 (Jung and Kim, 2008). 플루발리네이트, 아미트라즈, 쿠마포스가 대표적인 합성화합물이다. 천연물로는 개미산, 옥살산, 티몰 등이 있다 (Tihelka, 2018).
옥살산은 1980년대부터 사용이 되어왔으며 (Takeuchi and Harada, 1983), 접촉독제로서 (Aliano et al., 2006; Aliano and Ellis, 2008), 벌통 내 낮은 잔류와 높은 방제 효과를 보이며 (Gregorc and Planinc, 2001; Nanetti et al., 2003; Rademacher and Harz, 2006; Bacandritsos et al., 2007), 아직까지 저항성 보고가 없는 상태이다. 개미산도 비슷한 장점을 가지는데 특히 성충에 붙어있는 응애뿐 아니라 소방 안에 있는 응애의 방제도 일부 가능하다는 장점을 가지고 있다 (Fries, 1991; Bogdanov et al., 1998; Rosenkranz et al., 2010).
플루발리네이트는 사용법이 간단하여 농가에서 가장 흔하게 장기간 사용해왔다 (Lee et al., 2005; Jeong et al., 2016). 약효도 매우 좋았으나 (Kim and Jung, 2008), 최근 국내 플루발리네이트 저항성 돌연변이가 83%까지 증가되었다고 보고되었다 (Kim and Lee, 2022). 그러나 현재까지 플루발리네이트에 대한 현장 약효 평가에 대한 정보는 미비하다.
꿀벌 외부 기생성 응애류는 여름철에 꿀벌 군집 내 밀도가 급증하기 때문에, 여름철 약제 방제가 매우 중요하다 (Choi et al., 1986; Jung and Kim, 2008). 국내 여름철은 고온 다습하여 꿀벌응애류의 번식에 유리하며, 또한 응애류 개체군 증가 속도가 빠른 시기이다 (Underwood and Currie, 2003; Jung, 2015). 따라서 봄철이나 가을철과는 약제 방제 효과가 다르게 나타날 수 있다 (Oh et al., 2024b).
본 연구는 고온 다습한 여름철 환경에서 꿀벌 외부 기생성 응애류 밀도 억제 방안을 찾아보고자 하였다. 특히 다음의 가설에 집중하고자 하였다. 1) 온도 조건이 맞는다면 번데기 방 내부와 외부에서 약효를 발휘하는 개미산의 방제 효과가 우수하고, 저항성이 발달된 플루발리네이트는 방제 효과가 없다. 2) 번데기 방이 있고, 응애류 밀도 증가율이 높은 여름철에 옥살산 처리는 효과가 적다. 3) 약제 노출 기간이 더 많은 꿀벌응애가 중국가시응애보다 방제 효과가 우수하다. 4) 고온 다습한 조건에서 꿀벌 응애류 방제 약제는 꿀벌 건강에 위협이 될 수 있다.
재료 및 방법
1. 시험 봉군
꿀벌 기생성 응애류 방제 시험은 2024년 6월 24일부터 7월 26일까지 군위군과 안동시에 위치한 농가에서 수행하였다 (군위군 (36°16ʹ17ʺN, 128°33ʹ05ʺE)과 안동시 (36°34ʹ17ʺN, 128°43ʹ32ʺE)). 각 양봉장에서 정상적으로 산란하는 양봉꿀벌 봉군을 이용하였다. 봉군은 5매상, 성충 약 6,000마리, 소비 전체에 번데기 방 영역은 20% 정도로 표준화하였다. 4개의 처리구를 5반복으로 하여, 지역별 20개의 벌통을 이용하였다. 두 양봉장 모두 시험 진행 3개월 전부터 살비제 처리하지 않은 봉군을 사용하였다.
2. 공시 약제 및 처리 방법
평가 약제는 개미산, 옥살산, 플루발리네이트를, 후속 처리 약제로 티몰을 사용하였다. 양봉용 개미산 (60%, CAS NO. 64-18-6, Feicheng aicd chemicals Co., Ltd. China), 99.6% 분말형태의 옥산살 (CAS NO. 6153-56-6, 중국, Epoch Master Global Business Inc. Jiangsu, China), 그리고 플루발리네이트 스트립 (30 mg, 대한민국, ㈜제이비즈), 티몰 액제 (21 g, 메파티카, 대한민국, 비센바이오㈜)를 구입하여 사용하였다.
개미산은 봉군 당 15 mL을 비가드 기화기 (대한민국, (유)다비)에 처리하였다. 기화기 (가로×세로×높이, 13.7×8.8×2.9 cm)에 포함되어 있는 흡수패드에 개미산을 흡수시켰다. 사용 방법에 따라 휘산량 조절 뚜껑은 닫아 단시간 휘발을 방지하였다. 기화기는 봉군 내부 소광대 위에 배치하였다. 기화기 배치 후, 소문을 완전히 열어 두었다. 옥살산은 가스 토치형 옥살산 훈증기 (Henan Bee Healthy Bio-Technology Co., Ltd, China)를 사용하여 소문을 통해 훈증 처리하였다. 해당 기계에 2 g의 옥살산을 넣은 후 연기가 더 이상 나오지 않을 때까지 처리 후 10분간 소문을 닫아두었다. 플루발리네이트의 경우 봉군 당 1개의 스트립을 3번과 4번째 소비 사이에 걸어 두었다. 약제처리는 6월 29일, 7월 5일, 그리고 7월 14일에 약 1주일 간격으로 3회 처리하였고 1주일 후에 티몰 후속처리를 하였다. 티몰은 약제 20 mL를 물 980 mL에 희석한 후, 소비 당 5 mL씩 흘림 처리하였다 (Table 1).
3. 약제 방제 효과
응애류 밀도 조사는 두 가지 방법으로 진행하였다. 바닥 끈끈이법; 벌통 바닥에 바셀린을 도포한 끈끈이판을 넣어 3일간 바닥으로 떨어지는 응애 개체수를 확인하였다 (Kim and Jung, 2010; Dietemann et al., 2013). 처리 효과를 파악하고자 할 때에는 약제 처리 직전 끈끈이판을 배치하였다. 번데기 방 열기법; 번데기 방 내 응애 감염률을 알아보기 위하여 번데기 방이 형성된 소비 2장을 수거한 후, 핀셋을 이용하여 번데기 방을 열어 번데기 방 내에 있는 응애를 확인하였다 (Pettis et al., 2013). 이때, 번데기의 단계는 나누지 않았다. 흰 눈과 분홍 눈 단계의 번데기의 경우, 번데기를 꺼낸 후 응애가 소방 벽면에 붙어 있어 확인이 되지 않는 경우가 많아 작은 붓을 이용하여 소방 내부를 쓸어 확인하였다. 소방 10개를 일렬로 열어 확인하였으며, 10개를 끝낸 후 무작위로 위치를 변경하여 번데기 방을 확인하였다. 해당 방법으로 소비 한 면당 50개 번데기 방을 열어 봉군당 총 200개의 소방을 확인하였다. 처리 전과 마지막 약제 처리 후 3일째에 실시하였다.
약제들의 방제 효과는 Dietemann et al. (2013)을 참고하여 계산하였다. 계산식은 아래와 같다. 계산된 방제 효과를 기반으로 응애 종별, 지역별 방제 효과의 순위를 바탕으로 방제 가능성을 추정하였다.
4. 봉군 영향 평가
응애류 약제 처리로 인한 봉군 영향을 파악하기 위하여 봉군 세력을 측정하였다. 평가 항목으로는 꿀벌 성충과 소비에서의 번데기 방의 비율을 확인하였다. 해당 방법은 벌 1마리가 소방 3칸을 차지한다는 점에서 착안하여, 성충이 소비 한 면을 가득 채웠을 때 1,150마리로 가정하여 평가를 진행하였다. 번데기 방의 면적은 소비 한 면을 32칸으로 나누었고, 번데기 방이 차지하는 비율을 확인하였다 (Delaplane et al., 2013). 봉군 영향은 약제 처리 전, 6월 24일과 최종 약제 처리 후 7월 17일에 실시하였다.
5. 통계 처리
처리 전, 후 번데기 방 내 감염률, 꿀벌 성충 수와 번데기 방 면적 자료는 정규성을 띄었을 때는 paired t-test, 정규성을 띄지 않았을 때는 Wilcoxon signed-rank test 방법을 이용하여 분석하였다. 독립변수는 처리 전, 후 시간으로 두었고, 종속변수에는 번데기 내 응애 감염률, 꿀벌 성충 수, 번데기 방 면적을 두었다. 그리고 지역별 꿀벌응애와 중국가시응애에 대한 약제 방제 효과는 정규성 검정 후, 이원배치 분산분석을 통하여 분석하였다. 분석은 SPSS software (IBM Armonk, NY, USA)을 이용하였다.
결 과
1. 번데기 방 내의 응애 감염률
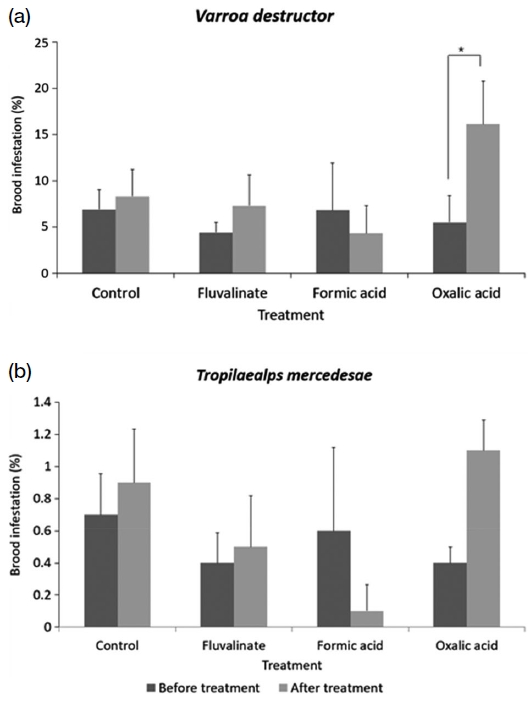
군위 지역에서의 약제 처리 전 꿀벌응애 번데기 방 감염률은 무처리, 플루발리네이트, 개미산, 옥살산 훈증 처리구 순으로 6.9±2.1, 4.4±1.1, 6.8±5.1, 5.5±2.9%이었다. 약제 처리 후에는 무처리, 플루발리네이트, 개미산, 옥살산 훈증 처리구 순으로 8.3±2.9, 7.3±3.3, 4.3±3.0, 16.1±4.6%이었다 (Fig. 1a). 통계 분석 결과 옥살산 훈증 처리구에서 약제 처리 후 응애 감염률이 통계적으로 유의미하게 증가하였다 (Paired t-test, t=-3.277, p<0.05). 중국가시응애의 약제 처리 전 번데기 방 내 감염률은 무처리 0.7±0.2, 플루발리네이트 0.4±0.2, 개미산 0.6±0.5, 옥살산 훈증 처리구 0.4±0.1%이었다. 약제 처리 후 무처리 0.9±0.3, 플루발리네이트 0.5±0.3, 개미산 0.1±0.2, 옥살산 훈증 처리구 1.1±0.2%로 나타났다 (Fig. 1b). 통계 분석 결과 모든 처리구에서 통계적으로 유의미한 차이가 나타나지 않았다.
안동 지역에서의 약제 처리 전 끌벌응애 번데기 방 내의 감염률은 무처리, 플루발리네이트, 개미산, 옥살산 훈증 처리구 순으로 0.1±0.1, 0.7±0.3, 0, 1±0.5%였다. 약제 처리 후에는 무처리, 플루발리네이트, 개미산, 옥살산 훈증 처리구 순으로 12.1±4.6, 6.4±2.8, 3±0.7, 2.8±0.7%이었다. 꿀벌응애의 번데기 방 내 감염률에서 약제 처리 후 무처리구 (Wilcoxon Signed-Rank test, Z= -2.023, p<0.05, Fig. 2a)와 플루발리네이트에서는 통계적으로 유의미하게 증가하였다 (Wilcoxon Signed-Rank test, Z= -2.032, p<0.05, Fig. 2a). 중국가시응애의 약제 처리 전 번데기 방 내 감염률은 무처리 0, 플루발리네이트 0.1±0.1, 개미산 0.1±0.1, 옥살산 훈증 처리구 0.1±0.1%이었다. 약제 처리 후 무처리 0.3±0.1, 플루발리네이트 0.5±0.3, 개미산 0, 옥살산 훈증 처리구 0.1±0.1%로 나타났다 (Fig. 2b). 통계적으로 유의미한 차이는 나타나지 않았다.
2. 꿀벌응애와 중국가시응애에 대한 약제 방제 효과
각 지역에 대한 약제 방제 효과는 다음과 같다. 군위 지역의 꿀벌응애에 대한 방제 효과는 플루발리네이트는 65.7, 개미산 86.5, 그리고 옥살산 훈증 처리구 72.2%였다. 그리고 중국가시응애의 방제 효과는 플루발리네이트 61.4, 개미산 81.9, 그리고 옥살산 훈증 처리구는 54.0%였다. 안동의 경우 꿀벌응애에 대한 방제 효과는 플루발리네이트는 61.7, 개미산 76.8, 그리고 옥살산 훈증 처리구는 66.8%이다. 그리고 중국가시응애에 대한 플루발리네이트, 개미산, 그리고 옥살산 훈증 처리구의 효과는 각 54.3, 67.4 그리고 48.0%로 나타났다.
군위에서의 약제 효과와 대상 응애에 대해 이원배치 분산분석 결과, 처리약제와 응애 종 모두 방제 효과에서 통계적으로 유의미한 차이가 나타나지 않았다. 그리고 이들 간의 상호작용 역시 확인되지 않았다. 안동 지역 역시 처리 약제와 응애 종 모두 방제 효과에서 통계적으로 유의미한 차이가 나타나지 않았다.
3. 봉군 영향 평가
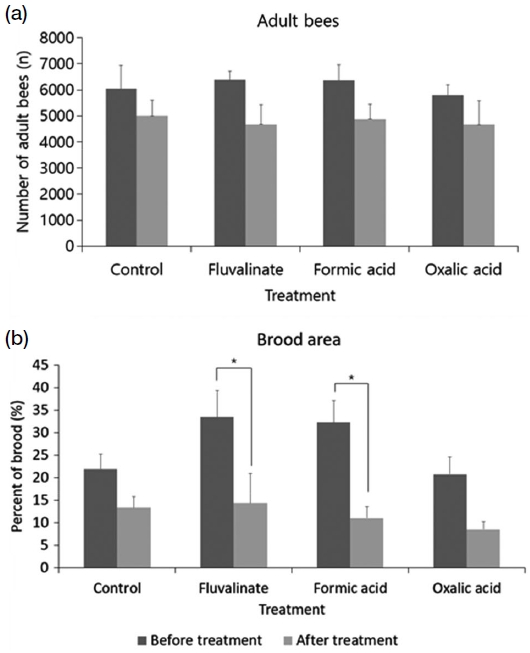
군위 지역에서의 약제 처리 전 성충 수는 무처리 4857.6±595.6, 플루발리네이트 6083.5±971.3, 개미산 5853.5±679.2, 옥살산 훈증 처리구 6152.5±543.1마리이었다. 약제 처리 후는 무처리 3427±1248.2, 플루발리네이트 3611±722.2, 개미산 3526.7±2058.6, 옥살산은 4381.5±829.6마리이었다. 플루발리네이트 처리구에서는 통계적으로 유의미하게 감소하였다 (Paired t-test, t=3.276, p<0.05, Fig. 3a). 약제 처리 전 번데기 방의 영역에서는 순차적으로 무처리, 플루발리네이트, 개미산, 옥살산 훈증 처리 각 16.1±12.8, 8.3±3.4, 15.7±5.1, 17.2±2.7%이었다. 약제 처리 후에는 무처리, 플루발리네이트, 개미산, 옥살산 훈증 처리 각 14.5±6.1, 13.8±3.9, 7.0±2.4, 17.8±3.4%로 나타났다 (Fig. 3b). 그러나 통계적으로 유의미한 차이는 나타나지 않았다.
안동 지역에서 약제 처리 전 성충 수는 무처리, 플루발리네이트, 개미산, 옥살산 처리구 순으로 각 6049±884.2, 6382.5±326.8, 6359.5±598.0, 5796±409.2마리이었다. 약제 처리 후 성충수는 각각 5002.5±608.8, 4680.5±746.3, 4876±585.0, 4669±921.7마리이었다. 약제 처리 전, 후 차이는 통계적으로 유의미하지 않았다 (Fig. 4a). 번데기 방의 영역은 약제 처리 전 무처리 21.9±3.4, 플루발리네이트 33.5±5.9, 개미산 32.3±4.8, 옥살산 훈증 처리구는 20.8±3.8 %이었다. 약제 처리 후에는 무처리 13.4±2.4, 플루발리네이트 14.4±6.5, 개미산 11.1±2.6, 옥살산 훈증 처리 8.6±1.8%이었다. 플루발리네이트 처리구 (Paired t-test, t=2.830, p<0.05)와 개미산 처리구 (Paired t-test, t=2.972, p<0.05)에서 통계적으로 유의미한 감소가 나타났다 (Fig. 4b).
고 찰
여름철 꿀벌 기생성 응애류 방제 효과 시험을 통하여 다음과 같은 결과를 얻을 수 있었다. 개미산의 방제 효과는 우수하였고, 플루발리네이트는 방제 효과가 없었다. 그리고 번데기 방이 있는 조건에서 옥살산 훈증 처리 효과는 크지 않았다. 중국가시응애보다 꿀벌응애에 대한 방제 효과가 전반적으로 우수했다. 또한 여름철 꿀벌 응애류 방제는 꿀벌 유충이나 성충에게 피해를 줄 수 있음이 확인되었다.
처리 전, 후의 번데기 방 내 감염률을 확인하였다. 군위의 경우, 개미산에서만 꿀벌응애, 중국가시응애 모두 약제 처리 후 번데기 방 내 감염률이 낮아진 것을 확인할 수 있었으나, 통계적으로는 유의미하지 않았다. 안동의 결과에서는 중국가시응애의 번데기 방 내 감염률은 개미산에서만 낮아진 것을 확인할 수 있었으나, 통계적으로 유의미하지 않았다. 그러나 다른 약제에서는 번데기 방 내 응애 감염률이 증가하였고, 개미산에서만 감염률이 감소하였다. 이는 개미산이 꿀벌 성충에 붙어있는 응애뿐만 아니라 번데기 방 내부에도 작용한다는 선행연구와 일치한다 (Rosenkranz et al., 2010). 군위 옥살산 훈증 처리구에서 번데기 내 감염률이 통계적으로 유의미하게 증가하였다. 옥살산은 번데기 방 내부로 침투를 하지 못하여, 번데기가 없는 시기에 가장 효과적인 것으로 보고되었다 (Gregorc and Planinc, 2001; Charriére and Imdorf, 2002; Gregorc et al., 2017; Jack et al., 2020). 옥살산이 번데기 방 내부에 있는 응애를 방제하지 못하여 계속 번식이 진행되었기 때문에 약제 처리 후에도 감염률이 증가한 것으로 보인다.
본 시험에서 플루발리네이트와 개미산과 옥살산 훈증의 효과를 비교하였다. 플루발리네이트는 전 세계적으로 장기간 동안 사용되어왔다 (Gracia-Salinas et al., 2006; Jeong et al., 2016). 반복적 사용은 저항성 문제로 이어졌고, 현재 꿀벌응애 방제에 큰 어려움을 겪고 있다 (Kamler et al., 2016). 국내 역시 2009년 저항성이 보고되었다 (Kim et al., 2009). Kim and Lee (2022)의 보고에 따르면 2021년에는 플루발리네이트에 대한 꿀벌응애의 저항성 비율이 24%, 2022년에는 83%으로 증가하였다. 국내에서도 플루발리네이트에 대한 저항성이 확산되고 있다. 본 연구에서도 플루발리네이트 처리구에서 두 지역 모두 끈끈이판에 떨어진 꿀벌응애의 개체수가 다른 약제들에 비하여 적었으며, 방제 효과 또한 낮게 나타났다. 안동의 번데기 방의 감염률이 약제 처리 후 통계적으로 유의미하게 증가한 것을 확인할 수 있었다. 저항성 응애 비율이 83%까지 증가하였음에도 불구하고, 방제 효과가 60%대로 예상보다 높게 나타났다. 그러나 해당 부분이 장기적으로 효과가 있음을 나타내진 않는다. 플루발리네이트는 지용성 화합물로서 밀납에 축적되어 낮은 농도로 지속적으로 노출되게 되고, 이로 인해 저항성 유전자가 확산된다 (Bonzini et al., 2011). 플루발리네이트 사용은 단기간 노출뿐만 아니라 잔류로 인하여 장기간 노출이 된다. 해당 약제 사용 시 저항성 유전자를 증가시킬 가능성이 있으며, 이는 장기적으로 방제 효과를 저하시킬 수 있다 (Hawkins et al., 2019). 플루발리네이트 사용은 단기적 효과는 나타나지만, 저항성 개체의 증가로 인해 장기적으로 부정적인 영향이 나타날 수 있다.
중국가시응애에 비하여 꿀벌응애에 방제 효과가 높게 나타났다. 이는 꿀벌응애와 중국가시응애의 행동과 약제 노출 기간의 차이에서 기인한다고 판단된다. 꿀벌응애와 중국가시응애 모두 번데기 방 내에서 번식 및 기생을 한다. 꿀벌응애의 생활사는 꿀벌 번데기에 기생하면서 번식하는 번식기와 꿀벌 성충에 기생하는 편승기로 나눌 수 있다 (Jung, 2015; Traynor et al., 2020). 이는 꿀벌 성충에 기생이 가능하다는 것을 의미한다. 그리고 13일동안 번데기 방 외부에서 머물 수 있다는 선행연구도 존재한다 (Schulz, 1984). 중국가시응애는 꿀벌 성충에 대한 형태적 적응이 부족하며 (Delfinado-Baker et al., 1992), 번데기 방 외부에서 1~2일 정도 생존이 가능하다 (Woyke, 1987b). 중국가시응애는 꿀벌응애에 비하여 꿀벌 성충에 기생하는 기간 및 번데기 방 외부에 있는 시간이 짧기 때문에, 약제의 효과가 덜 미치는 것으로 볼 수 있다 (Pettis et al., 2017). Dong et al. (2016)에서는 중국가시응애 앞다리의 TmTRPA1 채널이 미세한 화학자극을 빠르게 감지할 수 있다고 보고하였다. 빠른 자극 감지 능력은 주변 약제와 같은 독성물질을 인지하고 신속하게 반응할 수 있음을 시사한다 (Dong et al., 2016). 약제를 인지하고 회피하여 약제 효과가 상대적으로 낮게 나타난 것으로 보인다.
약제 처리 전에 비하여 처리 후 봉군의 세력 및 번데기 방의 영역이 감소한 것을 확인할 수 있었다. 성충 수는 군위와 안동의 대부분의 처리구에서는 통계적으로 유의미한 차이가 나타나지 않았다. 그러나 군위의 플루발리네이트 처리구에서는 통계적으로 유의미한 차이가 나타났다. 꿀벌 군집은 6월까지 증가하는 것으로 알려져 있다. 밀원의 감소와 고온 환경으로 인해 7월 중순이 되면 여왕의 산란이 감소하는 경향이 나타난다. 이로 인해 산란의 감소는 새로운 일벌의 감소로 이어진다 (Bodenheimer, 1937). 본 시험은 7월 말까지 진행되었고, 무처리에서도 성충수가 감소하였으므로 시기적인 꿀벌 성충 수 감소의 영향이 반영된 것으로 판단된다. 다른 처리구들과 달리, 군위의 플루발리네이트 처리구에서는 약제 처리 전, 후 성충 수에서 통계적으로 유의미한 감소가 나타났다. 선행연구에서 플루발리네이트는 꿀벌의 학습과 기억능력 그리고 비행능력에 부정적인 영향을 미치는 것으로 나타났다 (Frost et al., 2013; Ko et al., 2022). 외역활동을 하는 꿀벌의 채집 효율은 밀원식물의 위치를 빠르게 학습하고 기억하는 능력에 달려있다 (Wang et al., 2017). 학습, 기억 능력 및 비행 능력에 부정적 영향을 미치는 것은 외역봉이 외역 활동을 제대로 하지 못하는 결과를 초래한다. 그로 인하여 봉군 내 먹이 부족 및 외역봉 손실 등으로 이어질 수 있으며 봉군 세력 감소까지 영향을 미칠 수 있다. 두 지역에서 번데기 방의 영역이 감소한 것을 확인할 수 있었다. 개미산이 꿀벌의 애벌레에 영향을 미친다는 선행연구를 비추어 보았을 때 (Ostermann and Currie, 2004), 동일한 경향이 나타난 것으로 판단된다. 계절에 따른 개미산의 기화량을 보았을 때, 가을철에 비하여 여름철에 더 빠르게 기화하였다 (Oh et al., 2024a). 시험 시기인 여름의 고온에 의하여 개미산의 농도가 봉군 내부에서 단시간에 증가할 수 있음을 의미한다. 따라서, 여름철에 개미산으로 인해 애벌레에 대한 영향이 증가할 수 있다. 선행연구의 결과와 본 연구의 번데기 방에 미치는 영향을 고려하였을 때, 고온 다습한 환경인 여름철에 개미산 사용에 주의가 필요할 것으로 사료된다.
본 시험의 결과를 표로 정리하면 다음과 같다 (Table 2). 국내 여름철 조건에서 꿀벌응애와 중국가시응애에 개미산이 가장 좋은 효과가 나타났다. 플루발리네이트와 옥살산 훈증 처리구는 종에 따라 상이한 효과가 나타났다. 플루발리네이트는 꿀벌응애에서 다른 약제들에 비해 상대적으로 효과가 낮은 것을 확인할 수 있었다. 여름철 시험을 진행했던 선행연구들에 비해서도 다소 효과가 없음을 확인할 수 있었다 (Tables 2, 3). 따라서 여름철 꿀벌 기생 응애류의 효과적 방제를 위해서는 생태적 방법을 같이 동원해야 할 것으로 판단된다. Tokach et al. (2024)에 따르면 왕 가둠 이후 개미산을 처리했을 때 100%에 가까운 방제 효과를 보고하였다. 국내에서도 여름철 비슷한 결과를 얻은 바 있다 (Aurell et al., in review). 따라서, 계절 및 봉군 상태에 최적화된 방제방법을 선택하는 것이 필요하다. 화학적 방제에서는 저항성 문제를 고려하였을 때, 플루발리네이트 사용은 지양하고, 천연물을 이용한 방제가 필요하다. 화학적 방법과 병행하여 왕가둠 등 생태적 방법을 통합적으로 운영하여야 한다. 여름철처럼 번데기 방 내에 존재하는 응애까지 효과적으로 제어할 수 있는 종합적 응애 관리 전략을 마련해야 할 필요가 있다.
적 요
본 연구는 여름철 국내 양봉장에서 사육 중인 양봉꿀벌 봉군을 대상으로, 꿀벌응애 (Varroa destructor)와 중국가시응애 (Tropilaelaps mercedesae)에 대하여 개미산 (60% formic acid)과 옥살산 훈증의 방제 효과를 비교 평가하였다. 시험은 안동과 군위의 상업 양봉장에서 총 40개 벌통을 대상으로 진행되었으며, 각 약제 처리는 1주 간격으로 3회 시행하였다. 후속 처리는 티몰로 수행되었다. 방제 효과 평가는 벌통 바닥에 바세린을 바른 바닥판에 떨어진 응애 수, 번데기 내 응애 감염률 및 봉군 세력 (성충 수 및 번데기 면적)을 측정하여 산출되었다. 연구 결과, 전반적으로 개미산 처리군은 두 지역 모두에서 꿀벌응애에 대해 가장 높은 방제 효과를 나타내었으며, 번데기 내 감염률 역시 유의하게 감소한 것으로 확인되었다. 반면에, 옥살산은 번데기가 존재하는 조건에서 효과가 제한적이었으며, 군위에서는 번데기 내 감염률이 오히려 유의미하게 증가하였다. 또한, 국내에서 오랜 기간 사용되어온 플루발리네이트는 내성 문제로 인해 꿀벌응애에 대해 방제 효과가 낮게 나타났다. 본 연구는 여름철 고온과 습한 환경 및 봉군 생장기에 따른 약제의 효능 차이를 고려할 때, 개미산을 적정 농도로 사용한 방제 전략이 가장 효과적임을 제안한다. 그리고 플루발리네이트 사용을 지양하고 천연 화합물을 기반으로 한 통합 방제 전략의 필요성을 강조 한다.
Acknowledgments
본 연구는 농촌진흥청 농업정책지원기술개발 사업 꿀벌 강건성 연구 과제 (이상기온 대응 꿀벌 스마트 관리 기술개발, RS-2023-00232847)의 지원으로 수행되었습니다.
References
-
Aliano, N. P., M. D. Ellis and B. D. Siegfried. 2006. Acute contact toxicity of oxalic acid to Varroa destructor (Acari: Varroidae) and their Apis mellifera (Hymenoptera: Apidae) hosts in laboratory bioassays. J. Econ. Entomol. 99(5): 1579-1582.
[https://doi.org/10.1093/jee/99.5.1579]

-
Aliano, N. P. and M. D. Ellis. 2008. Bee-to-bee contact drives oxalic acid distribution in honey bee colonies. Apidologie 39(5): 481-487.
[https://doi.org/10.1051/apido:2008030]

-
Anderson, D. L. and J. M. Roberts. 2013. Standard methods for Tropilaelaps mites research. J. Apic. Res. 52(4): 1-16.
[https://doi.org/10.3896/IBRA.1.52.4.21]

-
Bacandritsos, N., I. Papanastasiou, C. Saitanis, A. Nanetti and E. Roinioti. 2007. Efficacy of repeated trickle applications of oxalic acid in syrup for varroosis control in Apis mellifera: Influence of meteorological conditions and presence of brood. Vet. Parasitol. 148(2): 174-178.
[https://doi.org/10.1016/j.vetpar.2007.06.001]

-
Bodenheimer, F. S. 1937. Studies in animal populations. II. Seasonal population-trends of the honey-bee. Q. Rev. Biol. 12(4): 406-425.
[https://doi.org/10.1086/394540]

-
Boecking, O. and E. Genersch. 2008. Varroosis-the ongoing crisis in beekeeping. J. Verbrauch. Lebensm. 3: 221-228.
[https://doi.org/10.1007/s00003-008-0331-y]

-
Bogdanov, S., V. Kilchenmann and A. Imdorf. 1998. Acaricide residues in some bee products. J. Apic. Res. 37(2): 57-67.
[https://doi.org/10.1080/00218839.1998.11100956]

-
Bonzini, S., P. Tremolada, I. Bernardinelli, M. Colombo and M. Vighi. 2011. Predicting pesticide fate in the hive (part 1): experimentally determined τ-fluvalinate residues in bees, honey and wax. Apidologie 42: 378-390.
[https://doi.org/10.1007/s13592-011-0011-2]

-
Burgett, M., P. Akratanakul and R. A. Morse. 1983. Tropilaelaps clareae: a parasite of honeybees in south-east Asia. Bee World 64(1): 25-28.
[https://doi.org/10.1080/0005772X.1983.11097904]

-
Calderone, N. W. 2012. Insect pollinated crops, insect pollinators and US agriculture: trend analysis of aggregate data for the period 1992-2009. PLoS ONE 7(5): e37235.
[https://doi.org/10.1371/journal.pone.0037235]

-
Charriére, J. D. and A. Imdorf. 2002. Oxalic acid treatment by trickling against Varroa destructor: recommendations for use in central Europe and under temperate climate conditions. Bee World 83(2): 51-60.
[https://doi.org/10.1080/0005772X.2002.11099541]

-
Chen, Y. P. and R. Siede. 2007. Honey bee viruses. Adv. Virus Res. 70: 33-80.
[https://doi.org/10.1016/S0065-3527(07)70002-7]

- Choi, S. Y., K. S. Woo and Y. S. Kim. 1986. Questionary survey on the Varroa mites in Korean beekeeping. J. Apic. 1(1): 62-75.
-
Dainat, B., T. Ken, H. Berthoud and P. Neumann. 2009. The ectoparasitic mite Tropilaelaps mercedesae (Acari, Laelapidae) as a vector of honeybee viruses. Insectes Soc. 56: 40-43.
[https://doi.org/10.1007/s00040-008-1030-5]

-
de Jongh, E. J., S. L. Harper, S. S. Yamamoto, C. J. Wright, C. W. Wilkinson, S. Ghosh and S. J. Otto. 2022. One Health, One Hive: A scoping review of honey bees, climate change, pollutants, and antimicrobial resistance. PLoS ONE 17(2): e0242393.
[https://doi.org/10.1371/journal.pone.0242393]

-
De Jong, D., P. H. De Jong and L. S. Gonçalves 1982. Weight loss and other damage to developing worker honeybees from infestation with Varroa jacobsoni. J. Apic. Res. 21(3): 165-167.
[https://doi.org/10.1080/00218839.1982.11100535]

-
Delaplane, K. S., J. Van Der Steen and E. Guzman-Novoa 2013. Standard methods for estimating strength parameters of Apis mellifera colonies. J. Apic. Res. 52(1): 1-12.
[https://doi.org/10.3896/IBRA/1.52.1.03]

-
Delfinado, M. D. 1963. Mites of the honeybee in South-East Asia. J. Apic. Res. 2(2): 113-114.
[https://doi.org/10.1080/00218839.1963.11100070]

-
Delfinado, M. D. and E. W. Baker. 1961. Tropilaelaps, a new genus of mite from the Philipppines (Laelaptidae: Acarina). Fieldiana Zoology 44: 53-56
[https://doi.org/10.5962/bhl.title.3028]

-
Delfinado-Baker, M., W. Rath and O. Boecking. 1992. Phoretic bee mites and honeybee grooming behavior. Int. J. Acarol. 18(4): 315-322.
[https://doi.org/10.1080/01647959208683966]

-
Dietemann, V., F. Nazzi, S. J. Martin, D. L. Anderson, B. Locke, K. S. Delaplane, ... and J. D. Ellis. 2013. Standard methods for varroa research. J. Apic. Res. 52(1): 1-54.
[https://doi.org/10.3896/IBRA.1.52.1.09]

-
Dong, X., M. Kashio, G. Peng, X. Wang, M. Tominaga and T. Kadowaki. 2016. Isoform-specific modulation of the chemical sensitivity of conserved TRPA1 channel in the major honeybee ectoparasitic mite, Tropilaelaps mercedesae. Open Biol. 6(6): 160042.
[https://doi.org/10.1098/rsob.160042]

- Duay, P., D. De Jong and W. Engels. 2002. Decreased flight performance and sperm production in drones of the honey bee (Apis mellifera) slightly infested by Varroa destructor mites during pupal development. Genet. Mol. Res. 1(3): 227-232.
-
Francis, R. M., S. L. Nielsen and P. Kryger 2013. Varroa-virus interaction in collapsing honey bee colonies. PLoS ONE 8: e57540.
[https://doi.org/10.1371/journal.pone.0057540]

- Fries, I. 1991. Treatment of sealed honey bee brood with formic acid for control of Varroa jacobsoni. Am. Bee J. (USA) 131(5): 313-314.
-
Frost, E. H., D. Shutler and N. K. Hillier. 2013. Effects of fluvalinate on honey bee learning, memory, responsiveness to sucrose, and survival. J. Exp. Biol. 216(15): 2931-2938.
[https://doi.org/10.1242/jeb.086538]

-
Gallai, N., J. M. Salles, J. Settele and B. E. Vaissière. 2009. Economic valuation of the vulnerability of world agriculture confronted with pollinator decline. Ecol. Econ. 68(3): 810-821.
[https://doi.org/10.1016/j.ecolecon.2008.06.014]

-
Garibaldi, L. A., I. Steffan-Dewenter, R. Winfree, M. A. Aizen, R. Bommarco, S. A. Cunningham, ... and A. M. Klein. 2013. Wild pollinators enhance fruit set of crops regardless of honey bee abundance. Science 339(6127): 1608-1611.
[https://doi.org/10.1126/science.1230200]

-
Garrido, C. and P. Rosenkranz. 2003. The reproductive program of female Varroa destructor mites is triggered by its host, Apis mellifera. Exp. Appl. Acarol. 31: 269-273.
[https://doi.org/10.1023/B:APPA.0000010386.10686.9f]

-
Gracia-Salinas, M. J., M. Ferrer-Dufol, E. Latorre-Castro, C. Monero-Manera, J. A. Castillo-Hernández, J. Lucientes-Curd and M. A. Peribanez-Lopez. 2006. Detection of fluvalinate resistance in Varroa destructor in Spanish apiaries. J. Apic. Res. 45(3): 101-105.
[https://doi.org/10.1080/00218839.2006.11101326]

-
Gregorc, A. and I. Planinc. 2001. Acaricidal effect of oxalic acid in honeybee (Apis mellifera) colonies. Apidologie 32(4): 333-340.
[https://doi.org/10.1051/apido:2001133]

-
Gregorc, A., M. Alburaki, C. Werle, P. R. Knight and J. Adamczyk. 2017. Brood removal or queen caging combined with oxalic acid treatment to control varroa mites (Varroa destructor) in honey bee colonies (Apis mellifera). Apidologie 48: 821-832.
[https://doi.org/10.1007/s13592-017-0526-2]

-
Hawkins, N. J., C. Bass, A. Dixon and P. Neve. 2019. The evolution of insecticide resistance in agricultural pests. Insect Biochem Mol. Biol. 108: 1-11.
[https://doi.org/10.1016/j.ibmb.2019.04.001]

-
Ifantidis, M. D. 1983. Ontogenesis of the mite Varroa jacobsoni in worker and drone honeybee brood cells. J. Apic. Res. 22(3): 200-206.
[https://doi.org/10.1080/00218839.1983.11100588]

-
Jack, C. J., E. van Santen and J. D. Ellis 2020. Evaluating the efficacy of oxalic acid vaporization and brood interruption in controlling the honey bee pest Varroa destructor (Acari: Varroidae). J. Econ. Entomol. 113(2): 582-588.
[https://doi.org/10.1093/jee/toz358]

-
Jeong, S., C. Lee, D. Kim and C. Jung. 2016. Questionnaire study on the overwintering success and pest management of honeybee and damage assessment of Vespa hornets in Korea. J. Apic. 31: 201-210.
[https://doi.org/10.17519/apiculture.2016.09.31.3.201]

-
Johnson, R. M., M. D. Ellis, C. A. Mullin and M. Frazier. 2010. Pesticides and honey bee toxicity-USA. Apidologie 41: 312-331.
[https://doi.org/10.1051/apido/2010018]

- Jung, C. 2009. Frame Work of the Adaptive Population Dynamic Model of Varroa Mite in Korean Beekeeping Environment. Kor. J. Apic. 24: 67-74.
-
Jung, C. 2015. Simulation study of varroa population under the future climate conditions. J. Apic. 30(4): 349-358.
[https://doi.org/10.17519/apiculture.2015.11.30.4.349]

- Jung, C. and D. Kim. 2008. A population model of the Varroa mite, Varroa destructor on adult honeybee in the colony I. Exponential population growth. J. Apic. 23(4): 269-273.
-
Jung, C. and Y. H. Bae. 2022. Production and Characteristics of Winter Generation Honey Bees, Apis mellifera: Discussion with Overwintering Failure. J. Apic. 2022.37(3): 265-274.
[https://doi.org/10.17519/apiculture.2022.09.37.3.265]

- Jung, C. and J. H. Shin. 2022. Evaluation of crop production increase through Insect Pollination Service in Korean Agriculture. Korean J. Appl. Entomol. 61(1): 229-238.
-
Jung, C., D. W. Kim and J. W. Kim. 2014. Redefined species of Tropilaelaps mercedesae Anderson and Morgan, 2007. (Acari: Laelapidae) parasitic on Apis mellifera in Korea. J. Apic. 29: 217-221.
[https://doi.org/10.17519/apiculture.2014.11.29.4.217]

-
Kamler, M., M. Nesvorna, J. Stara, T. Erban and J. Hubert. 2016. Comparison of tau-fluvalinate, acrinathrin, and amitraz effects on susceptible and resistant populations of Varroa destructor in a vial test. Exp. Appl. Acarol. 69: 1-9.
[https://doi.org/10.1007/s10493-016-0023-8]

-
Khongphinitbunjong, K., P. Neumann, P. Chantawannakul and G. R. Williams. 2016. The ectoparasitic mite Tropilaelaps mercedesae reduces western honey bee, Apis mellifera, longevity and emergence weight, and promotes deformed wing virus infections. J. Invertebr. Pathol. 137: 38-42.
[https://doi.org/10.1016/j.jip.2016.04.006]

- Kim, D. and C. Jung. 2008. Evaluation of Chemical Susceptibility for the Ectoparasitic Mite Varroa destructor Anderson and Trueman (Mesostigmata: Varroidae) in Honeybee (Apis mellifera L.). J. Apic. 23(4), 259-268.
- Kim, D. and C. Jung. 2010. Comparison of population monitoring techniques for the ectoparasitic mite Varroa destructor in honeybee (Apis mellifera L.). J. Apic. 25(3), 201-209.
- Kim, W., M. Lee, S. Han, K. Park, J. Choi, J. Kim, ... and Y. Koh. 2009. A geographical polymorphism in a voltage-gated sodium channel gene in the mite, Varroa destructor, from Korea. J. Apic. 24(3): 159-165.
-
Kim, Y. H. and S. H. Lee. 2022. Current status of fluvalinate resistance in Varroa destructor in Korea and suggestion for possible solution. J. Apic. 37(3): 301-313.
[https://doi.org/10.17519/apiculture.2022.09.37.3.301]

-
Klein, A. M., B. E. Vaissière, J. H. Cane, I. Steffan-Dewenter, S. A. Cunningham, C. Kremen and T. Tscharntke. 2007. Importance of pollinators in changing landscapes for world crops. Proc. R. Soc. B-Biol. Sci. 274(1608): 303-313.
[https://doi.org/10.1098/rspb.2006.3721]

-
Ko, C. Y., Y. S. Nai, W. Lo, C. T. Chen and Y. W. Chen. 2022. Low-level fluvalinate treatment in the larval stage induces impaired olfactory associative behavior of honey bee workers in the field. Insects 13(3): 273.
[https://doi.org/10.3390/insects13030273]

-
Kralj, J., A. Brockmann, S. Fuchs and J. Tautz. 2007. The parasitic mite Varroa destructor affects non-associative learning in honey bee foragers, Apis mellifera L. J. Comp. Physiol. A 193: 363-370.
[https://doi.org/10.1007/s00359-006-0192-8]

- Laurent, M., P. Hendrikx, M. Ribiere-Chabert and M. P. Chauzat. 2015. A pan-European epidemiological study on honeybee colony losses 2012-2014. EPILOBEE Rep.
- Lee, M. L., Y. M. Park, M. Y. Lee, Y. S. Kim and H. K. Kim. 2005. Density distribution of parasitic mites, Varroa destructor Anderson and Trueman and Tropilaelaps clarea Delfinado and Baker, on honeybee pupae (Apis mellifera L.) in autumn season in Korea. Korean J. Apic. 20(2): 77-82.
-
Lee, S. J., S. H. Kim, J. Lee, J. H. Kang, S. M. Lee, H. J. Park, J. Nam and C. Jung. 2022. Impact of ambient temperature variability on the overwintering failure of honeybees in South Korea. J. Apic. 37(3): 331-347.
[https://doi.org/10.17519/apiculture.2022.09.37.3.331]

- Mahmood, R., E. S. Wagchoure, S. Raja, G. Sarwar and M. Aslam. 2011. Effect of thymol and formic acid against ectoparasitic brood mite Tropilaelaps clareae in Apis mellifera colonies. Pak J. Zool. 43(1): 91-95.
-
Martin, S. J. 1994. Ontogenesis of the mite Varroa jacobsoni Oud. in worker brood of the honeybee Apis mellifera L. under natural conditions. Exp. Appl. Acarol. 18(2): 87-100.
[https://doi.org/10.1007/BF00055033]

-
Matheson, A. 1995. World bee health update. Bee World 76(1): 31-39.
[https://doi.org/10.1080/0005772X.1995.11099235]

- Nanetti, A., R. Büchler, J. Charrière, I. Fries, S. Helland and A. Imdorf. 2003. Oxalic acid treatments for varroa control (a review). Apiacta 38(1): 81-87.
-
Oh, D., K. W. Kim, K. M. Kim, P. N. Akongte, J. K. Kim, C. Lee, B. S. Park, S. B. Kim, Y. Y. Jo, Y. S. Choi and D. Kim. 2024a. Evaluation of vaporization amount of formic acid in different conditions for controlling honeybee mites. J. Apic. 38(1): 11-20.
[https://doi.org/10.17519/apiculture.2023.04.38.1.11]

-
Oh, H., T. Begna and C. Jung. 2024b. Evaluating the Efficacy of Registered Acaricides on Varroa destructor and Tropilaelaps mercedesae, in Apis mellifera Colonies. J. Apic. 39(1): 21-30.
[https://doi.org/10.17519/apiculture.2024.04.39.1.21]

-
Oldroyd, B. P. 2007. What’s killing American honey bees? PLoS Biol. 5(6): e168.
[https://doi.org/10.1371/journal.pbio.0050168]

-
Oldroyd, B. P. and S. Wongsiri. 2009. Asian honey bees: biology, conservation, and human interactions. Harvard Univ. Press, Cambridge, MA, USA.
[https://doi.org/10.2307/j.ctv2drhcfb]

-
Ostermann, D. J. and R. W. Currie. 2004. Effect of formic acid formulations on honey bee (Hymenoptera: Apidae) colonies and influence of colony and ambient conditions on formic acid concentration in the hive. J. Econ. Entomol. 97(5): 1500-1508.
[https://doi.org/10.1603/0022-0493-97.5.1500]

- Oudemans, A. C. 1904. On a new genus and species of parasitic acari. Notes Leyden Mus. 24(4): 216-222.
-
Pettis, J. S., R. Rose, E. M. Lichtenberg, P. Chantawannakul, N. Buawangpong, W. Somana, ... and D. Vanengelsdorp. 2013. A rapid survey technique for Tropilaelaps mite (Mesostigmata: Laelapidae) detection. J. Econ. Entomol. 106(4): 1535-1544.
[https://doi.org/10.1603/EC12339]

-
Pettis, J. S., R. Rose and V. Chaimanee. 2017. Chemical and cultural control of Tropilaelaps mercedesae mites in honeybee (Apis mellifera) colonies in Northern Thailand. PLoS ONE 12(11): e0188063.
[https://doi.org/10.1371/journal.pone.0188063]

-
Plamondon, L., M. Paillard, C. Julien, P. Dubreuil and P. Giovenazzo. 2024. Effects of summer treatments against Varroa destructor on viral load and colony performance of Apis mellifera colonies in Eastern Canada. J. Insect Sci. 24(3): 14.
[https://doi.org/10.1093/jisesa/ieae042]

-
Rademacher, E. and M. Harz. 2006. Effectiveness of oxalic acid for controlling the varroa mite. Apidologie 37: 100-101.
[https://doi.org/10.1051/apido:2005063]

-
Ramsey, S. D., R. Ochoa, G. Bauchan, C. Gulbronson, J. D. Mowery, A. Cohen and D. van Engelsdorp. 2019. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proc. Natl. Acad. Sci. USA 116(5): 1792-1801.
[https://doi.org/10.1073/pnas.1818371116]

-
Rosenkranz, P., P. Aumeier and B. Ziegelmann. 2010. Biology and control of Varroa destructor. J. Invertebr. Pathol. 103: S96-S119.
[https://doi.org/10.1016/j.jip.2009.07.016]

-
Roth, M. A., J. M. Wilson, K. R. Tignor and A. D. Gross. 2020. Biology and management of Varroa destructor (Mesostigmata: Varroidae) in Apis mellifera (Hymenoptera: Apidae) colonies. J. Integr. Pest Manag. 11(1): 1.
[https://doi.org/10.1093/jipm/pmz036]

-
Sajid, Z. N., M. A. Aziz, I. Bodlah, R. M. Rana, H. A. Ghramh and K. A. Khan. 2020. Efficacy assessment of soft and hard acaricides against Varroa destructor mite infesting honey bee (Apis mellifera) colonies, through sugar roll method. Saudi. J. Biol. Sci. 27(1): 53-59.
[https://doi.org/10.1016/j.sjbs.2019.04.017]

-
Schatton-Gadelmayer, K. and W. Engel. 1988. Blood proteins and body weight of newly-emerged worker honeybees with different levels of parasitization of brood mites (Hymenoptera: Apidae: Apis mellifera/Acarina: Varroidae: Varroa jacobsoni). Entomol. Gen. 14: 93-101.
[https://doi.org/10.1127/entom.gen/14/1988/093]

-
Schulz, A. E. 1984. Reproduction and population dynamics of the parasitic mite Varroa jacobsoni Oud. and its dependence on the brood cycle of its host Apis mellifera L. [in German]. Apidologie 15: 401-420.
[https://doi.org/10.1051/apido:19840404]

-
Shen, M., X. Yang, D. Cox-Foster and L. Cui. 2005. The role of varroa mites in infections of Kashmir bee virus (KBV) and deformed wing virus (DWV) in honey bees. Virology 342(1): 141-149.
[https://doi.org/10.1016/j.virol.2005.07.012]

-
Smith, K. M., E. H. Loh, M. K. Rostal, C. M. Zambrana-Torrelio, L. Mendiola and P. Daszak. 2013. Pathogens, pests, and economics: drivers of honey bee colony declines and losses. EcoHealth 10: 434-445.
[https://doi.org/10.1007/s10393-013-0870-2]

- Takeuchi, K. and K. Harada. 1983. Control of Varroa jacobsoni mites with oxalic acid spray. Honeybee Sci. 4: 113-116.
-
Tihelka, E. 2018. Effects of synthetic and organic acaricides on honey bee health: a review. Slov. Vet. Res. 55(3): 114-140.
[https://doi.org/10.26873/SVR-422-2017]

-
Tokach, R., B. Chuttong, D. Aurell, L. Panyaraksa and G. R. Williams. 2024. Managing the parasitic honey bee mite Tropilaelaps mercedesae through combined cultural and chemical control methods. Sci. Rep. 14(1): 25677.
[https://doi.org/10.1038/s41598-024-76185-4]

-
Traynor, K. S., F. Mondet, J. R. de Miranda, M. Techer, V. Kowallik, M. A. Oddie and A. McAfee. 2020. Varroa destructor: A complex parasite, crippling honey bees worldwide. Trends Parasitol. 36(7): 592-606.
[https://doi.org/10.1016/j.pt.2020.04.004]

-
Truong, A. T., M. S. Yoo, B. R. Yun, J. E. Kang, J. Noh, T. J. Hwang, ... and Y. S. Cho. 2023. Prevalence and pathogen detection of Varroa and Tropilaelaps mites in Apis mellifera (Hymenoptera, Apidae) apiaries in South Korea. J. Apic. Res. 62(4): 804-812.
[https://doi.org/10.1080/00218839.2021.2013425]

-
Underwood, R. M. and R. W. Currie. 2003. The effects of temperature and dose of formic acid on treatment efficacy against Varroa destructor (Acari: Varroidae), a parasite of Apis mellifera (Hymenoptera: Apidae). Exp. Appl. Acarol. 29: 303-313.
[https://doi.org/10.1023/A:1025892906393]

- VanEngelsdorp, D., R. Underwood, D. Caron and J. Jr. Hayes. 2007. An estimate of managed colony losses in the winter of 2006-2007: a report commissioned by the Apiary Inspectors of America. Am. Bee J. 147: 599-603.
- Wang Kang, W. K., P. Q. Pang Qian, Z. W. Zhang WenWen and J. T. Ji Ting. 2017. Effects of sublethal doses of carbendazim on the growth and detoxifying enzyme activities of honeybee (Apis mellifera ligustica) larvae. Acta Entomol. Sin., 60(6): 642-649.
-
Woyke, J. 1987a. Length of successive stages in the development of the mite Tropilaelaps clareae in relation to honeybee brood age. J. Apic. Res. 26(2): 110-114.
[https://doi.org/10.1080/00218839.1987.11100746]

-
Woyke, J. 1987b. Length of stay of the parasitic mite Tropilaelaps clareae outside sealed honeybee brood cells as a basis for its effective control J. Apic. Res. 26: 104-109.
[https://doi.org/10.1080/00218839.1987.11100745]