월동 중 온도 상승이 서양뒤영벌 여왕벌의 생존율에 미치는 영향
Abstract
Climate change, including heatwaves, is causing a decline in the population size and diversity of bumblebees. This study examined the effects of rising temperature during hibernation on the survival rate of Bombus terrestris queens, sperm viability in the spermatheca, and subsequent colony characteristics. Queens that emerged under optimal (27°C) and high-temperature (32°C) conditions were mated and then hibernated at 2.5°C for 12 weeks. Additionally, some queens hibernated at 2.5°C for 8 or 9 weeks before the temperature increased to 7.5°C or 12.5°C for 4 or 3 weeks, respectively. As temperature and duration increased, post-hibernation weight loss in queens rose significantly, and survival rates declined sharply when the temperature was raised to 12.5°C for 3 or 4 weeks. However, sperm viability in the spermatheca of surviving queens showed no significant difference. Moreover, key colony characteristics, including oviposition rate, colony formation rate, new queen emergence rate, number of adult offspring, and adult body weight, remained largely affected. These findings suggest that elevated temperatures during hibernation negatively affect queen survival rates, potentially contributing to population decline.
Keywords:
Bumblebee, Bombus terrestris, Hibernation, Queen, Temperature서 론
기후변화로 인한 이상기온과 폭염은 전 세계적으로 계절과 지역에 상관없이 발생하며 그 빈도가 증가하고 기간이 길어지는 경향을 보이고 있다 (Meehl and Tebaldi, 2004; Hallmann et al., 2017; Mavrakis et al., 2021; Kaiser et al., 2023). 온도 상승은 주변 온도에 민감한 곤충에게 있어 발육, 정자 기능, 생식력, 개체수 및 서식지 분포에 직접적인 영향을 줌으로써 종의 감소를 일으킨다 (Parmesan et al., 1999; Bale et al., 2002; Parmesan, 2006; Deutsch et al., 2008; Kingsolver et al., 2013; Sales et al., 2018, 2021). 그중 자연생태계와 농업에 중요한 역할을 하는 화분매개곤충 뒤영벌 (Velthuis and van Doorn, 2006; Klein et al., 2007)은 기후변화에 의해 개체수와 다양성 감소에 심각한 영향을 받고 있다 (Bosch et al., 2000; Cornelissen, 2011; Radmacher and Strohm, 2011; Kerr et al., 2015; Vasiliev and Greenwood, 2021).
서양뒤영벌 (Bombus terrestris)은 27~28℃에서 최적 발육을 한다 (Wysocka-Owczarek, 2006; Roman and Szczesna, 2008). 그러나 봉군 내부 온도가 30~32℃로 상승하면 일벌이 선풍행동으로 온도를 조절하기 시작하며, 온도가 상승할수록 선풍행동에 참여하는 일벌의 비율이 증가한다 (Sepúlveda et al., 2024). 32℃의 고온 조건에서는 서양뒤영벌의 충체 크기가 일벌, 여왕벌, 수벌 순으로 줄어드는 것으로 알려져 있으며 (Kim et al., 2024a), 32℃ 이상의 온도에서 서양뒤영벌 및 B. impatiens의 화분매개 능력이 떨어진다고 보고되었다 (Kwon and Saeed, 2003; Couvillon et al., 2010; Martínez et al., 2014; Lee and Yoon, 2017; Gérard et al., 2022b). 또한 고온조건에서 뒤영벌의 행동, 생태 및 생리에 미치는 영향은 여러 연구를 통해 알려져 있다 (Kwon and Saeed, 2003; Maebe et al., 2021; Martinet et al., 2021; Campion et al., 2023; Kuo et al., 2023; White and Dillon, 2023; Sepúlveda et al., 2024).
서양뒤영벌은 북반구의 온대와 아한대를 중심으로 서식하는 화분매개곤충으로 1년에 1세대를 이루는 생활사를 가진다. 월동을 마친 여왕벌은 봄에 산란을 시작하여 여름철에 봉군을 형성하며, 가을철이 되면 신여왕벌과 수벌이 출현하여 생식기에 접어든다. 이 시기 교미를 끝낸 신여왕벌은 땅속에서 월동을 통해 성충으로 겨울을 나는 것으로 알려져 있다 (Heinrich, 1979; Duchateau and Velthuis, 1988; Yoon et al., 2014). 서양뒤영벌은 월동 기간 동안 난소 발육이 멈춘 상태로 겨울철 저온기를 보낸다. 저온기를 거치면서 점진적으로 휴면이 타파되고 다음해 봄에 산란이 가능해진다. 휴면 기간 중 충분한 휴면을 거친 여왕벌은 난소 발육이 활성화되지만 휴면 중 발육이 미흡한 개체는 월동 후 난소의 발육이 저조해지며 (Wigglesworth, 1974), 실내사육 호박벌 (B. ignitus)의 경우 2.5℃의 저온, 80%의 상대습도 및 2주 이상의 월동 조건이 여왕벌의 생존율을 향상시킨다고 보고하였다 (Yoon et al., 2014). 따라서 월동 기간 동안 온도는 서양뒤영벌의 생활사에 있어서 새로운 세대 형성에 영향을 미치는 중요한 요인이다.
본 연구에서는 서양뒤영벌의 월동 중 온도 상승 및 기간에 따른 여왕벌의 생존율에 미치는 영향을 알아보기 위하여, 발육 적온 (27℃) 및 고온 (32℃) 조건에서 우화한 서양뒤영벌 여왕벌을 대상으로 월동 중 온도 상승 및 기간에 따른 여왕벌의 체중 감소율 및 생존율을 조사하였다. 또한 생존 여왕벌의 수정낭 내 정자 생존율 및 봉세발달 특성을 조사하였다. 교미 후 2.5℃에서 12주 월동 처리하였고, 2.5℃에서 월동 8주 또는 9주 후 온도를 7.5℃와 12.5℃ 로 상승하여 4주 또는 3주 처리하였다. 월동 처리 후 여왕벌의 체중 감소율 및 생존율을 조사하였다. 또한 생존 여왕벌의 수정낭 내 정자 생존율 및 봉세발달 특성을 조사하였다.
재료 및 방법
1. 실험 곤충 및 사육
실험곤충은 농촌진흥청 국립농업과학원에서 분양 받은 10세대 이상의 서양뒤영벌 (Bombus terrestris)을 동아대학교 응용생물공학과에서 각각 온도 27℃ 또는 32℃에서 2~3세대 계대사육하여 사용하였다. 습도는 65±5%, 암조건 속에서 실내 사육하였다 (Yoon et al., 2004). 사육상자는 봉군의 발달 단계에 따라 산란용 나무상자 (9.5×15.0×10.5 cm), 봉군형성용 플라스틱상자 (15.5×16.5×10.5 cm) 및 봉군숙성용 플라스틱상자 (22.0×28.0×14.0 cm)로 옮겨 사육하였다. 먹이는 0.2%의 Sorbic acid (Sigma-Aldrich, St. Louis, MO, USA)가 첨가된 40% 설탕물 (Yoon et al., 2005a)과 신선한 잡화분 (Yoon et al., 2005b)을 40% 설탕물과 혼합하여 화분단자로 만들어 충분히 공급하였다.
2. 뒤영벌의 교미
뒤영벌의 교미를 위해서 27℃와 32℃에서 사육하여 새로 출현한 여왕벌 (우화 5~6일)과 수벌 (우화 7~8일)을 1 : 2~3의 비율로 철망과 아크릴로 제작한 교미용 상자 (60×50×65 cm)에 넣어 교미를 시켰다 (Yoon et al., 2016). 이때 근친교배를 막기 위해 각각 다른 봉군에서 출현한 신여왕벌과 수벌을 사용하였다. 교미환경은 온도 23±1℃, 습도 65±5%, 14L : 10D, 1,000 lux 이상으로 일주일간 진행하였다 (Yoon et al., 2008). 월동 후 여왕벌의 생존율을 높이기 위하여 교미가 끝난 여왕벌을 1일간 15±1℃로 전처리 과정 후 여왕벌의 체중을 디지털저울 (HS 300B, 화성계기, 광명시, 대한민국)로 측정하였다.
3. 여왕벌의 인공 월동 방법
체중이 측정된 교미 여왕벌을 대상으로 인공 월동 실험은 월동용 병을 이용한 방법으로 하였다 (Yoon et al., 2010). 월동용 병 방법은 플라스틱 월동용 병 (Ø2.5×5.5 cm)에 수분을 함유한 펄라이트 (perlite)를 1/3 정도 채운 다음 여왕벌을 넣고 그 위에 다시 1/3 정도 펄라이트를 넣은 다음 구멍이 뚫린 뚜껑으로 닫았다. 그 다음 사각플라스틱 상자 (26.5×19.5×9 cm) 바닥에 펄라이트를 깔고 그 위에 여왕 벌이 든 월동용 병을 배치 후 그 위에 다시 펄라이트로 덮은 다음 구멍이 뚫린 뚜껑으로 닫았다. 월동 중 습도는 70% 이상 유지하였다. 월동은 저온 인큐베이터 (Twin Room Incubator DS-12UH, 다솔과학, 화성시, 대한민국)에서 12주간 저장하였다 (Yoon et al., 2010, 2014).
4. 월동 온도 및 기간에 따른 여왕벌의 체중 감소율 및 생존율
27℃와 32℃에서 사육 후 교미한 여왕벌을 각각 2.5℃에서 12주 동안 월동 (C2.5-12W)을 대조구로, 온도변화 및 월동 기간에 따른 차이를 알아보기 위하여 2.5℃에서 9주 월동 후 7.5℃로 3주 처리한 실험구 (2.5T7.5-3W), 2.5℃에서 8주 월동 후 7.5℃로 4주 처리한 실험구 (2.5T7.5-4W), 2.5℃에서 9주 월동 후 12.5℃로 3주 처리한 실험구 (2.5T 12.5-3W) 그리고 2.5℃에서 8주 월동 후 12.5℃로 온도 4주 처리한 실험구 (2.5T12.5-4W)로 설정하였다. 각 실험구의 여왕벌수는 10마리, 4~6 반복으로 월동시켰다. 총 12주 후 실험구별 여왕벌은 23℃에서 1시간 동안 관찰 후 생존한 여왕벌의 체중을 측정하여 체중 감소율을 조사하였다. 체중 감소율은 월동 전 여왕벌 체중-월동 후 체중×100으로 계산하였다. 생존율은 온도 23±1℃, 습도 65±5%, 14L : 10D 1,000 lux 이상의 환경 조건에서 투명아크릴과 철망으로 제작된 비행상자 (46×46×47 cm)에 체중 측정 후 여왕벌을 넣고 3일간 비행 후 살아남은 여왕벌로 조사하였다.
5. 월동 후 여왕벌의 수정낭 내 정자수 및 정자 생존율
월동 여왕벌의 수정낭 (Spermathecae)에 존재하는 정자수 및 정자 생존율 측정은 각 실험구별 월동 조건에서 월동 후 생존한 여왕벌을 이용하여 조사하였다. 실험구별로 5~6마리 여왕벌로부터 수정낭을 해부하여 여왕벌 한 마리 당 수정낭 내 정자를 수집하였다 (Kim et al., 2024b). 수집 된 정자는 1.5 mL의 튜브 (Eppendorf tube)에서 PBS 버퍼 20 μL에 혼합하였다. 이 혼합액 중 10 μL를 헤모사이토미터 (Hemocytometer)로 이동하여 400배 배율로 현미경 (Optinity 4K HD Camera KCX-80LA, Olympus Corporation, Tokyo, Japan) 하에서 헤모사이토미터를 이용하여 정자수를 조사하였다 (Woo et al., 2024). 여왕벌 수정낭 내 정자 생존율은 상기의 정자수 조사와 같은 방법으로 헤모사이토미터 위의 정자들을 1분간 동영상 촬영 후 움직임이 있는 정자수를 확인해 정자 생존율을 구하였다.
6. 월동 온도에 따른 뒤영벌의 봉세발달
각 실험구별로 월동 후 3일의 비행을 마친 여왕벌을 이용하여 봉세발달을 조사하였다. 실험구당 여왕벌은 6~8마리로 하였다. 사육환경은 32℃, 습도 65±5%, 암조건으로 하였다. 월동 온도별 여왕벌의 봉세발달은 첫산란소요일수, 산란율, 봉군형성소요일수, 봉군형성률, 신여왕출현봉군율, 성충 출현일 및 출현수 등을 조사하였다. 산란율은 사육 시작 7일 이내 폐사한 여왕벌을 제외하고 30일 이내 산란한 것으로 계산하였다. 봉군형성소요일수는 첫 산란일부터 일벌 50마리 이상이 출현한 기간으로, 봉군형성율은 일벌이 50마리 되는 봉군으로 계산하였다 (Yoon et al., 2005a). 신여왕출현봉군율은 여왕벌이 1마리 이상 출현한 봉군을 대상으로 하였다. 또한 일벌, 수벌, 여왕벌 등 성충의 체중은 일벌 50마리 이후 우화 1일차 성충을 대상으로 디지털 저울 (Mettler Ae 260, Delta Range®, Metter Toledo, Columbus, Ohio, USA)을 이용하여 각각 30마리씩 체중을 측정하였다.
7. 통계 분석
본 실험의 결과는 평균±표준편차로 나타내었다. 모든 통계분석은 SPSS PASW 22.0 통계 패키지 (IBM, Chicago, USA)를 이용하였다. 월동 기간 온도변화에 따른 여왕벌의 체중 감소율, 생존율, 수정낭 내 정자수, 월동 후 정자 생존율, 월동 후 여왕벌의 봉세발달 조사를 위한 산란율, 첫산란소요일수, 성충 출현일 및 성충 출현수, 봉군형성율, 신여왕출현봉군율, 봉군형성소요일수, 성충체중, 여왕벌 수명을 One-way ANOVA test (일원배치 분산분석)로 분석하였으며, 유의성이 확인된 항목에 대해 사후검정은 Tuckey’s HSD로 진행하였다.
결 과
1. 월동 중 온도 상승에 따른 서양뒤영벌 여왕벌의 체중 감소율 및 생존율
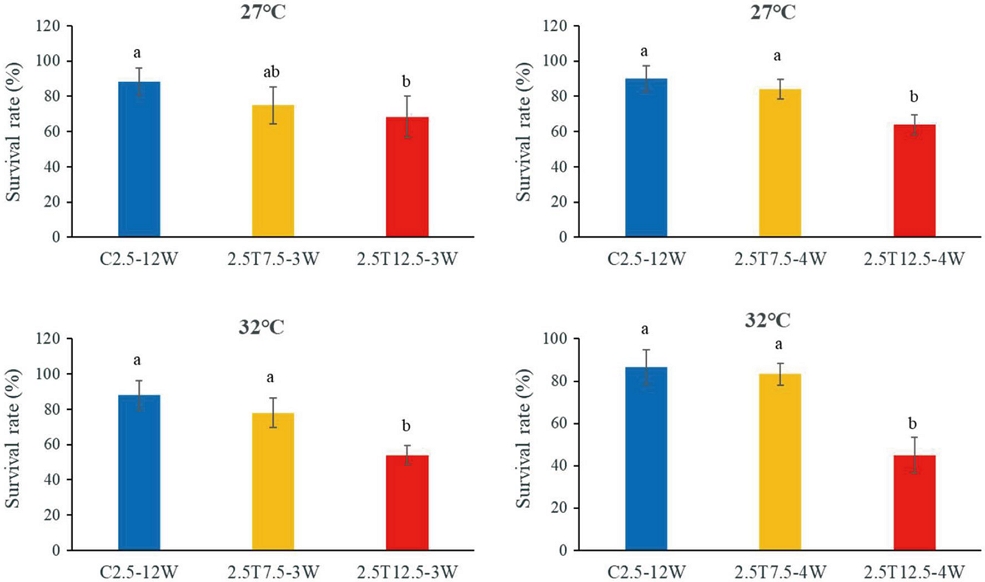
적온 (27℃) 및 고온 (32℃)에서 사육한 서양뒤영벌 여왕벌의 월동 중 온도 상승 및 기간에 따른 체중 감소율과 생존율을 조사하였다. 체중 감소율을 조사한 결과 (Fig. 1), 27℃ 및 32℃ 사육 후 월동한 여왕벌의 경우 2.5℃에서 12.5℃로 온도 상승, 4주 (4W) 처리기간에서 체중 감소율이 현저히 증가하였다. 27℃ 사육 후 월동한 여왕벌에서 C2.5에 비해 2.5T7.5나 2.5T12.5로 온도가 올라갈수록 (F2,108=28.62, p=0.0001) 그리고 처리기간이 길어질수록 (F2,121=64.42, p=0.0001) 체중 감소율이 증가하는 경향으로 통계적 유의성을 보였다. 32℃ 사육 여왕벌 역시 온도 상승 (F2,101=15.53, p=0.0001)과 처리기간의 연장 (F2,154=92.99, p=0.0001)에 따라 체중 감소율의 현저한 증가를 보였다. 이러한 결과는 27℃ 및 32℃ 사육 후 월동한 여왕벌 모두 2.5℃에서 12.5℃로 온도 상승, 4주 처리기간에서 체중 감소율이 유사한 경향으로 현저히 증가함을 나타내었다.
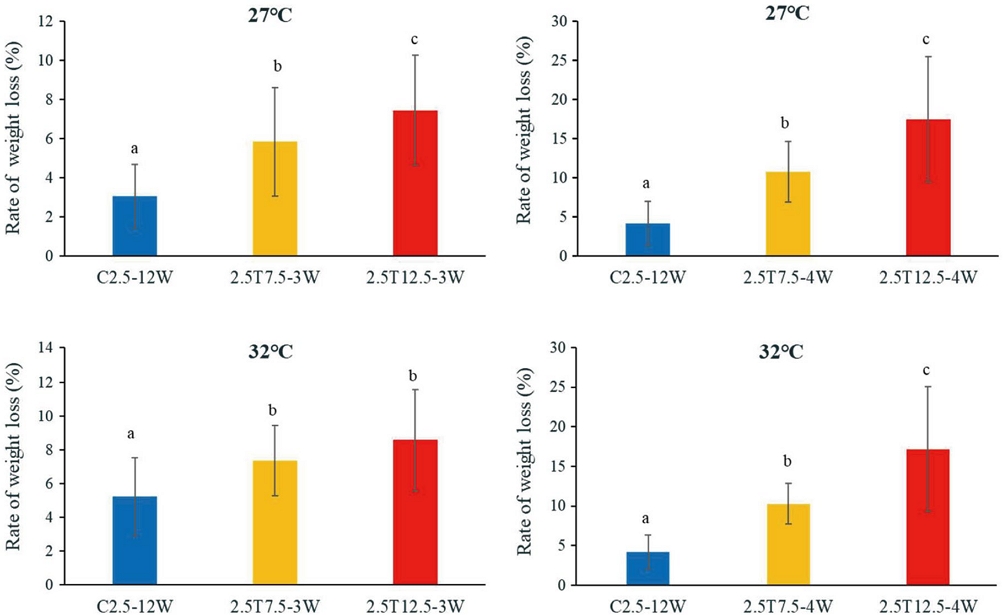
Weight loss rate of queens under different hibernation temperature conditions, measured one day after hibernation. Bombus terrestris queens were reared at either the optimal temperature (27℃) or a high temperature (32℃) prior to hibernation. The treatment subgroups were as follows: constant at 2.5℃ (C2.5) for 12 weeks (C2.5-12W); transposition from 2.5℃ to 7.5℃ after 9 weeks (3W) or 8 weeks (4W) during hibernation for a total of 12 weeks (2.5T7.5); transposition from 2.5℃ to 12.5℃ after 9 weeks (3W) or 8 weeks (4W) during hibernation for a total of 12 weeks (2.5T12.5). Different letters indicate significant differences among the treatments (p = 0.0001).
월동 후 여왕벌의 생존율을 조사한 결과 (Fig. 2), 27℃ 사육 후 월동 여왕벌의 생존율은 온도가 상승할수록 3주 (F2,15=6.22, p=0.011)와 4주 (F2,12=21.27, p=0.0001) 처리 시 모두 현저히 감소하였다. 32℃ 사육 후 월동 여왕벌 역시 온도가 올라갈수록 (F2,12=26.94, p=0.0001) 그리고 4주 처리에서 생존율이 감소하였다 (F2,15=59.08, p=0.0001). 여왕벌 생존율은 C2.5와 2.5T7.5에서는 큰 차이를 보이지 않았으나 2.5T12.5에서는 현저히 감소하였고, 특히 32℃ 여왕벌의 3주와 4주 처리의 2.5T12.5에서 생존율의 감소가 뚜렷하였다.
2. 월동 중 온도 상승에 따른 여왕벌의 수정낭 내 정자수 및 정자 생존율
월동 여왕벌의 생존율이 현저히 감소한 27℃와 32℃ 사육 후 월동 여왕벌의 온도 상승 4주 처리를 모델로 수정낭 내 정자수와 정자 생존율을 조사하였다 (Fig. 3). 27℃와 32℃ 사육 후 월동 여왕벌 모두 C2.5-12W, 2.5T7.5-4W 및 2.5T12.5-4W의 여왕벌 수정낭 내 정자수의 차이는 통계적 유의성은 보이지 않았다 (27℃, F2,96=0.10, p=0.906; 32℃, F2,92=0.22, p=0.807) (Fig. 3A). 또한 수정낭 내 정 자의 생존율 차이 (Fig. 3B) 역시 통계적으로 유의성이 없었다 (27℃, F2,43=2.71, p=0.078; 32℃, F2,43=0.56, p=0.577).
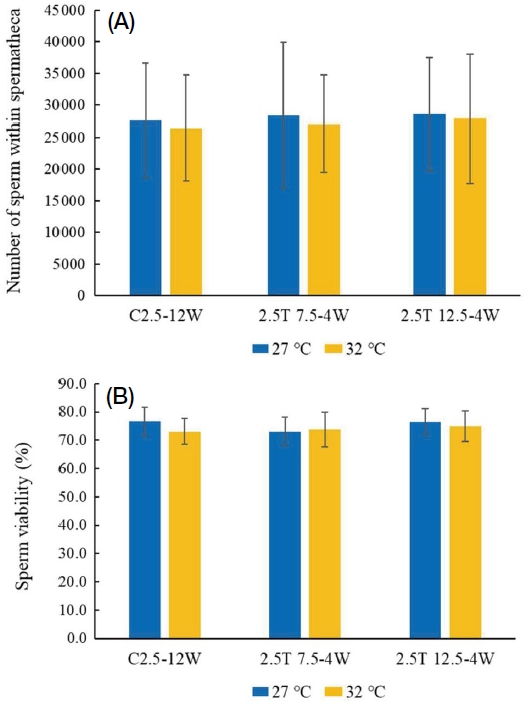
Sperm number (A) and viability (B) in the queens’ spermathecae after hibernation, measured three days after hibernation. The queens, temperature treatments, and durations are the same as in Fig. 1. For this experiment, the queens were from C2.5-12W, 2.5T7.5-4W, and 2.5T12.5-4W. No significant differences were observed among the treatments.
3. 월동 중 온도 상승에 따른 여왕벌의 봉세발달
월동 여왕벌의 생존율을 기초로 32℃ 사육 후 월동 중 온도 상승 3주 처리한 여왕벌을 모델로 사육온도 32℃에서 계속 사육하면서 봉세발달을 조사하였다 (Fig. S1). C2.5, 2.5T7.5 및 2.5T12.5 처리구에서 여왕벌의 첫산란소요일수 (F2,31=0.44, p=0.646; Fig. S1A)와 산란율 (F2,3=0.38, p=0.715; Fig. S1B)의 통계적 유의미한 차이는 보이지 않았다. 봉군형성기간 역시 처리구들 간에 유의미한 차이가 없었다 (F2,14=2.28, p=0.139; Fig. S1C). 일벌이 50마리 이상 출현한 봉군을 대상으로 봉군형성률 (Fig. S1D)은 C2.5에 비해 2.5T7.5 및 2.5T12.5로 온도가 상승 할수록 봉군형성률이 떨어지는 경향을 보였으나 통계적 유의성은 보이지 않았다 (F2,3=7.18, p=0.072). 신여왕벌이 1마리 이상 출현한 신여왕출현봉군율 (Fig. S1E) 역시 C2.5에 비해 2.5T7.5 및 2.5T12.5에서 감소하였으나 통계적 유의성은 없었다 (F2,3=1.86, p=0.298).
서양뒤영벌의 성충 출현일수를 조사한 결과 (Fig. S1F), 일벌은 약 23~27일 (F2,24=0.82, p=0.453), 수벌은 약 66~70일 (F2,18=0.44, p=0.654), 신여왕벌은 약 71~83일 (F2,24=1.86, p=0.298)로 C2.5, 2.5T7.5 및 2.5T12.5 처리구 간에 통계적 유의성은 보이지 않았다. 일벌이 50마리 이상 출현한 봉군으로 성충출현수를 조사한 결과 (Fig. S1G), 처리구에서 일벌 (F2,19=0.03, p=0.972) 및 수벌 (F2,19=0.13, p=0.881) 역시 온도 상승에 따른 출현수 차이에 유의성은 보이지 않았다. 또한, 신여왕벌 출현수는 C2.5와 2.5T7.5에 비해 2.5T12.5 처리구에서 다소 차이를 보이나 통계적 유의성은 없었다 (F2,22=1.18, p=0.327). 여왕벌의 수명 (Fig. S1H)은 C2.5에서 약 114일, 2.5T7.5는 약 110일, 2.5T12.5는 약 104일로 통계적 유의성은 없었으나 (F2,23=0.80, p=0.463) 월동 기간 중 온도가 상승할수록 수명이 감소하는 경향을 보였다.
출현 성충의 체중을 우화 1일째 측정하여 비교한 결 과 (Fig. S1I), 일벌은 0.26~0.27 g (F2,590,=3.58, p=0.028), 수벌은 0.34~0.36g (F2,750=8.86, p=0.0001), 여왕벌은 0.86~0.87g (F2,737=1.89, p=0.152)로 처리구 간에 큰 차이를 보이지 않았다.
고 찰
기후변화에 의한 극단적인 기상현상과 온도 상승은 전 세계적인 환경문제 (Meehl and Tebaldi, 2004; Hallmann et al., 2017; Mavrakis et al., 2021; Kaiser et al., 2023)로 화분매개곤충 뒤영벌의 개체수 및 종 다양성의 감소의 주요 요인으로 작용하고 있다 (Cornelissen, 2011; Kerr et al., 2015; Vasiliev and Greenwood, 2021). 뒤영벌의 월동 조건이 여왕벌의 생존과 봉군 발육 능력에 미치는 영향을 조사한 연구에서 최적의 인공 월동 온도는 2.5℃로 보고되었다 (Yoon et al., 2010). 따라서 본 연구에서는 뒤영벌의 월동 중 온도 상승과 기간에 의한 영향을 알아보기 위해 월동 전 사육온도 (적온 27℃ 또는 고온 32℃) 및 월동 조건 (2.5℃에서 12주 처리, 2.5℃에서 8주 또는 9주 후 7.5℃ 또는 12.5℃로 온도 상승)에서 뒤영벌 여왕벌의 생존율 조사에 초점을 맞추었다.
본 연구에서 서양뒤영벌 (B. terrestris)의 사육온도 (27℃, 32℃)에 따른 월동 후 체중 감소율은 크게 차이가 없었다. 하지만 C2.5, 2.5T7.5 및 2.5T12.5의 월동 온도 상승 조건에서 온도가 높아지고 기간이 길어 질수록 체중 감소율이 현저히 증가하였다. 이는 본 연구에서 월동에서 깨울 때 2.5T12.5>2.5T7.5>C2.5 순으로 여왕벌의 움직임을 확인한 결과와 일치하였다. 뒤영벌은 월동 중 대사활동에 필요한 에너지는 비축된 지방을 통해 주로 확보하며, 월동 중인 여왕벌은 많은 지방을 필요로 하고 월동 기간 동안 비축한 지방을 이용한다 (Holm, 1972; Enriquez and Visser, 2023). 따라서 온도가 상승함에 따라 월동에서 일찍 깨어나 대사량이 높아짐으로써 저장한 지방을 많이 소모하여 체중이 감소하였을 것으로 여겨진다.
월동 후 여왕벌의 생존율은 월동 중 온도가 높아지고 처리기간이 길어질수록 감소하는 경향을 나타내었다. 27℃에서 사육된 여왕벌에 비해 32℃에서 사육된 여왕벌의 생존율이 2.5T12.5-3W에서 약 14%, 2.5T12.5-4W에서는 약 19% 저하되었다. 월동 중 온도 상승에 따른 여왕벌의 생존율 저하는 27℃에서 사육한 여왕벌보다 32℃에서 사육한 여왕벌에서 더 민감하게 나타났는데, 이는 고온 (32℃) 조건에서의 사육에 따른 열 스트레스 반응 (Gérard et al., 2022a; Sepúlveda et al., 2024)과 충체 크기 (Radmacher and Strohm, 2011; Kim et al., 2024a) 등에 의한 영향에 기인되었을 것으로 추정된다. 체중은 월동 생존에 중요한 영향을 미치는 요인으로 월동과 체중의 관계를 조사한 결과 생존한 여왕벌이 폐사한 여왕벌보다 더 무거운 경향을 보였고 동면에 들어가기 전 여왕벌의 체중이 0.6 g 이하인 여왕벌은 생존할 수 없었다 (Horber, 1961; Beekman et al., 1998). 따라서 2.5T12.5에서 여왕벌은 많은 지방을 소모하여 C2.5나 2.5T7.5에 비해 생존에 불리한 영향을 받아 생존율이 떨어졌을 것으로 판단된다. 본 연구에서 월동 중 온도 상승에 따른 체중 감소율 증가는 생존율 저하로 이어진다는 것을 보인다.
한편 월동 중 온도 상승으로 여왕벌의 체중 감소율 증가와 생존율 저하에 있어서 영향을 가장 많이 받았을 것으로 보이는 4주 처리에서의 생존 여왕벌을 모델로 수정낭 내 정자수와 정자 생존율을 조사한 결과, 27℃나 32℃에서 사육되어 C2.5, 2.5T7.5 및 2.5T12.5에서 월동한 여왕벌에서 큰 차이를 보이지 않았다. 이는 생존 여왕벌의 경우 수정낭 내 정자수나 정자 생존율에 영향이 없음을 보여준다. 정자수 역시 서양뒤영벌의 성숙봉군에서 300~1,000마리 정도의 전체 성충 우화수 (Heinrich, 1979; Duchateau, 1991; Ono and Wada, 1996)를 고려할 때, 수정낭 내 정자 생존율은 다음 세대의 봉군발달에 영향이 없을 것으로 판단된다.
아울러 월동 중 온도 상승으로 여왕벌의 체중 감소율 및 생존율, 수정낭 내 정자 생존율 등을 근거로 32℃에서 사육되어 C2.5, 2.5T7.5 및 2.5T12.5에서 3주 처리의 월동 조건에서 생존한 여왕벌을 모델로 32℃에서 계속 사육하여 다음 세대의 봉세발달을 조사하였다. 본 연구에서 조사한 여왕벌의 첫산란소요일수, 산란율, 봉군형성 기간, 봉군형성률, 신여왕출현봉군율, 성충 출현일수, 성충출현수, 출현 성충의 체중 및 여왕벌의 수명에 있어서 처리구 간에 현저한 차이를 보이지 않았다. 이러한 결과들은 월동 중 온도 상승은 여왕벌의 생존에 크게 영향을 미치지만 생존한 여왕벌의 봉세발달에는 대체적으로 영향이 없음을 나타낸다.
결론적으로 본 연구는 서양뒤영벌 여왕벌이 월동 중인 겨울철 온도가 상승할수록 기간이 길어질수록 여왕벌의 체중 감소율은 증가하고 이는 생존율의 저하로 이어진다는 것을 보였다. 이러한 월동 중 여왕벌의 생존율 감소는 다음 세대의 개체수 감소에 영향을 미칠 수 있음을 시사한다. 한편, 생존한 여왕벌의 수정낭 내 정자 생존율 및 차세대 봉세발달에 있어서는 큰 차이를 보이지 않아 뒤영벌의 가소 및 적응 반응 (Maebe et al., 2021)으로 여겨진다. 따라서 본 연구 결과는 기후 변화 영향으로 인한 월동 기간 온도 상승이 야생 뒤영벌 개체군 감소에 영향을 끼칠 수 있다는 것을 제시하여 야생 뒤영벌 개체군 보존전략을 수립할 필요성이 제기된다.
적 요
기후변화는 뒤영벌의 개체수와 다양성 감소에 영향을 미치고 있다. 본 연구에서는 서양뒤영벌 (Bombus terrestris)의 월동 중 온도 상승 및 기간에 따른 여왕벌의 생존율과 생존 여왕벌의 수정낭 내 정자 생존율 및 봉세 발육 특성을 조사하였다. 발육 적온 (27℃) 및 고온 (32℃) 조건에서 우화한 서양뒤영벌 여왕벌을 교미 후 2.5℃에서 12주 월동, 2.5℃에서 월동 8주 또는 9주 후 온도를 7.5℃와 12.5℃로 상승하여 4주 또는 3주 처리하였다. 온도 상승 및 기간에 따라 월동 후 여왕벌의 체중 감소율은 증가하였고, 생존율은 12.5℃로 상승하여 3주 또는 4주 처리하였을 때 현저하게 감소하였다. 그러나 생존한 여왕벌의 수정낭에서 정자 생존율은 차이를 보이지 않았다. 또한 월동 후 생존 여왕벌의 산란율, 봉군형성율, 신여왕벌출현율, 성충 출현수 및 성충의 체중 조사 결과, 봉세발달에 있어서 현저한 차이를 보이지 않았다. 이러한 결과들은 월동 중 온도 상승은 여왕벌의 생존율에 영향을 미치고, 이는 개체수 감소로 이어질 수 있음을 시사한다.
Acknowledgments
본 연구는 농촌진흥청 연구과제 (RS-2023-00232335)의 지원으로 수행되었다.
References
-
Bale, J. S., G. J. Masters, I. D. Hodkinson, C. Awmack, T. M. Bezemer, V. K. Brown, J. Butterfield, A. Buse, J. C. Coulson, J. Farrar, J. E. G. Good, R. Harrington, S. Hartley, T. H. Jones, R. L. Lindroth, M. C. Press, I. Symrnioudis, A. D. Watt and J. B. Whittaker. 2002. Herbivory in global climate change research: Direct effects of rising temperature on insect herbivores. Glob. Chan. Biol. 8: 1-16.
[https://doi.org/10.1046/j.1365-2486.2002.00451.x]

-
Beekman, M., P. van Stratum and R. Lingeman. 1998. Diapause survival and post-diapause performance in bumblebee queens (Bombus terrestris). Entomol. Experi. Appli. 89: 207-214.
[https://doi.org/10.1046/j.1570-7458.1998.00401.x]

-
Bosch, J., W. P. Kemp and S. S. Peterson. 2000. Management of Osimia lignaria (Hymenoptera: Megachilidae) populations for almond pollination: Methods to advance bee emergence. Environ. Entomol. 29(5): 874-883.
[https://doi.org/10.1603/0046-225X-29.5.874]

-
Campion, C., A. Rajamohan and M. E. Dillon. 2023. Sperm can’t take the heat: Short-term temperature exposures compromise fertility of male bumble bees (Bombus impatiens). J. Insect Physiol. 146: 104491.
[https://doi.org/10.1016/j.jinsphys.2023.104491]

-
Cornelissen, T. 2011. Climate change and its effects on terrestrial insects and herbivory patterns. Neotrop. Entomol. 40(2): 155-163.
[https://doi.org/10.1590/S1519-566X2011000200001]

-
Couvillon, M. J., G. Fitzpatrick and A. Dornhaus. 2010. Ambient air temperature does not predict whether small or large workers foragers in bumble bees (Bombus impatiens). Psyche 2010: 536430
[https://doi.org/10.1155/2010/536430]

-
Deutsch, C. A., J. J. Tewksbury, R. B. Huey, K. S. Sheldon, C. K. Ghalambor, D. C. Haak and P. R. Martin. 2008. Impacts of climate warming on terrestrial ectotherms across latitude. Proc. Natl. Acad. Sci. USA. 105(18): 6668-6672.
[https://doi.org/10.1073/pnas.0709472105]

-
Duchateau, M. J. 1991. Regulation of colony development in bumblebees, Bombus terrestris. J. Ethol. 7: 141-151.
[https://doi.org/10.17660/ActaHortic.1991.288.17]

-
Duchateau, M. J. and H. H. W. Velthuis. 1988. Development and reproductive strategies in Bombus terrestris colonies. Behaviour 107(8): 186-207.
[https://doi.org/10.1163/156853988X00340]

-
Enriquez, T. and B. Visser. 2023.The importance of fat accumulation and reserves for insect overwintering. Curr. Opin. Insect Sci. 60: 101118.
[https://doi.org/10.1016/j.cois.2023.101118]

-
Gérard, M., A. Amiri, B. Cariou and E. Baird. 2022a. Short-term exposure to heatwave-like temperatures affects learning and memory in bumblebees. Glob. Chang. Biol. 28(14): 4251-4259.
[https://doi.org/10.1111/gcb.16196]

-
Gérard, M., B. Cariou, M. Henrion, C. Descamps and E. Baird. 2022b. Exposure to elevated temperature during development affects bumblebee foraging behavior. Behav. Ecol. 33(4): 816-824.
[https://doi.org/10.1093/beheco/arac045]

-
Hallmann, C. A., M. Sorg, E. Jongejans, H. Siepel, N. Hofland, H. Schwan, W. Stenmans, A. Müller, H. Sumser, T. Hörren, D. Goulson and H. de Kroon. 2017. More than 75 percent decline over 27 years in total flying insect biomass in protected areas. PLoS One 12(10): e0185809.
[https://doi.org/10.1371/journal.pone.0185809]

- Heinrich, B. 1979. Bumblebee economics. Harvard University Press. Cambridge, Massa. pp. 245.
-
Holm, S. N. 1972. Weight and life length of hibernating bumble bee queens (Hymenoptera: Bombidae) under controlled conditions. Ent. Scand. 3(4): 313-320.
[https://doi.org/10.1163/187631272X00184]

- Horber, E. 1961. Beitrag zur Domestifikationsversuche mit Hummeln (Bombus Latr). Albredht Thaer-Arch 5: 282-304.
-
Kaiser, D., Y. G. Voynova and H. Brix. 2023. Effects of the 2018 European heatwave and drought on coastal biogeochemistry in the German Bight. Sci. Total Environ. 892: 164316.
[https://doi.org/10.1016/j.scitotenv.2023.164316]

-
Kerr, J. T., A. Pindar, P. Galpern, L. Packer, S. G. Potts, S. M. Roberts, P. Rasmont, O. Schweiger, S. R. Colla, L. L. Richardson, D. L. Wagner, L. F. Gall, D. S. Sikes and A. Pantoja. 2015. Climate change impacts on bumblebees coverage across continents. Science 349(6244): 177-180.
[https://doi.org/10.1126/science.aaa7031]

-
Kim, H. S., J. M. Kim, W. Qiu, H. J. Yoon, K. Y. Lee, K. S. Lee and B. R. Jin. 2024a. Negative relationships between elevated developmental temperatures and morphological traits of different castes of bumblebees (Bombus terrestris). J. Asia-Pac. Entomol. 27(4): 102326.
[https://doi.org/10.1016/j.aspen.2024.102326]

-
Kim, Y. H., B. Y. Kim, H. J. Yoon, Y. S. Choi, K. S. Lee and B. R. Jin. 2024b. Amwaprin is a sperm-binding protein that inhibits sperm motility and enhances sperm viability in honeybees. Entomol. Gen. 44(6): 1503-1511.
[https://doi.org/10.1127/entomologia/2024/2633]

-
Kingsolver, J. G., S. E. Diamond and L. B. Buckley. 2013. Heat stress and the fitness consequences of climate change for terrestrial ectotherms. Funct. Ecol. 27(6): 1415-1423.
[https://doi.org/10.1111/1365-2435.12145]

-
Klein, A. M., B. E. Vaissière, J. H. Cane, I. Steffan-Dewenter, S. A. Cunningham, C. Kremen and T. Tscharntke. 2007. Importance of pollinators in changing landscapes for world crops. Proc. R. Soc. B 274(1608): 303-313.
[https://doi.org/10.1098/rspb.2006.3721]

-
Kuo, Y., Y. H. Lu, Y. H. Lin, Y. C. Lin and Y. L. Wu. 2023. Elevated temperature affects energy metabolism and behavior of bumblebees. Insect Biochem. Mol. Biol. 155: 103932.
[https://doi.org/10.1016/j.ibmb.2023.103932]

-
Kwon, Y. J. and S. Saeed. 2003. Effect of temperature on the foraging activity of Bombus terrestris L. (Hymenoptera: Apidae) on greenhouse hot pepper (Capsicum annuum L.). Appl. Entomol. Zool. 38(3): 275-280.
[https://doi.org/10.1303/aez.2003.275]

-
Lee, K. Y. and H. J. Yoon. 2017. The pollination properties and pollination efficiency of bumblebee (Bombus terrestris L.) relation to colony ventilation under high temperature condition in a greenhouse. Kor. J. Appl. Entomol. 32(3): 205-221.
[https://doi.org/10.17519/apiculture.2017.09.32.3.205]

-
Maebe, K., A. F. Hart, L. Marshall, P. Vandamme, N. J. Vereecken, D. Michez and G. Smagghe. 2021. Bumblebee resilience to climate change, through plastic and adaptive responses. Glob. Change Biol. 27: 4223-4237.
[https://doi.org/10.1111/gcb.15751]

-
Martinet, B., E. Zambra, K. Przybyla, T. Lecocq, A. Anselmo, D. Nonclercq, P. Rasmont, D. Michez and E. Hennebert. 2021. Mating under climate change: Impact of simulated heatwaves on the reproduction of model pollinators. Funct. Ecol. 35(3): 739-752.
[https://doi.org/10.1111/1365-2435.13738]

-
Martínez, F. D., F. J. S. García, M. S. Hernández and F. C. Ferre. 2014. Evaluation of a novel bumble bee pollination station under summer greenhouse conditions. J. Apic. Res. 53(3): 408-412.
[https://doi.org/10.3896/IBRA.1.53.3.09]

-
Mavrakis, A., A. Kapsali, I. X. Tsiros and K. Pantavou. 2021. Air quality and meteorological patterns of an early spring heatwave event in an industrialized area of Attica, Greece. Euro-Mediterr. J. Environ Integr. 6: 25.
[https://doi.org/10.1007/s41207-020-00237-0]

-
Meehl, G. A. and C. Tebaldi. 2004. More intense, more frequent, and longer lasting heat waves in the 21st century. Science 305: 994-997.
[https://doi.org/10.1126/science.1098704]

- Ono, M. and T. Wada. 1996. The word of bumblebees-Biological foundation and application. Corporation. Plant Prevent Association. 132p.
-
Parmesan, C. 2006. Ecological and evolutionary responses to recent climate change. Annu. Rev. Ecol. Evol. Syst. 37: 637-669.
[https://doi.org/10.1146/annurev.ecolsys.37.091305.110100]

-
Parmesan, C., N. Ryrholm, C. Stefanescu, J. K. Hill, C. D. Thomas, H. Descimon, B. Huntley, L. Kaila, J. Kullberg, T. Tammaru, W. J. Tennent, J. A. Thomas, W. J. Tennent, J. A. Thomas and M. Warren. 1999. Poleward shifts in geographical ranges of butterfly species associated with regional warming. Nature 399: 579-583.
[https://doi.org/10.1038/21181]

-
Radmacher, S. and E. Strohm. 2011. Effects of constant and fluctuating temperatures on the development of the solitary bee Osmia bicornis (Hymenoptera: Megachilidae). Apicologie 42(6): 711-720.
[https://doi.org/10.1007/s13592-011-0078-9]

- Roman, A. and N. Szczesna. 2008. Assessment of the flying activity of the buff-tailed bumblebee (Bombus terrestris L.) on greenhouse-grown tomatoes. J. Apic. Sci. 52(1): 93-101.
-
Sales, K., R. Vasudeva and M. J. G. Gage. 2021. Fertility and mortality impacts of thermal stress from experimental heatwaves on different life stages and their recovery in a model insect. R. Soc. Open Sci. 8(3): 201717.
[https://doi.org/10.1098/rsos.201717]

-
Sales, K., R. Vasudeva, M. E. Dickinson, J. L. Godwin, A. J. Lumley, Ł. Michalczyk, L. Hebberecht, P. Thomas, A. Franco and M. J. G. Gage. 2018. Experimental heatwaves compromise sperm function and cause transgenerational damage in a model insect. Nat. Commun. 9: 4771.
[https://doi.org/10.1038/s41467-018-07273-z]

-
Sepúlveda, Y., E. Nicholls, W. Schuett and D. Goulson. 2024. Heatwave-like events affect drone production and broodcare behaviour in bumblebees. PeerJ 12: e17135.
[https://doi.org/10.7717/peerj.17135]

-
Vasiliev, D. and S. Greenwood. 2021. The role of climate change in pollinator decline across the Northern Hemisphere is underestimated. Sci. Total Environ. 775: 145788.
[https://doi.org/10.1016/j.scitotenv.2021.145788]

-
Velthuis, H. H. W. and A. van Doorn. 2006. A century of advances in bumblebee domestication and the economic and environmental aspects of its commercialization for pollination. Apidologie 37(4): 421-451.
[https://doi.org/10.1051/apido:2006019]

-
White, S. A. and M. E. Dillon. 2023. Climate warming and bumble bee declines: The need to consider sub-lethal heat, carry-over effects, and colony compensation. Front. Physiol. 14: 1251235.
[https://doi.org/10.3389/fphys.2023.1251235]

-
Wigglesworth, V. B. 1974. Insect Physiology. 7th Edn., Chapman and Hall, London. pp. 166.
[https://doi.org/10.1007/978-1-4899-3202-0]

-
Woo, J. H., M. S. Park, H. J. Yoon, K. S. Lee and B. R. Jin. 2024. Oviposition behavior of bumblebee (Bombus terrestris) workers in queenless colonies and the reproductive traits of worker-produced males. Kor. J. Appl. Entomol. 39(3): 163-173.
[https://doi.org/10.17519/apiculture.2024.09.39.3.163]

- Wysocka-Owczarek, M. 2006. Ocena efektywnooeci trzmieli. Owoce Warzywa Kwiaty. 9: 8-10.
- Yoon, H. J., K.Y. Lee, J. S. Hwang and I. G. Park. 2010. Chilling temperature and humidity to break diapause of the bumblebee queen Bombus terrestris. Int. J. Indust. Entomol. 20(2): 93-98.
-
Yoon, H. J., K. Y. Lee, M. J. Shin and S. Y. Kim. 2016. Sexual maturity and mating ability of the bumblebees, Bombus terrestris. Kor. J. Apic. 31(4): 305-313.
[https://doi.org/10.17519/apiculture.2016.11.31.4.305]

-
Yoon, H. J., K. Y. Lee, Y. B. Lee and N. J. Kim. 2014. Conditions for the keeping the Bombus ignitus queen bumblebees under low-temperature. J. Apic. 29(4): 359-366.
[https://doi.org/10.17519/apiculture.2014.11.29.4.359]

- Yoon, H. J., S. E. Kim, K. Y. Lee, S. B. Lee and I. G. Park. 2005b. Oviposition and colony development of the bumblebees, Bombus ignitus and B. terrestris depending on different pollen. Int. J. Indust. Entomol. 11(2): 99-105.
- Yoon, H. J., S. E. Kim, K. Y. Lee, S. B. Lee, I. G. Park and K. Choi. 2008. Temperature, photoperiod and illumination for mating of the European bumblebee, Bombus terrestris. Int. J. Indust. Entomol. 16(2): 101-107.
- Yoon, H. J., S. E. Kim, S. B. Lee and K. Y. Seol. 2005a. The effect of antiseptic and sugar solution on colony development of the bumblebees, Bombus ignitus and B. terrestris. Int. J. Indust. Entomol. 11(1): 43-48.
- Yoon, H. J., S. E. Kim, Y. S. Kim and S. B. Lee. 2004. Colony developmental characteristics of the bumblebee of the bumblebee queen, Bombus ignitus by the first oviposition day. Int. J. Indust. Entomol. 8(2): 139-143.
Appendix
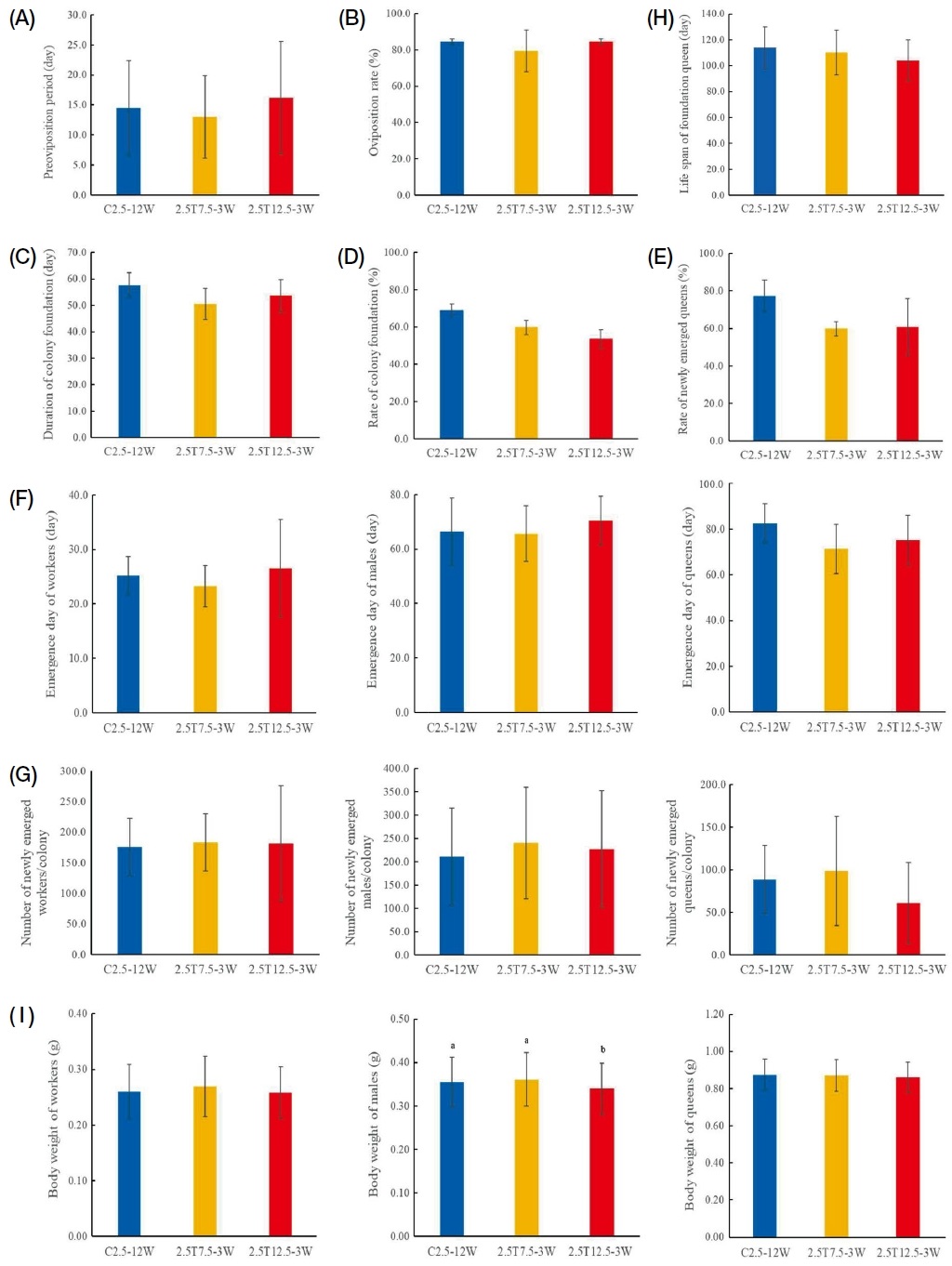
Colony development of queens after hibernation. The queens, temperature treatments, and durations are the same as in Fig. 1. For this experiment, the queens were reared at a high temperature (32°C) prior to hibernation and were from C2.5-12W, 2.5T7.5-3W, and 2.5T12.5-4W. (A) Preoviposition period, (B) Oviposition rate, (C) Duration of colony formation, (D) Colony formation rate, (E) Colony rate with newly emerged queens, (F) Emergence day of workers, males, and queens, (G) Number of newly emerged workers, males and queens per colony, (H) Lifespan of queens, and (I) Body weight of worker, male, and queen. In (I), different letters indicate significant differences among the treatments.