동결건조를 이용한 다래화분의 영양성분 추출 효과
Abstract
There are about 20 thousand beekeepers caring for approximately 1.8 million colonies in Korea. Honey production totaled almost 27 thousands M/T in 2012. Pollens have been known to possess various biological properties. Therefore, pollens have been extensively used in functional food, folk medicine, and beverage industry to improve human health. However stiff pollen wall hinder dissolution of polysaccharides and lower extraction efficiency. So in this study, we established a new method for cytoplasm extraction from pollen using a lyophilization method, and confirmed the husk removal effect. Contents of crude protein, fat and carbohydrate were increased after lyophilizing darae pollen. Retention ratio of aspartic acid, histidine, threonine, alanine, arginine, tyrosine, valine, isoleucine, and leucine in the lyophilized pollen showed over 100% and the average retention ratio of total amino acid was 97.5%. Retention ratio of stearic acid and linolenic acid in the lyophilized darae pollen showed 100% and the average retention ratio of total fatty acid was 105.9% comparing to raw material. The antioxidant activity of the lyophilized darae pollen was increased to 150% compared to raw pollen in the DPPH free radical scavenging. The contents of total polyphenol and flavonoid were respectively increased to 137% and 234% compared to raw material when raw pollen was lyophilized. The lyophilized darae pollen showed inhibitory activity higher than that of raw pollen against mushroom tyrosinase.
Keywords:
Darae pollen, Lyophilization, Antioxidant activity, Flavonoid, Polyphenol서 론
벌은 식물의 꽃에서 꿀과 화분(꽃가루)을 모아 온다(Ryu, 2003). 화분은 꿀벌의 유충과 성충의 단백질원으로 탄수화물, 지방, 비타민, 무기질 등의 영양성분이 풍부하며, 또한 로열젤리(royal jelly)의 원료이다. 꿀벌화분(bee pollen)은 일벌이 어린 벌에게 먹이기 위해서 다리에 묻혀오는 화분에 꿀과 효소가 혼합되어 경단처럼 뭉쳐진 덩어리로 일반 화분보다 영양성분이 풍부하여 오래전부터 자연 건강식품으로 이용되어 왔다(Todd and Bretherick, 1942; 정 등, 1984; 김 등, 1984). 화분은 혈관 및 순환계, 소화계, 신진대사계, 노화 등 다양한 질환에 효과가 있다고 알려져 있으며(Li et al., 2009) , 최근에는 항균 및 항산화 효능, 면역증강 효과, 전립선 비대증 및 전립선염 치료 효과 등이 보고되었다(최 등, 2007; Fang et al., 2008; Abouda et al., 2011). 화분은 이용가치가 매우 높은 자연식품이지만 sporopollenin으로 된 외피(exine)와 cellulose와 pectin으로 구성된 내피(intine)는 화학적으로 견고하여 강산 처리에도 구조가 파괴되지 않으며(Kress et al., 1978; 이, 1986), 또한 대부분의 동물, 곤충들도 분해하지 못하여 영양성분의 일부만 흡수한다(Roulston and Cane, 2000; Blackmore et al., 2010). 따라서 화분의 세포질 영양성분을 추출하기 위한 연구가 활발히 진행되고 있다. 단백질 분해효소를 이용한 세포벽 용해(이 등, 1997; 최와 정, 2004), 삼투압 또는 발아를 이용한 영양성분 추출(Stanley and Linskens, 1965; 최 등, 2007; Fang et al., 2008), 벌 내장 효소를 이용한 세포질 추출(김, 1989), 화분 외피를 물리적 방법으로 파쇄하여 세포질을 추출하는 방법 등이 보고되었다(김과 손, 1990; 한 등, 2004; Xu et al., 2009). 본 연구에서는 화분의 영양성분 추출방법을 정립하기 위하여 국내에서 생산량이 많은 다래화분을 동결건조하여 일반성분, 아미노산, 지방산, 항산화 활성, 미백효과 등을 조사하여 영양성분의 추출 효과를 분석하였다.
재료 및 방법
시험재료
강원도 화천에서 수집한 다래화분을 한국양봉농협(Ansung, Korea)에서 구입하여 -20°C에서 냉동보관하면서 사용하였다.
동결건조
급속냉동기(Deep Freezer, DF 9010, Ilshin Lab Co. Ltd, Korea)를 이용하여 80°C에서 급속냉동한 후, 동결건조기(Freeze dryer, FD5508, Ilshin Lab Co. Ltd, Korea)에서 -45°C로 건조하였다.
일반성분 분석
화분시료의 일반성분은 AOAC(1980)법에 의하여 정량하였고, 수분함량은 105°C 상압가열건조법, 회분은 550°C에서 직접 회화법으로, 조지방 함량은 soxhlet 추출법으로 측정하였다. 조단백질은 semimicro Kjeldahl 법으로 측정하였으며, 질소 환산계수는 6.25를 사용하였다. 탄수화물의 함량은 100에서 수분, 회분, 조지방, 조단백질 함량을 뺀 값으로 나타내었다.
아미노산 분석
아미노산 조성 분석은 Pico Tag System (Waters, USA)를 사용하였다. 먼저 40mg의 시료를 채취하여 vial에 담고 6 N HCl 15ml를 가하여, vial의 산소 등을 질소로 치환한 후 105°C 오븐에서 20시간동안 가수분해하였다. 가수분해 된 용액으로부터 50μl를 취하여 Pico Tag의 표준방법에 의하여 PTC-amino acid 유도체를 제조하여 분석용 시료로 사용하였다. 분석에 사용한 이동상 용액은 A 용액은 sodium acetate trihydrate 19.5g, triethylamine 550μl, 1l milli Q water를 혼합한 후 인산을 사용하여 pH 6.4로 고정하여 제조한 용액 935ml와 CH3CN 65ml를 혼합하여 제조하였다. B 용액은 60%의 CH3CN을 그대로 사용하였다.
지방산 분석
화분에 hexane을 넣고 liquid funnel shaker(EYELA, MMV-1000W)로 250rpm에서 15분간 총 3회 추출하였다. 용매 분획된 hexane에 내부표준물질 PDA (pentadecanoic acid in MeOH, 1,000 ppm) 1ml를 첨가하고 감압농축기와 N2 gas로 완전 농축시킨 후 0.5 N NaOH solution(in MeOH) 8ml를 넣고 초음파처리 후 toluene 5ml을 넣고 80°C에서 10분간 가수분해시켰다. 방냉후, 14% BF3(boron trifluoride) 8ml를 넣고 80°C에서 10분간 재 메틸화반응을 시키고 다시 방냉시켰다. 이에 증류수 10ml와 petroleum ether 15ml를 더하여 2,000rpm, 4°C에서 10분간 원심분리한 후, petroleum ether층을 여과하고N2 gas로 건조시킨 후 hexane 0.5ml로 회수하여 GC-FID(gas chromatography-flame ionization detector)로 분석을 하였다(Metcalfe et al., 1966; 김 등, 2007). 정량 시 사용한 기기는 GC CP-3800(Varian, Palo Alto, USA)이었고, 컬럼은 J&W DBWAX capillary column(60cm×0.25×0.25μm, Hewlett Packard, USA)을 사용하였다(Petrovic et al., 2010). 시료 주입기와 검출기 온도는 230°C, 컬럼 온도는 80°C로 시작하여 240°C까지 올려주었다. 운반기체(carrier gas)는 He을 사용하였고, 컬럼 유속은 1.5ml/min 이었다. 지방산의 정량은 내부표준물질 pentadecanoic acid(C15:0)의 면적에 기준하여 반응지수(response factor)를 보정하지 않고 환산하였다.
항산화 활성
DPPH 라디칼 소거능의 전자 공여능(electron donating ability, EDA) 측정은 Liangli 등의 방법에 준하여 DPPH(2,2-diphenyl-1-picrylhydrazyl)에 대한 수소공여 효과로 측정하였다(Liangli et al., 2002). 96 well plate에 화분 발아액 10μl와 0.2mM DPPH 190μl를 균일하게 혼합하여 37°C에서 30분간 방치한 후 517nm에서 흡광도를 측정하였다(3-29). 각 시료에 의한 흡광도의 차이는 ethanol만의 흡광도를 측정하여 보정해 주었고, 이때 전자 공여능은 시료 첨가구와 비첨가구의 흡광도 차이를 백분율(%)로 구하였다.
화분의 FRAP(Ferric reducing antioxidant power)에 의한 항산화 활성은 Ku 등의 방법으로 측정하였다(Ku et al., 2009). 반응용액은 300 mM acetate buffer(pH 3.6)와 40mM HCl로 용해시킨 10mM 2,4,6-tripyridyl-Striazine(TPTZ) 용액, 20mM ferric chloride(FeCl3·6H2O)를 10 : 1 : 1(v/v/v)의 비율로 혼합하여 37°C에서 10∼15분간 가온하여 FRAP reagent를 제조하였다. 활성은 시료 추출물 100μl에 FRAP reagent 3ml를 혼합하여 37°C에서 30분 동안 방치 한 후 593nm에서 흡광도를 측정하였으며, 표준물질은 FeSO4·7H2O(Iron(Ⅱ) sulfate heptahydrate)를 사용하였다.
총 폴리페놀 함량(total polyphenol contents, TPC)
총 폴리페놀 함량은 Folin-Ciocalteu의 방법을 변형하여 측정하였다(Blois, 1958). 화분 발아액 1ml에 EtOH 1ml, 증류수 5ml와 50% Folin-Ciocalteu regent 0.5ml를 가하여 상온에서 5분간 반응시켰다. 혼합액에 5% sodium carbonate(Na2CO3) 1ml를 가하고 어두운 상태에서 1시간 보관한 후 UV spectrophotometer로 725nm에서 흡광도를 측정하였다. 총 페놀 함량은 표준물질로서 gallic acid(Sigma, USA)를 이용하여 얻은 검량선으로부터 함량을 구하였다.
총 플라보노이드 함량(total flavonoid contents, TFC)
총 플라보노이드 함량은 Moreno 등의 방법으로 측정하였다(Moreno et al., 2000). 화분 시료 25μl에 증류수 125μl를 가하고 5% NaNO2 8μl를 첨가 후 5분간 상온에서 반응시켰다. 반응 후 10% AlCl3 15μl를 넣고 6분간 반응 후 1M NaOH 50μl와 증류수 27μl를 첨가하여 혼합한 후 ELISA reader를 이용해 510nm에서 흡광도를 측정하였다. 총 플라보노이드 함량은 표준물질로서 quercetin을 이용하여 얻은 표준곡선으로부터 시료의 총 플라보노이드의 함량을 구하였다.
Tyrosinase 활성 측정
Tyrosinase 활성은 0.1M potassium phosphate buffer(pH 6.8) 1.0ml, 0.3mg/ml L-tyrosine (Sigma, USA)수용액 1,0ml, 1250 unit/ml mushroom tyrosinase (Sigma, USA) 0.1ml을 혼합한 후 다양한 농도의 시료용액을 각각 0.2ml을 첨가하여 37°C에서 10분 동안 효소반응을 진행시켰다(Ha et al., 2005). 반응용액의 흡광도를 475nm에서 측정하여 시료의 효소 저해활성을 다음 식에 따라 구하였다.
A: 시료를 첨가하지 않은 반응용액의 475nm에서 흡광도
B: 시료를 첨가한 방응용액의 475nm에서 흡광도
결과 및 고찰
일반성분
다래화분의 일반성분을 분석한 결과는Table 1과같다. 조단백질 함량은 35.8%로 벚나무화분 24.6%(김과 손, 1990), 송화분 14%(이 등, 1997), 도토리화분 24.1%(홍 등, 2013)보다도 월등히 높았으며, 동결건조화분의 조단백질 함량은 35.7%로 파쇄 후에도 성분 함량에는 변화가 없었다. 조지방 함량은 8.7%로 송화분 3.0%(이 등, 1997), 유채화분 3.2%(김과 손, 1990)보다 높았으며, 동결건조 후에도 함량 변화는 없었다. 탄수화물 함량은 48.1%로 도토리화분 47.9%와 비슷하였으며 송화분 31.9%(이 등, 1997)보다는 높았다. 동결건조한 다래화분의 조단백질, 조지방, 탄수화물 등의 성분 함량은 동결건조 전에 비하여 비슷하거나 증가하는 경향을 보였다.
아미노산 조성
다래화분의 아미노산 조성을 분석한 결과는 Table 2와 같다. 다래화분에는 threonine, valine, methionine, phenylalanine, isoleucine, leucine, lysine 등 필수 아미노산이 분포하였다. 함량면에서는 glutamic acid와 aspartic acid가 가장 많이 함유되어 있으며 leucine, arginine, serine 순이었고, histidine, methionine, cystine 등은 소량 존재하였다. 이 등(1997)은 도토리화분의 아미노산 조성을 glutamic acid, aspartic acid, leucine 순으로 보고하여 다래화분과 유사한 경향을 보였으며, Solberg and Remedios(1980) 등은 화분에는 aspartic acid, glutamic acid, arginine, leucine, proline, lysine 등 6종의 아미노산이 60%를 차지한다는 보고와 유사한 결과이다. aspartic acid, histidine, threonine, alanine, arginine, tyrosine, valine, isoleucine, leucine 등은 동결건조 후에도 100% 보존율을 보였으며, 평균 보존율은 97.5%였다. 한 등(2004)은 high impact planetary mill을 이용한 소나무화분(송화분)의 세포벽 파쇄과정에서 아미노산 보존율을 94.1%로 보고하였다.
지방산 조성
다래화분의 지방산 조성을 분석한 결과Table 3에서와 같이 필수지방산인 linoleic acid와 linolenic acid가 함유되어 있었다. 다래화분에는 linolenic acid(48.3%)와 palmitic acid(29.1%)가 가장 많았으며 oleic acid와 linoleic acid는 7.7%, 6.7% 존재하였다. 이 등(1997)은 송화분에서는 oleic acid(25.7%)와 palmitic acid(20.5%)의 함량이 가장 많다고 보고하였으며, Xu et al.(2009)이 보고한 유채화분의 지방산 함량도 linolenic acid(38.7%), palmitic acid(20%) 순으로 분포한다고 보고하였다. 따라서 화분의 지방산 함량은 밀원식물에 따라 다르지만 불포화지방산 linolenic acid, linoleic acid, oleic acid와 포화지방산 palmitic acid가 주로 존재하였다. 전체 지방산 조성 중 불포화지방산이 차지하는 비율은 63.2%로 매우 높았으며, 특히 다가불포화지방산(polyunsaturated fatty acid, PUFA)이 55%이상 분포하였다. stearic acid와 linolenic acid는 동결건조 후에도 100% 보존율을 보였으며, 평균 보존율은 105.9%였다.
항산화 활성
다래화분을 에탄올로 추출하여 DPPH radical 소거능, FRAP 등의 방법으로 항산화 활성을 조사한 결과는 Table 4와 같다. DPPH radical 소거능은 원재료 15.04%에서 동결건조 후에는 23.25%로 150% 증가하였다. DPPH radical 소거능은 산화작용에 의하여 발생하는 hydroxyl radical, superoxide radical 등을 제거하는 항산화 능력을 평가할 때 가장 널리 이용되는 지표이다(김 등, 2000; 이 등, 2011). FRAP 항산화 활성에서도 원재료 1.82μmole Fe(Ⅱ)/g에서 동결건조 후에는 2.37μmole Fe(Ⅱ)/g로 130% 증가하였다. FRAP은 총항산화능을 측정하는 방법으로 낮은 pH에서 환원제에 의해 ferric tripyridyltriazine(Fe3+-TPTZ) 복합체가 ferrous tripyridyltriazine(Fe2+-TPTZ)으로 환원되는 원리를 이용한다. 화분의 항산화능이 동결건조 화분이 원재료보다 높게 나나났으며, 이는 동결건조에 의한 세포벽 파괴로 화분의 영양성분이 추출된 결과로 해석된다.
총 폴리페놀 및 총 플라보노이드 함량
다래화분을 에탄올로 추출하여 총 폴리페놀함량과 총 플라보노이드 함량을 조사한 결과는 Table 5와 같다. 총 폴리페놀 함량(TPC)은 원재료 18.883mg GAE/100ml에 서 동 결 건 조 후 에 는 26.027mg GAE/100ml로 137% 증가하였다. 총 폴리페놀 함량이 증가할수록 항산화 등 생리활성이 증가하는 것으로 보고되어 있으며(Rice-Evans et al., 1997), 특히 페놀성 화합물에 존재하는 phenolic hydroxyl(OH)기는 항산화, 항암, 항균효과 등의 활성이 보고되었다(Droge, 2001; Halliwell et al., 1995). 총 플라보노이드 함량(TFC)은 원재료 4.70mg GAE/100ml에서 동결건조 후에는 11.0mg GAE/100ml로 234% 증가하였다. 최근에는 항산화(Zhang et al., 2006), 항혈전(Hong et al., 2008), 항염증(Suryavanshi et al., 2007), 항암(Martinez et al., 2005) 등 플라보노이드 성분의 다양한 생리활성이 보고되었다. 따라서 화분의 동결건조 방법이 화분의 생리활성을 증가시키는 효과적인 방법으로 생각된다.
적 요
국내의 양봉산업은 2012년 기준으로 약 2만 농가에서 180만개의 봉군을 사육하여 연간 4,000억원의 소득을 올리며, 이중 약 60% 이상을 꿀 생산에 의존하고 있다. 양봉산물 중 화분은 꿀벌의 유충과 성충벌의 영양식품이며, 단백질의 공급원으로서 필수불가결한 물질이다. 화분은 영양성분이 풍부하여 오래전부터 자연 건강식품으로 이용되어 왔다. 화분은 이용가치가 매우 높은 자연식품이지만 외피가 견고하여 영양성분의 일부만 흡수된다. 본 연구는 화분의 세포질 영양성분을 추출하기 위하여 동결건조 방법으로 외피세포를 파괴하여 그 효과를 확인하였다.
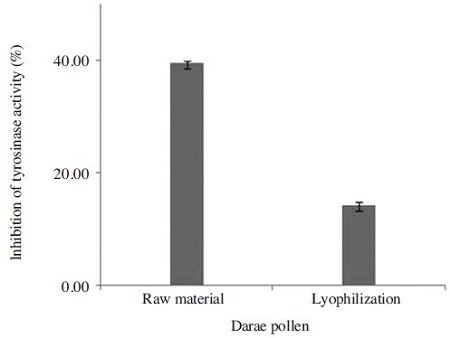
다래화분의 일반성분은 동결건조 후 조단백질, 조지방, 탄수화물 등의 성분 함량이 동결건조 전에 비하여 비슷하거나 증가하는 경향을 보였다. 다래화분의 아미노산 조성은 동결건조 후 aspartic acid, histidine, threonine, alanine, arginine, tyrosine, valine, isoleucine, leucine 등은 100% 보존율을 보였으며, 평균 보존율은 97.5%였다. 다래화분의 지방산 조성은 stearic acid와 linolenic acid는 동결건조 후에도 100% 보존율을 보였으며, 평균 보존율은 105.9%였다. 다래화분의 항산화활성 DPPH radical 소거능은 동결건조 후에 150% 증가하였으며, FRAP 항산화 활성에서도 130% 증가하였다. 다래화분의 총 폴리페놀 함량은 동결건조 후 137% 증가하였으며, 플라보노이드 함량은 234% 증가하였다. 다래화분의 Tyrosinase 생성 억제 효과는 동결건조 화분에서 양호하였으며, 특히 100μg/ml 농도에서 억제 효과가 우수하였다. 따라서 동결건조 방법에 의한 화분의 외피 파괴는 영양성분 추출에 매우 효과적이었다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 공동연구국책기술개발사업(과제번호: PJ010837)에 의하여 수행되었음.
References
- 김동신, (1989), 벌 유충 창자의 효소가 화분에 미치는 영향, 한국식품과학회지, 21, p404-408.
- 김재길, 손재형, (1990), 화분립 파쇄에 따른 이화학적 성분조성의 변화, 한국양봉학회지, 5, p23-30.
- 김정봉, 김경환, 홍승범, 박종석, 이종렬, 김삼선, 배신철, 조강진, 이동진, (2007), Gas Chromatography-Mass Spectroscopy를 이용한 γ-Linolenic Acid(GLA) 생성균주탐색 및 확인, 한국균학회지, 35, p96-100.
- 김정우, 신상철, 김병각, (1984), 건강식품으로서의 화분제재에 관한 연구, 생약학회지, 15, p147-149.
- 김현구, 권영주, 김공환, 정윤화, (2000), 마이크로웨이브 추출조건에 따른 섬쑥부쟁이 추출물의 총 폴리페놀 함량 및 전자공여 작용 변화, 한국식품과학회지, 153, p1022-1028.
- 이부용, 최희돈, 황진봉, (1997), 국내산 화분 및 화분 추출물의 성분 분석, 한국식품과학회지, 29, p869-875.
- 이상태, (1986), 화분학과 식물분류학, 한국양봉학회지, 1, p46-53.
- 이진하, 박애리, 최대운, 김종대, 김진철, 안주희, 이현용, 최면, 최근표, 신인철, 박희준, (2011), 산나물류의 식품 화학적 성분과 전자 공여능, 한국약용작물학회지, 19, p111-116.
- 정영건, 윤수홍, 권정숙, 배만종, (1984), 화분립의 영양생화학적 연구(Ⅰ), 한국영양식학회지, 13, p169.
- 최수정, 정윤화, (2004), 화분에서의 조단백질 및 환원당 추출시 단백질 분해 효소가 미치는 영향, 한국식품영양과학회지, 33, p1353-1358.
- 최준혁, 임기영, 장세영, 정용진, (2007), 도토리 화분의 발아조건에 따른 식품유해균 억제 효과, 한국식품저장유통학회지, 14, p87-93.
- 한명륜, 이수정, 김명환, (2004), High impact planetary mill 공정을 이용한 송화분의 세포벽 파쇄 기술, 단국대학교신소재 연구논문집, 12, p43-54.
- 홍인표, 이만영, 우순옥, 심하식, 최용수, 한상미, 김혜경, 변규호, 이명렬, 하남규, (2013), 도토리 화분(꽃가루)의 물리적 처리에 의한 성분 변화, 한국양봉학회지, 28, p217-221.
-
Abouda, Z., I. Zerdani, I. Kalalou, M. Faid, and T. Ahami, (2011), The antibacterial activity of Moroccan bee bread and bee-pollen (fresh and dried) against pathogenic bacteria, Res. J. Microbiol, 6, p376-384.
[https://doi.org/10.3923/jm.2011.376.384]

- AOAC, (1980), Official methods of analysis, 14th ed, Association of official analytical chemists, Washington DC.
-
Blackmore, S., A. H. Wortley, J. J. Skvarla, N. I. Gabarayeva, and J. R. Rowley, (2010), Developmental origins of structural diversity in pollen walls of Compositae, Plant Syst. Evol, 284, p17-32.
[https://doi.org/10.1007/s00606-009-0232-2]

-
Blois, M. S., (1958), Antioxidants determination by the use of a stable free radical, Nature, 181, p1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Droge, W., (2001), Free radicals in the physiological control of cell function, Physiol. Rev, 82, p47-95.
[https://doi.org/10.1152/physrev.00018.2001]

-
Fang, K., Y. N. Wang, T. Q. Yu, L. Y. Zhang, F. Baluska, J. Samaj, and J. X. Lin, (2008), Isolation of de-exined pollen and cytological studies of the pollen intines of Pinus bungeana Zucc. Ex Endl. and Picea wilsonii Mast, Flora, 203, p332-340.
[https://doi.org/10.1016/j.flora.2007.04.007]

-
Ha, T. J., S. Tamura, and J. Kubo, (2005), Effects of mushroom tyrosinase on anisaldehyde, J. Agric. Food Chem, 53, p7024-7028.
[https://doi.org/10.1021/jf047943q]

-
Halliwell, B., R. Aeschbach, J. Loliger, and O. I. Aruoma, (1995), The characterization of antioxidants, Food Chem. Toxicol, 33, p601-617.
[https://doi.org/10.1016/0278-6915(95)00024-V]

- Hong, G., Y. N. Huang, B. Gao, P. Y. Xu, C. Inagakia, and J. Kawabata, (2008), α-Glucosidase inhibitory effect by the flower buds of Tussilago farfara L, Food Chemistry, 1063, p1195-1201.
-
Kress, W. J., D. E. Stone, and S. C. Sellers, (1978), Ultrastructure of exine-less pollen: Heliconia (Heliconiaceae), Amer. J. Bot, 65, p1064-1076.
[https://doi.org/10.2307/2442323]

- Ku, K. M., S. K. Kim, and Y. H. Kang, (2009), Antioxidant activity and functional components of corn silk (Zea mays L.), Korean J. Plant Res, 22, p323-329.
-
Li, F., Q. P. Yuan, and F. Rashid, (2009), Isolation, purification and immunobiological activity of a new water-soluble bee pollen polysaccharide from Crataegus pinnatifida Bge, Carbohydrate Polymers, 78, p80-88.
[https://doi.org/10.1016/j.carbpol.2009.04.005]

- Liangli, Y., A. Scott, P. Jonathan, H. Mary, W. John, and Q. Ming, (2002), Antioxidant properties of hard winter wheat extracts, J. Agric. Food Chem, 60, p1619-1624.
-
Martínez Conesa, C., V. Vicente Ortega, M. J. Yéñez Gascón, M. Alcaraz Baños, M. Canteras Jordana, O. Benavente-García, and J. Castillo, (2005), Treatment of metastatic melanoma B16F10 by the flavonoids tangeretin, rutin, and diosmin, J. Agric. Food Chem, 53, p6791-6997.
[https://doi.org/10.1021/jf058050g]

-
Metcalfe, L. D., A. A. Schmitz, and J. R. Pelka, (1966), Rapid preparation of fatty acid esters from lipids for gas chromatographic analysis, Anal. Chem, 38, p514-515.
[https://doi.org/10.1021/ac60235a044]

-
Moreno, M. I. N., M. I. Isla, A. R. Sampietro, and M. A. Vattuone, (2000), Comparison of the free radical-scavenging activity of propolis from several regions of Argentina, Journal of Ethnopahrmacology, 71, p109-114.
[https://doi.org/10.1016/S0378-8741(99)00189-0]

-
Petrovic, M., N. Kezic, and V. Bolanca, (2010), Optimization of the GC method for routine analysis of the fatty acid profile in several food samples, Food Chem, 122, p285-291.
[https://doi.org/10.1016/j.foodchem.2010.02.018]

-
Rice-Evans, C. A., N. J. Miller, and G. Paganga, (1997), Antioxidant properties of phenolic compounds, Trends Plant Sci, 2, p152-159.
[https://doi.org/10.1016/S1360-1385(97)01018-2]

-
Roulston, T. H., and J. H. Cane, (2000), Pollen nutritional content and digestibility for animals, Plant Syst. Evol, 222, p187-209.
[https://doi.org/10.1007/BF00984102]

- Ryu, J. B., (2003), Classification of honey plants in Korea, Korean J Apiculture, 18, p5-22.
- Solberg, Y., and G. Remedios, (1980), Chemical composition of pure and bee-collected pollen, Meldinger fra Norges Landbrukshoegskole, 59, p2-12.
-
Stanley, R. G., and H. F. Linskens, (1965), Protein diffusion from germinating pollen, Physiol Plant, 18, p47-53.
[https://doi.org/10.1111/j.1399-3054.1965.tb06868.x]

-
Suryavanshi, V. L., P. A. Sathe, M. M. Baing, G. R. Singh, and S. N. Lakshmi, (2007), Determination of Rutin in Amaranthus spinosus Linn. Whole Plant Powder by HPTL, Chromatographia, 65, p767-769.
[https://doi.org/10.1365/s10337-007-0239-1]

-
Todd, F. E., and O. Bretherick, (1942), The composition of pollens, J. Econ. Entomol, 35, p312-317.
[https://doi.org/10.1093/jee/35.3.312]

-
Xu, X., L. P. Sun, J. Dong, and H. C. Zhang, (2009), Breaking the cells of rape bee pollen and consecutive extraction of functional oil with supercritical carbon dioxide, Innovative Food Science and Emerging Technologies, 10, p42-46.
[https://doi.org/10.1016/j.ifset.2008.08.004]

-
Zhang, J., R. A. Stanley, A. Adaim, L. D. Melton, and M. A. Skinner, (2006), Free radical scavenging and cytoprotective activities of phenolic antioxidants, Mol Nutr Food Res, 50, p996-1005.
[https://doi.org/10.1002/mnfr.200600072]