
동충하초 배지 추출물을 이용한 꿀벌 노제마병 방제
Abstract
Nosemosis (Nosemosis apium) is one of the most important parasites of honey bee, a recently described pathogen of Apis mellifera and Apis cerana. In honey bees, nosemosis infections are caused by microsporidian species of Nosema apis and Nosema ceranae. Nosemosis symptoms include digestive and absorption disorders because the spores damage epithelial tissue of the alimentary canal that is responsible for food absorption. Although fumagillin is the only antibiotic approved for control of Nosema disease in honey bees, fumagillin is known to be toxic to mammals and has a risk of residues in honey. In this paper, we have been conducting experiments of reduce production of Nosema spores using newly emerging bees that orally inoculated with Nosema ceranae spores. The data shown that the medium of Cordyceps militaris reduced spore production of Nosema cerenae to 97.82% compared with control and can be used for eco-friendly material to control of Nosema cerenae.
Keywords:
Honey bee, Apis mellifera, Noseam disease, Cordyceps militaris, Medium of Cordyceps militaris서 론
서양종 꿀벌(Apis mellifera L.)은 구한말에 우리나라에 도입된 이래 지금까지 사육되어 오면서(최, 1986; 이 등, 2010) 벌꿀, 프로폴리스, 로얄젤리, 봉독, 화분, 밀랍 등 다양한 양봉산물을 생산하는 산업화된 산업곤충 중 하나이다. 최근 통계결과에 따르면(NHERI, 2013) 우리나라 2011년 벌꿀 생산량은 3만 5,310톤으로 3,629억 원 수준이며, 이는 축산업 생산액(18조원)의 2% 비중이라고 밝힌 바가 있다. 특히 꿀벌 화분수정 가치는 6조 7,021억 원이며, 이는 2011년 우리나라 농업생산액(41조 3,582억 원)의 16.2% 비중으로, 꿀벌의 화분매개가 양봉농가의 소득창출 및 농업생태계 유지 측면에서 중요한 가치로 인정받고 있음을 확인할 수 있다(Martin, 2001; Winston, 1987; Jensen et al., 2005; Morse and Calderone, 2000). 그러나 최근 전 세계적 문제로 인식되고 있는 봉군붕괴현상(Colony Collapse Disorder, CCD) (Watanabe, 2008; Ho and Cummins, 2007)으로 인한 꿀벌 개체 수 감소 및 각종 질병(Bakonyi et al, 2002; Bailey, 1975; Bailey and Ball, 1991), 환경오염, 농약피해, 기후변화 등은 양봉산업의 발전에 위험요소로 작용하고 있어 이에 대한 대책이 시급한 상황이다.
지금까지 알려져 있는 꿀벌의 주요 질병은 크게 감염성 질병과 기생성 질병으로 나눌 수 있다. 감염성 질병은 다시 세균성과 바이러스성, 진균성, 원생동물성 질병으로 나눌 수 있는데, 그중 꿀벌 노제마병은 미포자충류(microsporidia)의 일종인 노제마 균에 의한 진균성 질병으로 분류되고 있다(Sina et al., 2005). 노제마병의 원인균은 Zander(1909)에 의해 서양종 꿀벌에서 처음으로 확인되었으며(Nosema apis), 그 후 동양종 꿀벌인 A. cerena에서 Nosema ceranae가 분리!⁄동정되었다(Fries, 1988; Toan et al., 2014). 그러나 두 꿀벌 종간의 지속적 교류로 인해 현재는 동양종꿀벌 및 서양종 꿀벌 모두 N. ceranae에 대한 감염성 더 크고(Higes et al., 2007; Paxton et al., 2007) 발생률 또한 더 빈번한 것으로 드러났다(Chen et al., 2009).
미포자충류(microsporidia)의 감염은 꿀벌 먹이에 노제마 포자가 섞여 들어가면서 일어난다(Chen et al., 2008; Webster et al., 2004). 노제마 포자는 한번 꿀벌의 장속에 들어가게 되면 7개월 이상 활성을 지니다가, 30~34°C의 온도 조건이 충족되면 발아, 증식하다 일부 포자는 배설물과 함께 체외로 나와 또 다른 전염원이 되어 다른 꿀벌에 옮겨간다. 꿀벌 노제마병은 꿀벌 개체수가 급격히 증가하는 봄에 가장 많이 발병하며, 여름에 안정기를 찾다 가을에 다시 증가한다. 노제마병에 걸린 일벌들은 소화 장애를 겪게 되는데, 그 결과로 묽은 변을 보거나 잘 날지 못하고 소문 앞을 기어 다니는 증상을 보인다. 노제마병에 걸린 일벌의 중장은 유백색을 띠고 있으며, 중장을 분리하여 현미경을 통해 포자를 관찰하면(×400) 쌀알모양의 노제마 포자를 확인할 수 있다. 일벌이 노제마병에 감염되면 꿀 생산, 화분매개가 감소하고, 수명이 단축되며, 여왕벌이 산란하지 않아 봉군이 감소한다. 또한 노제마병에 한번 감염되면 급격히 봉군내로 퍼지게 되어 그 피해가 매우 심각하다. 현재 국내에서 노제마 질병에 대해 사용하는 약제는 후미딜-B(프랑스 CEVA사), 노노스(헝가리 CHEMOR Kft사), 옥시테트라싸이클린(2%), 식소다(2%) 등(최 등, 2008)이 있으나, 노제마 원충(Nosema sp.)의 방제에 직접적으로 약효를 나타내는 약품은 푸마질린(fumagillin)을 함유한 제품이 유일하다. 푸마질린(fumagillin)은 1949년 아스퍼질러스 푸미가투스(Aspergillus fumigatus)에서 분리된 이래 기존의 모세혈관으로부터 새로운 모세혈관이 생기는 혈관신생(angiogenesis)의 억제제로서 사용되었으며, 현재는 미포자충류의 방제에 빈번하게 사용되고 있는 약품이다. 그러나 가격이 비싸고 국내에서는 전량 수입되는 문제점이 있으며, 최근에는 안정성 및 벌꿀 내에 잔류의 우려가 있어 사용에 신중을 기해야 할 것으로 보인다.
동충하초는 살아있는 곤충을 기주로 살아가는 곤충 기생균으로, 기주의 외피를 통하여 충체 내에 침입하여 내생균핵을 형성한 후, 충체 밖으로 자실체를 형성한다(Sung et al., 1997). 그러나 동충하초의 약리 기능성이 알려지면서 수요가 급증하자 현미 배지 등 곡물배지를 통한 자실체 인공배양에 성공하기도 하였다(Kobayasi, 1941). 동충하초는 주로 동아시아에서 자양강장제의 원재료로 사용되어 왔으며, 다당체(polysaccharides), cordycepin (3'-deoxyadenosine), ergosterol, mannitol 등 여러 가지 유효성분들을 함유하고 있는 것으로 잘 알려져 있다(Mizuno, 1999; Ng and Wang, 2005). 동충하초는 지금까지 약 800여종이 분리·동정되어 왔으나 우리나라 식품공전 상 식품에 사용할 수 있는 원료로 분리되어 있는 것은 눈꽃동충하초(Paecilomyces japonica / P. tenuipes)와 밀리타리스 동충하초(Cordyceps militaris) 두 가지 뿐이다. 그중 밀리타리스 동충하초는 간기능 개선, 항암, 항염증 등 다양한 임상에 효과가 있는 것으로 알려져 있다(김 등, 2012; 조 등, 2008; 최 등, 2012). 최근 홍 등(2014)에 의해서 밀리타리스 동충하초가 꿀벌 노제마병 방제에 효과가 있는 것을 밝혀낸 바가 있다. 이는 최초로 동충하초에 의한 노제마 원충을 방제한 사례라고 할 수 있으나 값비싼 동충하초 추출물을 꿀벌 질병에 적용하기에는 비용적인 한계를 극복하기 힘든 단점을 지니고 있다. 본 연구에서는 이러한 단점을 보완하기 위해 곡물배지인 동충하초 현미 배지 추출물을 노제마 원충 방제에 이용하였다. 동충하초 자실제 배양배지에는 cordycepin 등 생리활성 유효성분이 전이된다는 것은 이미 잘 알려진 사실이다. 그러나 본 연구에서는 동충하초 자실체와는 달리 동충하초 배지 추출물을 꿀벌 노제마 병에 대해 이용함으로써 실제 효과를 검정 할 뿐만 아니라 폐자월 활용을 통한 수익 창출 가능성을 제시하고자 하였다.
재료 및 방법
추출물 제조
본 실험에서는 동충하초 자실체 및 배지추출물을 노제마 원충 방제에 사용하였다. 먼저 동충하초 자실체(Fig. 1-A)와 동충하초 배지(Fig. 1-B) 부분을 절단하여 각각 300g씩 증류수 30L에 넣고 70°C에서 24시간 동안 가열하여 열수 추출을 실시하였다(1%). 농축한 용액은 여과지(Avantec Toyo Co., No. 2, Japan)로 여과하여 사용하였다.
노제마 포자 분리 및 현미경 관찰
노제마 포자 분리 방법은 채집한 꿀벌의 중장을 분리하여 1.5ml 튜브에 넣고 증류수 0.2ml을 가한 후 일회용 균질기(폐슬)을 이용해 분쇄하였다. 파이펫을 이용하여 포자 현탁액 10μl을 혈구계수기(Superior, Marienfeld, Germany)에 넣고 2~3분 기다린 후 광학현미경(DM2500, Leica)으로 400배에서 관찰하였다. 노제마 포자수는 Cantwell의 분석법을 참고하여 계산하였다.
PCR을 이용한 노제마 균주 동정
노제마 균주 동정은 꿀벌에서 분리한 중장의 genomic DNA를 추출하여 PCR을 통해 확인하였다. genomic DNA 추출 방법은 DNA extraction Kit(Promega)의 방법에 따라 실시하였으며, 추출한 Genomic DNA는 Table 1의 primer를 이용하여 PCR 하였다(Chen et al., 2008). 반응조건은 20mM Tris-HCl, pH 8.4, 2.0mM MgCl2, 100μm dNTP와 0.1μM의 forward와 reverse primer를 각각 사용하였다. PCR 증폭반응은 PTC-200(MJ Research, USA)을 사용하였으며, 25ng의 genomic DNA에 대해 0.6 U Takara Ex Taq(Takara Biomedical, Japan)으로 PCR 증폭반응을 실시하였다. 반응 시간은 Pre-denaturation 95°C 5분, 94°C 30초 52°C 30초 72°C 45초로 35cycle을 반복하고 72°C에서 5분간 final extension을 수행하였다. PCR 산물은 UV-light를 통해 확인한 후 정제하여 염기서열을 분석하였다. 염기서열은 NCBI(National Center for Biotechnology Information)에서 제공하는 BLAST(Basic Local Alignment Search Tool)를 이용해 alignments 하였다.
노제마 포자 감염실험
꿀벌 노제마 포자 감염 실험은 일벌에 경구 투여하는 방식을 사용하였다. 먼저 농촌진흥청 국립농업과학원 실험 양봉장에서 연중 계대 사육 중인 서양종 꿀벌(A. mellifera) 일벌을 채집하여 광학 현미경을 통해(x400) 노제마 감염여부를 확인 하였다. 그중 노제마 포자가 감염 되지 않은 봉군을 선별하여 봉개된 봉판(brood frames)을 온도 34°C, 습도 75% 조건의 인큐베이터에서 24시간 어둡게 처리함으로써 우화를 유도하였다. 인큐베이터에서 깨어나는 유봉(emerged bee)은 실험용 케이지에 옮겨 실험에 사용하였으며 각각의 실험은 3번 반복하였다. 그와 동시에 일벌에 감염시킬 노제마 포자 준비를 위해 서양종꿀벌(A. mellifera) 일벌을 채집하였다. 채집한 꿀벌은 중장을 분리하여 균질기(폐슬)을 이용해 분쇄하여 현미경 관찰법 및 PCR 진단을 병행하여 빠르게 노제마 포자를 분리!⁄동정하였다. 동정된 노제마 포자는 혈구계수기를 통해 개수 한 후 일벌 개체당 노제마 포자가 1×104이 되도록 희석하여 일벌에 먹임으로써 노제마 병 감염을 유도하였다.
추출물에 의한 노제마 포자 저감실험
동충하초 자실체(C. militaris) 및 배지추출물(Medium of C. militaris)에 의한 꿀벌 노제마 포자 저감효과를 확인하기 위해 노제마 포자를 감염시킨 일벌에 동충하초 자실체와 동충하초 배지 추출물을 농도별로 먹이(50% sugar syrup)에 섞어 투여하였다. 이때 양성대조군은 fumagillin을 함유하고 있는 약제 휴미딜-B를 1.5% 사용하였고, 음성대조군은 50% 당액(w/w)을 사용하였다.
결과 및 고찰
노제마 포자 분리 및 동정
서양종 꿀벌(A. mellifera) 일벌의 노제마 포자 감염에 사용된 노제마 균주는 서양종꿀벌 일벌로 부터 채집하여 PCR 및 염기서열 분석을 실시하였다. 노제마 포자를 동정하기 위한 노제마 특이적 프라이머는 (Table 1)과 같으며, PCR 산물을 염기서열 분석하여 BLAST(Basic Local Alignment Search Tool)를 이용해 alignments 한 결과 꿀벌 일벌에 감염된 노제마 균주는 N. ceranae로 동정되었다. 매 실험에 사용한 노제마 균주는 빠른 결과 도출을 위해 PCR 후 전기영동을 통해 확인한 후 결정하였다.
노제마 포자 섭식에 의한 꿀벌 노제마병 감염 실험
섭식에 의한 꿀벌 노제마병 감염 실험은 3개의 각각 다른 봉군을 노제마 포자를 섭식시킨 실험군과 섭식시키지 않은 대조군으로 나누어 수행 되었다. 실험은 16일간 매일 각 처리구별 일벌 1마리씩 채집한 후 노제마 포자를 개수 하여 그래프로 나타내었다(Fig. 2). 그 결과 노제마 균을 섭식시키지 않은 대조군에서는 전혀 노제마 포자가 발견 되지 않았으나 노제마 균을 섭식시킨 실험군에서는 노제마 포자가 관찰되었다. 노제마 포자는 시간이 지남에 따라 그 수가 증가하여 감염 7일 이후 10×103 이상의 노제마 포자가 관찰 되었고, 감염 16일 이후 100×103 이상의 노제마 포자가 관찰되었다(Fig. 2A). 노제마 포자 감염률은 노제마포자를 감염시킨 봉군 1, 2, 3에서 각각 56%, 40%, 48%를 나타내어 꿀벌 전 개체에 대한 질병 유발 효과는 없는 것으로 판단되었다(Fig. 2B). 그러나 본 연구방법은 갓 출방한 유봉(emerged bee)에대해노제마포자를 섭식시켜 꿀벌 노제마병을 유발함으로써 초기 감염 및 기타 환경 등 다른 외적인 요인들을 제어 할 수 있는 장점을 지니고 있다. 이전의 연구결과에서는 (홍 등, 2014) 이러한 실험방법이 정립되지 않아 노제마 검사를 통한 초기 노제마 포자를 개수한 후 추출물을 처리하여 이를 비교하는 방법으로 추출물의 효과를 검증하였다. 그러나 본 연구에서 정립된 방법을 통해 노제마병 감염 및 추출물 등에 대한 효과를 보다 정확하게 검증 할 수 있어 다양한 연구에 대한 활용도가 높을 것으로 기대하고 있다.
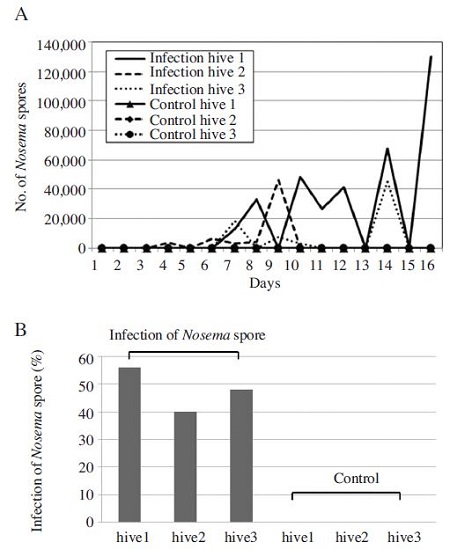
The number of Nosema cerenae spores (A) and infection rate per bee (B) by inoculated with Nosema cerenae spores. Newly emerged bees in three different hive (hive1, hive2, hive3) were transferred to cages and orally inoculated with 1 ×104 spores and control with uninoculated Nosema spores. Inoculated bees feed 50% sugar solution (w/w) in growth chambers with 34°C, 75% RH. Treated bees sampled five bees randomly from each cage everyday until 16days. The infection rate of Nosema cerenae spores had been accumulated for 16 days and calculated infection rate per bee. The data shown experiment of orally inoculation spore with well established.
밀리타리스 동충하초 자실체 및 배지 추출물에 의한 노제마 병 방제 효과
동충하초 자실체(C. militaris) 및 배지추출물(Medium of C. militaris)에 의한 꿀벌 노제마 포자 저감효과를 확인하기 위해 각각의 추출물 10% 씩을 먹이(50% 당액)에 섞어 일벌에 투여하였다. 이때 양성대조군은 푸마질린을 함유하고 있는 약제인 휴미딜-B를 1.5% 사용하였고, 음성대조군은 50% 당액(w/w)를 사용하였다. 실험은 인큐베이터에서 깨어나는 유봉(emerged bee) 50마리씩을 실험용 케이지에 넣어 각 처리구당 3번 반복을 실시하였으며, 20일 동안 5일 간격으로 일벌 5마리씩을 샘플링 하여 노제마 포자를 개수 하여 평균을 구하였다(Fig. 3, Table 2). 그 결과 양성대조군인 푸마질린을 처리한 케이지의 일벌은 노제마 포자가 전혀 검출되지 않았으나, 음성대조군인 당액을 처리한 케이지의 일벌의 노제마 포자수는 점차 증가하여 20일 경에는 4,661×103의 노제마 포자가 검출되었다. 반면 동충하초 자실체 추출물을 처리한 일벌의 경우 10일, 15일, 20일을 경과함에 따라 각각 14×103, 110×103, 240×103의 노제마 포자수가 검출되었다. 동충하초 배지 추출물을 처리한 일벌의 경우는 마찬가지로 10일, 15일, 20일을 경과에 따라 각각 25×103, 307×103, 102×103의 노제마 포자가 검출되어, 노제마 포자 숫자가 오히려 늘어났다 줄어드는 경향을 보인다. 그러나 음성대조군과 비교해 볼 때 근소한 차이 이므로 무시할 만한 수준으로 판단된다. 결과에 따르면 꿀벌 노제마 포자 감염 20일 경과 후 동충하초 자실체 추출물 및 배지 추출물의 노제마병 방제효과는 양성대조군에 비해 각각 94.86%, 97.82%의 억제 효과를 보였다. 이는 100% 방제 효과를 보인 양성대조군에 비해 다소 낮은 억제 효과 결과를 보였다(Table 2). 그러나 서두에 언급 한 것과 같이 양성대조군인 푸마질린은 비싼 수입약제이며 안전성문제가 정립되지 않은 점, 내성의 우려가 있다는 점 등을 고려하면 현재 식품으로도 사용 가능한 동충하초 추출물이 꿀벌 노제마병 방제제로서의 이용 가치는 클 것으로 기대하고 있다.
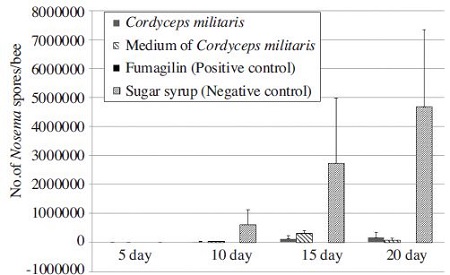
The number of Nosema cerenae spores per bee by treated with Cordyceps militaris (yellow), medium of Cordyceps militaris, fumagillin and sugar syrup. Newly emerged bees were transferred to cages and orally inoculated with 1×104 spores per bee. Inoculated bees feed 50% sugar solution (w/w) with Cordyceps militaris (10%), medium of Cordyceps militaris (10%), fumagillin (1.5%) and untreated control (sugar syrup). Treated bees sampled five bees randomly freom each cage every 5 days until 15 days. The data shown that Cordyceps militaris and medium of Cordyceps militaris susceptibily reduced spore production of Nosema cerenae spores.
밀리타리스 동충하초 자실체 및 배지 추출물의 농도별 노제마 병 방제 효과
앞서 확인한 동충하초 자실체 및 배지추출물에 의한 꿀벌 노제마 포자 저감효과를 농도별로 확인하기 위해 각각의 추출물 1%, 10% 씩을 먹이(50% 당액)에 섞어 일벌에 투여하였다(Fig. 4). 실험은 앞서 수행한 방법과 마찬가지로 인큐베이터에서 깨어나는 유봉(emerged bee) 50마리씩을 실험용 케이지에 넣어 각 처리구당 3번 반복을 실시하였으며, 15일 동안 5일 간격으로 일벌 5마리씩 샘플링 하여 노제마 포자를 개수하여 평균을 구하였다. 그 결과 동충하초 자실체 및 배지추출물을 10% 사용한 처리구에서는 두 추출물간 노제마 포자 저감 효과차이가 거의 없는 것으로 나타났다. 하지만 각각의 추출물을 1% 섞은 처리구에서는 15일경부터 동충하초 자실체 추출물을 처리한 처리구의 노제마 포자수는 증가하기 시작하나 동충하초 배지 추출물을 처리한 처리구에서는 여전히 노제마 포자 증식이 억제 되는 것을 확인 할 수 있다. 단순히 이 결과만을 놓고 보면, 동충하초 배지 추출물의 효과가 더 뛰어난 것으로 보여 질 수 있으나 각 추출물 간의 유효물질의 함량을 조사한 결과가 없어 단순 비교는 힘들 것으로 여겨진다. 그러나 그동안 버려지던 폐자원을 꿀벌 관리에 활용한다는 점, 그리고 지금까지 푸마질린을 제외하고 노제마병 방제효과를 보인 천연물이 없었다는 점에서 동충하초 배지 추출물의 노제마병 방제 효과는 의미 있는 결과라 생각된다. 하지만 동충하초가 식품으로 사용이 가능한 천연물이긴 하나 독성 문제가 제기 되고 있는 만큼, 실용화하기 이전에 적정 사용량 및 안전성 부분에 관한 연구를 더 강화해야 할 것으로 여겨진다.
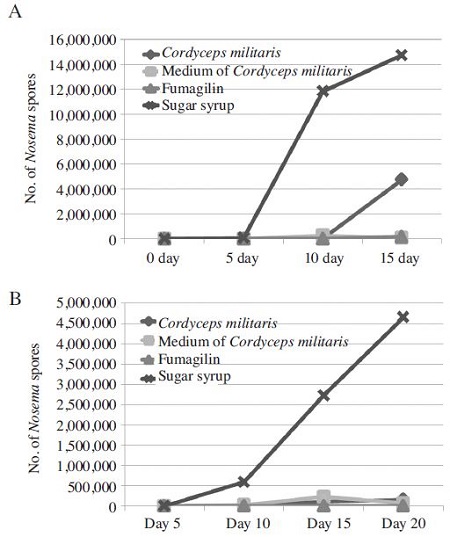
The number of Nosema cerenae spores by treated with two different concentrations of extracts. Newly emerged bees were transferred to cages and orally inoculated with 1×104 spores per bee. (A), Inoculated bees feed 50% sugar solution (w/w) with Cordyceps militaris (1%), medium of Cordyceps militaris (1%), fumagillin (1.5%) and untreated control. (B), Inoculated bees feed 50% sugar solution (w/w) with Cordyceps militaris (10%), medium of Cordyceps militaris (10%), fumagillin (1.5%) and untreated control. The data shown that 10% of Cordyceps militaris and medium of Cordyceps militaris susceptibily reduced spore production of Nosema cerenae spores and 1% of Cordyceps militaris shown lower effect of reduced Nosema spore production.
적 요
미포자충류(microsporidia)의 감염은 꿀벌 먹이에 노제마 포자가 섞여 들어가면서 일어나 꿀벌 개체수가 급격히 증가하는 봄에 가장 많이 발병한다. 일벌이 노제마병에 감염되면 꿀 생산, 화분매개가 감소하고, 수명이 단축되며, 여왕벌이 산란하지 않아 봉군이 감소하고, 급격히 봉군내로 퍼지게 되어 그 피해가 매우 심각하다. 현재 국내에서 노제마 질병에 대해 사용하는 약제는 노제마 원충(Nosema sp.)의 방제에 직접적으로 약효를 나타내는 약품은 푸마질린(fumagillin)을 함유한 제품이 유일하나 가격이 비싸고 국내에서는 전량 수입되는 문제점이 있으며, 최근에는 안정성 및 벌꿀 내에 잔류의 우려가 있어 이를 대체 할 천연물질의 개발이 시급하다. 본 연구에서는 동충하초 배지 추출물을 노제마 원충 방제에 이용하기 위하여 동충하초 배지를 열수 추출 하여 효과를 검정한 결과 양성대조군 대비 97.82% 노제마 포자 증식이 억제되는 것을 확인할 수 있었다. 이 결과는 천연물을 이용한 꿀벌 노제마 병 방제제로서 동충하초 배지의 이용 가능성에 대해 시사하고 있을 뿐만 아니라 폐자원 활용을 통한 농가 수익 창출의 가능성 또한 기대할 수 있을 것으로 생각된다.
Acknowledgments
본 연구는 농촌진흥청 시험연구사업(PJ01120101)의 연구비로 수행된 결과이며 이에 깊은 감사를 드립니다.
References
- NHERI 리포트, (2013), (제217호), 농협경제연구소, 양봉산업의 과제와 발전방향.
- 김혜주, 이태호, 권용삼, 손미원, 김채균, (2012), 밀리타리스 동충하초(Cordyceps militaris) 에탄올 추출물의 면역억제 마우스 면역활성에 미치는 영향, 한국식품영양과학회지, 41(4), p494-500.
- 이만영, 홍인표, 최용수, 김남숙, 김혜경, 이광길, 이명렬, (2010), 국내 양봉산업 현황, 한국양봉학회지, 25(2), p137-144.
- 조월순, 남병혁, 오수정, 최유진, 강은영, 홍숙희, 이상호, 정민호, (2008), 굼벵이 유래 밀리타리스 동충하초 열수추출물의 간기능개선 효과 및 단화독성 평가, 한국식품과학회지, 40(1), p106-110.
- 최승윤, (1986), 신제 양봉학, 집현사, p439.
- 최용수, 이명렬, 이만영, 이광길, (2008), 국내 꿀벌에서의 바이러스진단 및 질병발생 현황 조사, 한국양봉학회지, 23(2), p153-159.
- 최재훈, 김금숙, 이승은, 조재한, 성기호, 이대영, 김승유, 이태호, 노형준, (2012), 밀리타리스 동충하초 추출물의 항염활성 효과, 한국버섯학회지, 10(4), p249-253.
- 홍인표, 우순옥, 한상미, 여주홍, 최용수, 김혜경, 이명렬, 김남숙, 이만영, 심하식, (2014), 약용버섯 추출물의 꿀벌 노제마병 방제 효과, 한국양봉학회지, 29(2), p119-123.
-
Bailey, L., (1975), Recent research on honey bee viruses, Bee World, 56, p55-64.
[https://doi.org/10.1080/0005772X.1975.11097544]

- Bailey, L., and B.V. Ball, (1991), Honey Bee Pathology, second ed, Academic Press, London, UK.
- Bakonyi, T., Farkas, R., Szendroi, A., Dobos-Kovacs, M., and M. Rusvai, (2002), Detection of acute bee paralysis virus by RT-PCR in honey bee and Varroa destructor field samples: rapid screening of representative Hungarian apiaries, Apidologie, 33, p63-74.
-
Chen, Y., Evans, J.D., Smith, I,B., and J.S. Pettis, (2008), Nosema ceranae is a long-present and wide-spread microsporidian infection of the European honey bee (Apis mellifera) in the United States, J. Invertebr. Pathol, 97(2), p186-188.
[https://doi.org/10.1016/j.jip.2007.07.010]

-
Chen, Y.P., Evans, J.D., Murphy, C., Gutell, R., Zuker, M., Gundensen-Rindal, D., and J.S. Pettis, (2009), Morphological, molecular, and phylogenetic characterization of Nosema ceranae, a microsporidian parasite isolated from the European honey bee, Apis mellifera, J. Eukaryot. Microbiol, 56(2), p142-147.
[https://doi.org/10.1111/j.1550-7408.2008.00374.x]

-
Fries, I., (1988), Infectivity and multiplication of Nosema apis Z. in the ventriculus of the honey bee, Apidologie, 19(3), p319-328.
[https://doi.org/10.1051/apido:19880310]

-
Higes, M., Garcia-Palencia, P., Martin-Hernandez, R., and A. Meana, (2007), Experimental infection of Apis mellifera honeybees with Nosema ceranae (Microsporidia), J. Invertebr Pathol, 94, p211-217.
[https://doi.org/10.1016/j.jip.2006.11.001]

- Ho, M.W., and J. Cummins, (2007), Mystery of disappearing honeybees, Science in Society, 34, p35-36.
-
Jensen, A.B., Palmer, K.A., Boomsma, J.J., and B.V. Pedersen, (2005), Varying degrees of Apis mellifera ligustica introgression in protected populations of the black honeybee, Apis mellifera mellifera, in northwest Europe, Mol Ecol, 14(1), p93-106.
[https://doi.org/10.1111/j.1365-294X.2004.02399.x]

- Kobayasi, Y., (1941), The genus Cordyceps and its allies, Sci. Rept. Tokyo Bunrika Daikaku, Sect. B, 5, p53-260.
-
Martin, S.J., (2001), The role of Varroa and viral pathogens in the collapse of honeybee colonies: a modeling approach, J. Appl. Ecol, 38, p1082-1093.
[https://doi.org/10.1046/j.1365-2664.2001.00662.x]

-
Mizuno, T., (1999), Medicinal effects and utilization of Cordyceps (Fr.) Link (Ascomycetes) and Isaria Fr. (Mitosporic fungi) Chinese caterpillar fungi, "Tochukaso" (review), Intl J Med Mushroom, 1, p251-261.
[https://doi.org/10.1615/IntJMedMushrooms.v1.i3.80]

- Morse, R.A., and N.W. Calderone, (2000), The value of honey bee pollination in the United States, Bee Cult, 128, p1-15.
-
Ng, T.B., and H.X. Wang, (2005), Pharmacological actions of Cordyceps, a prized folk medicine, J Pharm Pharmacol, 57(12), p1509-1519.
[https://doi.org/10.1211/jpp.57.12.0001]

-
Paxton, R.J., Klee, J., Korpela, S., and I. Fries, (2007), Nosema ceranae has infected Apis mellifera in Europe since at least 1998 and may be more virulent than Nosema apis, Apidologie, 38, p558-565.
[https://doi.org/10.1051/apido:2007037]

-
Sina, M., Alastair, G., Farmer, M., Andersen, R., Anderson, O., Barta, J., Bowser, S., Brugerolle, G., Fensome, R., Fredericq, S., James, T., Karpov, S., Kugrens, P., Krug, J., Lane, C., Lewis, L., Lodge, J., Lynn, D., Mann, D., Maccourt, R., Mendoza, L., Moestrup, O., Mozley, S., Nerad, T., Shearer, C., Smirnov, A., Spiegel, F., and M. Taylor, (2005), The New Higher level classification of Eukaryotes with emphasis on the taxonomy of Protists, J. Eukar. Microbiol, 52, p399-451.
[https://doi.org/10.1111/j.1550-7408.2005.00053.x]

- Sung, J.M., Lee, H.K., Choi, Y.S., Kim, Y.Y., Kim, S.H., and G.H. Sung, (1997), Distribution and taxonomy of entomopathogenic fungal species from Korea, Kor J Mycol, p239-252.
- Toan, T.V., Tam, D.Q., Lee, M.L., Sim, H.S., Kim, H.K., Byuon, G.H., and Y.S. Choi, (2014), Nosema Disease on Honey Bee Apis cerana in Viet Nam, Journal of Apiculture, 29(1), p35-42.
-
Watanabe, M.E., (2008), Colony collapse disorder: Many suspects, no smoking gun, BioScience, 58, p384-388.
[https://doi.org/10.1641/B580503]

- Webster, T.C., Pomper, K.W., Hunti, G., Thackerk, E.M., and S.C. Jones, (2004), Nosema apis infection in worker and queen Apis mellifera, Apidologie, 35(1), p49-54.
- Winston, M.L., (1987), The Biology of the Honey Bee, Harvard University Press, Cambridge, London, UK.
- Zander, E., (1909), Tierische Parasiten aZsKrankheitserreger beider Biene, Munchener Bienenzeitung, 31, p196-204.

