Bacillus thuringiensis의 꿀벌부채명나방, Galleria mellonella L. (Lepidoptera: Pyralidae)에 대한 방제 효과
Abstract
Bacillus thuringiensis K1 and K2 which was isolated soils and wax showed high toxicity to wax moth, Galleria mellonella L.. The crystal protein profiles of B. thuringiensis K1 were similar to those of its reference strain, subsp. kurstaki. But, K2 were similar with subsp. aizawai. PCR analysis using cry gene primers showed that B. thuringiensis K1 and K2, unlike its reference strain, had cry1Aa, cry1Ab, cry1Ac, cry1E, cry1F, cry2, and cry5 genes for K1 and cry1Aa, cry1Ab, cry1Ac, cry1B, cry1C, cry1D, cry2, and cry5 genes for K2, suggesting that B. thuringiensis K1 and K2 was a unique strain with respect to gene type. In addition, B. thuringiensis K2 was showed high level of toxicity against 1 instar to 3 instar wax moth, G. mellonella. Furthermore, B. thuringiensis K1 was showed high level of toxicity against 3 instar to 5 instar wax moth, G. mellonella.
Keywords:
Bacillus thuringiensis K1, K2, Galleria mellonella, cry1Aa, cry1Ab, cry1Ac, cry1E, cry1F, cry2, and cry5서 론
Bacillus thuringiensis(Bt)는 생물학적 살충제로 전 세계적으로 알려져 있는 미생물로써 곤충의 섭식 행동에 따라서 곤충의 장에서 활성을 가지면서 내독소 단백질이 곤충의 유충을 죽이는 기작으로 작용을 하는데, 꿀벌부채명나방(Galleria mellonella L.)에 대한 살충력을 가지고 있는 Bt제에 대한 연구결과가 Burges와 Bailey(1968), Burges(1970)에 의하여 발표된 적이 있다. 꿀벌부채명나방(G. mellonella L.)은 주로 밀랍을 먹고 자라는 곤충으로써 전 세계적으로 6종이 분류되어 있으며(Amett, 1985), 국내에는 Galleria mellonella L.와 Achroia grisella 2종이 양봉농가에 피해를 주는 것으로 알려져 있다(Calvert, 1982; Hachiro and Knox, 2000; 우 등, 1995). 꿀벌부채명나방(G. mellonella L.)에 의한 서양종꿀벌(A. mellifera L.) 피해로는 저장된 빈 벌집 및 먹이용 벌집을 사용하지 못할 정도의 피해를 유발한다(Caron, 1992). 또한, 꿀벌부채명나방(G. mellonella L.)은 벌통과 벌통사이를 이동하기 때문에 부저병과 같은 질병을 매개하여 피해를 가중하기도 한다(Charrirer and Imdorf, 1999). 이러한 꿀벌에 피해를 유발하는 꿀벌부채명나방(G. mellonella L.)의 방제를 위하여 많은 노력이 있어왔으며, 대표적인 방법으로 온도조절을 통한 고온 및 저온처리, 이산화탄소를 처리하는 방법이 많이 알려져 있으며, 화학적인 방법으로는 훈연제인 P-dichlorobenzene(PDB), 아세트산, 시안화칼슘, 다이브롬화 에틸렌, 메틸 브로마이드, 포스핀 등으로 방제하기도 한다(Hood et al., 2003). 그러나 화학물질에 의한 방제는 벌꿀에의 잔류 등으로 인한 인체 유해물질의 잔류 위험성이 있어서 인체에 무해한 친환경 방제 기술의 개발을 위한 연구 결과로 Bt제의 개발에 대한 보고도 있다. 특히, B. thuringiensis aizawai의 경우 나비목 곤충에 살충력을 보이면서(Tabashnik et al., 1994; Liu et al., 1998) 꿀벌부채명나방(G. mellonella L.)에도 효과적인 살충 효과를 가지고 있음이 보고된 바 있다(Li et al., 1987). 그 외의 연구 결과로써 꿀벌부채명나방(G. mellonella L.)에 의한 피해를 예방하기 위하여 Bt 내독소단백질 발현유전자를 옥수수에 형질전환 시켜 꿀벌의 먹이원인 화분에 Bt 내 독소 단백질이 발현되게 하여 살충력을 가지고 있는 형질전환 옥수수 화분을 먹여서 방제하는 방법도 발표되었다(Anne et al., 2003).
따라서 본 연구에서는 국내에서 분리된 B. thuringiensis K1과 K2의 꿀벌부채명나방(G. mellonella L.)에 대한 살충력을 검정하고 이의 이용을 통한 양봉농가의 꿀벌부채명나방(G. mellonella L.) 피해를 예방하기 위하여 연구를 수행하였다.
재료 및 방법
꿀벌부채명나방(Galleria mellonella L.) 사육
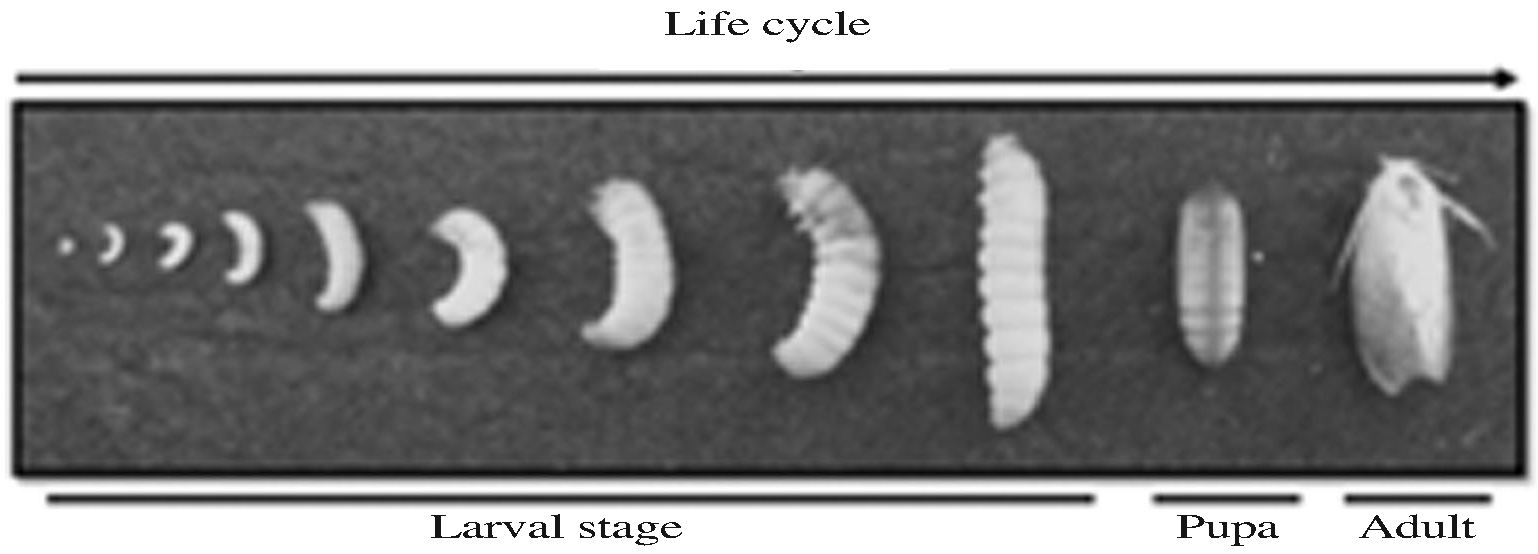
토종벌(Apis cerana) 봉군 내에 기생하면서 피해를 유발하는 꿀벌부채명나방(G. mellonella L.)은 국내 양봉장에서 사육중인 벌통에서 채집하였으며, 이 등(2007)의 방법에 의하여 30°C에서 24시간 암조건으로, 벌집을 절단하여 먹이로 주며 실내에서 사육하면서 Fig 1.과 같은 생활사에서 각각의 령기별로 선별된 유충을 살충력 검정에 사용하였다.
Bacillus thuringiensis 균주 분리
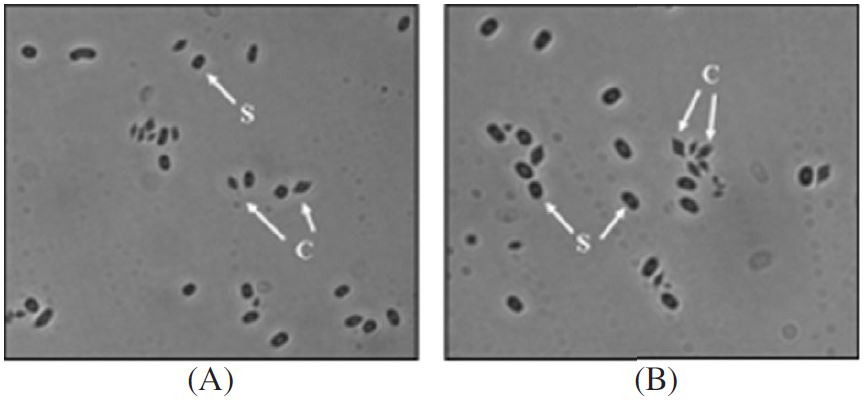
양봉장인근 표토로부터 2~5cm 깊이에서 수집된 토양과 꿀벌 벌통 내의 벌집에서 Bacillus thuringensis(Bt)를 분리하기 위한 기본 배지는 nutrient agar (NA, Difco, BactoR) 배지를 이용하였다. 분리방법은 시료 1g씩을 임의로 취하여 이를 9ml의 멸균수가 들어있는 시험관에 넣고 10분간 교반한 후 기타 미생물의 생장을 억제하기 위하여 80°C에서 10분간 열처리하고 희석평판배양법으로 희석한 후 NA agar plate에 도말하였다. 그리고 30°C 항온기에서 4∼5일간 배양함으로서 형성된 colony를 위상차 현미경(×1,000)으로 관찰하여 포자와 내독소 단백질을 형성하는 균주를 선발하였으며(Fig. 2), 선발된 Bt 균주는 단일 콜로니로 순수 분리하였으며 임의로 B. thuringiensis K2로 명명하였다.
Bacillus thuringiensis 균주 살충력 검정
꿀벌부채명나방(G. mellonella L.) 방제를 위한 Bacillus thuringiensis 균주는 서울대학교에서 분양받은 B. thuringiensis K1과 벌통 양봉장 인근 토양에서 분리한 B. thuringiensis K2를 시험에 사용하였다. B. thuringiensis K1과 K2 균주는 살충력 검정을 위하여 GYS배지[(NH4)2SO4; 0.2%, K2HPO4; 0.05%, CaCl2; 0.008%, MgSO4; 0.002%, MnSO4·4H2O; 0.005%, Yeast extract; 0.2%, Glucose; 0.1%]에 5일간 배양하였다. 배양되어 완전한 auto-lysis가 이루어진 배양액을 원심분리 한 후 독성단백질만을 회수하여 살충력 검정에 이용하였으며 살충력 검정은 3반복으로 수행하였다. 꿀벌부채명나방(G. mellonella L.)을 령기별로 유충 10마리씩 선발하여 1일간 섭식을 중단시키고 앞서 회수한 내독소단백질을 희석하여 살포한 공소비를 섭식시키는 방법으로 살충력을 검정하였다. 살충력 검정시에 Bt 농도를 1μg/ml~100μg/ml 단계별로 설정하였으며 4×6cm의 공소비에 1ml의 내독소단백질을 살포하여 사용하였다.
Plasmid DNA분리
Bacillus thuringiensis 균주의 Plasmid DNA분리를 위해 5ml LB배지에 접종하고, 30°C에서 12시간 동안 배양하였다. 배양액을 100ml SPY배지[(NH4)2SO4; 0.2%, K2HPO4; 1.4%, KH2PO4; 0.6%, Sodium citrate; 0.1%, MgSO4·7H2O; 0.02%, Yeast extract; 0.1%, Glucose; 0.1%]에 다시 접종한 다음, 30°C에서 OD600=0.7 될 때까지 배양하였다. 이것을 Qiagen plasmid mini kit(Qiagen, Germany)를 이용하여 분리하였다.
PCR
PCR을 통해 Bacillus thuringiensis 균주가 가지는 내독소 단백질 유전자에 대한 유전자형을 조사하기 위해 현재까지 보고된 cry 유전자내의 보존영역을 특이적으로 증폭시키는 특이적인 PCR primer를 사용하였다. PCR은 Pre-Mix(Bioneer, Korea)에 B. thuringiensis plasmid DNA 시료와 각 primer 0.1∼0.5μM을 넣은 다음 DNA Thermal Cycler(Bioneer, Korea)로 94°C에서 1분, 55°C에서 1분 그리고 72°C에서 1분씩 35회 반복조건을 설정하여 수행하였으며 그 primer의 염기서열은 Table 1(Kalman et al., 1993; Chang et al., 1998)과 같다.
결과 및 고찰
선발 강독성 Bt K1과 K2의 생화학적 특성구명
꿀벌부채명나방(Galleria mellonella L.) 방제를 위한 독성과 살충 범위에서 가장 효과적인 Bacillus thuringiensis K1과 K2의 특성을 조사하기 위하여 B. thuringiensis K1과 K2의 내독소 단백질의 형태를 위상차현미경으로 관찰하였다(Fig. 2). B. thuringiensis K1과 K2는 각각 포자를 형성하고 crystal protein을 형성하여 기존에 알려져 있는 B. thuringiensis 균주의 특성인 포자 형성 및 독성단백질을 발현하는 균주로 확인하였다. 또한, B. thuringiensis K1과 K2 균주의 분리된 plasmid DNA를 주형으로 증폭된 PCR결과로 B. thuringiensis K1은 일반적으로 나방류에 독성을 가지고 있는(Herman and Whiteley, 1989) B. thuringiensis 균주가 보유하고 있는 cry1형의 단백질 유전자 영역의 발현을 확인하였으며, B. thuringiensis K1은 cry1Aa, cry1Ab, cry1Ac, cry1Ecry1F, cry2 그리고 cry5형의 단백질 유전자 영역의 발현이 확인되었다(Fig. 3A). 그리고 B. thuringiensis K2도 나방류에 살충력을 보이는 cry1형의 단백질 유전자 영역이 발현하는 것으로 확인하였는데, B. thuringiensis K1과는 상이하게 cry1B, cry1C와 cry1D가 발현되는 반면, cry1E와 cry1F는 발현이 되지 않는 것으로 확인되었다(Fig. 3B).

Detection of cry genes of B. thuringiensis K1 and K2 by PCR. The PCR products of B. thuringiensis K1 (cry1Ab, cry1Ab, cry1Ac, cry1E, cry1F, cry2 and cry5) (A) and K2 (cry1Aa, cry1Ab, cry1Ac, cry1B, cry1C, cry1D, cry2 and cry5) (B) were analysed by 1% agarose gel electrophoresis. M indicates 100 bp (left) and 1 kb (right) DNA ladders.
Bt K1과 K2의 살충력
Bacillus thuringiensis K1과 K2의 꿀벌부채명나방(Galleria mellonella L.) 유충을 50% 살충하는 농도(LC50)를 측정한 결과 B. thuringiensis K1은 24.08μg/ml에서 효과를 보였으며, 반수치사시간(LT50)은 24시간이 소요되었다. 그리고 B. thuringiensis K2의 경우에는 반수치사농도(LC50)가 32.83μg/ml을 처리하였을 때 효과를 보였으며, 반수치사시간(LT50)은 36시간으로 확인되었다. 특이한 점으로 B. thuringiensis K1의 경우에는 동일량의 내독소단백질을 처리하였으나 3일이 경과한 후에도 50%이하의 살충력을 보여서 반수치사농도(LC50)와 반수치사시간(LT50)을 측정 할 수 없었으며, 5령기의 유충에 대한 살충효과가 우수하게 관찰 되었으며, B. thuringiensis K2의 경우에는 2∼5령기에서 K1과 유사하게 3일이 경과하여도 50%이하의 살충력을 보여서 반수치사농도(LC50)와 반수치사시간(LT50)을 측정 할 수 없었다(Data not show). 따라서 K2의 경우에는 1령기의 유충에 튿이적으로 우수한 살충력을 보였다. 이는 선발된 B. thuringiensis K1과 K2균주를 봉군에 적용할 경우 두 가지 균주를 혼합하여 사용한다면 폭넓은 유충령기에 대한 살충력을 보일 가능성이 있다. 따라서 본 연구에서는 국내에 보유중이거나 분리된 B. thuringiensis K1과 K2 두 가지 균주를 대상으로 꿀벌부채명나방(G. mellonella L.) 유충에 대한 살충력을 검정한 결과, 토종벌(A. cerana)과 서양종 꿀벌(A. mellifera)에 직접적인 피해를 주는 꿀벌부채명나방(G. mellonella L.)을 적절히 제거할 수 있을 것으로 확인하였으며, 이러한 독성단백질을 벌통 내에서 꿀벌부채명나방(G. mellonella L.)이 먹을 수 있도록 소초광에 도포 및 혼합을 통한 소초광 제작 과정이 필요할 것으로 보인다. 특히 꿀벌부채명나방(G. mellonella L.)이 낭충봉아부패병 및 각종 질병을 매개하는 것으로 알려져 있는(Choi et al., 2012) 토종벌(A. cerana)에 이들 균주를 적용하였을 때, 보다 효과적으로 봉군을 증식하고 질병발생 위험성을 낮출 수 있을 것으로 기대한다.
적 요
꿀벌부채명나방(G. mellonella L.)을 방제하기 위한 미생물 살충제의 개발을 위하여 Bt균주를 선발하고 각각의 균주가 가지고 있는 유전적 특성을 구명하고 독성단백질을 분리하였으며, 균주들의 유전적 특성을 구명하여 나방류 해충인 꿀벌부채명나방(G. mellonella L.)에 대한 살충력을 검정하였다. 그 결과 선발된 B. thuringiensis K1과 K2는 꿀벌부채명나방(G. mellonella L.) 1령기와 5령기에 우수한 살충력을 보이는 것을 확인하였다. 꿀벌부채명나방(G. mellonella L.) 유충의 반수치사농도(LC50)를 측정한 결과 B. thuringiensis K1은 24.08μg/ml, B. thuringiensis K2는 32.83μg/ml임을 확인하였는데, 특이한 점으로 K1은 5령기 유충, K2는 1령기 유충에 보다 우수한 살충효과를 보였다. 이러한 결과를 바탕으로, 선발된 균주는 각각 배양하여 혼합사용 하는 것이 넓은 발생단계의 꿀벌부채명나방(G. mellonella L.) 유충을 효과적으로 살충할 수 있을 것으로 보인다.
Acknowledgments
본 연구는 농림수산식품기술개발 연구과제(꿀벌 응애류 및 토종벌 해충 관리 기술 개발, 312027-03-1-HD010)에 의하여 수행되었음.
Reference
- 우건석, 이종호, 조광선, 조영희, (1995), 꿀벌 해충(응애류 및 소충), 감염실태 및 방제대책에 관한 연구, 한국양봉학회지, 10, p35-48.
- 이승옥, 이동운, 추호렬, (2007), 꿀벌부채명나방[Galleria mellonella (L.)] 사육을 위한 경제적 인공사료 개발, Korean J. Appl. Entomol, 46(3), p385-392.
- Amett, R. H., (1985), Galleria mellonella: In American Insects, published by van Nostrand Reinhold Company Inc, New York, USA, p570.
- Anne, V. H., Zachary, Y. H., and Walter, L. P., (2003), Effects of dietary transgenic Bt corn pollen on larvae of Apis mellifera and Galleria mellonella, Journal of Apicultural Research, 42(4), p77-81.
-
Burges, H. D., and Bailey, L., (1968), Control of the greater and lesser wax moths (Galleria mellonella and Achroia grisella) with Bacillus thuringiensis, J. Invertebr. Pathol, 11, p184-195.
[https://doi.org/10.1016/0022-2011(68)90148-1]

- Burges, H. D., (1970), Stability of Bacillus thuringiensis in beeswax and bee comb, Proc. 4th Int. CoNoq. Iysect Pathol, Maryland, p214-218.
- Calvert, III P., (1982), Certan™, a bacterial insecticide for control of wax moth (a literature review), American Bee J, 122, p200-202.
- Caron, D. M., (1992), Wax moth, American Bee J, 132, p647-649.
-
Chang, J. H., Roh, J. Y., Je, Y. H., Park, H. W., Jin, B. R., Woo, S. D., and Kang, S. K., (1998), Isolation of a strain of Bacillus thuringiensis ssp. kurstaki HD 1 encoding d-endotoxin Cry1E, Lett Appl Microbiol, 26, p387-390.
[https://doi.org/10.1046/j.1472-765X.1998.00355.x]

- Charriere, J. D., and Imdorf, A., (1999), Protection of honey combs from wax moth damage, American Bee J, 139, p627-630.
- Choi, Y. S., Byeon, G. H., Ratna, Y., and Lee, M. L., (2012), Transmission of Bee Virus in Apis cerana Hives by Brachymeria ornatipes and Galleria mellonella, Korean J. Apiculture, 27(2), p123-127.
- Hachiro, S., and Knox, D., (2000), Diagnosis of Honey Bee Diseases, USDA, Agricultural Handbook, 690, p61.
- Herman, H., and Whiteley, H. R., (1989), Insecticidal Crystal Proteins of Bacilllus thuringiensis, Microbiological Reviews, 53(2), p242-255.
- Hood, W. M., Horton, P. M., and McCreadie, J. W., (2003), Field evaluation of the red imported fire ant (Hymenoptera: Formicidae) for the control of the wax moths (Lepido ptera: Pyralidae) in stored honey bee comb, J. Agric. Urban Entomol, 20, p93-103.
- Kalman, S., Kiehne, K. L., Libs, J. L., and Yamamoto, T., (1993), Cloning of a novel cryIC type gene from a strain of Bacillus thuringiensis subsp. galleriae, Applied and environmental microbiology, 59(4), p1131-1137.
- Liu, Y. B., Tabashnik, B. E., Moar, W. J., and Smith, R. A., (1998), Synergism between Bacillus thuringiensis spores and toxins against resistant and susceptible Diamondback moths (Plutella xylostella), Appl. Environ. Microbiol, 64, p1385-1389.
-
Li, R. S., Jarrett, P., and Burges, H. D., (1987), Importance of spores, crystals, and delta endotoxins in the pathogenicity of different varieties of Bacillus thuringiensis in Galleria mellonella and Pieris brassicae, J. Invertebrate Pathol, 50, p277-284.
[https://doi.org/10.1016/0022-2011(87)90093-0]

- Tabashnik, B. E., Finson, N., Johnson, M. W., and Heckel, D. G., (1994), Crossresistance to Bacillus thuringiensis toxin CryIF in the Diammondback moth (Plutella xylostella), Appl. Environ. Microbiol, 60, p4627-4629.