국내산 아카시나무(Robinia pseudoacacia) 꿀로부터 abscisic acid 성분 분리
Abstract
Honey is nectar of flowers brought by the worker honeybees to their hives and modified during the process of storing and ripening. Actually it is a plant product. In this study, we carried out the extraction and identification of the botanical origin constituent from honey of Black Locustg (Robinia pseudoacacia) in Korea. To isolate characteristic constituent from the honey, sample was extracted with ethyl acetate and then the extract was subjected to column chromatography using silica gel and ODS resins. We isolated (+)-abscisic acid and its structure was identified by the basis of physicochemical method such as 1D-NMR (1H, 13C, DEPT 90 and 135), 2D-NMR (HMQC and HMBC) and mass spectrometery. (+)-Abscisic acid was detected at UV 260nm as characteristic peak by UPLC-PDA and was obtained for the first time from Black Locust honey. This insight might lead to important characterization features for differentiate honeys.
Keywords:
Black Locust honey, Abscisic acid, UPLC, Botanical origin서 론
벌꿀은 꿀벌에 의해 생산되는 천연 식품이며 탄수화물이 주 성분으로 과당 및 포도당을 포함한 당류(70~80%), 수분(18~20%), 단백질, 아미노산, 미네랄, 유기화합물 등으로 구성되어 있다(Chang et al., 1988). 예로부터 천연감미료로 이용했을 뿐만 아니라 의약적 기능이 있는 것으로 알려져 민간요법으로 사용된 벌꿀은 밀원에 따라 프로바이틱(probiotic), 항산화, 항균, 그리고 항돌연변이 등 다양한 생리활성을 나타내며, 이는 당분과 더불어 밀원에서 유래된 유기화합물에 기인하는 것으로 알려져 있다(Truchado et al., 2009; Israili, 2014; Can et al., 2015). 벌꿀은 밀원의 명칭에 따라 아카시아나무 꿀, 밤꿀, 마누카꿀, 유채꿀, 메밀꿀 등으로 나뉘며 색, 향기, 맛 등이 각기 다르다(Kim and Lee, 1996). 벌꿀로 전환되는 밀원 기원의 생리활성물질인 유기화합물에 대한 성분 연구로는 phenolic acids(caffeic acid, gallic acid, cinnamic acid, protocatechuic acid, p-coumaric acid, chlorogenic acid, 4-hydroxybenzoic acid, vanillic acid), flavonoids (isorhamnetin, kaempferol, quercetin, apigenin, luteolin, chrysin, pinobanskin, rutin)와 같은 페놀성 화합물들이 주로 알려져 있다(Gasi´c et al., 2014; Can et al., 2015). 또한 벌꿀의 독특한 향기에 관련된 휘발성 화합물(volatile compounds)인 nonanal, decanal, linalool, benzaldehyde, dimethyl sulphide, furfural, phenylacetaldehyde, isophorone, cetoisophorone, phenylacetaldehyde 등이 GC/MS로 분석하여 보고되었다(Castro-Várquez et al., 2006; Castro-Várquez et al., 2009; Wardencki et al., 2009; Bayraktar and Onogur, 2011). 이외에도 Truchado 등(Truchado et al., 2009)은 밤꿀로부터 quinoline alkaloids(kynurenic acid, 4-quinolone-2-carboxylic acid)를 분리하여 보고하였으며, 화상치료에 사용하는 뉴질랜드 마누카꿀로부터 methylglyoxal, methyl syringate 등이 분리되었다(Kato et al., 2012). 벌꿀의 성분 연구는 주로 유럽, 뉴질랜드, 남미 등에서 활발히 이루어진 반면, 국내에서는 식품공전 규격(KFDA, 2014)에 따라 당, 수분, HMF(hydroxymethylfurfural) 함량 등을 측정한 벌꿀의 품질 평가와 비타민 및 무기질 함량 등에 대한 연구가 전부인 실정이다(Jung et al., 2011; Kim et al., 2014; Paik et al., 2014).
따라서 본 연구에서는 우리나라에서 전체 꿀 생산량의 70% 이상을 차지하는 아카시아나무 꿀의 밀원식물 유래 성분을 분리하고, 분리한 물질에 대한 화학적 구조을 동정하였다. 이러한 연구결과는 국산 아카시아나무 꿀을 건강기능식품이나 천연물신약의 신소재로 개발 할 경우 품질 관리를 위한 지표로 활용이 가능할 것으로 기대한다.
재료 및 방법
공시시료
한국양봉농협(안성)으로부터 2014년 경기지역에서 채밀한 아카시아나무 꿀을 구입하여 사용하였다. 시험에 사용한 아카시아나무 꿀의 수분함량, 전화당함량, 자당함량, 산도, HMF함량, 탄소 동위원소비 등 식품공전(KFDA, 2014) 벌꿀 기준규격에 적합한 꿀만을 시험에 사용하였다(자료 미제시).
기기 및 시약
NMR spectrometer(JEOL, Japan)는 JNM-ECA600을 이용하여 측정하였으며, mass spectrometer(Shimadzu, Japan)는 LCMS-IT-TOF를 사용하였다. 교반기(HS-30D, 대한과학)를 사용하여 시료를 추출하였으며, 시료 추출에 사용한 ethyl acetate 및 methanol 등 유기용매는 SK chemical(Korea)사로부터 구입하여 사용하였다. 성분분리에 사용한 TLC plate(layer thickness 0.25mm, 20×20cm, Merck Art. No. 5715) 및 silica gel(40-63μm, Art. No. 9385)은 Merck(Germany), ODS-A(75μm)는 YMC(Japan), NMR 측정용 용매는 Cambridge Isotope Laboratories(USA)에서 구입하여 사용하였다.
추출 및 분리
국내산 아카시아나무 꿀 15 kg에 ethyl acetate(꿀 1kg 당 2L)를 넣고 교반기를 사용하여 30분간 3회 반복 추출한 후 감압농축기를 사용하여 추출용매를 제거하고 ethyl acetate 추출물 13g을 수득하였다. 얻어진 추출물 13g을 ODS로 충진된 컬럼(5×60cm)에 넣고 전개용매를 20% methanol에서 100% methanol의 기울기 조건으로 용출시킨 후 TLC를 실시하여 화합물의 극성이 유사한 8개의 소분획(AHF1∼8)을 얻었다. 이 중 AHF5 분획을 silica gel이 충진된 컬럼(1.5×50cm)에 methylene chloride:methanol:water=90:15:10(하층)를 이 동상으로 하여 화합물 1(16.8mg)을 분리하였다.
시료 전처리 및 UPLC 분석 조건
부피플라스크를 이용하여 아카시아나무 꿀 ethylacetate 추출물에 메탄올을 넣어 20mg/mL의 농도로 30분간 초음파를 이용하여 추출한 후, 0.2μm PTFE 필터를 사용하여 여과하였다. 분석 기기는 PDA(photodiode array, Waters, USA)검출기가 장착된 Acquity UPLC I-Class(Waters, USA)를 사용하였다. 컬럼은 BEH C18(50×2.1mm, 1.7μm, Waters, USA)을 사용하여 흐름속도 0.5mL/min, 주입량 2.0μl, 컬럼오븐 온도 40°C에서 260nm의 검출파장으로 설정하였으며, 이 동상은 (A)MeCN, (B)0.1% H3PO4의 용매를 (A)5%;0-2min, (A)5-35%;2-12 min로 설정하였다(Table 1).
결과 및 고찰
국산 아카시아나무 꿀 내 밀원 식물로부터 유래된 물질을 분리하고자 ethyl acetate로 추출한 후 컬럼 크로마토그래피를 실시하여 화합물 1을 분리하였으며, NMR assignment는Table 2에 나타냈다.
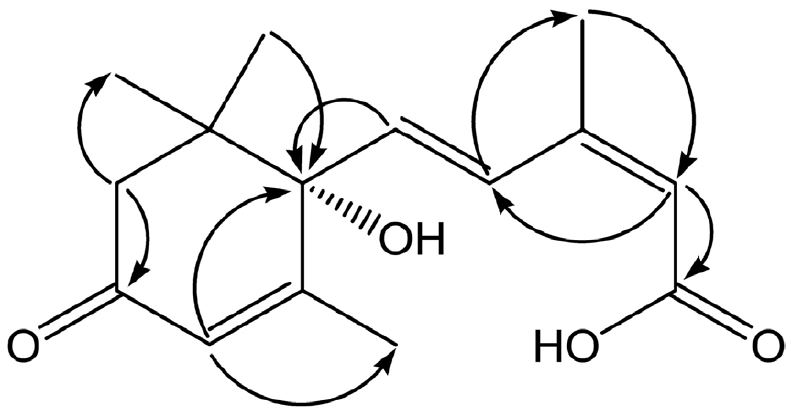
화합물 1은 흰색의 가루로서 1H-NMR spectrum으로부터 δ 0.92, 0.96, 1.82 및 1.97에서 4개의 methyl기에 의한 singlet signal이 관찰되었으며, δ 6.22과 7.73에서 doublet으로 나타나는 olefinic proton signal을 관찰할 수 있었고, coupling constant 값이 15.8 Hz로 trans form임을 알 수 있었다. 13C-NMR spectrum으로부터 δ 125.9, 127.3, 137.1 및 148.8에서 olefinic carbon signals, δ 167.0 및 197.2에서 2개의 carbonyl signals, δ 18.8, 20.8, 23.2 및 24.1에서 methyl carbon signals를 포함한 총 15개의 carbon signals를 관찰할 수 있었다. 또한, DEPT 90 and 135 spectra로부터 6개의 quaternary carbon, 4개의 methine carbon, 1개의 methylene carbon 및 4개의 methyl carbon signals를 확인하였으며, 1H- 및 13C-NMR data을 통하여 sesquiterpene류 화합물일 것이라 추정하였다. 보다 더 정확한 구조를 확인하기 위하여 2D-NMR을 측정한 결과, HMQC spectrum에서 δH 2.11(1H, d, J=16.5 Hz) 및 δ 2.53(1H, d, J=16.5 Hz)의 proton signals는 δC 49.3의 methylene carbon과 correlation 하는 것을 알 수 있었으며, HMBC spectrum로부터 δH 5.67(1H, s)의 olefinic proton signal과 δH 5.81(1H, s)의 sp2 carbon proton signal은 각각 δC 167.0의 carbonyl carbon과 δC 78.3(oxygenated methine carbon) 및 18.8(methyl carbon)에 나타난 signals와 correlation하고 있는 것으로 확인되었다(Fig. 1).
또한, ESI-MS spectrum에서 m/z 264.1 [M+H]+ 의 분자량과 1D- 및 2D-NMR 데이터를 기존문헌에 보고된 바와 비교하여 화합물 1은 분자식 C15H20O4인 (+)-abscisic acid로 동정하였다(Milborrow, 1984; Kato-Noguchi et al., 2002). Abscisic acid는 sesquiterpene류 식물호르몬으로써 주로 식물가뭄에 대한 저항성을 높여주는 역할을 하고 식물의 대사과정 중 기공개폐의 조절, 개화, 구근의 발아억제, 측아의 성장저해 등에 관여하는 것으로 알려져 있으며, 체내에서는 포도당 항상성(glucose homeostasis)을 조절하며(Ameri et al., 2015), 인간 호중구(neutrophils)에서 superoxide anion의 발생과 elastase의 활성을 저해시켜 항염효과를 나타낸다(Leu et al., 2012). Abscisic acid는 바나나, 사과, 딸기 등과 같은 과일류, 양배추, 감자, 토마토 등과 같은 야채류에서 발견되며(Lee et al., 2014; Dong et al., 2015), 호주 및 뉴질랜드산 마누카꿀(Yao et al., 2003), 세르비아 잡화꿀(Gasi´c; et al., 2014)에 주요성분으로 알려져 있다. 이에 UPLC-PDA를 이용하여 국산 아카시아나무 꿀 내 abscisic acid의 정성분석을 실시하였다. 그 결과, Fig. 2의 UPLC chromatogram에서 retention time(tr) 7.63분에 검출된 피크는 260nm에서 강한 흡수를 보이는 특이 성분으로 확인되어 지표성분으로 설정 가능한 화합물일 것이라 사료되었다. 식물호르몬인 abscisic acid는 꿀벌이 밀원식물의 꽃꿀을 수집하는 과정에서 벌꿀내로 유입되었을 가능성을 시사한다. 본 연구에서는 국내 양봉농가에서 채밀한 아카시아 꿀로부터 column chromatography를 이용하여abscisic acid를 단리하고 구조를 동정한 후, 처음으로 보고하는 바이다.
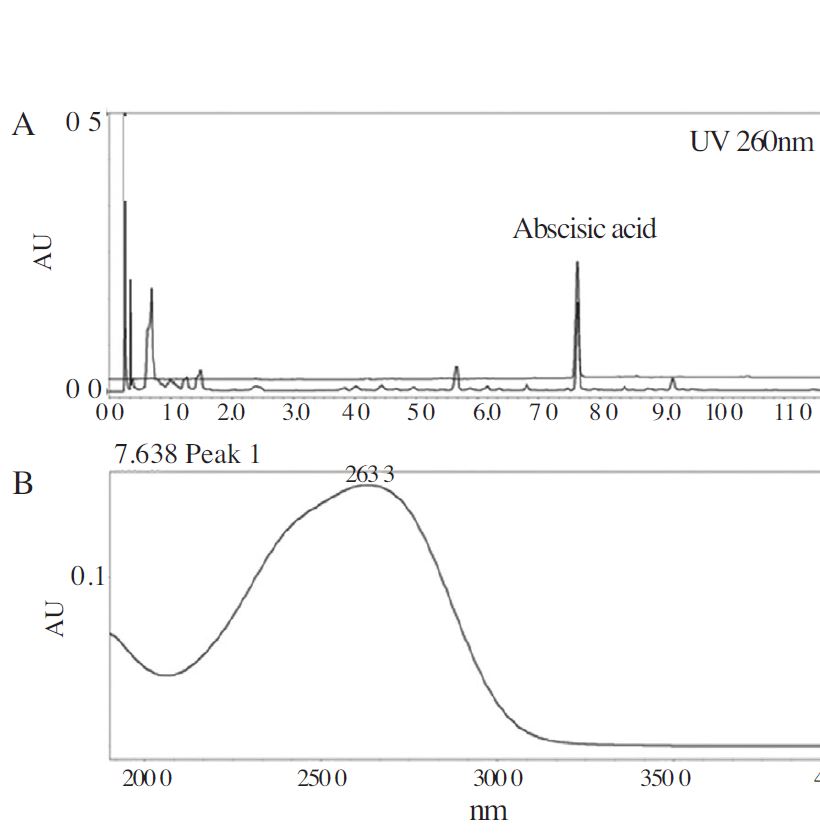
Typical chromatogram of ethyl acetate extract of Korean acacia honey (A) and UV spectrum of abscisic acid (B) .
적 요
국내에서 채밀한 아카시아나무 꿀의 밀원으로부터 유래된 구성 성분을 탐색하고 그 구조를 확인하고자 아카시아나무 꿀을 ethyl acetate로 추출한 후, 그 추출물을 ODS 및 silica gel을 이용한 column chromatography를 실시하여 주요성분으로 확인되는 1종의 화합물을 분리하였다. 단리된 화합물은 1D-NMR, 2D-NMR 및 ESI-MS와 같은 이화학적인 분석방법을 통하여 (+)-abscisic acid로 동정하였다. 국내에서 채밀한 아카시아나무 꿀에서 식물로부터 유래된 물질 abscisic acid 성분이 확인된 것은 최초이며, 꿀벌이 아카시나무로부터 밀원을 수집 했을 경유에 유래되는 물질로 사료된다. 따라서, 향후 아카시아나무 꿀의 품질관리 및 지표 물질로 abscisic acid 성분의 활용이 가능할 것으로 사료된다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 공동연구국책기술개발사업(과제번호: PJ01083701)의 지원에 의해 수행된 결과입니다.
Reference
-
Ameri, P., S. Bruzzone, E. Mannino, G. Sociali, G. Andraghetti, A. Salis, M. L. Ponta, L. Briatore, G. F. Adami, A. Ferraiolo, P. L. Venturini, D. Maggi, R. Cordera, G. Murialdo, and E. Zocchi, (2015), Impaired increase of plasma abscisic Acid in response to oral glucose load in type 2 diabetes and in gestational diabetes, PLoS One, 10, e0115992.
[https://doi.org/10.1371/journal.pone.0115992]

-
Bayraktar, D., and T. A. Onogur, (2011), Investigation of the aroma impact volatiles in Turkish pine honey samples produced in Marmaris, Datça and Fethiye regions by SPME/GC/MS technique, Int. J. Food Sci. Technol, 46, p1060-1065.
[https://doi.org/10.1111/j.1365-2621.2011.02588.x]

-
Can, Z., O. Yildiz, H. Sahin, E. A. Turumtay, S. Silici, and S. Kolayli, (2015), An investigation of Turkish honeys: their physico chemical properties, antioxidant capacities and phenolic profiles, Food Chem, 180, p133-141.
[https://doi.org/10.1016/j.foodchem.2015.02.024]

-
Castro Várquez, L. M., M. C. Díaz Maroto, E. Guchu, and M. S. Pérez Coello, (2006), Analysis of volatile compounds of eucalypt honey by solid phase extraction followed by gas chromatography coupled to mass spectrometry, Eur. Food Res. Technol, 224, p27-31.
[https://doi.org/10.1007/s00217-006-0284-2]

-
Castro Várquez, L., M. C. Díaz Maroto, M. A. González Viñas, and M. S. Pérez Coello, (2009), Differentiation of monofloral citrus, rosemary, eucalyptus, lavender, thyme and heather honeys based on volatile composition and sensory descriptive analysis, Food Chem, 112, p1022-1030.
[https://doi.org/10.1016/j.foodchem.2008.06.036]

- Chang, H. G., M. K. Han, and J. G. Kim, (1988), The Chemical Composition of Korean Honey, Korean J. Food Sci. Technol, 20, p631-636.
-
Dong, T., Y. Park, and I. Hwang, (2015), Abscisic acid: biosynthesis, inactivation, homoeostasis and signalling, Essays Biochem, 58, p29-48.
[https://doi.org/10.1042/bse0580029]

-
Gasi´c, U., S. Keckes, D. Dabic, J. Trifkovi´c, D. Milojkovi´c Opsenica, M. Nati´c, and Z. Tesi´c, (2014), Phenolic profile and antioxidant activity of Serbian polyfloral honeys, Food Chem, 145, p599-607.
[https://doi.org/10.1016/j.foodchem.2013.08.088]

- Israili, Z. H., (2014), Antimicrobial properties of honey, Am. J. Ther, 21, p304-323.
-
Jung, M. E., C. J. Kim, H. D. Paik, J. W. Oh, and S. K. Lee, (2011), Comparision of Mineral, Hydroxy Methyl Furfural Content and SDS PAGE Pattern of Proteins in Different Honeys, Korean J. Food Sci. Ani. Resour, 31, p241-249.
[https://doi.org/10.5851/kosfa.2011.31.2.241]

-
Kato Noguchi, H., Y. Tanaka, T. Murakami, S. Yamamura, and S. Fujihara, (2002), Isolation and identification of an allelopathic substance from peel of Citrus junos, Phytochemistry, 61, p849-853.
[https://doi.org/10.1016/S0031-9422(02)00382-5]

-
Kato, Y., N. Umeda, A. Maeda, D. Matsumoto, N. Kitamoto, and H. Kikuzaki, (2012), Identification of a novel glycoside, leptosin, as a chemical marker of manuka honey, J. Agric. Food Chem, 60, p3418-3423.
[https://doi.org/10.1021/jf300068w]

- KFDA, (2014), Korean food standards codex, Korea Food & Drug Administration, p.5 29 7.
- Kim, E. S., and C. O. Lee, (1996), Comparison of Quality Attributes of Korean Native Bee Honey and Foreign Bee Honey by K/Na Ratio, J. Korean Soc. Food Sci. Nutr, 25, p672-679.
- Kim, J. Y., H. Y. Song, J. A. Moon, M. H. Shin, and S. H. Baek, (2014), Quality Properties of Honey in Korean Commercial Markets, Korean J. Food Sci. Technol, 46, p432-437.
-
Lee, J. H., (2014), ABA Signal Transduction Pathway in Plants: ABA Transport, Perception, Signaling and Post Translational Modification, Journal of Life Science, 24, p196-208.
[https://doi.org/10.5352/JLS.2014.24.2.196]

-
Leu, Y. L., T. L. Hwang, P. C. Kuo, K. P. Liou, B. S. Huang, and G. F. Chen, (2012), Constituents from Vigna vexillata and their anti inflammatory activity, Int. J. Mol. Sci, 13, p9754-9768.
[https://doi.org/10.3390/ijms13089754]

-
Milborrow, B. V., (1984), The conformation of abscisic acid by n.m.r. and a revision of the proposed mechanism for cyclization during its biosynthesis, Biochem J, 220, p325-332.
[https://doi.org/10.1042/bj2200325]

- Paik, W. K., A. K. Kwak, M. L. Lee, and H. S. Sim, (2014), Studies on the Chemical Characteristics of Jujube (Zizyphus jujube var. inermis) and Snowbell (Styrax japonica) Honey Produced in Korea, J. Apic, 29, p125-135.
-
Truchado, P., I. Martos, L. Bortolotti, A. G. Sabatini, F. Ferreres, and F. A. Tomas Barberan, (2009), Use of quinoline alkaloids as markers of the floral origin of chestnut honey, J. Agric. Food Chem, 57, p5680-5686.
[https://doi.org/10.1021/jf900766v]

- Wardencki, W., T. Chmiel, T. Dymerski, P. Biernacka, and B. Plutowska, (2009), Application of gas chromatography, mass spectrometry and olfactometry for quality assessment of selected food products, Ecol. Chem. Eng, 16, p287-300.
-
Yao, L., N. Datta, F. A. Tomás Barberán, F. Ferreres, I. Martos, and R. Singanusong, (2003), Flavonoids, phenolic acids and abscisic acid in Australian and New Zealand Leptospermum honeys, Food Chem, 81, p159-168.
[https://doi.org/10.1016/S0308-8146(02)00388-6]