국산 아카시나무(Robinia pseudoacacia) 벌꿀로부터 분리한 Abscisic acid의 생리활성
Abstract
Pathogenic effects associated with Helicobacter pylori infection include peptic ulcer. Eradication of H. pylori by triple therapy often results in emerging resistance of H. pylori. Thus there is a need to seek alternative treatments. The aim of this study was to estimate abscisic acid (ABA) isolated from honey of Black Locust (Robinia pseudoacacia) in Korea. The anti-H. pylori activity of ABA was the minimun inhibitory concentrations (MIC), minimum bactericidal concentration (MBC), and postantibiotic effect (PAE). The MIC and MBC of ABA were 2.7±1.3μg/ml and 6.9±1.3μg/ml, respectively. The PAE of ABA was highest at 32×MIC concentrations for 8.5 hr. We determined that ABA may be the potential lead phytochemical constituents with anti-H. pylori activity. The acacia honey in Korea could be useful chemopreventive agents for peptic ulcer in H. pylori-infected individuals
Keywords:
Black Locust honey, Abscisic acid, Helicobacter pylori, Antibacterial서 론
벌꿀은 예로부터 천연 감미료로 이용했을 뿐만 아니라 풍부한 영양학적 기능과 의약적 효능으로 한방과 민간요법으로도 사용되고 있다. 탄수화물이 주성분인 벌꿀은 과당 및 포도당을 포함한 당류(70~80%), 수분(18~20%), 단백질, 아미노산, 미네랄, 유기화합물 등으로 구성되어 있다(Chang et al., 1988). 벌꿀은 밀원에서 유래된 유기화합물에 따라 항균, 항산화, 프로바이틱(prebiotic) 및 피부 보습 등 다양한 생리활성을 나타내는 것으로 알려져 있다(Truchado et al., 2009; Israili, 2014; Can et al., 2015). 밀원에 따라 아카시아꿀, 밤꿀, 마누카꿀, 유채꿀, 메밀꿀 등으로 나뉘며 색, 향기, 맛 등이 각기 다르며, 이들 밀원의 토양 등 서식환경에 따라서도 다르게 나타난다(Kim and Lee, 1996). 지금까지 알려진 벌꿀의 유기화합물은 phenolic acids (caffeic acid, gallic acid, cinnamic acid, protocatechuic acid, p-coumaric acid, chlorogenic acid, 4-hydroxybenzoic acid, vanillic acid), flavonoids (isorhamnetin, kaempferol, quercetin, apigenin, luteolin, chrysin, pinobanskin, rutin)와 같은 페놀성 화합물들이 주로 알려져 있다(Gasić; et al., 2014; Can et al., 2015). 뉴질랜드 마누카꿀로부터 분리된 methylglyoxal, methyl syringate 등은 항균활성 물질로 가장 널리 알려진 성분이다(Kato et al., 2012). 또한 벌꿀의 항산화 효능은 밤꿀의 quinoline alkaloids(kynurenic acid, -2-carboxylic acid) 성분, 세리비아의 잡화꿀과 크로아티아의 버드나무꿀에서 분리한 abscisic acid (ABA) 성분에서 기인한다고 보고하였다(Truchado et al., 2009). 주로 토마토, 감자, 양배추와 같은 채소에서 확인되는 ABA는 식물호르몬으로서 식물의 대사과정 중 기공개폐의 조절, 개화, 구근의 발아억제, 측아의 성장저해 등에 관여하는 것으로 알려져 있다(Lee et al., 2014; Dong et al., 2015). 그러나 아직까지 국내에서 생산되는 벌꿀에서 ABA에 대한 성분 분석에 대한 보고는 없었다. 또한 ABA는 체내에서 포도당 항상성(glucose homeostasis)을 조절하며(Ameri et al., 2015), 인간 호중구(neutrophils)에서 superoxide anion의 발생과 elastase의 활성을 저해시켜 항염효과를 나타낸다고도 알려져 있다(Leu et al., 2012).
최근, 국내에서도 벌꿀의 생리활성과 함께 성분에 대한 연구가 활발히 진행되고 있다. 따라서, 본 연구에서는 국내 소비자 기호에 가장 적합한 향과 맛을 갖고 있는 아카시아벌꿀의 항균력을 검정하고자 하였다. 본 연구진에서는 아카시아꿀이 Helicobacter pylori에 대한 항균효과를 갖고 있는 것으로 확인하였으며, 아카시아꿀에서 ABA 성분을 분리하고 동정한 바 있다(Kim et al., 2015). 그람음성균인 H. pylori는 위궤양 환자의 위장관벽에서 처음 발견된 이후 만성위염, 웨궤양 및 위암의 원인균으로 밝혀졌으며, 항생제를 이용하여 균을 제거하면 궤양 증세도 치유되는 것으로 보고되어 있다(Goodwin & Armstron 1990; Torres et al., 2000; Kusters et al., 2006). 따라서 H. pylori에 대한 예방 및 치료의 중요성이 매우 크다고 할 수 있으나, 기존 항생제에 대한 내성균의 출현, 어린아이들에서의 감염에 대한 적용의 어려움 등 항생제를 이용한 치료가 부적절하다는 문제가 야기되고 있다(Romano et al., 2008). 이러한 문제를 극복하기 위하여 우수한 항균활성을 갖는 천연물을 중심으로 H. pylori에 대한 항균활성을 갖는 성분을 탐색하고자 하는 연구가 활발하다.
본 연구에서는 H. pylori에 감수성이 있는 것으로 확인된 아카시아꿀로부터 분리한 ABA의 H. pylori에 대한 항균력을 검정하고자 하였다.
재료 및 방법
공시시료
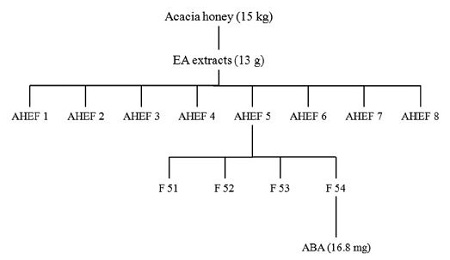
시험에 사용한 시료는 Fig. 1과 같이 2014년 채밀한 아카시아벌꿀로부터 H. pylori에 대해 항균력이 가장 강한 분획을 얻어ABA를 분리 정제하여 시험에 사용하였다. 국내산 아카시아꿀 15kg에 ethyl acetate를 넣고 교반기를 사용하여 30분간 3회 반복 추출한 후 감압농축기를 사용하여 추출용매를 제거하고 ethyl acetate 추출물 13g을 수득하였다. 얻어진 추출물 13g을 ODS로 충진된 컬럼(5×60cm)에 넣고 전개용매를 20% methanol에서 100% methanol의 기울기 조건으로 용출시킨 후 TLC를 실시하여 화합물의 극성이 유사한 8개의 소분획(AHF1∼8)을 얻었다. 이 중 AHF5 분획을 silica gel이 충진된 컬럼(1.5×50cm)에 methylene chloride:methanol:water=90:15:10(하층)를 이동상으로 하여 화합물 1(16.8mg)을 분리하였다(Kim et al., 2015). 분리한 화합물 I의 순도 확인을 위해 UPLC를 실시한 결과 단일 peak를 보였으며, 단일물질인지 확인해 보기 위해 LC-ESI-mass spectrum을 통해 분자량을 측정하였으며, 순수한 단일물질로 분리되었음을 확인할 수 있었다 (Kim et al., 2015).
H. pylori 배양
위 및 십이지장 궤양 원인균인 H. pylori(ATCC 43526) 한국미생물보존센터(KCCM, 서울)로부터 구입하여 사용하였다. 균의 배양은 5% horse serum(MB cell, 서울)을 첨가한 Trypticase soy broth(TSB, BD, Franklin Lakes NJ, 미국) 배지를 사용하여 미호기 조건을 유지하기 위하여 Anaerobe Container System(BD)를 넣은 chamber에서 37°C 조건으로 배양하였다.
Non-peroxide 반응
벌꿀의 항균작용은 삼투(Osmotic effect), 강산(Acidity), 그리고 과산화수소(Hydrogen peroxide)에 기인하는 것으로 알려져 있다(Molan, 1992). 그러나 벌꿀을 이용하여 식의약소재로 사용하게 될 경우엔 당에 의한 삼투효과 및 산에 의한 항균력은 벌꿀의 희석에 의해 기대하기 어렵다. 벌꿀의 희석 후에도 항균력을 유지할 수 있는 방법은 벌꿀 내 존재하는 항균성분 또는 과산화수소 반응에 의한 것이다. 따라서 본 연구에서는 아카시아벌꿀의 항 H. pylori 효과가 벌꿀 내 존재하는 항균성분인지 과산화수소반응에 의한 것인지를 알아보고자 non-peroxide 반응 후 항균력을 측정하였다. Non-peroxide 반응은 catalase(Sigma-Aldrich, MO, 미국)을 이용하였다. Catalase 반응액은 5600U/ml 조제한 후 최종 농도가 25%(w/v)가 되도록 아카시아꿀에 첨가하였다(Molan, 1992).
항균 활성 분석
아카시아꿀 용매분획 추출물에 대한 H. pylori 항균력 검정은 디스크 확산법을 이용하였다(Spooner & Sykes 1972; National Committee for Clinical Laboratory Standards 1992). 시험 하루 전에 H. pylori를 전 배양 한 후 1×107cells/mL의 농도로 조정 하여 TSA(BD)배지에 100μL를 분주하여 멸균 유리봉으로 도말한다. 멸균된 paper disc(8mm, Advantec, 일본)에 프로폴리스 시료 30μL(1μg/ml stock in 20% DMSO)를 흡수시킨 후 용매가 모두 휘발 된 다음에 도말한 배지 위에 올린다. Anaerobe Container System을 넣은 chamber서 37°C 조건으로 16시간 배양한 다음 디스크 주위의 생육 저지환(clear zone) 크기를 측정한다.
최소성장억제농도(Minimun Inhibitory Concentration, MIC) 측정
액체배지 희석법을 사용하여 H. pylori에 대한 최저 성장억제농도를 구하였다. 아카시아꿀과 ABA시료는 멸균 증류수로 희석한 후 무균 여과하여 액체배지 희석법에 준하여 단계적으로 희석하였다(Wu and Hancock, 1999). 각각의 시험균주를 액체배지에서 전 배양한 후 접종 균의 2×106 CFU/well이 되도록 조절하여 ABA 시료와 함께 18시간 동안 배양한 후, 육안 및 현미경으로 균의 성장을 관찰하였고, 흡수파장 540nm에서 흡광도 (Molecular device spectramax M2e, 캐나다)를 측정하여 순수배양액의 흡광도 값과 같은 결과를 얻은 것을 최소억제농도로 결정하였다.
최소살균농도(Minimum Bactericidal Concentration, MBC)
ABA 시료를 시험균주에서 사용하는 액체배지로 희석한 후 액체배지희석법에 따라 단계적으로 희석한 후 2×106 CFU/well이 되도록 조절한 H. pylori 균주에 접종하여 24시간 동안 배양하였다. 각각의 배양액 100μl를 새로운 배지에 접종하여 24시간 동안 배양한 다음 흡광도 (540nm)를 측정하여 증식이 일어나지 않은 농도를 최소살균농도로 나타내었다(Holla et al., 2012).
항균력 지속 시간(Postantibiotic effect, PAE) 측정
시험균주에 대한 ABA의 살균력 지속시간을 측정하기 위하여 1×108 CFU/ml로 조절한 균주에 1, 2, 4, 8, 16 그리고 32×MIC값 농도로 각각 ABA와 함께 1시간 동안 배양한 후 원심분리와 배지 희석법을 사용하여 ABA 성분을 제거하였다(Lowdin et al., 1993) 이후 새로운 배지로 교환하여 배양기에서 배양하며 2시간 <B374><간격으로 균수를 측정하였다. 이때 PAE 수치가 클수록 항균 지속 효과가 우수하다고 할 수 있으며, PAE를 구하는 식은 아래와 같다.
PAE=T-C
T: ABA를 처리한 시험구에서 1 log10까지의 생육에 걸리는 시간
C: 무처리구에서 1 log10까지의 생육에 걸리는 시간
결과 및 고찰
H. pylori에 대한 ABA의 항균효과
H. pylori와 같은 병원성 세균에 의한 질병 치료에 있어 항생제의 오남용으로 인한 내성균주 출현은 의약적으로 매우 큰 문제를 야기한다. 이러한 문제를 줄일 수 있는 방안으로 기존항생제를 대체할 수 있는 천연항생제 개발에 대한 요구가 증가하고 있다(Kusters et al., 2006; Romano et al., 2008). 천연물질인 벌꿀, 프로폴리스, 봉독 등과 같은 양봉산물은 비 항생제로 병원성 세균 감염 예방과 치료제로 접근이 시도되고 있다. 벌꿀은 의료용 소재로서 뉴질랜드, 남미, 유럽국가에서 사용되고 있으며, 다양한 밀원으로부터 채집되는 벌꿀은 밀원과 지역 등 조건에 따라 성분이 달라짐에 따라 항균효과에 차이를 보이는 것으로 알려져 있다(Kato et al., 2012; Gasić et al., 2014; Can et al., 2015). 그러나 국내에서 채집되는 벌꿀에 대한 성분 연구는 미흡한 실정이다. 최근 국내 양봉농가에서 채집한 아카시아꿀이 H. pylori에 대해 항균력을 갖고 있는 것으로 확인되었으며 밀원에서 유래된 것으로 예측되는 ABA 성분을 분리 동정하였다(Kim et al., 2015).
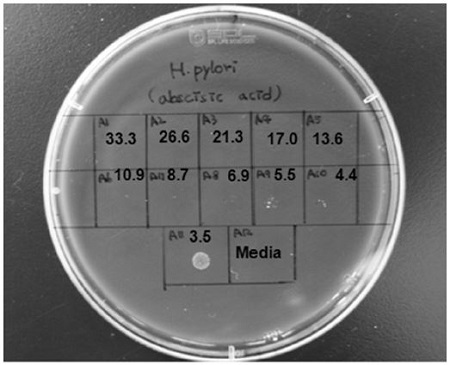
본 연구에서는 국내에서 생산되는 아카시아꿀에 대한 H. pylori 항균활성을 측정하여 천연항생제 소재로서의 사용 가능성을 검토하였다. Table 1에서 아카시아꿀과 non-peroxide 아카시아꿀 그리고 용매 분획물의 H. pylori 항균활성을 측정하였다. 아카시아꿀은 물론 non-peroxide 아카시아꿀에서도 H. pylori에 대한 항균력을 갖고 있어 당류에 의한 항균작용 뿐만 아니라 항균력에 관여하는 성분이 존재하는 것으로 추정할 수 있었다. 비극성에서 극성 용매 순으로 아카시아꿀을 추출하여 H. pylori에 대한 항균력을 측정한 결과 에틸아세테이트 추출물에서 가장 효과적 이였다(Table 1). 에틸아세테이트 추출물을 8개의 분획으로 나누어 항균력을 측정하고 그 중에서 가장 높은 항균력을 보인 AHEF 5 분획물을 다시 4개의 분획으로 나누어 4번째 분획인 F 54에서 10%의 농도에서 저지환이 20mm 이상으로 확인되었다. ABA는 가장 높은 항균력을 보인 F 54로부터 분리 정제되었다.
ABA의 H. pylori에 대한 최소성장억제농도 및 최소 살균농도
ABA의 최소성장억제농도는 흡광도를 이용하여 측정하였으며, 최소살균농도는 고체배지에 배양하여 균이 자라지 않는 최저농도로 하였다. 그 결과 Table 2에서 보는 바와 같이 ABA의 최소성장억제농도는 2.7±1.3μg/ml로 양성대조구로 사용한 amoxicillin 보다 H. pylori에 대해 낮은 농도에서도 균의 성장을 억제하는 것으로 확인되었다. 최소살균농도 역시 6.9±1.9μg/ml 농도 이하에서도 H. pylori 균을 사멸시키는 것으로 확인되었다(Fig. 2). 이러한 결과들로 미루어 국내에서 채집되는 아카시아꿀 성분 중에 하나인 ABA는 H. pylori에 대한 항균효과에 관여하는 성분으로 사료되었다.
ABA의 항균력 지속시간
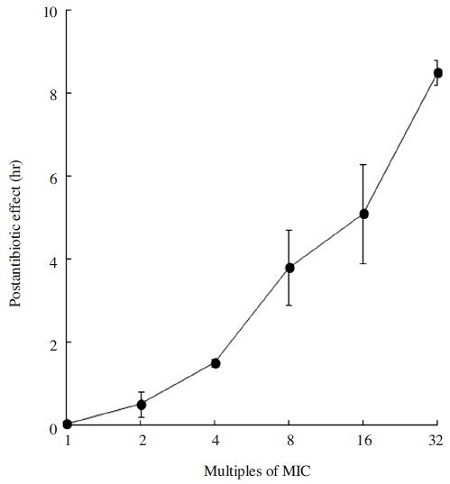
H. pylori균에 대한 ABA의 항균력 지속시간(PAE)을 측정하였다. ABA 제거 후 2시간 간격으로 균수를 측정한 결과 Fig. 2와 같이 H. pylori균에 대해 우수한 항균력 지속 활성을 가지는 것으로 확인 할 수 있었다. PAE 수치가 클수록 항균력 지속 효과가 우수한 것으로 8×MIC ABA 농도로 처리했을 경우 3.8 시간, 32×MIC에서는 8.5시간으로 우수한 항균력 지속시간을 갖고 있었다.
이처럼 만성위염, 위궤양 및 위암의 원인균인 H. pylori균에 대해 강한 항균력과 항균력 지속시간이 길은ABA는 천연물질로서 기존의 화학제를 대체 할 가능성이 매우 높은 것으로 판단되었다. 무엇보다도 벌꿀은 비타민과 무기물이 풍부한 천연감미료로서 다양한 식품 소재로 사용할 경우 만성위염이나 위궤양의 효과적인 예방 및 치료효과를 나타낼 것으로 사료된다. 앞으로 국내에서 생산되는 아카시아벌꿀에 대한 다양한 효능 구명과 함께 생리활성을 갖는 성분에 대한 연구가 더 많이 이루어져야 할 것이다.
적 요
국내에서 채밀한 아카시아꿀의 밀원으로부터 유래된 ABA 성분을 분리 동정하여 만성위염과 위궤양 등의 원인균으로 알려진 H. pylori균에 대한 항균효과를 측정하였다. 항균력은 최소성장억제농도와 최소살균농도 그리고 항균력 지속시간으로 측정하였다. ABA의 최소성장억제농도는 2.7±1.3μg/ml, 최소살균농도는 6.9±1.3μg/ml로 강한 항균력을 갖고 있는 것으로 확인되었다. 항균력 지속시간에 있어서도 8×MIC ABA 농도로 처리했을 경우 3.8 시간, 32×MIC에서는 8.5시간으로 우수한 항균력 지속시간을 갖고 있었다. 국내에서 최초로 확인된 아카시아나무 꿀에서 식물로부터 유래된 물질 ABA는 H. pylori균에 강한 항균력 뿐만 항균력 지속시간이 우수한 성분으로 확인되었다. 따라서, 향후 아카시아나무 꿀의 품질관리 및 지표 물질로 ABA 성분의 활용이 가능하며, 위궤양 및 위염 예방에 효과적인 다양한 식품 소재로 아카시아꿀이 활용될 수 있을 것으로 사료된다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 공동연구 국책기술개발사업(과제번호: PJ01083701)의 지원에 의해 수행된 결과입니다.
References
-
Ameri, P., S. Bruzzone, E. Mannino, G. Sociali, G. Andraghetti, A. Salis, M.L. Ponta, L. Briatore, G.F. Adami, A. Ferraiolo, P.L. Venturini, D. Maggi, R. Cordera, G. Murialdo, and E. Zocchi, (2015), Impaired increase of plasma abscisic Acid in response to oral glucose load in type 2 diabetes and in gestational diabetes, PLoS One, 10, e0115992.
[https://doi.org/10.1371/journal.pone.0115992]

-
Can, Z., O. Yildiz, H. Sahin, E.A. Turumtay, S. Silici, and S. Kolayli, (2015), An investigation of Turkish honeys: their physico-chemical properties, antioxidant capacities and phenolic profiles, Food Chem, 180, p133-141.
[https://doi.org/10.1016/j.foodchem.2015.02.024]

- Chang, H.G., M.K. Han, and J.G. Kim, (1988), The Chemical Composition of Korean Honey, Korean J. Food Sci. Technol, 20, p631-636.
-
Dong, T., Y. Park, and I. Hwang, (2015), Abscisic acid: biosynthesis, inactivation, homoeostasis and signalling, Essays Biochem, 58, p29-48.
[https://doi.org/10.1042/bse0580029]

-
Gasić, U., S. Keckes, D. Dabić, J. Trifković, D. Milojković-Opsenica, M. Natić, and Z. Tesić, (2014), Phenolic profile and antioxidant activity of Serbian polyfloral honeys, Food Chem, 145, p599-607.
[https://doi.org/10.1016/j.foodchem.2013.08.088]

-
Goodwin, C.S., and J.A. Armstron, (1990), Microbiological aspects of Helicobacter pylori (Campylobacter pylori), Eur. J. Clin. Microbiol. Infect. Dis, 9, p1-13.
[https://doi.org/10.1007/BF01969526]

-
Holla, G., R. Yeluri, and A.K. Munshi, (2012), Evaluation of minimum inhibitory and minimum bactericidal concentration of nano-silver base inorganic anti-microbial agent (NovaronⓇ) against streptococcus mutans, Contemp. Clin. Dent, 3, p288-293.
[https://doi.org/10.4103/0976-237X.103620]

- Israili, Z.H., (2014), Antimicrobial properties of honey, Am. J. Ther, 21, p304-323.
-
Kato, Y., N. Umeda, A. Maeda, D. Matsumoto, N. Kitamoto, and H. Kikuzaki, (2012), Identification of a novel glycoside, leptosin, as a chemical marker of manuka honey, J. Agric. Food Chem, 60, p3418-3423.
[https://doi.org/10.1021/jf300068w]

- Kim, E.S., and C.O. Lee, (1996), Comparison of Quality Attributes of Korean Native-Bee Honey and Foreign-Bee Honey by K/Na Ratio, J. Korean Soc. Food Sci. Nutr, 25, p672-679.
- Kim, S.G., I.P. Hong, S.O. Woo, H.J. Jung, H.R. Jang, and S.M. Han, (2015), Iosolation of Abscise Acid from Honey of Black Locust (Robinia pseudoacacia) in Korea, J. Api, 30, p287-292.
-
Kusters, J.G., A.H. van Vliet, and E.J. Kuipers, (2006), Pathogenesis of Helicobacter pylori infection, Clin. Microbiol. Rev, 19, p449-490.
[https://doi.org/10.1128/CMR.00054-05]

-
Lee, J.H., (2014), ABA Signal Transduction Pathway in Plants: ABA Transport, Perception, Signaling and Post-Translational Modification, Journal of Life Science, 24, p196-208.
[https://doi.org/10.5352/JLS.2014.24.2.196]

-
Leu, Y.L., T.L. Hwang, P.C. Kuo, K.P. Liou, B.S. Huang, and G.F. Chen, (2012), Constituents from Vigna vexillata and their anti-inflammatory activity, Int. J. Mol. Sci, 13, p9754-9768.
[https://doi.org/10.3390/ijms13089754]

-
Lowdin, E., I. Odenholt-Tornqvist, S. Bengtsson, and O. Cars, (1993), A new method to determine postantibiotic effect and effects of subinhibitory antibiotic concentrations, Antimicrob. Agents Chemother, 37, p2200-2205.
[https://doi.org/10.1128/AAC.37.10.2200]

-
Molan, P.C., (1992), The antibacterial activity of honey: 1. The nature of the antibacterial activity, Bee World, 73, p5-28.
[https://doi.org/10.1080/0005772X.1992.11099109]

- National Committee for Clinical Laboratory Standards, (1992), Methods for Determining Bactericidal Activity of Antimicrobial Agents: Tentative Guideline M26-T, NCCLS, Wayne, PA, USA.
-
Romano, M., M. R. Iovene, M.I. Russo, R. Salerno, D. Cozzolino, A.P. Pilloni, M.A. Tufano, D. Vaira, and G. Nardone, (2008), Failure of first-line eradication treatment significantly increases prevalence of antimicrobial resistant Helicobacter pylori clinical isolates, J. Clin. Pathol, 61, p1112-1115.
[https://doi.org/10.1136/jcp.2008.060392]

- Spooner, F.D., and G. Sykes, (1972), Laboratory assessment of antibacterial activity, In Norris, JR., Ribbons, DW., Methods in Microbiology, 7B, Academic Press, London, UK, p52-150.
-
Torres, J.I., G. Perez-Perez, K.J. Goodman, J.C. Atherton, B.D. Gold, P.R. Harris, A.M. la Garza, J. Guarner, and O. Munoz, (2000), A comprehensive review of Helicobacter pylori the natural history of infection in children. Arch, Med. Res, 31, p431-469.
[https://doi.org/10.1016/S0188-4409(00)00099-0]

-
Truchado, P., I. Martos, L. Bortolotti, A.G. Sabatini, F. Ferreres, and F.A. Tomas-Barberan, (2009), Use of quinoline alkaloids as markers of the floral origin of chestnut honey, J. Agric. Food Chem, 57, p5680-5686.
[https://doi.org/10.1021/jf900766v]

-
Wu, M., and R.E. Hancock, (1999), Interaction of the cyclic antimicrobial cationic peptide bactenecin with the outer and cytoplasmic membrane, J. Biol. Chem, 274, p29-35.
[https://doi.org/10.1074/jbc.274.1.29]