화분에 다빈도 검출되는 농약 성분에 대한 꿀벌 유충의 독성 영향
Abstract
Residual pesticide levels detected in pollen and honey in hive would be important factor in risk assessment of pesticide exposure for adult and larval honeybee. Herein, we investigated the cumulative mortality of larvae on single exposure of the four most common pesticides detected in pollen, and compared its susceptibility with the lethal dose 50% of adult bees. Four pesticides used in this study were acetamiprid, chlorothalonil, coumaphos, and tau-fluvalinate, which were mixed in artificial diet at the average and maximum residual concentrations reported in pollen. Chlorothalonil and tau-fluvailnate at the average levels induced higher cumulative mortality (respectively 25% and 17%) than other tested pesticides. Mortality occurred more quickly after single exposure in larvae treated with the maximum pesticide levels than the average levels. However, cumulative larval mortality did not increase pesticide-dose dependently in a single exposure test of four all pesticides. Based on the lethal dose 50% of pesticides for adult bees, the larval mortality was greater than bee adult mortality. Therefore, larval stage of honeybee might be much more sensitive to pesticides relative to the adult stage.
Keywords:
Acute toxicity, Larval honeybee, Pesticide, Single exposure서 론
그 동안 꿀벌( Apis mellifera) 집단의 안전성을 확인하기 위한 연구는 주로 봉군에 대한 위해성 평가나 field 시험 중심으로 꿀벌 성충을 대상으로 진행되어 왔으며( Henry et al., 2012 ; Pettis et al., 2013 ) 최근 들어서 농약 성분이 꿀벌 유충에 미치는 영향에 대한 안전성 시험들이 시도되고 있다( Zhu et al., 2014 ).
우리나라는 농약의 등록단계의 꿀벌에 대한 안전성을 확인하기 위해 Tier I 단계에서 접촉 및 섭식경로의 꿀벌 성체의 급성독성시험을, Tier II 단계에서 엽상잔류독성시험을 통해 농약의 안전성을 확인하고 있다(농촌진흥청 시 제 2014-36호, 농약 및 원제의 등록기준). 반면 OECD에서는 야외에서 이루어지는 semi-field 시험법( OECD, 2007)이나 꿀벌 유충 독성시험법( OECD, 2013) 등을 통해 유충단계의 안전성을 확인하고 있다.
꿀벌 유충은 꿀벌 성충에 비해 화학물질에 보다 민감하게 반응하기 때문에 유충단계의 성장상태가 꿀벌 집단의 안전성 평가에 중요한 변수가 될 수 있다( Burlew 2010; Godfray et al., 2014 ; Sanchez-Bayo and Goka, 2014). 따라서, 꿀벌 성충만을 이용한 급성 독성 평가 결과만으로 농약 사용이 꿀벌 집단에 미치는 영향을 예측하기에 무리가 있을 수 있다. 이에 우리나라에서도 농약 등록단계의 꿀벌 유충 독성시험법의 도입에 대한 필요성 및 타당성을 검토 중에 있으며 시험 조건 확립에 대한 연구도 같이 진행 중에 있다.
꿀벌은 성장을 위해 필요한 에너지원인 탄수화물과 단백질을 얻기 위해 벌통(hive)에 저장된 화밀(nectar)과 화분(pollen)를 섭취하는데, 특히 꿀벌 유충은 섭식 과정에서 섭취와 접촉이 동시에 이루어지므로 꿀벌 성충에 비해 식이 내 잔류되는 물질에 대한 독성영향이 더 큰 것으로 보고되었다( Rortais et al., 2005 ; Mullin et al., 2010 ; Zhu et al., 2014 ).
한편, 선행연구에 따르면 유럽과 아메리카, 아시아의 화분(pollen)에서 농약성분의 잔류량을 확인한 결과 coumaphos(32.6%), tau-fluvalinate(32.2%), chlorothalonil(26.7%), acetamiprid(24.1%) 순으로 농약이 높게 검출되었다( Sanchez-Bayo and Goka, 2014). 또한, 꿀벌 및 유충에 대한 농약의 위해성을 보다 현실적인 노출 조건으로 평가하기 위해서는 식이로 사용되는 화분에 잔류하는 농약의 잔류량을 근거로 하는 것이 중요하다.
따라서, 본 연구에서는 선행연구( Sanchez-Bayo and Goka, 2014)을 근거로 화분에서 다빈도 검출되는 농약 2종(acetamiprid, chlorothalonil)과 꿀벌 응애방제제 2종(coumaphos, tau-fluvalinate)의 4종 성분에 대해 평균 및 최대 잔류량 수준으로 급여하여 꿀벌 유충시험을 시행함으로써 개별 성분이 유충의 치사에 미치는 영향에 대해 살펴보았으며, 이를 꿀벌의 급성독성치인 반수치사량(lethal dose 50%; LD 50)과 비교함으로써 꿀벌 유충의 민감성을 확인하였다.
재료 및 방법
유충 준비
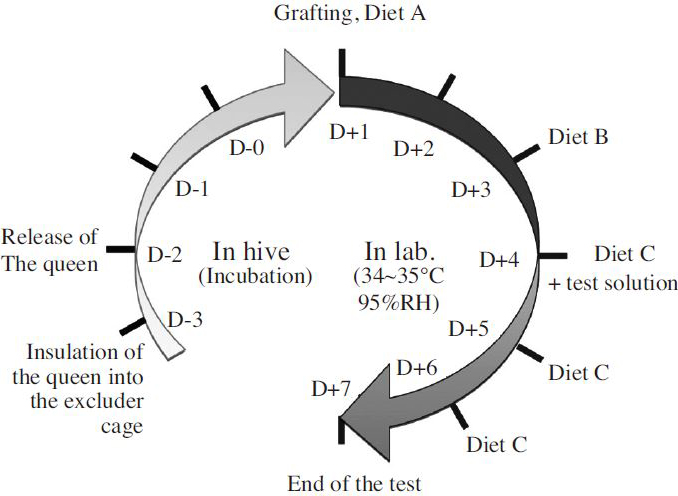
실험에 사용된 꿀벌은 전라북도 국립농업과학원 잠사양봉소재과 양봉장에 위치한 총 5개의 벌통에서 무작위 선발하였다. OECD guideline에 따르면( OECD, 2013), 격왕판을 설치하고 30시간 뒤 제거하여 여왕벌이 동일시간에 산란한 1일령 유충으로 시험을 진행하는 방법을 제시하였으나( Fig. 1) 본 시험에서는 격왕판을 설치하지 않고 산란이 끝난 소비(comb)에서 1일령 유충을 선별하는 방법으로 진행하였다.
시험약제
시험약제는 화분에서 다빈도로 검출된 농약 2종(acetamiprid, chorothalonil)과 꿀벌 응애방제제 2종(coumaphos, tau-fluvalinate)의 4종 성분으로 선정하였다( Sanchez-Bayo and Goka, 2014). 꿀벌 유충독성시험의 양성대조물질로 사용된 dimethoate는 Dr. Ehrenstorfer (Augsburg, Germany) 제품을 사용하였다.
유충먹이 준비
유충먹이에 사용된 로얄젤리는 허니테크(수원, 한국)에서 구입하여 사용하였으며, 유충먹이의 기본구성에 yeast extract(Bacto, Sparks, USA)와 dextrose (Difco, Sparks, USA), D-fructose(JUNSEI, Japan)를 사용하였다. 유충먹이는 A, B, C 타입의 총 3종류로 구성은 Table 1과 같이 각각 시험 1일차(D1)에 유충먹이 A를 20μl, 시험 3일차(D3)에 유충먹이 B를 20μl, 시험 4일차(D4)부터 6일차(D6)의 3일간 유충먹이 C를 30~50μl 제공하였다. 시험 4일차에는 시험성분을 유충먹이 C 30μl에 혼합하여 처리하였다. 유충먹이는 yeast extract를 함유한 수용액을 먼저 제조 후 0.20μm syringe filter로 여과 후 로얄젤리에 사용직전에 혼합하여 사용하였다. 로얄젤리는 -18~-25°C 사이에서 냉동 저장하였으며, 유충먹이로 급여하기 전 상온에 녹여 사용하였다.
시험성분 처리
시험성분의 유충먹이 중 농도는, 4종 성분의 화분 중 검출된 평균 잔류량과 최대 잔류량을 근거로 하여( Sanchez-Bayo and Goka, 2014), acetamiprid(3.0 ppb, 0.13 ppm), chlorothalonil(802.3 ppb, 98.9 ppm), coumaphos(128.0 ppb, 5.9 ppm), tau-fluvalinate(123.0 ppb, 2.7 ppm) 되도록 조제하였다. 시험에서 사용된 4종 성분의 접촉 및 섭식을 통한 꿀벌의 급성독성수치는 Table 2와 같다( Sanchez-Bayo and Goka, 2014).
본 시험의 음성대조군은 증류수를 사용하였으며, 양성대조물질로 사용된 dimethoate는 유충독성이 나타날 수 있는 3.0μg/larvae로 제조하였다. 각 시험은 48 well plate 에 12마리의 유충을 사용하며, 3개의 plate를 이용하여 3반복 시행하였다.
유충사육 및 치사율 확인
시험기간 동안 plate(SPL, Korea)를 34~35°C 상태의 항온인큐베이터(DAIHAN Scientific Co., Korea)에 설치된 밀폐형 desiccator cabinet(NALGENE, USA)에 넣어 시험하였다. 시험기간 동안 유충의 치사율 확인을 위해 유충을 배양기에서 꺼내는 시간 등 시험 중 온도를 이탈하는 시간이 15분을 초과하지 않도록 하였다. 유충기간 동안 potassium sulfate(Junsei, Japan) 포화용액을 이용하여 인큐베이터의 습도를 95±5% Relative humidity (RH)로 유지하였으며, 용단계(pupal stage)에서는 sodium chloride(Sigma-Aldrich, USA) 포화용액을 이용하여 80 ±5% RH로 유지하였다.
시험 첫날(D1)에 well plate에 이충용기(grafting cell; NICOTPLAST Society, France)를 넣고 유충먹이 A를 20μl 처리 후 5개의 벌통 내의 소비를 선별하여 1일령 유충에 대한 이충(grafting)을 실시하였다. 시험 3일차(D3)에 유충먹이 B를 20μl 공급하며, 시험 4일차(D4)에 유충먹이 C에 시험용액을 혼합하여 30μl 공급하였다. 시험 5일차(D5)와 6일차(D6)에 유충먹이 C를 각각 40μl와 50μl 공급하면서, 치사한 개체는 기록하고 제거하였다. 시험7일차(D7)부터 유충먹이 공급 없이 치사개체를 기록하였으며, 시험 8~15일차(D8~D15)인 용단계에서 치사 개체를 확인하였다.
결과 및 고찰
대조군 독성
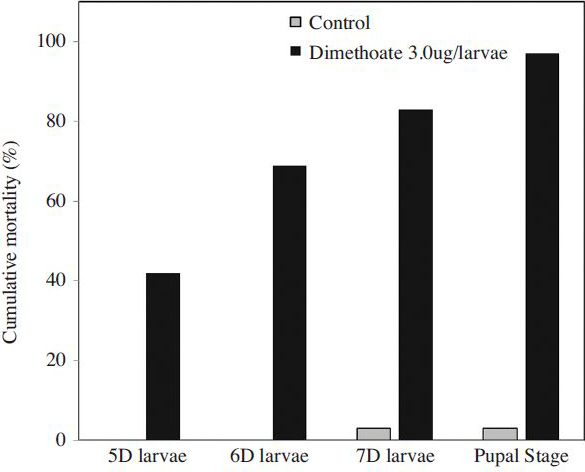
음성대조군과 양성대조군의 치사율은 Fig. 2에 나타내었다. 음성대조군은 시험 7일차까지의 누적 치사율이3%로 나타나, 유충단계 치사율이 15%를 넘지 않아야 한다는 시험조건에 부합되었다( OECD, 2013). 또한 음성대조군의 용단계에서의 치사율은 나타나지 않았다.
Dimethoate를 처리한 양성대조군은 시험 5~7일인 유충단계의 누적치사율이 83%에 해당하여, 양성대조군의 유충 누적치사율이 50% 이상이어야 한다는 시험조건에 부합하여( OECD, 2013) 본 시험기법의 신뢰도가 높음을 확인 할 수 있었다. 양성대조군은 유충단계 이후의 용단계에서 치사율이 추가로 14% 발생하였다.
유충먹이를 통한 시험성분의 평균 잔류량이 유충에 미치는 영향
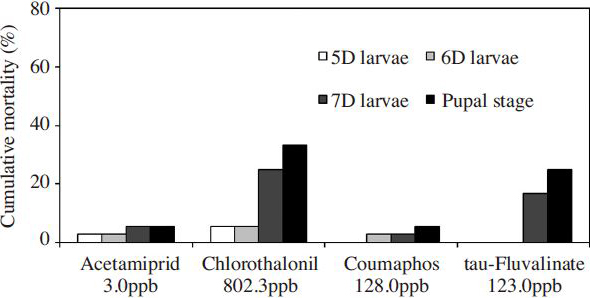
화분에서 다빈도 검출되는 4종 성분을 평균 잔류량(acetamiprid 3.0 ppb, chlorothalonil 802.3 ppb, coumaphos 128.0 ppb, tau-fluvalinate 123.0 ppb) 수준으로 유충먹이를 이용해 꿀벌 유충에 단회 처리한 후 치사율을 살펴본 결과는 Fig. 3과같다.
유충단계인 시험 4~7일의 누적치사율은 chlorothalonil(25%), tau-fluvalinate(17%), acetamiprid (6%), coumaphos(3%) 순으로 나타나, chlorothalonil과 tau-fluvalinate의 꿀벌 유충에 미치는 영향이 다른 시험성분에 비해 높았다. 또한, chlorothalonil와 tau-fluvalinte 처리군은 시험성분 처리 3일째인 시험 7일차에 전체 유충의 누적치사율의 80%와 100%가 발생하여 시험성분에 대한 치사반응이 유충단계 후반에 발생하는 것을 알 수 있었다.
또한 용단계의 치사율은 chlorothalonil 8%, tau-fluvalinate 8%, coumaphos 3%, acetamiprid 0%로 나타났다. 따라서, 유충단계의 치사율이 높은 chlorothalonil과 tau-fluvalinate 성분은 용단계의 추가 치사율도 다른 시험성분에 비해 높게 발생시키며 우화(emergence)단계를 거쳐 성충으로 성장해 나갈 개체수가 감소하였다.
유충먹이를 통한 시험성분의 최대 잔류량이 유충에 미치는 영향
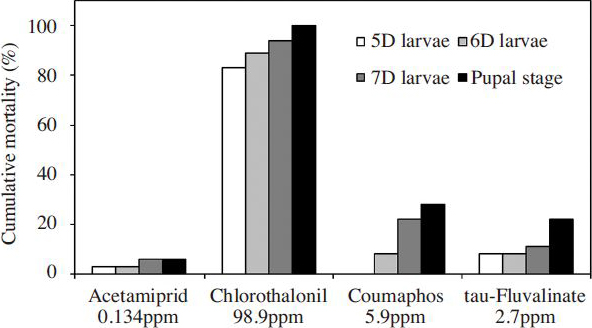
꿀벌 유충이 시험성분에 노출되는 최악의 상황을 가정하여 시험하기 위하여, 선행연구에서 화분 중 다빈도로 검출된 성분 4종을 최대 잔류량(acetamiprid 0.134 ppm, chlorothalonil 98.9 ppm, coumaphos 5.9 ppm, tau-fluvalinate 2.7 ppm) 수준으로 포함한 유충먹이를 꿀벌 유충에 단회 처리 한 후 치사율을 살펴본 결과는 Fig. 4와같다.
시험성분 4종을 최대잔류량 수준으로 처리한 꿀벌 유충단계의 누적치사율은 chlorothalonil(94%), coumaphos(22%), tau-fluvalinate(11%), acetamiprid(6%) 순으로 나타났다( Fig. 4). 선행연구를 통해 선정된 시험성분의 최대잔류량은 평균잔류량에 비해 acetamiprid 40배 및 chlorothalonil 12배, coumaphos 40배, tau-fluvalinate 22배로 높은 수준이었다. 그러나 꿀벌 유충의 치사율은 chlorothalonil과 coumaphos 처리에서 각각 3.8배와 7.3배 증가에 그쳤다. 또한, acetamiprid 처리에서는 최대잔류량 시험군의 유충 치사율이 평균잔류량 시험군의 결과와 동일하였고 오히려 tau-fluvalinate 처리에서는 0.7배로 감소한 것으로 나타나, 모든 시험성분의 꿀벌 유충의 치사율에 미치는 영향이 용량의존적이지 않음을 알 수 있었다.
Chlorothalonil이 잔류된 유충먹이를 급여한 꿀벌 유충의 치사율에 대한 선행연구에 따르면, chlorothalonil 34 ppm이 잔류하는 유충먹이를 매일 급여한 경우 6일령까지 유충의 치사율이 56.6%에 해당하였다( Zhu et al., 2014 ). 본 시험에서 사용된 chlorothalonil 농도는 98.9ppm으로 선행연구의 시험 농도의 약 3배 수준으로 높았으며 시험결과 6일령까지의 누적 치사율이 1.7배 높게 나타났다. 선행연구에서는 노출이 매일 반복적으로 이루어졌으며 6일령까지의 1일 평균 치사율이 9.82%로 매일 비교적 일정한 치사율을 보인데 반해, 본 시험에서는 단회 노출이며 노출 1일 후부터 83%의 높은 치사률을 보였다. 따라서, 본 시험에서 화분에서 검출된 이력 중 최고 농도의 시험물질을 노출시킴에 따라 노출 1일 이내인 단시간에 급격히 유충의 치사가 발생한 것으로 생각된다.
유충~용단계의 총 치사율 대비 용단계의 치사율은 tau-fluvalinate 50%, coumaphos 24%, chlorothalonil 6%, acetamiprid 0%로 나타났다. 따라서, tau-농도에 관계없이 tau-fluvalinate 성분은 유충단계의 단회 노출이 용단계의 치사까지 가장 크게 영향을 미치는 것을 알 수 있었다.
꿀벌 성충과 꿀벌 유충의 시험물질 노출에 따른 민감성 비교
서론에서 기술하였듯이 꿀벌 유충의 경우 유충먹이를 급여하면 섭취와 접촉경로로 동시에 노출이 이루이지므로, 두 경로의 LD 50 중 보다 낮은 농도로 시험성분이 유충먹이에 잔류하더라도 유충의 반수가 치사할 수 있다. 4종 성분의 LD 50은 꿀벌 유충에 대한 자료가 부재하므로 Table 2와 같이 꿀벌 성충 자료를 근거로 살펴보면, 유충먹이 중 acetamiprid와 tau-fluvalinate는 접촉경로로 각각 7.9ug bee -1과 8.7ug bee -1에서, chlorothalonil와 coumaphos는 섭취경로로 각각 63ug bee -1와 4.6ug bee -1에서 꿀벌의 반수가 사망할 수 있다( Sanchez-Bayo and Goka, 2014).
본 연구에서 사용된 시험성분의 최대잔류량을 유충먹이량인 30uL 기준으로 환산하면 acetamiprid 0.004ug, chlorothalonil 2.967ug, coumaphos 0.178ug, tau-fluvalinate 0.080ug에 해당한다. 이를 성분별로 보다 민감한 경로의 LD 50과 비교했을 때 각각 acetamiprid 0.05%, chlorothalonil 4.7%, coumaphos 3.9%, tau-fluvalinate 0.9%에 해당하여 매우 낮은 비율이므로 꿀벌 성충의 치사에 대한 영향은 미미할 것으로 예상하였다. 그러나, chlorothalonil의 최대잔류량을 유충먹이로 실제 처리한 결과 꿀벌 유충의 시험 6일차 누적치사율이 94%로 매우 높게 나타남에 따라, 꿀벌 유충은 실제 꿀벌 성충에 비해 보다 더 민감하게 독성을 보이는 것을 알 수 있었다.
Burlew(2010)은 꿀벌의 유충은 화분 중 농약성분에 대해 성체의 LD 50보다 매우 낮은 농도에서도 부작용이 나타난다고 보고한 바 있다. 또한, Villa et al.(2000) 은 유충이 빠르게 성장하기 위해서 성충보다 체중당화분을 더 필요로 하므로 화분 중 이물질에 대한 노출이 성충의 노출에 비해 10배 크다고 보고하였다. 본 시험에서도 꿀벌 유충이 성충에 비해 시험성분의 보다 낮은 농도에서 민감한 독성반응을 보이는 것으로 나타났으며, 이는 전체 꿀벌 집단의 유지를 위해 관리되어야 할 성분들에 대해서는 성충 대상 시험보다 유충시험에서 보다 민감하게 독성이 감지될 수 있음을 알 수 있다.
한편, 이상의 시험성분이 잔류하는 화분을 급여하는 꿀벌이나 꿀벌 유충에 대한 영향을 연구하기 위해서는 화분 중 잔류하는 개별 성분을 대상으로 하기 보다는 실제 현실적 조건에 해당하는 다양한 농약의 혼합 노출에 따른 영향을 확인하는 것이 도움이 될 것이다. 특히, 많은 성분의 물질들이 잔류하는 화분을 급여하는 경우 해당 성분의 독성기전 등 여러 요인들에 의해서 그 영향이 상승 또는 상쇄될 수 있다고 보고되고 있어 꿀벌 유충을 대상으로 하는 혼합 시험의 필요성이 높다( Zhu et al., 2014 ).
또한 현재 우리나라는 화분, 벌꿀 및 왁스 중 농약 등에 대한 잔류량 자료가 부재하기 때문에 향후 우리나라의 꿀벌 유충먹이에 함유된 농약 등에 대한 잔류량에 대한 연구가 진행될 필요가 있으며, 이를 근거로 우리나라 꿀벌 유충에 미치는 안전성을 정밀히 확인할 필요가 있다. 유충의 경우 노출 시기에 해당하는 시험개체의 일령이나 노출 횟수에 따라 동일한 수준의 이물질에 노출에 따른 영향이 다르며( Burlew, 2010), 농약에 따른 유충의 독성이나 무독화 과정은 노출 농도와 노출 기간에 따라 차이를 보인다고 보고( Suchail et al., 2001 )되고 있다. 따라서, 전체 꿀벌 집단의 안전성 확인을 위해서는 우화(emergence)단계까지 포함되는 다양한 범위의 시험의 시도가 필요할 것이며, 또한 전체 꿀벌 집단의 유지를 위해서는 이러한 시험결과들의 상호간 유기적인 분석 및 평가가 이루어져야 할 것이다.
적 요
꿀벌이나 꿀벌 유충의 농약 성분에 대한 위해성을 평가하기 위해서는 화분이나 꿀에 함유된 잔류량이 중요한 변수로 작용할 수 있다. 본 시험에서는 화분에서 다빈도 검출되는 농약인 acetamiprid와 chlorothalonil, 꿀벌 응애방제제인 coumaphos, tau-fluvalinate로 총 4종의 성분에 대해 평균과 최대 잔류량 수준으로 유충먹이를 제공하여 꿀벌 유충의 치사율을 확인하고, 이를 꿀벌의 급성독성치인 반수치사량과 비교함으로써 꿀벌 유충의 민감성을 확인하였다. 유충먹이를 통한 시험성분의 평균 잔류량에 노출된 유충의 누적치사율은 chlorothalonil과 tau-fluvalinate에서 각각 25%와 17%로 다른 성분보다 높게 나타났다. 시험성분의 최대 잔류량을 함유한 유충먹이를 처리한 유충은 평균 잔류량 처리군에 비해 노출 후 치사개체가 더 빠르게 발생하였으나, 유충단계의 누적치사율이 4종 성분 모두에서 농약의 처리농도에 따라 용량의존적으로 증가하지는 않았다. 시험결과를 꿀벌 성체의 독성기준치와 비교했을 때 꿀벌 유충이 성충에 비해 치사율이 높은 것으로 나타나 꿀벌 유충이 성충에 비해 시험성분을 보다 민감하게 감지하는 것을 확인할 수 있었다.
감사의 글
본 연구는 농촌진흥청 연구사업(과제번호: PJ00995001)의 지원에 의해 이루어진 것임.
인용문헌
- Burlew, D.A., (2010), The effects of pesticide-contaminated pollen on larval development of the honey, Apis mellifera, Master thesis, Evergreen State college, Washington, USA.
-
Godfray, H.C.J., Blacquiere, T.L., Field, M., Hails, R.S., Petrokofsky, G., Potts, S.G., Raine, N.E., Vanbergen, A.J., and Mclean, A.R., (2014), A restatement of the natural science evidence base concerning neonicotinoid insecticides and insect pollinators, Proc. Biol. Sci, 281, 20140558.
[https://doi.org/10.1098/rspb.2014.0558]

-
Henry, M., Béguin, M., Requier, F., Rollin, O., Odoux, J.-F., Aupinel, P., Aptel, J., Tchamitchian, S., and Decourtye, A., (2012), A common pesticide decreases foraging success and survival in honey bees, Science, 223, p348-350.
[https://doi.org/10.1126/science.1215039]

-
Mullin, C.A., Frazier, M., Frazier, J.L., Ashcraft, S., Simonds, R., vanEngelsdorp, D., and Pettis, J.S., (2010), High levels of miticides and agrochemicals in North American apiaries: implication for honey bee health, PLos ONE, 5(3), pe9754.
[https://doi.org/10.1371/journal.pone.0009754]

- OECD, (2007), Guidance document on the honey bee ( Apis mellifera L.) brood test under semi-field conditions , Series on testing and assessment No. 75.
- OECD, (2013), Honey bee ( Apis mellifera) larval toxicity test, single exposure , Test guideline 237.
-
Pettis, J.S., Lichtenberg, E.M., Andree, M., Stitzinger, S., Rose, R., and vanEngelsdorp, D., (2013), Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen
Nosema ceranae, PLos ONE, 8(7), pe70182.
[https://doi.org/10.1371/journal.pone.0070182]

-
Rortais, A., Arnold, G., Halm, M.P., and Touffet-Briens, F., (2005), Modes of honeybees exposure to systemic insecticides: estimated amounts of contaminated pollen and nectar consumed by different categories of bees, Apidologie, 36, p71-83.
[https://doi.org/10.1051/apido:2004071]

-
Sanchez-Bayo, F., and Goka, K., (2014), Pesticide residues and bees-a risk assessment, PLoS ONE, 9(4), pe94482.
[https://doi.org/10.1371/journal.pone.0094482]

-
Suchail, S., Guez, D., and Belzunces, L.P., (2001), Discrepancy between acute and chronic toxicity induced by imidacloprid and its metabolites in
Apis mellifera, Environ. Toxicol. Chem, 20(11), p2482-2486.
[https://doi.org/10.1897/1551-5028(2001)020%3C2482:DBAACT%3E2.0.CO;2]

- Villa, S., Vighi, M., Finizio, A., and Serini, G.B., (2000), Risk assessment for honeybees from pesticide-exposed pollen, Ecotoxicology, 9, p287-297.
-
Zhu, W., Schmehl, D.R., Mullin, C.A., and Frazier, J.L., (2014), Four common pesticides, their mixtures and a formulation solvent in the hive environment have high oral toxicity to honey bee larvae, PLos ONE, 9(1), pe77547.
[https://doi.org/10.1371/journal.pone.0077547]