
서양종 꿀벌로부터 분리한 정제봉독의 통풍 억제 효능 구명
농촌진흥청 국립농업과학원 농업생물부Abstract
Honeybee (Apis mellifera L.) venom (PBV) is a good candidate for development as a therapeutic modality. The gout is a form of inflammatory arthritis caused by excess uric acid in the bloodstream. Gout causes sudden severe joint pain. To investigate in vitro xanthine oxidase inhibitory properties of PBV for gout. PBV was studied for in vitro xanthine oxidase inhibitory activity using a spectrophotometric method and matrix metalloproteinase (MMP)-9 expression after 24 hr of monosodium urate crystal (MSU) treatment when MMP-9 production reached a maximum in RAW 264.7 cells. The highest xanthine oxidase inhibitory activity was 94.7% in the 10 μg/mL PBV. The treatment of 10 μg/mL PBV showed an inhibitory effect of MMP-9, gout inflammatory marker. PBV was evaluated the xanthine oxidase and MMP-9 inhibitory potential in our study. We suggest that PBV could be used an excellent substance for gout prevention.
Keywords:
Apis mellifera, Honeybee venom, Anti-gout, Xanthine oxidase, MMP-9서 론
통풍은 퓨린대사의 이상으로 체내에 과잉축적된 요산이 결정화되면서 관절과 관절 주위 조직에 염증을 일으키는 질환으로 최근 육류 섭취와 과다한 음주, 비만 등 식생활의 변화로 우리나라에서도 통풍 환자가 증가하고 있다 (Health Insurance Review & Assessment Service, 2011). 요산은 퓨린의 대사과정에서 xanthine oxidase 또는 xanthine dehydrogenase에 의해 생성되어, 대부분의 포유류에서는 간에서 urate oxidase에 의해 allantoin으로 산화된다고 알려져 있다. 요산 형성이 증가되거나 배설이 감소되는 상황에서는 혈중 요산 농도가 증가되어 요산염 (monosodium urate, MSU) 결정이 관절막에 침착되면서 염증반응을 유발하는 통풍의 원인이 된다는 보고가 있다 (Harrold, 2013). 또한 만성 통풍 환자에서 관찰할 수 있는 통풍 결정 (tophus)은 조직학적으로 요산염 결정과 조직 파편을 둘러싸고 있는 육아종이다. 통풍 결절은 연골의 파괴와 골미란에 관여하며, 결절 내의 대식세포들은 matrix metalloproteinase-2 (MMP-2)와 MMP-9을 분비하는데 이들은 제4형, 5형 콜라젠 (collagen), 엘라스틴 (elastin)과 젤라틴 (gelatin)을 분해함으로써 통풍 결절 주변 조직들이 파괴되게 된다 (Hsieh et al., 2003; Sutaria et al., 2006).
따라서 통풍개선제는 주로 요산 농도를 감소시키기 위해 xanthine oxidase 저해능이 우수한 천연물을 대상으로 많은 연구가 진행되어왔다 (Seo and Kim 2010; Lee et al., 2011). 통풍의 치료법으로 퓨린의 섭취를 조절하여 요산 생성을 감소시키는 식이요법, allopurinol과 같은 요산 형성을 억제하는 약물을 투여, probenecid 및 sulfinpyrazone과 같은 약물을 투여하여 요산의 배설을 증가시키는 방법 등이 있다. 하지만 이러한 치료 약물은 소화기계의 자극, 구토, 설사, 발열 및 간 손상 등의 부작용을 동반하기 때문에 부작용 없이 안전한 천연물을 이용한 치료법의 개발이 다양하게 진행되고 있다 (Gilman et al., 1985; Wortmann, 2005; Kwak et al., 2013).
순수 천연물질이면서 강력한 항균, 항염증 효과를 갖는 봉독은 부작용과 잔류에 대한 위험성이 적어 봉침요법으로 오래전부터 관절염, 통풍 등의 질환에 사용되어 오고 있다 (Kim et al., 2003). 서양종 꿀벌 (Apis mellifera L.) 일벌의 독인 봉독은 다양한 성분이 복합적으로 구성되어 있으며, 주성분인 멜리틴 (Melittin)은 항염증 (Habermann and Reiz, 1965; Piek, 1986)과 항균작용 (Fennell et al., 1967), 강력한 진통작용 (Curcio-Vonlanthen et al., 1997), 면역증강 (Rudenko and Nipot, 1996) 등의 역할을 한다고 알려져 있다. 본 연구팀에서는 2005년 봉독채집장치와 채집된 봉독으로부터 이물질을 제거할 수 있는 봉독정제법을 개발하였다. 정제봉독은 멜리틴 함량이 50∼70% 범위로 히스타민을 비롯하여 히알루니다아제, 포스포리파아제 등 꿀벌의 봉독 성분을 온전히 갖고 있는 상태의 봉독이다 (한 등, 2007).
본 연구에서는 봉독이 항통풍 소재로서의 가능성을 확인하고자 xanthine oxidase 저해활성과 통풍 결절 주변 조직을 파괴하는 MMP-9의 발현 억제 효능을 측정하였다.
재료 및 방법
봉독 시료 및 주요성분 함량 확인
봉독 시료는 봉독채집장치를 사용하여 서양종 꿀벌로부터 채취한 봉독을 ‘봉독의 간이정제방법’으로 (한 등, 2007) 정제한 정제봉독을 구입하여 사용하였다 (한국정제봉독협동조합, 한국). 구입한 정제봉독의 성분 확인을 위하여 4 mg/mL의 농도로 3차 증류수에 녹여 PTFE 0.2 μm 필터 (Sigma-Aldrich, 미국)로 여과하여 UPLC (Ultra performance liquid chromatography, Waters, 미국)를 사용하여 분석하였다. 표준품인 apamin, mellitin 그리고 phospholipase A2는 시그마사로부터 구입하여 2 mg/mL로 만들어 시험봉독과 동일한 필터를 사용하여 여과하였다. 분석기기는 PDA (photo diode array, Waters) 검출기가 장착된 Acquity UPLC I-Class (Waters)를 사용하여, Table 1과 같은 컬럼 및 분석 조건으로 220 nm의 검출파장에서 분석하였다 (Han et al., 2017). 정제봉독 내의 멜리틴, 아파민 그리고 포스포리파아제 A2의 함량은 각각의 표준품 수용액 시료에 나타나는 피크와 비교하여 63.9%, 2.3% 그리고 10.9%로 확인하였다.
Xanthine oxide 저해활성 측정
Xanthine oxide 저해활성은 Stirpe와 Della Corte의 방법에 따라 실시하였다 (Stirpe and Della, 1969). 이를 위해 0.1 M potassium phosphate buffer (pH 7.5)에 xanthine 2 mM을 녹인 기질액 1mL에 Xanthine Oxidase (Sigma-Aldrich) 0.1 mL와 다양한 농도의 봉독 0.1 mL를 첨가하였다. 이 때 음성 대조구에는 증류수 0.1 mL를 첨가하였고, 양성대조구에는 대표적인 통풍 치료제인 Allopurinol (Sigma-Aldrich) 0.5 μg/mL를 사용하였다. 다음으로 37℃에서 5분간 반응시키고 20% (v/v) trichloroacetic acid (Sigma-Aldrich) 1 mL를 가하여 반응을 종료하였다. 이후 3,500 rpm에서 15분간 원심분리하고, 292 nm에서 흡광도 (Molecular Devices, 미국)를 측정하여 아래 식에 따라 반응액 중에 생성된 요산 (uric acid) 양을 확인하였다.
저해율 (%)= (1-정제봉독 처리구의 흡광도 / 대조구의 흡광도)×100
세포배양 및 생존율 측정
본 실험에 사용한 RAW 264.7 세포는 한국세포주은행 (서울)에서 분양받아 사용하였다. 세포배양은 DMEM (Dulbecco’s modified Eagle’s medium) 배지에 5% CO2 배양기 (Sanyo, 일본)에서 37℃로 배양하였다. 정제봉독과 MSU에 대한 RAW 264.7 세포의 생존율을 측정하기 위하여 WST-8 (2-(2-methoxy-4-nitrophenyl)-3-(4-nitrophenyl)-5-(2,4-disulfophenyl-2H-tetrazolium, monosodium salt) 환원 방법을 이용하였다. 24시간 동안 배양 후 50 μL CCK-8 용액 (Dojindo, 일본)을 첨가하여 3시간 배양하고 450 nm에서 흡광도를 측정하였다.
MMP-9 발현 억제 활성 측정
RAW 264.7 세포를 계대배양 후 80~90% 세포가 자랐을 때 배양된 세포에 MSU (Enzo Life Sciences, 미국)를 1 mg/mL 처리하여 통풍 시 연골세포에서 일어나는 염증반응을 유도하였다. MSU와 다양한 농도의 정제봉독을 함께 처리하고 48시간 후 상층액을 수거한 후 MMP-9 발현량을 측정하였다. MMP-9의 농도는 Quantikine mouse MMP-9 ELISA Kit (R&D System, 미국)를 사용하여 측정하였다.
통계처리
실험에서 얻어진 결과의 통계적 유의성은 R (3.4.1 version, New Zealand) 통계 프로그램을 이용하여 분석하였으며, 대조군과 실험군 간의 평균에 대한 유의성은 ANOVA 검정을 이용하여 검증하였다.
결과 및 고찰
Xanthine oxidase 저해활성
통풍과 관련한 고요산혈증에 결정적인 역할을 하는 xanthine oxidase에 대한 정제봉독의 저해활성을 측정한 결과 Table 2와 같이 정제봉독은 농도 의존적으로 높은 저해활성을 보였다. 정제봉독은 비교적 낮은 농도인 1 μg/mL의 농도에서도 56.3%의 xanthine oxidase 저해활성을 보였으며 100 μg/mL의 농도에서는 90% 이상의 매우 높은 활성을 가지고 있었다. Xanthine oxidase에 대한 저해능이 우수한 정제봉독은 xanthine oxidase에 의한 hypoxanthine은 xanthine으로, xanthine은 다시 uric acid로 전환되는 것을 억제함으로써 고요산혈증을 예방할 수 있는 항통풍성 소재로 가능성이 확인되었다.
MMP-9 발현량 억제
급성 통풍 발작이 반복적으로 나타나는 만성 통풍 환자에서 관찰할 수 있는 통풍 결절 (tophus)은 조직학적으로 요산염 결정과 조직 파편을 둘러싸고 있는 육아종이다. 통풍 결절은 견고한 결체조직에 의해 둘러싸여져 있는데 결절 내부에는 다수의 대식세포들이 존재하고 표면에 성숙한 분화단계를 보이는 표시자들을 표현하고 있으며, 많은 세포들이 세포자멸사 (apoptosis)하고 있다. 반면 주변부의 대식세포들은 최근의 세포이동을 나타내는 표지들을 가지고 있는데 이로 미뤄볼 때 통풍 결절은 대식세포들이 지속적으로 모이고, 염증반응이 활성화되고, 대식세포가 성숙하고 사멸하는 과정의 부산물이라고 알려져 있다 (Dalbeth et al., 2010). 항염증 효능이 있는 것으로 알려진 정제봉독이 MSU에 의해 유발된 MMP-9의 발현을 억제하여 통풍 예방에 효과가 있는지를 알아보고자 대식세포인 RAW 264.7 세포에 MSU를 처리하여 MMP-9 분비를 촉진한 후 정제봉독을 처리하고 발현량을 측정하였다. Fig. 1과 같이 정제봉독은 10 μg/mL의 농도 이하에서는 세포독성을 갖지 않으며, MMP-9 발현을 증가시키는 MSU의 최적농도인 1 mg/mL 역시 세포독성을 유발하지 않는 것으로 확인하였다. Fig. 2는 RAW 264.7 세포에 통풍의 원인인 MSU와 정제봉독을 농도별로 처리한 후 MMP-9 발현량을 확인한 결과 10 μg/mL의 농도까지는 농도 의존적으로 발현이 억제되는 경향을 보였으나 정제봉독 농도가 100 μg/mL의 농도에서는 오히려 MMP-9 발현 억제율이 감소하는 것으로 확인되었다.
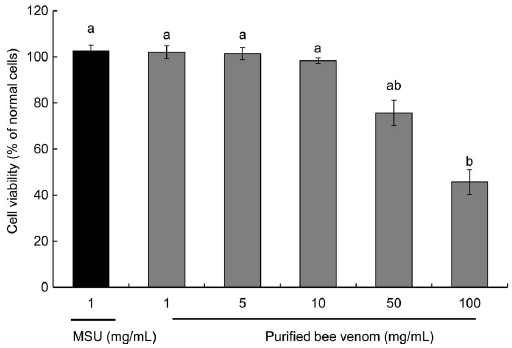
Effects of purified bee venom and MSU on cell viability in RAW 264.7 cells. Cell viability was measured by WST-8 assay. The cells were treated with various concentrations of purified bee venom and 1 mg/mL of MSU. After WST-8 assay, the MTT reduction rate (mean±SD of triplicate determination) was calculated by setting each of control survival in the normal cells. Different letters indicate statistically significant differences between groups (one-way ANOVA test, p≤0.01).
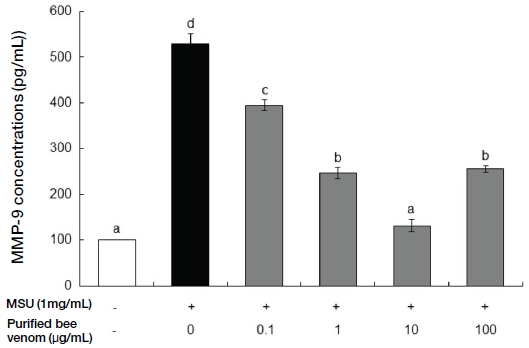
Effect of purified bee venom on MMP-9 production in MSU-induced RAW 264.7 cells. The data are presented as mean±SD. Different letters indicate statistically significant differences between groups (one-way ANOVA test, p≤0.01).
이상의 연구결과에서 서양종 꿀벌 일벌에서 채취한 정제봉독은 요산 생성에 관여하는 xanthin oxidase의 활성을 억제시키며 또한 통풍 결절 주변조직을 파괴시키는 MMP-9의 발현을 억제시키는 효과가 있음을 확인하였다. 따라서 정제봉독은 다양한 원인이 있을 수 있으나 고요산혈증과 요산염결정이 주요 원인으로 알려진 통풍의 예방과 치료 물질로서 활용이 가능할 것으로 사료되었다.
적 요
봉침요법은 오래전부터 한방과 민간에서 질병의 예방과 치료 목적으로 사용되어 왔으며 최근에는 봉독채집장치를 사용하여 대량으로 채취한 정제봉독이 항염증 및 관절염 치료제로 사용되고 있다. 통풍은 통증과 발열 및 부종을 일으키는 재발성 급성관절 질병으로 정제봉독이 통풍 증상을 개선하고 예방 및 치료에 효과가 있는지 확인하였다. 정제봉독이 요산 생성에 관여하는 xanthine oxidase의 활성을 저해할 수 있는지를 측정한 결과 100 μg/mL의 정제봉독에서 90% 이상의 매우 높은 저해활성을 보였다. 대식세포인 RAW 264.7 세포에 1 mg/mL의 MSU를 처리하여 염증작용을 유발한 후 요산염결정 발생인자인 MMP-9의 분비를 촉진시킨 다음 정제봉독이 MMP-9의 분비를 감소시키는지를 확인하였다. 그 결과 정제봉독은 비교적 낮은 농도인 0.1 μg/mL에서도 MMP-9의 분비를 억제시켰으며 10 μg/mL를 처리했을 때 가장 높은 억제효율을 보였다. 따라서 정제봉독은 낮은 농도로 통풍의 주요 원인인 요산 생성에 관여하는 xanthine oxidase의 활성을 저해하고 MSU에 의한 염증작용을 억제하므로 통풍 예방물질로서의 가치가 있다고 사료된다.
Acknowledgments
본 연구는 농촌진흥청 차세대바이오그린21사업 (과제번호: PJ01316602)에 의하여 수행되었습니다.
References
- 한상미, 이광길, 여주홍, 우순옥, 권해용, (2007), 봉독의 간이 정제 방법, 대한민국특허 10-075881.
- Curcio-Vonlanthen, V., C. H. Schneider, K. Frutig, K. Blaser, and H. Kalbacher, (1997), Molecular parameters in melittin immunogenicity, J. Pept. Sci., 3(4), p267-276.
-
Dalbeth, N., B. Pool, G. D. Gamble, T. Smith, K. E. Callon, F. M. McQueen, and J. Cornish, (2010), Cellular characterization of the gouty tophus: a quantitative analysis, Arthritis Rheum., 62(5), p1549-1556.
[https://doi.org/10.1002/art.27356]

- Fennell, J. F., W. H. Shipman, and L. J. Cole, (1967), Antibacterial action of a bee venom fraction (melittin) against a penicillin-resistant Staphylococcus and other microorganisms, Res. Dev. Tech. Rep., 5, p1-13.
- Gilman, A. G., L. S. Goodman, T. W. Rall, and F. Murad, (1985), Goodman and Gilman’s the pharmacological basis of therapeutics, 7th ed., Macmillan, New York, NY, USA., p712.
- Habermann, E., and K. G. Reiz, (1965), On the biochemistry of bee venom peptides, melittin and apamin, Biochem. Z., 343(2), p192-203.
-
Han, S. M., S. G. Kim, I. P. Hong, S. O. Woo, and H. R. Jang, (2017), Purification of phospholipase A2 from honeybeen venom, J. Apiculture, 32(1), p63-67.
[https://doi.org/10.17519/apiculture.2017.04.32.1.63]

-
Harrold, L., (2013), New developments in gout, Curr. Opin. Rheumatol., 25(3), p304-309.
[https://doi.org/10.1097/bor.0b013e32835fd5e5]

- Health Insurance Review & Assessment Service, (2011), 2010 National Health Insurance Statistical Yearbook, Wonju, Korea, p559-578.
-
Hsieh, M. S., H. C. Ho, D. T. Chou, S. Pan, Y. C. Liang, T. Y. Hsieh, J. L. Lan, and S. H. Tsai, (2003), Expression of matrix metalloproteinase-9 (gelatinase B) in gouty arthritis and stimulation of MMP-9 by urate crystals in macrophages, J. Cell Biochem., 89, p791-799.
[https://doi.org/10.1002/jcb.10530]

-
Kim, H. W., Y. B. Kwon, T. W. Ham, D. H. Roh, S. Y. Yoon, H. J. Lee, H. J. Han, I. S. Yang, A. J. Beitz, and J. J. Lee, (2003), Acupoint stimulation using bee venom attenuates formalin-induced pain behavior and spinal cord fos expression in rats, J. Vet. Med. Sci., 65(3), p349-355.
[https://doi.org/10.1292/jvms.65.349]

-
Kwak, C. S., K. J. Lee, J. H. Chang, J. H. Park, J. H. Cho, J. H. Park, K. M. Kim, and M. S. Lee, (2013), In vitro antioxidant, anti-allergic and anti-inflammatory effects of ethanol extracts from Korean sweet potato leaves and stalks, J. Korean Soc. Food Sci. Nutr., 42(3), p369-377.
[https://doi.org/10.3746/jkfn.2013.42.3.369]

-
Lee, Y. S., K. K. Kim, and N. W. Kim, (2011), The physiological activities of bark extract of Albizia julibrissin, Korean J. Food Preserv., 18(1), p79-86.
[https://doi.org/10.11002/kjfp.2011.18.1.079]

- Piek, T., (1986), Venoms of the Hymenoptera, p330, London, Academic Press.
- Rudenko, S. V., and E. E. Nipot, (1996), Modulation of melittin-induced hemolysis of erythocytes, Biokhimiia., 61(12), p2116-2124.
- Seo, S. J., and N. W. Kim, (2010), Physiological activities of leaf and root extracts from Liriope platyphylla, Korean J. Food Preserv., 17(1), p123-130.
- Stirpe, F., and E. Della Corte, (1969), The regulation of rat liver xanthine oxidase, J. Biol. Chem., 244, p3855-3863.
-
Sutaria, S., R. Katbamna, and M. Underwood, (2006), Effectiveness of interventions for the treatment of acute and prevention of recurrent gout-a systematic review, Rheumatology., 45(11), p1422-1431.
[https://doi.org/10.1093/rheumatology/kel071]

-
Wortmann, R. L., (2005), Recent advances in the management of gout and hyperuricemia, Curr Opin Rheumatol., 17(3), p319-324.
[https://doi.org/10.1097/01.bor.0000162060.25895.a5]

