
국내산 화분 (Bee pollen)의 항산화 및 혈관신생 억제 활성
Abstract
Bee pollen is collected from flowers by honeybees. And it has been reported to have excellent antioxidant capacity due to its various polyphenolic and flavonoid components. The aim of this study is to examine the amount of the total polyphenol flavonoid contents, and the antioxidant and antiangiogenic activities of the ethanol extracts of bee pollen (EEBP) collected from various regions of Korea. To evaluate the EEBP, antioxidant activities by 1,1-diphenyl-2-picylhydrazyl (DPPH) free radical-scavenging, 2,2ʹ-azino bis (3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) radical cation decolorization, and ferric reducing ability of plasma (FRAP) assays were performed. In addition, the in vitro angiogenesis experimental model, tube formation with growth of human umbilical vein endothelial cells (HUVECs), was used to test the antianiogenic effects of the EEBP. As a result, our data showed that the amount of total polyphenol and flavonoid contents in Korean bee pollens ranged from 25.61±3.75 to 145.39±2.71 mg/g of EEBP and from 11.68±0.47 to 56.40±0.01 mg/g of EEBP, respectively. The results of our antioxidant experiments showed that Korean bee pollens (B1~B12) have excellent antioxidant activities as compared to those from Spain (B13), Vietnam (B14), and China (B15). Especially, Korean bee pollens from Gyeongnam Sancheong (B9) and Gyeongbuk Uiseong (B10) had strong antioxidant activities. Also, Korean bee pollens collected from Jeju 1, 2 (B5, B6) and Gyeongnam Sancheong (B9) showed inhibitory effects in the tube formation assay. Thus, we concluded that Korean bee pollens have the antioxidant and anti-angiogenic effects as compared to the control groups. Based on our study, these effects of Korean bee pollens are expected to be useful to reduce the risk of developing lifestyle-related chronic diseases.
Keywords:
Korean bee pollen, Polyphenols, Flavonoids, Antioxidant activity, Antiangionenic activity서 론
벌 화분 (Bee pollen)은 꿀벌들이 꽃에서 꽃꿀을 수집할 때 뒷다리에 붙은 꽃가루와 꿀, 타액 등을 뭉쳐 수집한 것으로 꿀벌의 단백질원이자 생명유지와 성장에 필수적인 물질이며 로열젤리 (royal jelly)의 원료로도 이용된다 (Leblanc et al., 2009; Silva et al., 2014). 또한 탄수화물, 단백질, 지질, 비타민 및 무기질 등의 영양성분을 비롯하여, 페놀성 화합물 (phenolic compounds) 및 플라보노이드 (flavonoids)와 같은 생리활성물질이 풍부하여 완전한 식품으로 일컬어지고 있다 (Serra Bonbehí and Escolà Jordà, 1997; Feás, 2012). 화분의 화학 성분은 수확지역, 기후, 토양 상태 등 환경조건에 따라 달라지며 주로 식물의 종에 따라 달라지는 것으로 알려져 있다 (Feás et al., 2012).
활성산소 (Reactive Oxygen Species, ROS)는 정상적인 세포의 대사과정에서 생성되며 체내의 병원체를 공격하여 생체 방어작용을 한다. 그러나 활성산소는 불안정한 상태로 반응성이 높으므로 탄수화물, 단백질, 지질 및 핵산 등 생체 조직을 무차별적으로 공격하여 체내를 산화시키기도 한다 (Siems et al., 1995; Wang et al., 1996; Halliwell and Gutteridge, 1999; Marnett, 1999; Stadtman, 2004; Valko et al., 2006). 이러한 체내 과잉 생성된 활성산소로 인해 산화 균형이 깨진 상태를 산화 스트레스 (oxidative stress)라고 하며, 이는 노화와 암, 동맥경화, 당뇨병 등의 퇴행성 질환을 유발하는 것으로 보고되고 있다 (Yeh et al., 2003; Birben et al., 2012).
활성산소가 체내 필수 물질과 반응하기 전에 먼저 반응하여 세포의 산화를 억제하는 물질을 항산화제라고 한다. 페놀성 화합물과 같은 파이토케미컬 (phytochemicals)은 산화 스트레스를 줄이고 분자의 산화를 억제함으로써 퇴행성 질환의 위험을 감소시키는 것으로 보고되어 왔다 (Silva et al., 2004; Morais et al., 2011). 파이토케미컬은 식물류에 널리 존재하며 일반적으로 플라보노이드 (flavonoids), 카로티노이드 (carotenoids), 알칼로이드 (alkaloids), 탄닌 (tannins) 등이 있다. 특히 화분의 항산화 활성은 화분에 존재하는 페놀성 화합물과 플라보노이드 등과 관련이 있는 것으로 알려져 있으며, 그밖에도 항곰팡이, 간 보호, 항암 및 항염증 등의 효과가 있는 것으로 보고되고 있다 (Campos et al., 2003; Basim et al., 2006; Klarić et al., 2018).
혈관신생 또는 새로운 혈관의 성장은 기존의 혈관으로부터 새로운 혈관이 생성되는 과정이며, 세포는 혈관을 통해 영양분과 산소를 공급받으므로 암 세포의 성장과 전이에도 필수적인 역할을 하는 것으로 알려져 있다 (Folkman, 1971). 따라서 혈관신생의 억제는 암세포의 성장 지연과 더불어 암의 예방 및 치료에 도움을 줄 수 있는 것으로 기대되므로 현재 혈관신생 억제제에 관한 연구가 활발히 진행되고 있다 (Holleb and Folkman, 1972; Folkman, 1995; Tosetti et al., 2002). 양봉산물 중에서는 프로폴리스와 일부 꿀에 대한 혈관신생 억제활성 연구들이 보고되고 있으며, 국내에서 수집된 화분에 대하여 혈관신생 억제활성을 평가한 연구는 전무하다.
유럽을 비롯한 남미, 일본 등에서는 이미 오래 전부터 양봉산물에 대한 연구가 진행되어 왔으며, 가공식품뿐 아니라 의약품으로도 생산·개발되어 소비되고 있는 추세이다 (Kroyer and Hegedus, 2001). 최근 우리나라에서도 화분이 건강보조식품으로 각광받으며 수요가 지속적으로 증가하고 있으나 현재 국내에서 유통 중인 화분의 대부분은 수입산에 의존하고 있으며, 또한 국내산 화분의 구성성분 및 기능성 등에 대한 연구는 아직 충분하지 않은 실정이다. 따라서 본 연구는 국내산 화분의 항산화 및 혈관신생 억제 활성을 평가하여 화분의 유용성 및 기능성에 대한 기초 자료를 제공하고자 한다.
본 연구에서는 국내산 화분의 총 폴리페놀 및 플라보노이드 함량을 분석하여 특성을 파악하고, 더 나아가 기능성 식품소재로서 화분을 활용하기 위하여 1,1-diphenyl-2-picrylhydrazyl(DPPH)에 대한 free radical-scavenging activity, 2,2ʹ-azinobis (3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) radical cation decolorization, 그리고 ferric reducing ability of plasma (FRAP) assay를 통해 화분의 항산화 효능을 평가하였다. 뿐만 아니라 tube formation assay (in vitro)를 이용하여 인간 제대정맥 내피세포 (Human umbilical vein endothelial cells, HUVECs)에 대한 국내산 화분의 혈관신생 억제 활성을 평가하였다.
재료 및 방법
Bee pollen 시료
본 실험에 사용한 화분 시료는 국내산 화분 (12개)의 경우 2018년도, 국외산 화분 (3개)의 경우 2017년도에 생산된 것으로 한국양봉협회로부터 제공받아 분석하였다 (Table 1). 국내산 (B1~B12) 화분은 국내 다양한 지역으로부터 수집되었으며, 수입산 (B13~B15) 화분은 스페인, 베트남, 중국산 화분을 사용하였다. 단, 본 실험에서 시료의 상세는 모두 블라인드로 진행하였으며 제공받은 화분은 모두 밀폐된 상태로 -20℃에서 냉동 보관하였다.
Bee pollen 추출물 조제
화분 추출물은 동결건조한 화분 100 g에 100% ethanol 750 mL를 첨가하여 실온에서 3일간 교반하면서 추출하였다. 이후 여과지로 수차례 중복 여과한 여액을 농축기 (rotary vacuum evaporator, Buchi Rotavapor R-114, Switzerland)를 이용하여 감압농축 하였다. 그리고 동결건조 (Eyela, FD-5N, Japan)하여 분말화한 화분을 ethanol에 녹여 10% 용액으로 조제 (EEBP, ethanol extracts of bee pollen)한 후 본 실험에 사용하였다.
총 폴리페놀 함량 (total polyphenol contents)
총 폴리페놀 함량은 Folin-Ciocalteu 비색법을 일부 변형하여 분석하였다 (Singleton et al., 1999). EEBP 용액 0.5 mL에 10% Folin-Ciocalteu reagent 희석액 0.5 mL와 혼합하고, 3분 후 10% sodium carbonate (Na2CO3) 0.5 mL를 첨가하였다. 실온에서 1시간 반응시킨 후 3분간 3000 rpm으로 원심분리한 후 분광광도계 (UV spectrophotometer, OPTIMA)를 이용하여 760 nm에서 흡광도를 측정하였다. Gallic acid (Junsei Chemical, Japan)를 표준물질로 표준곡선을 작성하여 비색정량 하였으며, 농도는 건조된 bee pollen 무게당 정량된 total polyphenol 무게로 환산하였다.
총 플라보노이드 함량 (total flavonoid contents)
총 플라보노이드 함량은 Zhishen (1999) 등의 방법에 따라 측정하였다. EEBP 용액 0.5 mL에 2% aluminum chloride (AlCl3) 용액 0.5 mL를 첨가하여 실온에서 1시간 방치한 후 분광광도계를 이용하여 420 nm에서 흡광도를 측정하였다. Quercetin (Sigma, USA)을 표준물질로 표준곡선을 작성하여 비색정량 하였으며, 농도는 건조된 bee pollen 무게당 정량된 total flavonoid 무게로 환산하였다.
항산화 활성 평가
DPPH 소거활성은 Okada and Okada (1998)의 방법을 변형하여 측정하였다. EEBP 1250 μL에 0.5 mM DPPH ethanol solution 250 μL를 첨가하여 어두운 곳에서 1시간 방치한 후 517 nm에서 흡광도를 측정하였다. Control은 EEBP 대신 ethanol을 사용하였으며, control에 대한 흡광도의 감소 차를 이용하여 DPPH radical 소거능 (%)을 산출하였다. 이때 활성 비교를 위하여 합성 항산화제인 2,6-di-tert-butyl-4-methylphenol (BHT)와 천연 항산화제인 α-tocopherol (VE)를 첨가하여 동일한 방법으로 측정하였으며, DPPH radical 소거능은 다음의 계산식을 이용하여 산출하였다.
ABTS radical 소거활성은 Erel (2004)에 의해 기술된 방법에 따라 측정되었다. 7 mM ABTS 5 mL와 140 mM potasium persulphate (K2S2O8)를 혼합하여 암실에서 12~16시간 동안 방치하였다. 이후, ethanol 88 mL를 첨가하여 ABTS·+ 용액을 조제하였으며, ABTS·+ 용액의 농도를 734 nm에서 흡광도가 0.70±0.02가 되도록 ethanol로 희석하여 사용하였다. 희석된 ABTS·+ 용액 990 μL에 EEBP 용액 10 μL를 첨가하여 진탕하고, 5분간 실온에 방치한 후 734 nm에서 흡광도를 측정하였다. Control은 EEBP 대신 ethanol을 첨가하였으며 다음의 계산식에 의하여 ABTS radical 소거능 (%)을 산출하였다. 활성의 비교를 위하여 천연 항산화제인 VE와 합성 항산화제인 6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid (Trolox) 및 BHT를 첨가하여 같은 방법으로 측정하였다.
FRAP (Ferric reducing antioxidant power)에 의한 항산화 활성은 Benzie and Strain (1996)에 의해 기술된 방법을 일부 변형하여 평가하였다. 40 mM HCl에 녹인 10 mM 2,4,6-tripyridyl-s-triazine (TPTZ) 2.5 mL에 20 mM Iron (III) chloride hexahydrate (FeCl3·6H2O) 2.5 mL와 0.3 M acetate buffer (pH 3.6)를 혼합하여 FRAP reagent를 조제하였다. FRAP reagent 3 mL에 EEBP 100 μL를 첨가하여 3분간 방치한 후 593 nm에서 흡광도를 측정하였으며, FRAP 활성은 아래의 계산식에 의해 산출되었다. 시료간의 활성을 비교하기 위하여 천연 항산화제인 VE와 합성 항산화제인 BHT 및 Trolox를 첨가한 후 같은 방법으로 측정하였다.
혈관신생 억제활성
인체 유래의 제대정맥 내피세포 (human umbilical vein endothelial cells, HUVECs)는 collagen gel (Cell-gen)을 이용하여 모세관 모양의 구조물 (tube formation)을 형성하도록 유도하였다 (Kondo et al., 2002; Ahn et al., 2007). 200 μL의 collagen 용액 (0.21% in M199)을 24 well plate에 첨가하고 37℃에서 30분간 방치하여 gel을 굳혔다. 이어서, collagen gel에 HUVECs (1.2×105 cells/well)을 접종하여 1시간 동안 배양한 후 (37℃, 5% CO2) collagen 용액 150 μL를 첨가하고 30분간 배양하였다. 그리고 EEBP 용액을 첨가한 MCDB-104 (0.5% FBS, 10 ng/mL bFGF, 8 nM PMA, 25 μg/mL ascorbic acid) 배지 650 μL를 각 well에 첨가하고 24시간 동안 배양한 후 관강형성 (tube formation)의 정도를 현미경으로 관찰하였다.
결과 및 고찰
총 폴리페놀 및 플라보노이드 함량
국내산 (B1~B12) 화분 12개와 수입산 (B13~B15) 화분 3개에 대한 총 폴리페놀 및 총 플라보노이드 함량을 분석한 결과 Table 2와 같다. 전체 화분 (B1~B15) 시료의 총 폴리페놀 함량은 22.51±1.46~145.39±2.71 mg/g of EEBP 범위로 넓게 분포하고 있으며, 평균 함량은 51.63±1.25 mg/g of EEBP로 측정되었다. 특히 국내산 (B1~B12) 화분의 총 폴리페놀 함량은 평균 57.67±1.56 mg/g of EEBP으로, 수입산 (B13~B15) 화분의 평균 함량 (27.48±0.28 mg/g of EEBP)보다 약 2배 정도 더 높은 수치를 나타내었다. 경북 의성 (B10)에서 수집된 화분의 총 폴리페놀 함량은 145.39±2.71 mg/g of EEBP로 다른 화분 시료에 비해 월등히 높았으며, 제주 1 (B5), 경남 산청 (B9)에서 수집된 화분 또한 각 80.03±2.64 mg/g of EEBP, 75.09±2.26 mg/g of EEBP로 높게 나타났다. 반면 제주 2 (B6), 베트남 (B14), 중국 (B15)에서 수집된 화분의 경우 30 mg/g of EEBP 미만으로 낮은 폴리페놀 함량을 나타내었다. 제주 1, 2 (B5, B6)에서 수집된 화분의 경우 같은 지역에서 수집되었으나 총 폴리페놀 함량에 크게 차이를 나타내었는데, 이는 수집된 식물의 종, 색상 등에 차이가 있음을 보아 밀원식물이 다른 것에 기인된 것으로 사료된다. Ulusoy와 Kolayli (2013)가 보고한 터키산 화분의 총 폴리페놀 함량은 44.07~124.10 mg/g pollen 범위로 본 실험결과와 유사하게 나타났으며, 동결건조한 국내 다래 화분의 총 페놀 함량은 26.027 mgGAE/1000 mL로 보고된 바 있다 (홍 등, 2015).
화분 시료 15개에 대한 총 플라보노이드 함량을 분석한 결과 9.14±0.44~56.40±0.01 mg/g of EEBP 범위로, 평균 함량은 29.94±0.67 mg/g of EEBP로 측정되었다. 국내산 (B1~B12) 화분의 평균 플라보노이드 함량은 32.77±0.67 mg/g of EEBP로 앞서 측정한 폴리페놀 함량과 마찬가지로 수입산 (B13~B15, 18.62±0.68 mg/g of EEBP) 화분보다 높은 플라보노이드 함량을 나타내었다. 그리고 제주 1 (B5), 경남 산청 (B9), 경북 의성 (B10), 중국 (B15)에서 수집된 화분을 제외한 대부분의 화분은 플라보노이드가 페놀 함량의 대부분을 차지하는 것으로 나타났다. 특히 경남 산청 (B9)에서 수집된 화분의 플라보노이드 함량은 56.40±0.01 mg/g of EEBP으로 가장 높은 함량을 나타내었으며, 전북 고창 (B3), 전남 함평 (B4), 강원 양양 (B7)에서 수집된 화분의 경우도 40 mg/g of EEBP가 넘는 높은 플라보노이드 함량을 나타내었다. 반면, 경북 의성 (B10)에서 수집된 화분의 경우 높은 페놀 함량에 비해 비교적 낮은 플라보노이드가 함유되어 있는 것을 확인하였다. 각 화분의 총 폴리페놀 및 플라보노이드 함량의 차이는 화분의 품질을 결정하는데 중요한 요인으로 생각되며, 본 실험결과 국내산 (B1~B12) 화분은 높은 폴리페놀 및 플라보노이드 함량을 나타내고 있으므로 이로 인한 다양한 생리활성 등이 기대된다. 또한 화분 내 폴리페놀 성분의 대다수가 플라보노이드라고 알려져 있으나 일부 화분 시료의 경우 비플라보노이드 성분이 많이 함유된 경우도 있으므로 상세 구성성분 분석에 대한 추가적인 연구가 필요할 것으로 사료된다.
항산화 활성 평가
DPPH (2,2-diphenyl-2-picrylhydrazyl hydrate) radical 소거능은 산화방지제의 수소공여능을 측정함으로서 항산화능을 평가하는 대표적인 지표로 널리 이용되고 있다 (Ancerewicz et al., 1998; Miliauskas et al., 2004). 최종 농도 200 μg/mL로 첨가한 EEBP의 DPPH radical 소거능 결과는 Fig. 1과 같으며, 활성의 비교를 위해 사용된 BHT와 VE는 EEBP 1/10 농도에서 측정되었다. 각 화분 시료에 대한 항산화 활성은 2.81±0.67~89.02±1.62%로 나타났다. 국내산 (B1~B12) 화분의 DPPH free radical 소거능은 평균 57.58±1.42%, 수입산 (B13~B15) 화분의 radical 소거능은 평균 11.91±1.39%로 앞서 평가한 폴리페놀 함량 (Table 1)의 경향과 유사하게 나타났다. 제주 2 (B6), 강원 원주 (B8), 베트남 (B14), 중국 (B15)에서 수집된 화분을 제외한 모든 화분 시료는 positive control로 사용된 BHT (19.71±2.13%)보다 높은 활성을 나타내었다. 그리고 전북 고창 (B3), 전남 함평 (B4), 경남 산청 (B9), 경북 의성 (B10), 충남 금산 (B12)에서 수집된 화분의 경우 80% 이상의 높은 free radical 소거능을 보였으며, 특히 경북 의성 (B10)에서 수집한 화분의 DPPH free radical 소거능은 89.02±1.62%로 control로 사용된 천연 항산화제인 VE (88.61±1.94%)보다 높은 활성을 나타내었다. 반면 베트남 (B14)과 중국 (B15)에서 수집된 화분의 free radical 소거능은 각각 2.81±0.67%, 4.20±1.46%로 매우 낮은 활성을 나타내었다. 국내산을 포함한 모든 화분 (B1~B15) 시료의 DPPH free radical 소거능과 화분의 총 폴리페놀 함량과의 상관관계를 살펴본 결과 상관계수 R2은 0.480으로 나타났으며, 국내에서 수집된 화분의 DPPH free radical 소거능은 폴리페놀류의 기여가 있는 것으로 사료된다 (data not shown).
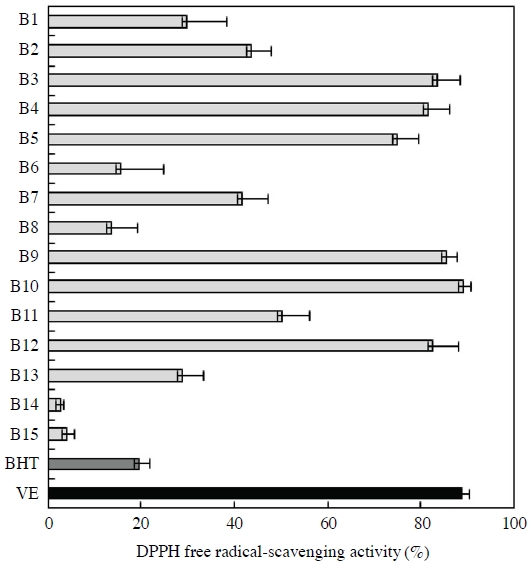
DPPH free radial-scavenging activity of EEBP (B1~B15). B1, Gyeonggi Namyangju 1; B2, Gyeonggi Namyangju 2; B3, Jeonbuk Gochang; B4, Jeonnam Hampyeong; B5, Jeju 1; B6, Jeju 2; B7, Gangwon Yangyang; B8, Gangwon Wonju; B9, Gyeongnam Sancheong; B10, Gyeongbuk Uiseong; B11, Gyeongbuk Youngdong; B12, Chungnam Geumsan; B13, Spain; B14, Vietnam; B15, China; BHT, butylated hydroxytoluene; VE, α-tocopherol. Measurements were carried out in triplicate. Means and standard deviations are indicated.
홍 등 (2014)은 국내산 도토리 화분과 다래 화분의 DPPH free radical 소거활성을 측정한 결과, 동결건조한 화분의 경우 물 추출물보다 에탄올 추출물에서 항산화능이 더욱 높아지며 radical 소거 활성은 각각 81.01±2.93%, 23.25±0.97%로 보고한 바 있다. 그리고 국내 메밀 화분과 벼 화분의 항산화능은 각각 8.10%, 36.09%라고 보고하였다 (홍 등 2016; 홍 등, 2017). Leja 등 (2007)도 폴란드의 크라쿠프 지역에서 토끼풀 (Trifolium sp.)을 포함한 12종의 화분에 대한 DPPH free radical 소거능을 분석한 결과 8.6~91.3%로 국내산 (B1~B12) 화분 시료와 비슷한 활성을 나타내었다. 이와 같이 국내에서 수집된 화분일지라도 수집 지역, 화분 내 함유 구성 성분과 그 함유량, 식물의 종 등에 따라 활성에 차이를 나타내는 것으로 사료된다.
전체 15개 화분 시료는 최종 농도 100 μg/mL의 EEBP로 평가하였으며 이에 대한 각 EEBP의 ABTS radical 소거능을 통해 항산화 활성을 분석하였다. 그 결과 EEBP의 ABTS radical 소거능은 28.19±3.66~93.34±0.07%이며, 국내산 (B1~B12) 및 수입산 (B13~B15) 화분의 평균은 각각 61.86±1.10%, 35.75±4.53%로 측정되었다 (Fig. 2). 경남 산청 (B9), 경북 의성 (B10)에서 수집된 화분의 ABTS radical 소거능은 각각 90.63±0.56%, 93.34±0.07%로 앞서 평가한 DPPH free radical 소거능 결과 (Fig. 1)와 같이 우수한 ABTS radical 소거능을 나타내었다. 이는 최종 농도 50 μg/mL의 positive control (BHT, Trolox 및 VE)에 대한 ABTS radical 소거능과 유사한 수치를 나타내었다. 그 다음으로 전북 고창 (B3), 충남 금산 (B12), 제주 1 (B5), 전남 함평 (B4)에서 수집된 화분이 각각 72.12±8.94%, 67.64±2.76%, 66.07±3.91%, 64.12±2.49%의 ABTS radical 소거활성을 나타내었다. 반면, 총 폴리페놀 함량 (Table 1)이 낮았던 베트남 (B14), 중국 (B15)에서 수집된 화분의 경우 ABTS radical 소거능 또한 낮게 측정되었다. 본 실험에서도 국내산 (B1~B12) 화분의 ABTS radical 소거능이 수입산 (B13~B15) 화분보다 2배 이상 높은 값을 나타내었으며 매우 우수한 것으로 평가되었다.
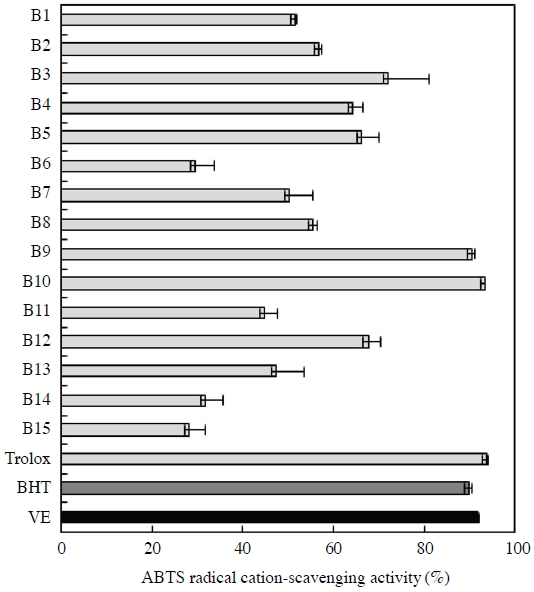
ABTS radial-scavenging activity of EEBP (B1~B15). B1, Gyeonggi Namyangju 1; B2, Gyeonggi Namyangju 2; B3, Jeonbuk Gochang; B4, Jeonnam Hampyeong; B5, Jeju 1; B6, Jeju 2; B7, Gangwon Yangyang; B8, Gangwon Wonju; B9, Gyeongnam Sancheong; B10, Gyeongbuk Uiseong; B11, Gyeongbuk Youngdong; B12, Chungnam Geumsan; B13, Spain; B14, Vietnam; B15, China; Trolox, 6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid; BHT, butylated hydroxytoluene; VE, α-tocopherol. Measurements were carried out in triplicate. Means and standard deviations are indicated.
박 등 (2013)이 보고한 한국산 참나무류 화분의 ABTS radical 소거활성은 90% 이상이었으며, 본 실험에서 분석한 경남 산청 (B9), 경북 의성 (B10)에서 수집된 화분은 이와 유사한 활성을 나타내었다. ABTS radical 소거능은 DPPH free radical 소거능 (Fig. 1)과 유사한 패턴의 결과를 나타내었으나, BHT를 포함한 positive control과 대부분 화분의 활성 수치는 DPPH radical 소거능 평가법 결과보다 다소 높게 나타났다. 이는 radical 측면에서 볼 때 DPPH는 안정한 free radical이나 ABTS는 양이온 radical이라는 차이가 있으며, 또한 DPPH는 주로 지용성 물질의 항산화능을 측정하는데 반해 ABTS는 수용성과 지용성 물질의 항산화능을 모두 측정할 수 있다는 점 등에 따라 다소 차이를 나타내는 것으로 사료된다 (Baltrušaitytė, 2007).
Ferric reducing ability of plasma (FRAP) 분석법은 colored ferrous tripyridyl triazine complex에 의해 ferric tripyridyltrizaine (Fe3+-TPTZ) 복합체가 낮은 pH에서 환원제에 의해 ferrous tripyridyltriazine (Fe2+-TPTZ)으로 전환되어지는 과정을 분석함으로써 시료 내의 항산화 능력을 측정하는 방법이다 (Benzie and Strain, 1996).
본 연구에 사용된 화분 (B1~B15) 시료는 5 mg/mL 농도의 EEBP를 이용하였으며, 이에 대한 FRAP 활성은 BHT 및 VE 1/10 농도와 비교하여 평가하였다 (Fig. 3). FRAP 활성은 전체 평균 78.49±3.85 μg/mL로, 국내산 (B1~B12) 및 수입산 (B13~B15) 화분의 평균 FRAP 활성은 각각 85.60±4.37 μg/mL, 31.99±3.31 μg/mL로 측정되었다. 특히 경북 의성 (B10)에서 수집된 화분의 FRAP 활성은 172.55±9.66 μg/mL로 천연 항산화제 VE (130.38±7.53 μg/mL)보다 더욱 높은 항산화 활성을 나타내었다. 이어서 경남 산청 (B9), 전남 함평 (B4), 전북 고창 (B3), 충남 금산 (B12), 강원 양양 (B7) 순으로 높은 FRAP 활성을 나타내었으며, 이는 합성 항산화제인 BHT (80.72±7.25 μg/mL)보다 높은 항산화 활성을 나타내었다. 또한 이들 시료는 총 폴리페놀 및 플라보노이드 함량, DPPH radical scavenging activity, ABTS radical cation-scavenging activity 결과에서도 모두 높은 활성을 나타내었다 (Table 1, Figs. 1, 2).
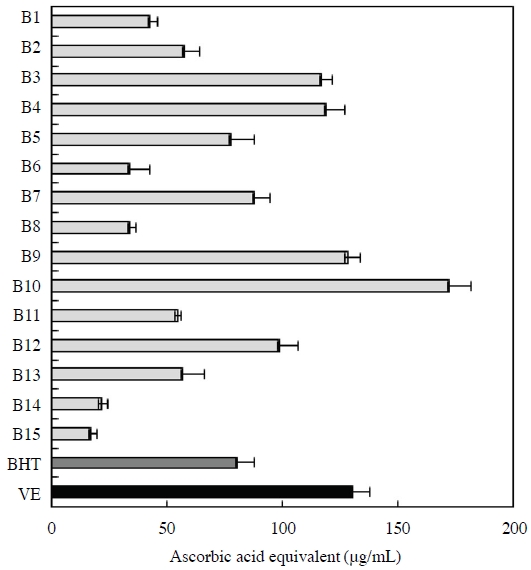
FRAP activity of EEBP (B1~B15). B1, Gyeonggi Namyangju 1; B2, Gyeonggi Namyangju 2; B3, Jeonbuk Gochang; B4, Jeonnam Hampyeong; B5, Jeju 1; B6, Jeju 2; B7, Gangwon Yangyang; B8, Gangwon Wonju; B9, Gyeongnam Sancheong; B10, Gyeongbuk Uiseong; B11, Gyeongbuk Youngdong; B12, Chungnam Geumsan; B13, Spain; B14, Vietnam; B15, China; BHT, butylated hydroxytoluene; VE, α-tocopherol. Measurements were carried out in triplicate. Means and standard deviations are indicated.
본 연구에서 분석한 화분 시료의 FRAP activity와 총 폴리페놀 함량과의 상관관계를 살펴본 결과, 상관계수 R2은 0.671로 시료에 함유된 총 폴리페놀 함량과 높은 상관관계가 있음을 확인하였다 (data not shown). 반면 수입산 (B13~B15) 화분은 총 폴리페놀 함량을 포함한 모든 항산화 평가에서 국내산 화분 (B1~B12)보다 낮은 활성을 나타내었다.
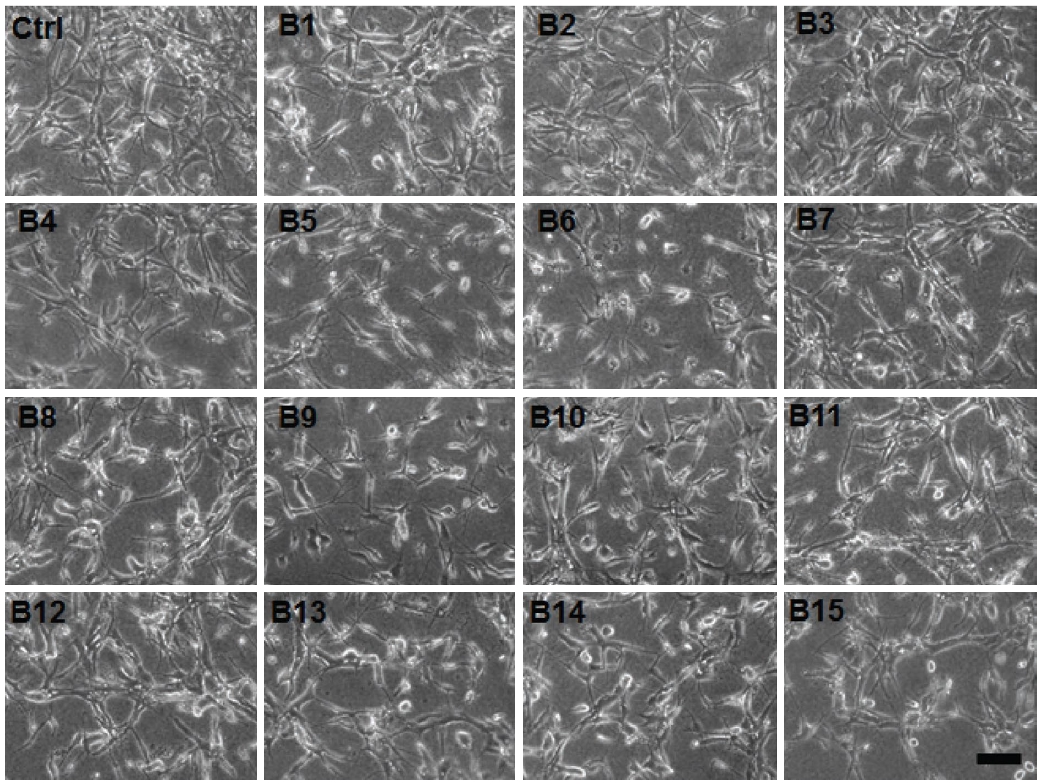
Tube formation assay with EEBP (B1~B15) on HUVECs. HUVECs were sandwiched between two layers of collagen gel and induced to form blood vessel-like tubes. The final concentration of EEBP was 400 μg/mL. Ctrl, Control; B1, Gyeonggi Namyangju 1; B2, Gyeonggi Namyangju 2; B3, Jeonbuk Gochang; B4, Jeonnam Hampyeong; B5, Jeju 1; B6, Jeju 2; B7, Gangwon Yangyang; B8, Gangwon Wonju; B9, Gyeongnam Sancheong; B10, Gyeongbuk Uiseong; B11, Gyeongbuk Youngdong; B12, Chungnam Geumsan; B13, Spain; B14, Vietnam; B15, China. Scale bar, 100 μm.
홍 등 (2014)은 동결건조한 국내 도토리 화분 및 다래 화분의 FRAP 활성을 측정한 결과, 물 추출물보다 에탄올 추출물에서 활성이 더 높게 나타났으며 그 값은 각각 3.89±0.04%, 2.37±0.03%로 보고한 바 있다. 또한 양봉산물인 propolis의 주요 구성성분에 따른 FRAP activity를 분석한 결과 artepillin C, p-coumaric acid, galangin은 BHT보다 우수한 항산화 활성을 가지며, caffeic acid phenethyl ester, kaempferol, quercetin 등은 천연 항산화제인 VE보다 우수한 활성을 가지는 것으로 보고된 바 있다 (Ahn et al., 2009). 특히 경북 의성 (B10)에서 수집된 화분을 포함한 일부 국내산 화분은 합성 항산화제인 BHT보다 높은 항산화 활성을 나타내었으며 이는 천연 산화방지제로서의 가능성이 매우 높은 것으로 보여진다. 따라서 국내산 (B1~B12) 화분의 밀원식물, 구성성분에 대한 체계적인 분석이 필요하며 이에 대한 지속적인 연구가 진행되어야 할 것으로 사료된다.
혈관신생 억제활성 평가
화분의 혈관신생 억제활성 평가는 본 연구팀이 독자적으로 개발한 in vitro tube formation assay 방법인 sandwich method를 통해 평가하였으며, 이는 ECM (extracellular matrix)의 소화 및 내피세포의 유주·접착이라 하는 주요한 혈관신생 과정과 내피세포 고유의 기능인 관강형성, 즉 세포의 형태변화 과정을 재현할 수 있는 점이 일반 샬레배양 실험법보다 매우 효과적이므로 이 점이 다른 연구와 가장 차별화된다.
전체 화분 시료 (B1~B15)에 대한 혈관신생 억제활성은 최종 농도 400 μg/mL로 첨가하였을 때 혈관신생 억제 활성을 나타내었다. 특히, 제주 1, 2 (B5, B6), 경남 산청 (B9)에서 수집된 화분은 관강형성을 억제하는 능력이 매우 우수한 것으로 나타났으며, 스페인 (B13), 베트남 (B14), 중국 (B15)에서 수집된 화분은 혈관신생 억제 효과가 다소 약한 것으로 확인되었다. 그리고 총 폴리페놀 함량과 항산화 활성이 가장 우수했던 경북 의성 (B10)의 화분은 혈관신생 억제 활성이 낮게 나타난 반면, 항산화 활성이 낮았던 제주 2 (B6), 중국 (B15)의 화분은 혈관신생 억제 효과가 비교적 높은 것으로 나타났다.
Izuta 등 (2009)은 양봉산물의 혈관신생 억제 활성을 평가한 결과, caffeic acid phenethyl ester (CAPE)와 red propolis (China)는 3 μg/mL에서, 화분 (Cistus ladanifer L., Cistus albidus L., Spain), 로열젤리 (Apis mellifera, China)는 300 μg/mL의 농도에서 유의적으로 관강형성을 억제하였으며, 이는 항산화 효과와도 일치한다고 보고한 바 있다. 또한 Rasouli 등 (2018)은 이란의 대추야자 (Phoenix dactylifera) 화분 추출물이 400 μg/mL 농도에서 혈관신생 억제 활성을 나타내었으며 농도 의존적으로 억제활성이 증가하는 것으로 보고하였던 바, 본 연구에서 조사한 화분과 유사한 농도에서 혈관신생 억제 활성을 나타내는 것을 확인하였다. 그러나 화분의 항산화 활성과 혈관신생 억제 활성에 대한 평가결과는 다소 일치하지 않는 것으로 보아 화분의 생리활성에 대한 상세성분 분석과 추가적인 연구가 필요할 것으로 사료된다.
본 연구에서는 국내산 (B1~B12) 화분과 수입산 (B13~B15) 화분에 대한 기능성을 다양한 항산화 실험방법과 in vitro tube formation assay를 이용하여 평가함으로써 국내산 화분의 잠재적인 생리활성 능력을 확인하였다. 결론적으로 국내산 화분은 수입산 화분에 비해 우수한 항산화 활성 및 혈관신생 억제 활성을 나타내는 것으로 확인되었으며, 이러한 결과는 국내산 화분을 이용하여 기능성 식품을 개발 및 제품화함에 있어 기초자료를 제공할 것으로 사료된다.
적 요
벌 화분 (Bee pollen)은 꽃에서 수집되어 꿀벌이 포장·운반하며 꿀벌의 주식으로 사용되므로 꿀벌의 성장과 생존에도 필수적이다. 화분은 다양한 폴리페놀 및 플라보노이드 성분으로 인해 우수한 항산화 능력을 가진 것으로 보고되고 있다. 따라서 본 연구는 국내 다양한 지역으로부터 화분을 수집하고, 에탄올 추출물 (ethanol extracts of the bee pollen, EEBP)을 조제하여 국내산 화분의 항산화 및 혈관신생 억제 활성과 같은 생리활성을 평가하고자 실시되었다. 본 연구결과, 국내산 화분의 총 폴리페놀과 플라보노이드 함량은 각각 25.61±3.75~145.39±2.71 mg/g of EEBP, 11.68±0.47~56.40±0.01 mg/g of EEBP로 나타났다. 또한 EEBP의 DPPH free radical 소거 활성, ABTS radical 양이온 소거능, 그리고 ferric reducing/antioxidant power (FRAP) assay를 이용하여 항산화 활성을 평가하였다. 그 결과, DPPH free radical 소거능, ABTS radical 양이온 소거활성 및 FRAP 분석 모두에서 국내산 (B1~B12) 화분이 수입산 (B13~B15) 화분보다 강력한 항산화 활성을 나타내었다. 특히 경북 의성 (B9), 경남 산청 (B10)에서 수집된 화분의 경우, 모든 항산화 실험에서 positive control로 사용된 천연 항산화 물질인 VE와 유사하거나 더 높은 활성을 나타내었다. 그리고 tube formation assay 실험결과, 대부분 시료의 경우 HUVECs의 관강 형성을 약하게 억제하였으나, 특히 제주 1, 2 (B5, B6)와 경남 의성 (B9)에서 수집된 화분의 혈관신생 억제 활성은 다른 화분에 비해 월등히 우수한 것으로 확인되었다.
Acknowledgments
본 연구는 한국양봉자조금위원회의 지원에 의하여 수행되었으며 이에 감사드립니다.
References
- 박영기, 김철우, 김재희, 김세현, 한상억, 최용수, (2015), 한국산 참나무류 화분의 항산화 활성, 한국양봉학회지, 30, p299-306.
- 홍인표, 우순옥, 한상미, 김세건, 장혜리, 이만영, 최용수, 김혜경, 이명렬, (2016), 벼화분의 영양학적 가치 및 항산화 활성, 한국양봉학회지, 31, p219-225.
- 홍인표, 우순옥, 한상미, 김세건, 장혜리, 최용수, 김혜경, 이명렬, 이만영, (2015), 동결건조를 이용한 다래화분의 영양성분 추출 효과, 한국양봉학회지, 30, p87-94.
- 홍인표, 우순옥, 한상미, 여주홍, 조미란, 주완택, 심하식, 최용수, 김혜경, 이명렬, 이만영, (2014), 도토리화분과 다래화분의 형태 및 항산화 활성, 한국양봉학회지, 29, p137-142.
- 홍인표, 우순옥, 한상미, 이미경, (2017), 메밀화분의 성분 특성 및 항산화 활성, 한국양봉학회지, 32, p261-268.
-
Ahn, M.-R., K. Kunimasa, S. Kumazawa, T. Nakayama, K. Kaji, Y. Uto, H. Hori, H. Nagasawa, and T. Ohta, (2009), Correlation between antiangiogenic activity and antioxidant activity of various components from propolis, Mol. Nutr. Food Res., 53, p643-651.
[https://doi.org/10.1002/mnfr.200800021]

-
Ahn, M.-R., S. Kumazawa, Y. Usui, J. Nakamura, M. Matsuka, F. Zhu, and T. Nakayama, (2007), Antioxidant activity and constituents of propolis collected in various areas of China, Food Chem., 101, p1383-1392.
[https://doi.org/10.1016/j.foodchem.2006.03.045]

- Ancerewicz, J., E. Miglavaca, P. A. Carrupt, B. Testa, F. Bree, R. Zinin, J. P. Tillement, P. Labidelle, S. D. Goyot, A. M. Chauvet-Monges, A. Crevent, and A. Le Ridant, (1998), Structure property relationship of trimetadizine derivatives and model compounds as potential antioxidants, Free Radic. Biol. Med., 25, p113-120.
-
Baltrušaitytė, V., P. R. Venskutonis, and V. Čeksterytė, (2007), Radical scavenging activity of different floral origin honey and beebread phenolic extracts, Food Chem., 101, p502-514.
[https://doi.org/10.1016/j.foodchem.2006.02.007]

-
Basim, E., H. Basim, and M. Özcan, (2006), Antibacterial activities of Turkish pollen and propolis extracts against plant bacterial pathogens, J. Food Process Eng., 77, p992-996.
[https://doi.org/10.1016/j.jfoodeng.2005.08.027]

- Benzie, I. F. F., and J. J. Strain, (1996), The ferric reducing ability of plasma as a measure of ‘antioxidant power’: the FRAP assay, Anal. Biochem., 293, p70-76.
- Birben, E., M. U. Sahiner, C. Sackesen, S. Erzurum, and V. O. Kalayci, (2012), Oxidative Stress and Antioxidant Defense, World Allergy Organ. J., 5, p9-19.
- Campos, M. G., R. F. Webby, K. R. Markham, K. A. Mitchell, and A. P. Da Cunha, (2003), Aged induced diminution of free radicals scavenging capacity in bee-pollens and the contribution of constituents flavonoids, J. Agric. Food Chem., 51, p742-745.
- da Silva, I. A., T. M. da Silva, C. A. Camara, N. Queiroz, M. Jaílson, J. S. de Novais, L. E. Soledade, O. Lima Ede, A. L. de Souza, and A. G. de Souza, (2014), Phenolic profile, antioxidant activity and palynological analysis of stingless bee honey from Amazonas, Northern Brazil, Food Chem., 141, p3552-3558.
-
Erel, O., (2004), A novel automated direct measurement method for total antioxidant capacity using a new generation, more stable ABTS radical cation, Clin. Biochem., 37, p277-285.
[https://doi.org/10.1016/j.clinbiochem.2003.11.015]

-
Feás, X., P. M. Vázquez-Tato, L. Estevinho, J. A. Seijas, and A. Antonio Iglesias, (2012), Organic Bee Pollen: Botanical Origin, Nutritional Value, Bioactive Compounds, Antioxidant Activity and Microbiological Quality, Molecules., 17, p8359-8377.
[https://doi.org/10.3390/molecules17078359]

- Folkman, J., (1971), Tumor angiogenesis: therapeutic implications, N. Engl. J. Med., 285, p1182-1186.
- Folkman, J., (1995), Clinical application of research on angiogenesis, N. Engl. J. Med., 333, p1757-1763.
- Halliwell, B., and J. M. C. Gutteridge, (1999), Free Radicals in Biology and Medicine, Free Radic. Biol. Med., 1, p331-332.
- Holleb, A. I., and J. Folkman, (1972), Tumor angiogenesis, CA: Cancer J. Clin., 22, p226-229.
- Izuta, H., M. Shimazawa, K. Tsuruma, Y. Araki, S. Mishima, and H. Hara, (2009), Bee products prevent VEGF-induced angiogenesis in human umbilical vein endothelial cells, BMC Complement Altern. Med., 17, p9-45.
-
Klarić, I., M. Domaćinović, V. Šerić, I. Miškulin, M. Pavić, and K. Paradinović, (2018), Effects of bee pollen and propolis on performance, mortality, and some haematological blood parameters in broiler chickens, Slov. Vet. Res., 55, p23-34.
[https://doi.org/10.26873/svr-385-2018]

-
Kondo, T., T. Ohta, K. Igura, Y. Hara, and K. Kaji, (2002), Tea catechins inhibit angiogenesis in vitro, measured by human endothelial cell growth, migration and tube formation, through inhibition of VEGF receptor binding, Cancer Lett., 180, p139-144.
[https://doi.org/10.1016/s0304-3835(02)00007-1]

-
Kroyer, G., and N. Hegedus, (2001), Evaluation of bioactive properties of pollen extracts as functional dietary food supplement, Innov. Food Sci. Emerg. Technol., 2, p171-174.
[https://doi.org/10.1016/s1466-8564(01)00039-x]

-
LeBlanc, B. W., O. K. Davis, S. Boue, A. DeLucca, and T. Deeby, (2009), Antioxidant activity of Sonoran Desert bee pollen, Food Chem., 115, p1299-1305.
[https://doi.org/10.1016/j.foodchem.2009.01.055]

-
Leja, M., A. Mareczek, G. Wyzgolik, B. J. Klepacz, and K. Czekońska, (2007), Antioxidative properties of bee pollen in selected plant species, Food Chem., 100, p237-240.
[https://doi.org/10.1016/j.foodchem.2005.09.047]

-
Marnett, L. J., (1999), Lipid peroxidation-DNA damage by malondialdehyde, Mutat. Res., 424, p83-95.
[https://doi.org/10.1016/s0027-5107(99)00010-x]

- Miliauskasa, G., P. R. Venskutonisa, and T. A. Beek van, (2004), Screening of radical scavenging activity of some medicinal and aromatic plant extracts, Food Chem., 85, p231-237.
-
Morais, M., L. Moreira, X. Feás, and L. M. Estevinho, (2011), Honeybee-collected pollen from five Portuguese Natural Parks: Palynological origin, phenolic content, antioxidant properties and antimicrobial activity, Food. Chem. Toxicol., 49, p1096-1101.
[https://doi.org/10.1016/j.fct.2011.01.020]

-
Okada, Y., M. Okada, (1998), Scavenging effect of water soluble proteins in broad beans on free radicals and active oxygen species, J. Agric. Food Chem., 46, p401-406.
[https://doi.org/10.1021/jf970470l]

-
Rasouli, H., H. A. Norooznezhad, T. Rashidi, Z. Hoseinkhani, A. Mahnam, M. Tarlan, N. Moasefi, A. Mostafaei, and K. Mansouri, (2018), Comparative in vitro/theoretical studies on the anti-angiogenic activity of date pollen hydroalcoholic extract: Highlighting the important roles of its hot polyphenols, BioImpacts., 8, p281-294.
[https://doi.org/10.15171/bi.2018.31]

- Serra Bonvehí, J., and R. Escolà Jordà, (1997), Nutrition composition and microbiological quantity of honeybee-collected pollen in Spain, J. Agric. Food Chem., 45, p725-732.
-
Siems, W. G., T. Grune, and H. Esterbauer, (1995), 4-Hydroxynonenal formation during ischemia and reperfusion of rat small intestine, Life Sci., 57, p785-789.
[https://doi.org/10.1016/0024-3205(95)02006-5]

-
Silva, B.M., P. B. Andrade, P. Valentão, F. Ferreres, R. M. Seabra, and M. A. Ferreira, (2004), Quince (Cydonia oblonga Miller) fruit (pulp, peel and seed) and jam: antioxidant activity, J. Agric. Food Chem., 52, p4705-4712.
[https://doi.org/10.1021/jf040057v]

- Singleton, V. L., R. Orthofer, and R. M. Lamuela-Raventos, (1999), Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent, Methods Enzymol., 299, p152-178.
-
Stadtman, E. R., (2004), Role of oxidant species in aging, Curr. Med. Chem., 11, p1105-1112.
[https://doi.org/10.2174/0929867043365341]

-
Tosetti, F., N. Ferrari, S. de Flora, and A. Albini, (2002), ‘Angioprevention’: angiogenesis is a common and key target for cancer chemopreventive agents, FASEB. J., 16, p2-14.
[https://doi.org/10.1096/fj.01-0300rev]

- Ulusoy, E., and S. Kolayli, (2013), Phenolic Composition and Antioxidant Properties of Anzer Bee Pollen, Food Biochem., 38, p73-82.
-
Valko, M., C. J. Rhodes, J. Moncol, M. Izakovic, and M. Mazur, (2006), Free radicals, metals and antioxidants in oxidative stress-induced cancer, Chem.-Biol. Interact., 160, p1-40.
[https://doi.org/10.1016/j.cbi.2005.12.009]

- Wang, M. Y., K. Dhingra, W. N. Hittelman, J. G. Liehr, M. de Andrade, and D. H. Li, (1996), Lipid peroxidation-induced putative malondialdehyde-DNA adducts in human breast tissues, Cancer Epidemiol. Biomark. Prev., 5, p705-710.
-
Yeh, G. Y., D. M. Eisenberg, T. J. Kaptchuk, and R. S. Phillips, (2003), Systematic review of herbs and dietary supplements for glycemic control in diabetes, Diabetes Care., 26, p1277-1294.
[https://doi.org/10.2337/diacare.26.4.1277]

-
Zhishen, J., T. Mengcheng, and W. Jianming, (1999), The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals, Food Chem., 64, p555-559.
[https://doi.org/10.1016/s0308-8146(98)00102-2]

