국산 밤꿀 중 kynurenic acid의 UPLC 신속 분석법
Abstract
Chestnut honey, which is collected from nectar of Castanea crenata by honeybees, is known as nutritional food with antioxidant and antibacterial effects. However, chromatographic method for quality control of chestnut honey has not yet been established. In present study, the UPLC method for kynurenic acid in chestnut honey was established using C18 column with mobile phase consisting of 20 mM TFA/MeCN and 20 mM TFA/H2O at 240 nm, and was validated by tests of various parameters such as specificity, linearity, precision and accuracy. The established method was sufficiently applied to quantitative analysis of kynurenic acid in chestnut honey produced in Korea. These results suggest that the UPLC method could be efficiently used for quality control of chestnut honey distributed in Korea.
Keywords:
Chestnut honey, Castanea crenata, Kynurenic acid, UPLC서 론
벌꿀은 2018년도 기준으로 국내 양봉산물 생산량 중 가장 큰 비중을 차지하고 있으며 국내 양봉농가의 주요 소득원으로 알려져 있다 (정 등, 2019). 벌꿀은 당류를 포함한 아미노산, 비타민, 무기질과 같은 영양성분이 포함되어 있는 꿀벌의 산물이며 다양한 밀원식물로부터 꿀벌이 꽃꿀을 수집하여 벌집에 저장한 물질이다 (Abou-Shaara, 2015; Meo et al., 2017).
벌꿀의 국내 규격은 식품의약품안전처 식품공전에 고시된 수분, 전화당, 산도, 자당, 히드록시메틸푸르푸랄, 타르색소, 사카린나트륨, 이성화당, 탄소동위원소비율 등 10가지 항목으로 설정되어 있다 (식품의약품안전처, 2020). 하지만, 아까시나무 (Robinia pseudoacacia), 밤나무 (Castanea crenata), 피나무 (Tilia amurensis), 때죽나무 (Styrax japonicus), 음나무 (Kalopanax septemlobus), 헛개나무 (Hovenia dulcis)와 같은 국내에서 자생하는 밀원식물 유래 벌꿀에 대한 개별적인 규격 기준은 설정되어 있지 않다.
밤꿀은 아카시아꿀 이후 생산되는 우리나라 여름철의 대표적인 벌꿀이다. 밤꿀은 동물취가 강하고 암갈색을 띠며 쓴맛이 있지만 항산화 및 항균 활성이 우수하며 아미노산, 무기질, 비타민과 같은 영양성분이 다양하게 포함되어 있다 (Lee et al., 2007; Jung and Chon, 2016; Kim et al., 2017). 밤꿀에는 영양성분 이외에도 밤나무 (Castanea crenata) 유래 2차 대사산물인 페놀성 화합물과 의약품의 선도물질로 이용되는 알칼로이드 계열 물질이 함유되어 있다 (Lee et al., 2007; Cho et al., 2015).
밤꿀의 품질평가 연구는 밤나무 화밀의 특이성분으로 알려진 kynurenic acid를 지표물질로 설정하여 HPLC로 분석한 결과를 Truchado et al. (2009)과 Turski et al. (2016)이 보고하였다. 하지만 이 분석방법들은 kynurenic acid의 검출시간이 길고 분석법에 대한 밸리데이션을 실시하지 않아 분석법의 신뢰성과 범용으로 사용하기 어려운 단점이 있다.
본 연구에서는 국내에서 유통되는 밤꿀의 품질평가를 위하여 kynurenic acid를 지표성분으로 설정한 다음 UPLC (ultra performance liquid chromatography)를 이용하여 기존의 방법보다 신속하고 정확한 방법을 확립하고자 하였다.
재료 및 방법
1. 공시 시료
분석시료는 경기도, 강원도, 충청북도, 충청남도, 전라북도, 전라남도, 경상북도, 경상남도에서 서양종꿀벌 (Apis mellifera)을 사육하는 농가로부터 2016년도에 채밀한 밤꿀을 구입하여 실험에 사용하였으며, 모든 시료는 상온 (25±5℃)에서 보관하였다.
2. 시약
밤꿀의 성분 추출 및 분리에 사용한 ethyl acetate, methanol은 SK chemical (Seongnam, Korea)사 제품을 사용하였고, HPLC 등급의 분석용매 acetonitrile은 Honeywell (Morris plains, NJ, USA)사 제품을 사용하였다. TLC plate (layer thickness 0.25 mm, 20×20 cm, Art. No. 5715)는 Merck (Darmstadt, Hessen, Germany)사 제품이었고, 컬럼 크로마토그래피에 사용한 ODS (octadecylsilyl-silica) 및 St-DVB (styene-dibinylbenzene polymer) gel은 각각 YMC (ODS-A, 75 μm, Kyoto, Japan), Mitsubishi chemical (CHP20/P120, 75~150 μm, Tokyo, Japan)사 제품이었다. NMR 측정용 DMSO-d6는 Cambridge Isotope Laboratories (Tewksbury, MA, USA)에서 구입하였다.
3. 지표성분의 분리
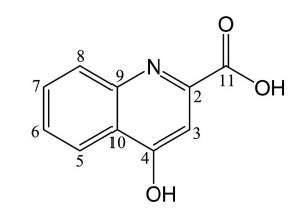
경기도에서 생산한 밤꿀 15.9 kg에 ethyl acetate 40 L를 넣고 교반기를 사용하여 30분간 3회 반복 추출한 후 상층액을 감압하에 농축하여 ethyl acetate 추출물 15 g을 얻었다. 얻어진 추출물 15 g에 대하여 St-DVB gel을 충진시킨 컬럼 (10×60 cm)에 20%, 30%, 40%, 50%, 60%, 70%, 80%, 100% methanol의 step-wise 조건으로 각각 2 L씩 용출시킨 다음 8개의 소분획으로 나누었다 (CHEF1-8). 이 중 CHEF2 (1.8 g) 획분에 대하여 ODS gel로 충진된 컬럼 (3×60 cm)에 20% methanol을 이동상으로 사용하여 용출시킨 다음 용출액을 20 mL씩 분획하였다. 수집된 용출액 중 340~720 mL 범위에 있는 소분획을 감압하에 농축하여 분말을 얻었다. 얻어진 분말 중 methanol에 용해되지 않는 부분만 취하여 화합물 (18 mg)을 분리하였다. 분리된 화합물은 문헌치 (Beretta et al., 2007)와 비교하여 kynurenic acid로 동정하였으며 (Fig. 1), 순도는 95% 이상이었다.
Kynurenic acid - 1H-NMR (600 MHz, DMSO-d6): δ 6.64 (1H, s, H-3), 7.36 (1H, t, J=7.6 Hz, H-6), 7.69 (1H, t, J=8.9 Hz, H-7), 7.95 (1H, d, J=8.9 Hz, H-8), 8.08 (1H, d, J=7.6 Hz, H-5); 13C-NMR (150 MHz, DMSO-d6): δ 109.9 (C-3), 119.7 (C-6), 123.9 (C-5), 124.7 (C-8), 125.8 (C-9), 132.5 (C-7), 139.1 (C-2), 140.1 (C-10), 163.7 (C-11), 177.6 (C-4).
4. 분석시료 전처리
밤꿀에 메탄올을 넣어 0.1 g/mL로 만들고 초음파 추출기에서 30분간 추출한 다음 0.2 μm PTFE (Adventec, Dublin, OH, USA) 필터로 여과하여 분석에 사용하였다. 분석시료는 분석 직전에 만들어 사용하였다.
5. UPLC 분석조건
UPLC는 Waters (Minneapolis, MN, USA)사의 ACQUITY UPLC I-Class 모델을 사용하였으며, 분석조건은 Table 1과 같다.
6. 분석법 밸리데이션
밤꿀의 UPLC 분석법은 특이성 (specificity), 직선성 (linearity), 검출한계 (limit of detection, LOD), 정량한계 (limit of quantification, LOQ), 정밀성 (precision) 및 정확성 (accuracy) 평가를 통하여 검증하였다.
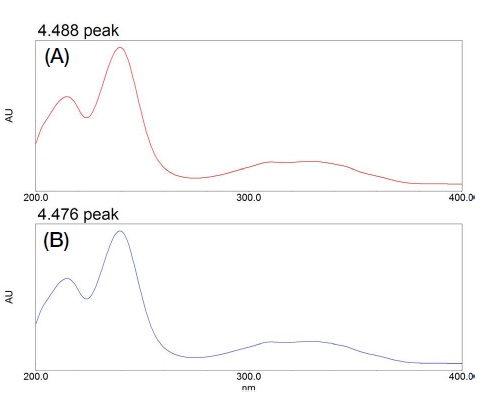
특이성은 표준용액과 시험용액에서 검출된 지표성분 피크의 UV 흡수 스펙트럼 (200~400 nm) 패턴의 일치 여부로 평가하였다.
직선성은 지표성분을 methanol에 녹여 200 μg/mL로 만들고 이를 희석하여 1, 5, 10, 50, 100 μg/mL의 5가지 농도에서 각각 3회 반복시험을 실시하여 검량선을 작성하였으며, 직선성의 평가는 검량선의 상관계수 (R2)가 0.99 이상일 때 직선성을 인정하였다.
검출한계와 정량한계는 검량선에 근거하는 방법을 사용하였다. 즉, 지표성분 검량선의 회귀방정식 (y=aX+b, y: 피크의 면적, a: 직선식의 기울기, b: y절편)에서 직선식의 기울기S)와 y절편의 표준편차 (σ)를 사용하였으며 각각의 식으로부터 3.3×σ/S, 10×σ/S 검출한계와 정량한계를 계산하였다.
정밀성은 직선성에 사용한 지표성분 1~100 μg/mL 범위에 있는 5, 10, 50 μg/mL의 농도에 대하여 일간 (inter day) 및 일내 (intra day) 농도 변화를 측정하여 평가하였다. 일간 정밀성 평가는 5일에 걸쳐 48시간마다 각 농도에 대하여 3회 반복 실험하였으며, 일내 정밀성 평가는 각 농도에 대한 3회 반복 실험을 통하여 평가하였다.
정확성 평가는 분석시료에 지표성분을 첨가하여 최종농도가 10, 20, 40 μg/mL로 만들고 각각의 농도를 3회씩 반복 분석한 다음 시험에 사용한 3가지 농도의 회수율 (recovery) 통하여 확인하였다.
결과 및 고찰
1. 분석조건의 확립
본 연구에서는 밤꿀의 밀원식물 유래 특이성분을 확인하고자 UPLC에 장착된 PDA (photo diode array) 검출기를 이용하여 200~400 nm에서 흡수되는 피크를 관찰하였다. 그 결과, 240 nm에서 강하게 흡수되는 피크가 확인되었으며 (결과 미제시) 이 성분은 NMR 분석을 통하여 kynurenic acid로 확인되었다. Kynurenic acid는 kynurenine pathway를 통하여 생성되는 tryptophan의 대사체이며 밤나무의 잎, 줄기, 뿌리, 꽃 등 다양한 부위에 존재한다. 특히 밤나무의 수꽃에 다량 함유된 물질로, 항염증 및 항위염 효과를 발현하는 생리활성 화합물이다 (Hilmas et al., 2001; Farkas and Zajacz, 2007; Adams et al., 2012; Turski et al., 2016). 따라서 밤꿀의 품질평가를 위하여 kynurenic acid를 지표물질로 사용하였다.
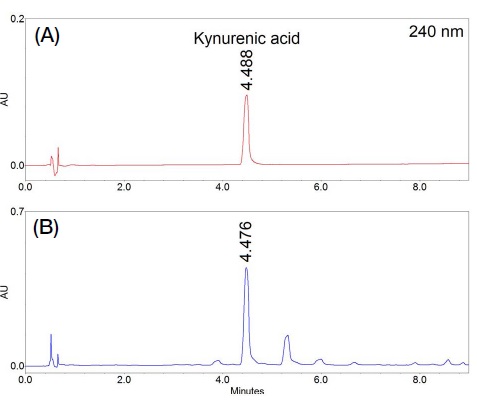
밤꿀에 포함된 kynurenic acid 피크의 분리도 향상을 위하여 컬럼의 고정상, pH 변화에 따른 이동상의 조성, 컬럼온도에 대하여 분석조건을 검토한 결과 (결과 미제시), 역상컬럼에 20 mM triÁuoroacetic acid가 함유된 distilled watr와 acetonitrile을 이동상으로 사용하고 컬럼온도를 30℃로 설정하였을 때 검출파장 240 nm에서 kynurenic acid와 인접한 피크와의 양호한 분리를 확인할 수 있었다 (Fig. 2). 밤꿀에 포함된 kynurenic acid의 UPLC 분석시간은 9분 이내에 가능하였으며 머무름시간은 4.488분이었다.
확립된 UPLC 분석법은 Turski et al. (2016)이 보고한 HPLC-FLD (high performace liquid chromatography-fluorescence detector) 분석법보다 7분 이상 빠르게 지표성분을 검출할 수 있었으며 Truchado et al. (2009)이 보고한 HPLC-DAD (diode array detector) 분석법보다 지표성분의 분리도가 우수하였다. 또한, 분석시료 전처리에서 염기 및 산을 사용한 알칼로이드 추출법을 사용하지 않고 methanol을 분석 전처리 용매로 사용하여 밤꿀에 포함된 kynurenic acid를 추출할 수 있었다.
2. 분석법 검증 (Method validation)
Fig. 3에서 보는 바와 같이 표준용액과 시험용액의 지표성분은 동일한 시간에 검출되었으며 UV 흡수 스펙트럼은 동일한 패턴을 나타내었다. 확립된 분석방법은 특이성을 나타내는 것으로 확인되었다.
지표성분의 1~100 μg/mL 범위에 있는 5가지 농도의 피크 면적을 측정하여 검량선을 작성한 결과, 검량선의 상관계수 (correlation coefficient, R2)는 1.000으로 우수한 직선성을 나타내었으며 지표성분의 함량을 계산할 수 있는 회귀방정식 (Y=53835x+2234.1)이 산출되었다. 밤꿀에 포함된 kynurenic acid의 검출한계와 정량한계는 각각 0.12, 0.41 μg/mL이었다 (Table 2).
직선성을 평가한 농도 범위에 있는 지표성분 3가지 농도 (5, 10, 50 μg/mL)에 대하여 일내 (intra day) 및 일간 (inter day) 농도 변화를 분석한 결과, 4% 미만의 상대표준편차 (RSD%)를 나타내어 우수한 정밀성을 가지는 것으로 확인되었다 (Table 3).
3. 지역별 생산 밤꿀에 대한 지표성분 함량평가
확립된 UPLC 분석법으로 국내 8개 지역에서 생산한 밤꿀에서 kynurenic acid를 분석하고 각각의 함량을 평가하여 그 결과를 Table 5에 나타내었다. 밤꿀에 포함된 kynurenic acid는 경기도 안산시에서 생산한 밤꿀에 가장 높은 함유량 (589.3 mg/kg)을 나타냈으며 전라북도 고창군에서 생산한 밤꿀에 가장 낮은 함유량 (192.4 mg/kg)을 나타내었다. Turski et al. (2016)은 이탈리아, 프랑스, 독일, 프랑스, 그리스 등 유럽에서 생산한 밤꿀 내 kynurenic acid는 129~601 mg/kg으로 보고하였는데, 국내 생산 밤꿀 역시 지역별로 함량 차이를 나타내었다. 이와 같은 결과는 밤나무의 개화시기 (6월)와 유사한 헛개나무 (Hovenia dulcis), 피나무 (Tilia amurensis), 모감주나무 (Koelreuteria paniculata)와 같은 밀원식물의 화밀이 꿀벌에 의하여 벌집에 같이 저장되어 밤꿀의 순도가 낮아진 것으로 판단된다. 또한, 식물은 같은 종이라 할지라도 식생지역의 온도, 습도, 토양성분에 따라 화밀의 성분 함량 차이를 나타내는데 (Kim et al., 2017), 밤꿀의 밀원식물인 밤나무의 식생지역 차이로 인하여 밤꿀 중 kynurenic acid 함량 차이를 보인 것으로 생각된다.
적 요
현재 우리나라에서 생산되는 밤꿀은 수분 함량, 탄소동위원소비, 당비 (과당/포도당 비율), (HMF)hydroxymethylfufural 함량에 따라 축산물품질평가원 및 한국양봉협회에서 품질등급이 판정되고 있지만 특이성분을 근거로 품질등급을 평가할 분석법이 확립되지 않았다. 본 연구에서는 밤나무 화밀 유래 특이성분으로 알려진 kynurenic acid를 이용하여 기존의 방법보다 신속하고 정확한 UPLC분석법을 확립하였으며 특이성, 직선성, 검출한계, 정량한계, 정밀성, 정확성을 통하여 분석법을 검증하였다. 확립된 분석법은 국내에서 생산된 밤꿀 중 kynurenic acid의 함량을 신속하고 효율적으로 평가할 수 있었으며 국내 유통되는 밤꿀의 품질평가 및 등급기준 마련을 위해 충분히 적용할 수 있을 것이라 판단되었다.
Acknowledgments
본 연구는 농촌진흥청 공동연구사업 (과제번호: PJ01574601)에 의하여 수행되었으므로 감사를 드립니다.
References
- 식품의약품안전처. 2020. 식품공전. 식품의약품안전처. 청주, 대한민국.
- 정민국, 허덕, 이용건, 이정민, 김태련. 2019. 양봉산업 실태조사 연구. 한국농촌경제연구원. pp. 9-13.
- Abou-Shaara, H. F. 2015. The origin of honey bees, life: A viewpoint. J. Entomol. Zool. Stud. 3: 239-241.
-
Adams, S., N. Braidy, A. Bessede, B. J. Brew, R. Grant, C. Teo and G. J. Guillemin. 2012. The kynurenine pathway in brain tumor pathogenesis. Cancer Res. 72: 5649-5657.
[https://doi.org/10.1158/0008-5472.CAN-12-0549]

-
Beretta, G., E. Caneva and R. M. Facino. 2007. Kynurenic acid in honey from arboreal plants: MS and NMR evidence. Planta Med. 73: 1592-1595.
[https://doi.org/10.1055/s-2007-993740]

-
Cho, J. Y., S. H. Bae, H. K. Kim, M. L. Lee, Y. S. Choi, B. R. Jin, H. Lee, H. Y. Jeong, Y. G. Lee and J. H. Moon. 2015. New Quinolinone Alkaloids from Chestnut (Castanea crenata Sieb) Honey. J. Agric. Food Chem. 63: 3587-3592.
[https://doi.org/10.1021/acs.jafc.5b01027]

- Farkas, A. and E. Zajacz. 2007. Nectar production for the hungarian honey industry. Eur. J. Plant Sci. Biotechnol. 1: 125-151.
-
Hilmas, C., E. F. Pereira, M. Alkondon, A. Rassoulpour, R. Schwarcz and E. X. Albuquerque. 2001. The brain metabolite kynurenic acid inhibits alpha7 nicotinic receptor activity and increases non-alpha7 nicotinic receptor expression: physiopathological implications. J. Neurosci. 21: 7463-7473.
[https://doi.org/10.1523/JNEUROSCI.21-19-07463.2001]

-
Jung, C. and J. W. Chon. 2016. Quality Assessment of Honey from Different Floral Origin in Korea. J. Apic. 31: 103-111.
[https://doi.org/10.17519/apiculture.2016.06.31.2.103]

-
Kim, S. G., I. P. Hong, S. O. Woo, H. R. Jang, J. S. Jang and S. M. Han. 2017. Chemical Composition of Korean Natural Honeys and Sugar Fed Honeys. Korean J. Food Nutr. 30: 112-119.
[https://doi.org/10.9799/ksfan.2017.30.1.112]

-
Kim, S. H., A. Lee, H. Y. Kwon, U. Lee and M. S. Kim. 2017. Analysis of Flowering and Nectar Characteristics of Major Four Chestnut Cultivars (Castanea spp.). J. Apic. 32: 237-246.
[https://doi.org/10.17519/apiculture.2017.09.32.3.237]

- Lee, M. L., H. K. Kim, M. Y. Lee, Y. S. Choi, H. B. Kim, H. G. Chung and S. H. Kim. 2007. Antioxidant and Antibacterial Capacity of Chestnut (Castanea crenata var. dulcis) Honey Produced in Korea. J. Apic. 22: 147-152.
-
Meo, S. A., S. A. Al-Asiri, A. L. Mahesar and M. J. Ansari. 2017. Role of honey in modern medicine. Saudi J. Biol. Sci. 24: 975-978.
[https://doi.org/10.1016/j.sjbs.2016.12.010]

-
Truchado, P., I. Martos, L. Bortolotti, A. G. Sabatini, F. Ferreres and F. A. Tomas-Barberan. 2009. Use of quinoline alkaloids as markers of the floral origin of chestnut honey. J. Agric. Food Chem. 57: 5680-5686.
[https://doi.org/10.1021/jf900766v]

-
Turski, M. P., S. Chwil, M. Turska, M. Chwil, T. Kocki, G. Rajtar and J. Parada-Turska. 2016. An exceptionally high content of kynurenic acid in chestnut honey and flowers of chestnut tree. J. Food Compos. Anal. 48: 67-72.
[https://doi.org/10.1016/j.jfca.2016.02.003]