프로폴리스와 벌꿀 섭취로 인해 유도되는 노랑초파리의 생리학적 변화
Abstract
Propolis and honey are beekeeping products and are widely used as health supplements for humans. Previous studies have shown that propolis and honey have various physiological properties, including antioxidant, anti-inflammatory, and antibacterial effects. In order to investigate the physiological response induced by propolis and honey, including developmental time (larval and pupal periods), reproductivity, and adult lifespan (both male and female), we treated Drosophila melanogaster, a representative model organism, with these beekeeping products. We observed alterations in developmental time, adult longevity, and reproductivity in D. melanogaster treated with either propolis or honey. Interestingly, when honey or propolis induces an increase in oviposition, the survival rate of female adults tended to decrease. However, when female D. melanogaster were fed with propolis the oviposition rate remained constant and, the extended longevity was observed. In this study, we provided insight into the physiological activity of honey and propolis through the Drosophila model, and future follow-up studies are expected to elucidate their molecular physiological mechanisms.
Keywords:
Drosophila melanogaster, Propolis, Honey, Physiological effect서 론
프로폴리스는 꿀벌이 나무껍질의 갈라진 틈이나 잎눈과 같은 다양한 밀원에서 유래하는 삼출물을 이용하여 생산하는데, 꿀벌의 타액 및 효소를 첨가해 부분적으로 소화한 뒤 밀랍과 혼합하여 만드는 수지성 물질이다 (Ghisalberti, 1979; Burdock, 1998). 꿀벌은 생산한 프로폴리스를 벌집의 틈새를 메우거나 내부의 침입자들 (곤충, 병원체)에 대응하는데 사용한다 (Ghisalberti, 1979; Marcucci, 1995; Burdock, 1998; De Almeida and Menezes, 2002). 프로폴리스를 구성하는 성분들은 주변의 식생, 환경, 계절과 같은 다양한 요소에 복합적으로 영향을 받기에 프로폴리스의 생산지에 따라 그 성분의 차이를 보인다 (Toreti et al., 2013; Huang et al., 2014). 아시아와 남미 지역의 포플라계 (poplar) 식물에서 유래하는 프로폴리스 성분은 주로 플라보노이드 (flavonoids)이고, 남미 지역의 바카리스 (baccharis)계 식물에서는 주로 아르테필린 (artepillin C)이 프로폴리스의 주요 성분인 것으로 보고되고 있다 (Salatino et al., 2005; Ristivojević et al., 2015). 꿀벌이 채집한 밀원에 따라 프로폴리스의 성분 구성 비율은 차이를 보이지만 일반적으로 수지 50%, 밀랍 30%, 정유 10%, 화분 5%, 그리고 기타 유기물 5%로 구성되어 있다 (Monti et al., 1983; Cirasino et al., 1987). 프로폴리스의 다양한 구성 성분 중 가장 큰 생리학적 특성을 유발하는 성분은 식물 유래 화합물 (phytochemical)인 플라보노이드 (flavonoids)와 폴리페놀 (polyphenols)로 (Havsteen, 2002), 항균, 항산화, 항암, 항염증과 같은 다양한 효과를 나타내는 것으로 알려져 있다 (Lindenfelser, 1967; Ghisalberti, 1979; Harborne and Williams, 2000).
벌꿀은 과당과 포도당이 풍부한 천연식품으로, 꿀벌이 식물의 화밀 (nectar)이나 감로를 이용해 생산해내는 물질이며 일반적으로 당 (포도당 및 과당)류 70~80%, 수분 18~20%와 더불어 단백질, 아미노산, 미네랄, 폴리페놀을 포함한 유기화합물 등으로 구성되어 있고 (Chang et al., 1988; Bogdanov et al., 2008; Alvarez-Suarez et al., 2010), 항균, 항산화, 항염증과 같은 다양한 효과를 나타내는 것으로 알려져 있다 (Vallianou et al., 2014).
프로폴리스와 꿀이 공통적으로 가지는 항산화 효과는 (Bankova et al., 2000; Omotayo et al., 2010) 꿀벌이 채집하는 다양한 밀원에 포함된 폴리페놀 성분에 의한 것이라고 알려져 있다 (Bors and Michel, 2002; Kaškonienė and Venskutonis, 2010; Kurek-Górecka et al., 2013). 프로폴리스의 경우 최대 70%의 생리학적 특성을 유발하는 유기화합물로 이루어져 있으며 이 중 58%가 폴리페놀 성분인 것에 반해 (Kędzia and Hołderna-Kędzia, 1991), 꿀은 약 0.5%의 유기화합물을 제외하고는 탄수화물과 수분으로 구성 된다고 보고되고 있다 (Bogdanov et al., 2008; Miguel et al., 2017).
쥐, 물고기, 선충과 같은 다양한 모델 생물들이 양봉산물의 생리학적 기능 구명을 위해 사용되어 왔고 (Kanbur et al., 2009; Taira et al., 2016; Wibowo et al., 2020), 초파리 (Drosophila melanogaster)의 경우, 짧은 생애주기, 높은 번식력, 실험실 내 사육의 용이성 등으로 인해 다양한 연구의 모델 생물로 활용되고 있다 (Zhu et al., 2003; Jennings, 2011). 특히 초파리는 과일이 부패되거나 발효되는 환경에 서식하는데, 초파리의 서식 환경은 다양한 종류의 미생물에 오염되어 있고, 이들 미생물에 의해 발효/부패 화학물질이 고농도로 발생하고 있다 (Zhu et al., 2003; Becher et al., 2012). 초파리의 서식 환경을 고려할 때, 초파리는 생애 주기 동안 지속적으로 미생물 감염과 화학물질 노출 등 다양한 환경 스트레스에 노출되는데, 이는 초파리가 항균, 항산화, 항염증 효과를 가진 것으로 알려져 있는 프로폴리스나 벌꿀의 생리학적 기능을 구명하는데 유용한 모델 생물이라고 판단된다. 초파리는 유전체 분석이 완료되어 있으며 (Adams et al., 2000), 각 유전자의 기능에 관한 연구가 활발히 진행 중인 모델 생물로 육안으로 관찰가능한 생리변화 뿐만 아니라 (Zirin and Perrimon, 2010; Ong et al., 2015; Mirzoyan et al., 2019) 프로폴리스 및 꿀의 생리학적 기능을 분자생물학적 수준에서 연구하기에 적합한 곤충이다. 또한 곤충인 초파리를 이용하여 생리변화를 관찰함으로써, 이후 곤충산업 분야에서 양봉산물의 이용가능성을 제시하는 근거자료로 이용될 수 있다고 판단된다.
따라서 본 연구에서는 프로폴리스와 벌꿀이 가지는 생리학적 증진 효과를 확인하기 위해 노랑초파리에 처리한 후, 프로폴리스와 벌꿀이 초파리의 발달기간, 성충의 수명, 암컷의 번식능력 등에 미치는 연구를 수행하였다.
재료 및 방법
1. 프로폴리스 및 꿀 처리 조건
노랑초파리 (wild-type control strain Canton-S of Drosophila melanogaster)는 블루밍턴 초파리 센터 (BDSC, Bloomington Drosophila Stock Center)로부터 구입하여 본 실험실에서 유지하고 있는 것을 실험에 이용하였다 (Kim et al., 2014; Kim et al., 2018). 실험동물 사육환경은 선행 연구 (Zwaan et al., 1991; Dalton et al., 2011)를 참고하여 25±2°C, 16 L : 8 D 조명주기, 상대습도 50% 조건으로 유지하였으며, 프로폴리스와 꿀을 각각 처리한 인공 먹이배지와 함께 초파리 바이알 (10 mL, Model: FFV-11010, Hansol Tech, Seoul, Korea)에서 알부터 성충에 이르는 전 생애주기 동안 사육되었다.
인공 먹이배지는 실험실에서 사육을 위해 공급하는 먹이와 동일한 조성으로, 1회 기준 증류수 100 mL 용량에 한천 1 g, 옥수수가루 4.08 g, 건조 효모 6.24 g, 항생제 0.577 mL, 항곰팡이제 1.46 mL를 첨가하여 제조하였고, 주사기 (10 mL, Model: K50732895, ShinChang Medical Corp, Gumi, Korea)를 이용하여 초파리 바이알에 3 mL 용량으로 동일하게 분주한 뒤, 4°C 조건에서 보관하였다. 최장 보관기간은 30일로, 보관기간 초과시 폐기 후 새롭게 제조해 실험에 이용하였다. 프로폴리스 (Chong Kun Dang Pharmaceutical Corp, Seoul, Korea)를 첨가한 인공 먹이배지의 경우 100 mL 용량에 기존 먹이 조성과 동일하게 8.4 g 포도당을 추가하고, 사전실험을 통해 확인한 초파리의 생장 및 번식이 가능한 프로폴리스 농도인 1 g과 5 g을 첨가하여 1% 및 5% 프로폴리스 배지를 제작하였다. 꿀을 첨가한 인공 먹이배지의 경우, 기존 먹이 배지에 당 공급을 위해 대조군에서는 설탕을, 실험군에서는 잡화꿀 (YASAENG & THEBEE, Gwangju, Korea)을 제공하였다. 설탕과 벌꿀의 열량을 산출한 후 동일한 열량을 공급하기 위해 100 mL의 인공 먹이배지 기준으로 대조군에서는 설탕 8.8 g, 실험군에서는 벌꿀 11.3 g을 첨가하여 초파리 배지를 제작하였다.
2. 프로폴리스 및 꿀이 초파리 생장에 미치는 영향 평가
본 연구에서는 프로폴리스와 꿀이 노랑초파리의 생리에 미치는 영향을 발달기간, 번식능력, 성충의 수명 차이를 통해 확인하였다. 초파리는 알부터 성충에 이르는 전 생애주기 동안 각각 프로폴리스 또는 꿀이 함유된 인공 먹이배지에서 성장하였고, 대조군 초파리는 일반 인공 먹이배지를 제공하였다.
프로폴리스 또는 꿀이 초파리의 발달에 미치는 영향을 평가하기 위해 유충 기간 (알-번데기)과 번데기 기간으로 구분하여 측정하였다. 프로폴리스나 꿀이 함유되어 있지 않은 일반 먹이배지에서 사육 중인 번데기에서 갓 우화한 성충 수컷과 미교배 암컷 각 5마리씩 프로폴리스 또는 꿀이 첨가된 인공 먹이배지가 있는 초파리 바이알에 넣어준 뒤 24시간 동안 교미 및 산란을 유도하였다. 24시간 후 산란된 바이알에서 성충을 모두 제거하고 알의 유무를 확인한 뒤 24시간 주기로 알이 성충으로 우화할 때까지 관찰 및 기록하였다. 번데기가 출현하면 색이 다른 펜으로 초파리 바이알 바깥 표면에 표시하여 유충 기간을 측정했으며, 번데기에서 성충이 우화하면 표시한 날짜를 기준으로 번데기 기간을 측정하였다. 유충 기간과 번데기 기간은 처리군 별로 3개의 초파리 바이알에서 발생한 모든 초파리들을 이용하여 측정하였다.
성충의 수명은 처리군별로 수컷과 암컷 모두 3개의 초파리 바이알에 10마리씩 총 30마리의 초파리를 이용하여 60일간 기록하였는데, 프로폴리스 또는 꿀이 함유된 배지에서 성장한 초파리가 성충으로 우화하면 날짜 및 성별로 구분하여 새로운 바이알 (꿀 또는 프로폴리스 함유 배지)로 옮긴 뒤 72시간을 주기로 생존율을 기록하였다. 또한 72시간마다 초파리 바이알을 교체하여 새로운 먹이 (꿀 또는 프로폴리스 함유 배지)를 공급하고 초파리 사체를 제거하였다. 초파리를 새로운 바이알로 옮길 때에는 이산화탄소를 이용하여 마취시킨 뒤 핀셋을 이용하여 옮겨주었다.
번식능력은 프로폴리스 또는 꿀이 첨가된 먹이배지에서 성장한 초파리 성충을 이용하여 측정하였다. 우화 직후의 성충 수컷과 미교배 암컷을 각 5마리씩 프로폴리스 또는 꿀이 첨가된 먹이배지가 들어있는 초파리 바이알에 위치시킨 후, 24시간 뒤 성충 초파리를 제거하고 초파리 바이알 표면과 먹이배지 표면에 있는 알의 수를 광학 현미경을 통해 측정하였다 (Olympus Corporation, Tokyo, Japan).
3. 통계분석
본 실험에서는 통계분석을 위해 SPSS for Windows version 25.0 (IBM, Armond, NY, USA)을 이용하였다. 대조구 (프로폴리스 무함유 배지) 및 1%와 5% 프로폴리스 함유 배지에서 성장한 초파리의 발달기간 및 번식능력은 일원배치분산분석 (one-way ANOVA with Bonferroni tests) (p<0.05)을 통해 비교·분석하였고, 꿀 처리군의 초파리의 발달기간 및 번식능력은 독립표본 t-검정 (Independent Two Samples t-test) (p<0.05)로 분석하였다. 프로폴리스 및 꿀이 초파리 성충의 수명에 미치는 영향 분석은 Kaplan-Meier 생존분석 (Kaplan-Meier survival analysis) (p<0.05)을 이용하여 비교하였다. 모든 데이터는 평균±표준오차로 제시하였다.
결과 및 고찰
1. 프로폴리스가 초파리 생장에 미치는 영향
항균, 항산화, 항암, 항염증과 같은 다양한 효과를 가지고 있는 것으로 알려져 있는 프로폴리스 (Lindenfelser, 1967; Ghisalberti, 1979; Harborne and Williams, 2000)의 생리활성 효과를 검증하기 위해 프로폴리스를 1%와 5%의 농도로 인공 먹이배지에 처리한 후 초파리의 발달 단계별 소요 시간과 성충의 수명 및 산란에 미치는 영향을 분석하였다. 프로폴리스를 함유하지 않은 대조군, 1% 및 5% 프로폴리스를 함유한 배지에서 각각 부화한 초파리 90마리, 181마리, 318마리 전수를 대상으로 유충 기간 및 번데기 기간을 비교·분석하였다. 우선 프로폴리스가 유충의 발달기간에 미치는 영향을 분석한 결과, 1% 프로폴리스 처리군은 6.28±0.77일, 5% 프로폴리스 처리군은 7.68±1.23일의 소요시간이 걸리는 반면 프로폴리스를 섭취하지 않은 대조군의 유충 기간은 4.68±0.78일로 프로폴리스 처리 농도 의존적으로 유충 기간이 늘어나는 경향을 보였다 (f=318.574, p<0.001, Fig. 1A). 반면 번데기 기간은 대조군에서 4.10±0.59일, 1% 프로폴리스 처리군에서 3.00±0.61일, 5% 프로폴리스 처리군에서 3.94±0.57일로, 1% 프로폴리스 처리 군의 초파리의 번데기 기간이 무처리 군과 5% 처리군에 비해 통계적으로 유의미한 수준으로 짧아지는 경향을 보였다 (f=72.186, p<0.001, Fig. 1B). 그러나 5% 프로폴리스 처리군과 대조군 간에는 통계적 유의성이 없었다 (p=0.242, Fig. 1B). 초파리 유충이 번데기까지 성장하는데 걸리는 시간이 프로폴리스의 농도에 의존적으로 증가하는 반면 (Fig. 1A), 농도 의존적이지는 않지만 프로폴리스 섭취 시 번데기 기간은 감소하는 것으로 관찰되었는데 (Fig. 1B), 이는 프로폴리스가 노랑초파리의 발달 단계에 따라 발달기간을 단축시키거나 지연시킬 수 있음을 의미한다. 이전 연구에 의하면 담배거세미나방 (Spodoptera frugiperda)에 플라보노이드 성분 중 하나인 루틴 (rutin)을 섭취시켰을 때 유충 기간은 농도 의존적으로 증가하고 번데기 기간은 감소하는 것이 확인되었고 (Silva et al., 2016), 폴리페놀 성분이 풍부한 자색옥수수 과피 추출물을 박각시나방 (Manduca sexta) 유충에 섭취시켰을 때 번데기 기간의 감소가 관찰된 바가 있다 (Tayal et al., 2020). 이와 더불어 플라보노이드와 곤충의 상관성을 고찰한 논문에서는 다양한 플라보노이드 성분들이 곤충의 발달에 직접적으로 영향을 미친다고 보고하고 있다 (Simmonds, 2003). 본 연구 결과는 위 선행연구들과 유사한 경향성을 나타냈고 위 내용들을 근거할 때, 폴리페놀과 플라보노이드 성분이 풍부한 프로폴리스가 노랑초파리의 유충 기간과 번데기 기간에 영향을 끼친 것으로 판단된다.
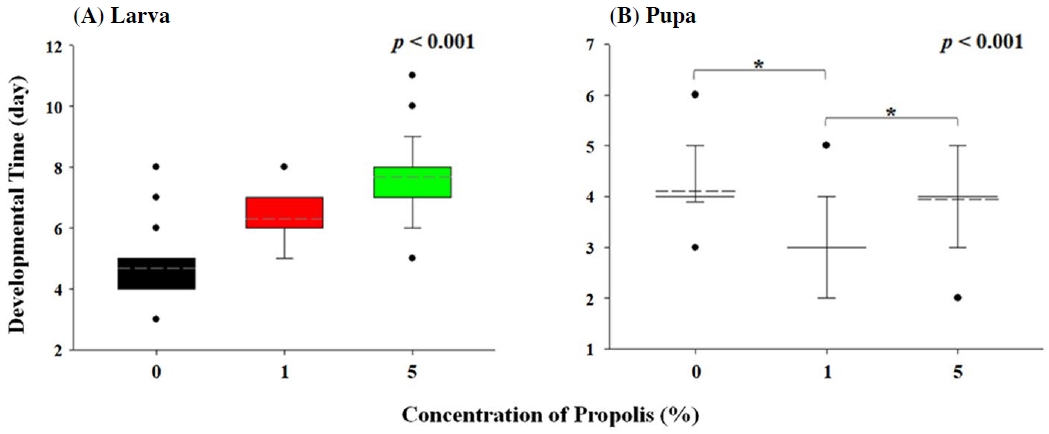
Comparison of developmental time of larval stage (A) and pupal stage (B) of D. melanogaster treated with 0%, 1%, and 5% of propolis. The developmental time of D. melanogaster treated with different concentration of propolis was statistically analyzed by one-way ANOVA with Bonferroni tests (p<0.05).
프로폴리스의 농도 의존적인 생리 반응 현상은 60일 동안 관찰한 수컷 초파리의 수명에서도 관찰되었다 (Fig. 2A). 50%의 개체가 사망한 시점은 대조군에서 33일, 1%의 프로폴리스를 섭취한 그룹에서는 51일이었고 5%의 프로폴리스를 섭취한 그룹은 수명 측정 기간 동안 50% 이상의 생존율을 기록했다 (Fig. 2A). 또한 60일 기준으로 대조군에서 20.83%, 1% 프로폴리스 처리군에서 36.36%, 5% 프로폴리스 처리군에서 55.56%의 개체가 생존하였다 (Fig. 2A). 이들 세 그룹 간 생존율 변화 양상을 분석한 결과, 농도 의존적인 수명 연장 현상이 통계적 유의성을 보였다 (x2=9.186, p=0.006, Fig. 2A). 이전 연구에서 프로폴리스를 섭취한 쥐의 수명이 프로폴리스의 농도 의존적으로 증가하는 것으로 관찰되었고 (Gressler et al., 2012), 프로폴리스의 항산화 효과에 의한 산화스트레스 감소가 수명 연장에 영향을 주는 것으로 판단된다 (Bankova et al., 2000; Mujica et al., 2017). 또 다른 항산화 물질로 알려져 있는 커큐민 (Curcumin)을 노랑초파리 유충에게 노출 시켰을 때 성충의 수명이 증가하는 것으로 관찰되었는데 (Soh et al., 2013), 이는 프로폴리스의 항산화 효과가 노랑초파리 노화 과정 중 발생하는 산화스트레스를 감소시켜 성충 수명 연장에 기여한 것으로 사료된다.

Effect of propolis on adult survivorship in D. melanogaster male (A) and female (B). The longevity of flies exposed to 0%, 1%, and 5% of propolis was monitored for 60 days and was statistically compared with Kaplan-Meier survival analysis (p<0.05).
프로폴리스를 섭취한 수컷의 수명과는 상이한 결과가 암컷 초파리에서 관찰되었는데, 5%의 프로폴리스를 섭취한 초파리 암컷은 60일 이후 80.95%의 생존율을 보인 반면, 대조군과 1% 프로폴리스 처리군에서는 각각 33.33%와 35%의 생존율을 보였다. 이들의 생존 곡선 분석 결과, 5%의 프로폴리스 노출 암컷이 통계적으로 1% 프로폴리스 처리군이나 대조군 암컷 초파리에 비해 높은 생존율을 보이는 것으로 분석되고 (x2=9.158, p<0.001, Fig. 2B), 대조군과 1% 프로폴리스 처리군 간에는 통계적 유의성이 없는 것으로 확인되었다 (p=0.785, Fig. 2B).
암컷의 수명과 더불어 산란율도 프로폴리스에 의해 영향을 받는 것으로 생각되는데, 프로폴리스 1%에 노출된 초파리 암컷은 24시간 동안 144±22.19개의 알을 산란하는 것으로 관찰되었고, 이는 80.4±18.93개와 73.6±8.1 개의 알을 산란한 대조군과 5% 프로폴리스에 노출된 암컷에 비해 통계적으로 유의미한 수준으로 높은 산란율을 보였다 (f=8.229, p=0.007, Fig. 3). 가축에 폴리페놀 성분을 노출시킨 후 관찰한 논문에서는 폴리페놀 성분이 가축의 생식기의 발달과 관련된 유전자의 발현을 증가시키기도 하고 감소시키기도 한다고 보고 하고 있는데 (Hashem et al., 2020), 이는 노출된 프로폴리스의 농도에 따라 산란율에 미칠 수 있는 영향의 차이가 발생할 수 있는 가능성을 시사한다. 초파리의 교미 및 산란 행위는 체내 산화스트레스를 증가시키는 것으로 알려져 있는데 (Wang et al., 2001; Rush et al., 2007), 실제 많은 수의 알을 산란한 1% 프로폴리스에 노출된 암컷은 적은 수의 알을 산란한 5% 프로폴리스에 노출된 암컷에 비해 짧은 수명을 보여 프로폴리스가 초파리의 수명과 산란에 모두 영향을 미치는 것으로 사료된다. 또한 대조구에 비해 많은 알을 산란하여 높은 산화스트레스에 노출될 것으로 예상되는 1% 프로폴리스에 노출된 초파리 암컷의 수명이 대조구와 통계적인 차이가 없는 것은 프로폴리스의 산화스트레스 감소 효과에 기인하는 것으로 생각된다 (Mujica et al., 2017) (Figs. 2B, 3). 실제 산란율에 차이가 없는 대조구와 5% 프로폴리스에 노출된 암컷의 경우, 유사한 수준의 산화스트레스에 노출되었다고 가정할 때, 5% 프로폴리스 노출 암컷 초파리의 노화 과정 중 자연적으로 발생하는 산화스트레스가 프로폴리스에 의해 감소하여 그 수명이 통계적으로 증가한 것으로 사료된다 (Figs. 2B, 3). 산란에 의한 산화스트레스를 배재할 수 있는 수컷에서, 노랑초파리에게 노출되는 프로폴리스의 양에 따라 농도 의존적으로 수명이 증가하는 현상은 더 명확히 프로폴리스의 항산화 효과를 설명한다고 판단된다 (Fig. 2A).
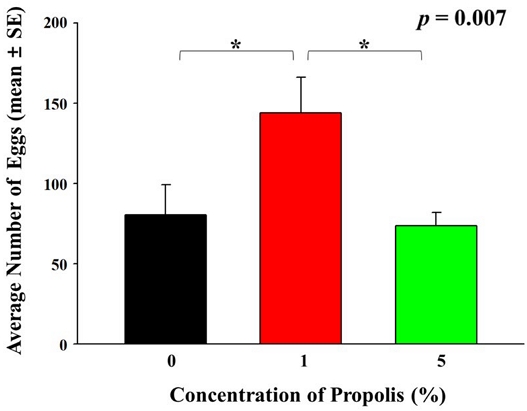
Average number of eggs (mean±SE) laid by D. melanogaster females developed in the diet containing 0%, 1%, and 5% of propolis. The reproductivity was statistically analyzed by one-way ANOVA with Bonferroni (p<0.05).
본 연구팀의 최근 연구에 의하면, 화학물질 노출 초파리에서 antimicrobial peptides (AMPs)의 발현량 증가를 유발하고, AMP의 발현량 증가가 에탄올이나 아세트산과 같은 화학물질에 대한 내성도를 높이는 것으로 관찰되었다 (Seong et al., 2020; Kim et al., 2022). 이들 화학물질 노출은 초파리내 활성 산소 (ROS, reactive oxygen species)의 발생량을 증가시키나 (Kim et al., 2022), AMP의 발현이 체내 ROS를 감소시킨다는 이전 연구에 근거할 때 (Zhao et al., 2011), AMP가 산화스트레스 조절에 관여할 수 있음을 시사한다. 또한 프로폴리스가 AMP의 발현을 조절하는 Toll-like receptor (TLR)에 영향을 준다는 최근 고찰에 근거할 때 (Aliyazicioglu and Kanbolat, 2018), 농도별로 차이는 있지만 프로폴리스 노출이 초파리의 AMP 발현량 증가를 유도하고 이를 통한 산화스트레스에 대한 내성도 증가 및 초파리 성충의 수명 증가를 유발하는 것으로 사료된다 (Fig. 2). 현재 본 연구팀이 수행하고 있는 프로폴리스와 AMP 발현과의 상관성을 검증하는 후속 연구는 프로폴리스가 가지는 항산화 효과의 기작을 생리학적 수준에서 더 명확히 구명할 수 있을 것으로 판단된다.
2. 벌꿀이 초파리 생장에 미치는 영향
프로폴리스와 유사하게 항균, 항산화, 항염증과 같은 다양한 효과를 나타내는 것으로 알려져 있는 벌꿀 (Vallianou et al., 2014)의 생리 활성을 초파리를 통해 추가 관찰하였다. 벌꿀을 함유하지 않은 대조군과 벌꿀을 함유한 배지에서 각각 부화한 초파리 140마리, 107마리 전수를 대상으로 유충 기간 및 번데기 기간을 비교·분석하였다. 우선 벌꿀이 유충의 발달기간에 미치는 영향을 분석한 결과, 꿀 처리군의 유충 기간은 6.06±0.89일, 대조군은 6.27±0.94일로 통계적 유의성은 없었고 (f=3.353, p=0.083, Fig. 4A), 번데기 기간은 꿀 처리군에서 4.96±095일, 대조군에서 4.63±0.74일로 꿀을 섭취한 초파리의 번데기 기간이 통계적으로 유의미하게 증가하는 것을 확인했다 (f=5.266, p=0.004, Fig. 4B). 본 연구의 결과와 유사하게 선행연구에서도 꿀을 섭취한 보리나방살이고치벌 (Bracon hebetor)의 유충 기간의 감소와 번데기 기간의 증가가 관찰된 바가 있는데 (El-Wahab et al., 2016), 이는 꿀이 곤충의 발달 단계별로 그 기간을 단축 또는 연장시킬 수 있음을 시사한다. 꿀을 섭취한 초파리의 유충 기간의 미약한 감소와 번데기 기간의 증가 현상과 상이하게 (Fig. 4), 프로폴리스를 섭취한 초파리의 경우 유충 기간의 증가와 번데기 기간의 감소 현상이 관찰된 바는 (Fig. 1), 두 양봉 산물이 초파리의 발달에 다른 기작으로 작동하고 있다고 예상된다. 또한 초파리의 발달기간에 프로폴리스는 1일 이상의 차이를 유발하는 것에 비해 (Fig. 1), 꿀은 약 0.33일의 차이만을 유발하였는데 (Fig. 4), 이는 두 양봉 산물이 초파리의 발달에 작용하는 정도의 차이도 존재하는 것으로 예상된다.
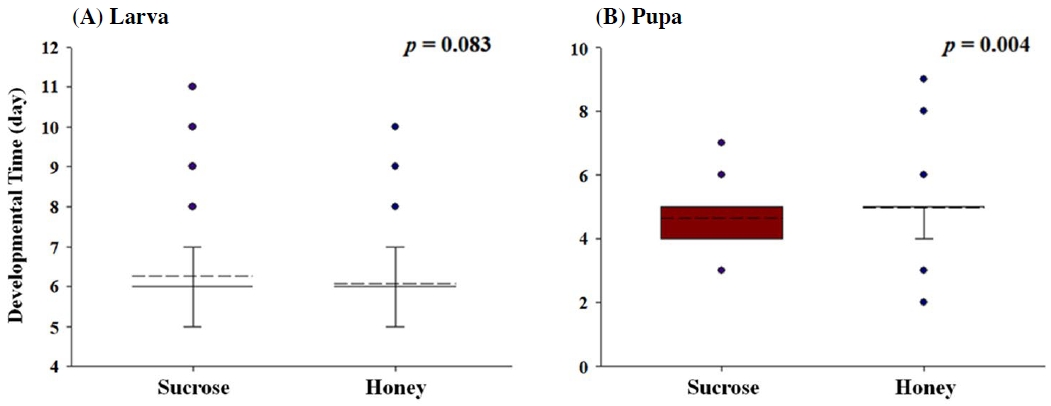
Comparison of developmental time of larval stage (A) and pupal stage (B) of D. melanogaster treated with honey and sucrose. The developmental time of D. melanogaster treated with honey and sucrose was statistically analyzed by Student t-test (p<0.05).
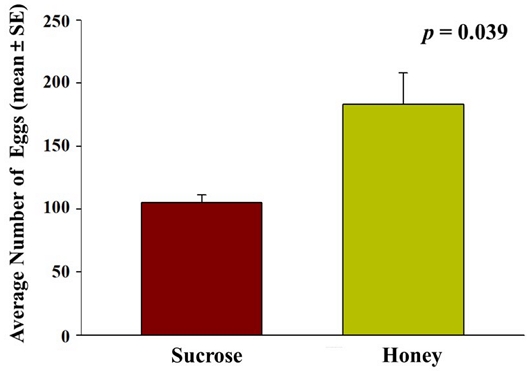
벌꿀이 초파리 성충 수컷과 암컷의 수명에 미치는 영향을 분석한 결과, 꿀을 섭취한 수컷, 암컷, 그리고 설탕을 섭취한 대조군 모두 60일 기준으로 생존율 0%를 기록했고 (Fig. 5), 수컷은 대조군과 꿀 처리군 모두 54일에 0% 생존율을 (Fig. 5A), 암컷은 대조군이 57일, 꿀 처리군이 54일에 0% 생존율을 기록했다 (Fig. 5B). 꿀 처리군 수컷은 초기에 대조군보다 높은 생존율을 보였지만 36일에 50%을 기록하면서 이후에는 유의미하게 대조군보다 낮은 생존율을 기록하였고 (x2=23.359, p=0.049, Fig. 5A), 암컷의 경우 36일 93.3%의 생존율을 기록한 것 이외에는 대조군보다 낮은 생존율을 기록했다 (x2=3.860, p<0.001, Fig. 5B). 초파리 성충의 수명 연장에 꿀이 긍정적인 영향을 주지 않는 본 연구 결과와 상반되게 선행연구에서는 보리나방살이고치벌이 벌꿀을 섭취했을 때 수컷과 암컷 모두 수명이 증가한다고 보고하고 있고 (El-Wahab et al., 2016), 쥐와 노랑초파리에게 벌꿀을 섭취 시키면 쥐와 초파리 성충의 수명이 증가하고 체내 산화스트레스가 감소한다고 보고되고 있다 (Cruz et al., 2014; Hegazi et al., 2014; Cruz et al., 2016). 본 연구에서 대조군에게 설탕을 제공하였는데, 설탕이 농도 의존적으로 초파리의 먹이 섭취량을 감소시키고 (Rovenko et al., 2015), 노랑초파리에게 제공되는 먹이를 제한했을 때 초파리의 수명이 증가한다고 선행 연구에 근거할 때 (Mair et al., 2003), 성충 수명에 꿀이 미치는 영향보다는 대조군 초파리에 제공한 설탕이 미치는 영향이 더 클 수도 있음이 예상된다. 대조군 대비 꿀을 섭취한 암, 수컷 간의 생존율 차이를 비교하면, 대조군 대비 꿀을 섭취한 암컷의 생존율 차이 (p<0.001, Fig. 5B)가 수컷의 차이 (p=0.049, Fig. 5A)보다 통계적 유의성의 측면에서 훨씬 큰데, 이는 산란율과의 상관성을 배재할 수 없다 판단된다. 많은 산란을 유발한 1% 프로폴리스 조건에서의 생존율의 증가가 관찰되지 않았지만, 산란율 증가를 유발하지 않았던 5% 프로폴리스 조건에서의 확연한 생존율 증가 현상 (Figs. 2, 3)이 관찰된 것과 유사하게 꿀을 섭취한 암컷에서 높은 산란율이 관찰되었고, 산란에 의한 산화스트레스 증가 (Wang et al., 2001; Rush et al., 2007)가 수명에는 부정적인 영향을 준 것으로 판단된다. 실제 본 연구에서 벌꿀 처리군에서는 암컷이 24시간 동안 183±24.99개의 알을 산란하는 것으로 관찰되었고, 105±11.14개의 알을 산란한 대조군보다 벌꿀 처리군에서 통계적으로 유의미한 산란율 증가가 관찰되었다 (f=6.078, p=0.039, Fig. 6). 본 연구 결과와 유사하게 보리나방살이고치벌에 벌꿀을 섭취시켰을 때 암컷의 번식능력이 증가한다고 보고된 바가 있는데 (El-Wahab et al., 2016), 이는 프로폴리스와 유사하게 벌꿀에 함유되어 있는 폴리페놀과 플라보노이드가 번식능력에 직접적으로 영향을 주는 것으로 판단된다 (Lopez et al., 2016; Santos-Buelga et al., 2017; Hashem et al., 2020).
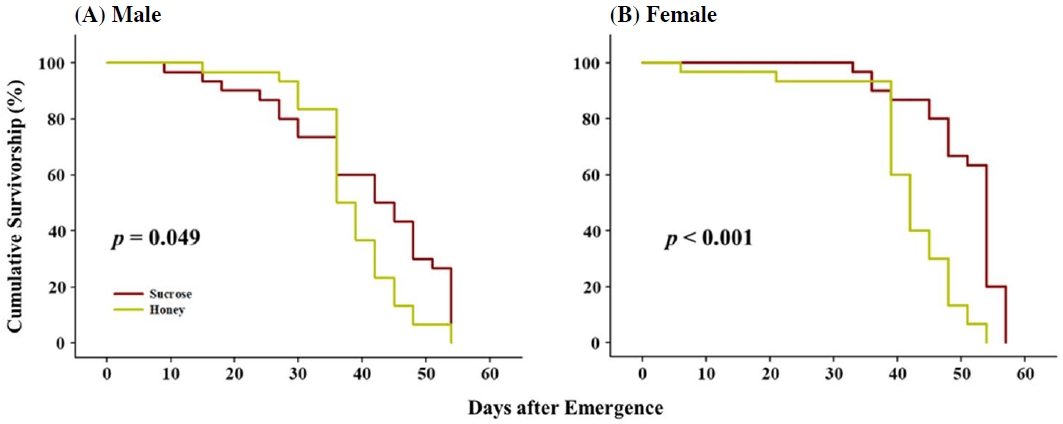
Effect of honey to adult survivorship in D. melanogaster male (A) and female (B). The longevity of flies exposed to honey and sucrose independently was monitored for 60 days and was statistically compared with Kaplan-Meier survival analysis (p<0.05).
결 론
본 연구에서는 모델 곤충인 초파리를 이용하여 프로폴리스와 벌꿀이 가지는 생리학적 활성을 조사하였다. 공통적으로 항산화 효능을 띄는 프로폴리스와 벌꿀 (Bankova et al., 2000; Omotayo et al., 2010)이 노랑초파리에 유사한 영향을 미칠 것이라는 예상과 달리 벌꿀 처리군에서 번식능력이 증가한 것을 제외하고, 유충의 발달기간 (유충 기간 및 번데기 기간)과 노랑초파리 성충의 수명은 프로폴리스 처리군과 정반대의 경향성을 보였다. 이는 프로폴리스와 벌꿀에 포함된 생리활성 물질인 폴리페놀과 플라보노이드의 양적 차이 (Kędzia and Hołderna-Kędzia, 1991; Bogdanov et al., 2008; Miguel et al., 2017)로 인한 섭취 용량의 차이와 더불어, 주요 에너지원인 당 성분의 차이로 인해 유도된 결과로 판단된다.
본 연구의 결과는 건강 보조 식품으로의 양봉 산물의 활용을 위한 과학적 근거자료뿐만 아니라 산업 곤충의 사육 시 발달기간의 조절이나 산란율 및 성충 수명 조절을 위해 프로폴리스나 벌꿀의 활용 가능성을 제시한다. 본 연구에서 관찰된 프로폴리스와 벌꿀이 가지는 각각의 생리학적 활성 특성은 추후 관련 유전자의 발현 양상에 근거한 분자생물학적 관점에서의 추가 연구가 필수적으로 수반되어야 할 것으로 생각된다.
적 요
프로폴리스와 꿀은 주요한 양봉 산물로 건강 보조제로 널리 이용되고 있다. 많은 연구에 의하면 꿀과 프로폴리스는 항산화, 항염증, 항생 효과를 비롯한 다양한 생리학적 효과를 가지고 있는 것으로 알려져 있다. 본 연구에서는 대표적인 모델 생명체인 초파리를 대상으로 프로폴리스와 꿀이 가지는 생리학적 효과를 검증하기 위해 유충 기간, 번데기 기간을 포함하는 초파리의 발달 단계에 미치는 영향과 암, 수 성충의 수명과 산란율을 조사하였다. 그 결과, 프로폴리스와 꿀이 초파리의 발달 단계의 소요 시간 및 성충의 수명과 산란율에 영향을 주는 것으로 관찰되었다. 특히 꿀이나 프로폴리스에 의해 산란율 증가가 유도된 경우, 암컷 성충의 생존율은 감소하는 경향을 보였으나, 프로폴리스를 섭취한 암컷이 산란율에 변화가 없는 경우에는 수명이 연장되는 효과가 관찰되었다. 본 연구에서 초파리 모델을 통해 꿀과 프로폴리스가 가지는 생리학적 활성 효과가 관찰된 바, 추후 이들의 분자생리학적 기작에 관한 후속 연구를 위한 자료로 활용할 수 있을 것으로 기대된다.
Acknowledgments
본 연구는 농촌진흥청 연구과제 (PJ015778012023)의 지원으로 수행되었습니다.
References
- Adams, M. D., S. E. Celniker, R. A. Holt, C. A. Evans, J. D. Gocayne, P. G. Amanatides, S. E. Scherer, P. W. Li, R. A. Hoskins and R. F. Galle. 2000. The genome sequence of Drosophila melanogaster. Science 287: 2185-2195.
-
Aliyazicioglu, R. and S. Kanbolat. 2018. Therapeutic Effects of Propolis: Review Article. Chem.
[https://doi.org/10.9734/CSJI/2018/44457]

-
Alvarez-Suarez, J. M., S. Tulipani, S. Romandini, E. Bertoli and M. Battino. 2010. Contribution of honey in nutrition and human health: a review. Med. J. Nutrition Metab. 3: 15-23.
[https://doi.org/10.1007/s12349-009-0051-6]

-
Bankova, V. S., S. L. de Castro and M. C. Marcucci. 2000. Propolis: recent advances in chemistry and plant origin. Apidologie 31: 3-15.
[https://doi.org/10.1051/apido:2000102]

-
Becher, P. G., G. Flick, E. Rozpędowska, A. Schmidt, A. Hagman, S. Lebreton, M. C. Larsson, B. S. Hansson, J. Piškur and P. Witzgall. 2012. Yeast, not fruit volatiles mediate Drosophila melanogaster attraction, oviposition and development. Funct. Ecol. 26: 822-828.
[https://doi.org/10.1111/j.1365-2435.2012.02006.x]

-
Bogdanov, S., T. Jurendic, R. Sieber and P. Gallmann. 2008. Honey for nutrition and health: a review. J. Am. Coll. Nutr. 27: 677-689.
[https://doi.org/10.1080/07315724.2008.10719745]

-
Bors, W. and C. Michel. 2002. Chemistry of the antioxidant effect of polyphenols. Ann. N. Y. Acad. Sci. 957: 57-69.
[https://doi.org/10.1111/j.1749-6632.2002.tb02905.x]

-
Burdock, G. 1998. Review of the biological properties and toxicity of bee propolis (propolis). Food Chem. Toxicol. 36: 347-363.
[https://doi.org/10.1016/S0278-6915(97)00145-2]

- Chang, H.-G., M.-K. Han and J.-G. Kim. 1988. The chemical composition of Korean honey. Korean J. Food Sci. Technol. 20: 631-636.
-
Cirasino, L., A. Pisati and F. Fasani. 1987. Contact dermatitis from propolis. Contact dermatitis 16: 110-111.
[https://doi.org/10.1111/j.1600-0536.1987.tb01394.x]

-
Cruz, L., J. Batista, A. Zemolin, M. Nunes, D. Lippert, L. Royes, F. Soares, A. Pereira, T. Posser and J. Franco. 2014. A study on the quality and identity of Brazilian Pampa biome honey: evidences for its beneficial effects against oxidative stress and hyperglycemia. Int. J. Food Sci. 2014.
[https://doi.org/10.1155/2014/470214]

-
Cruz, L., A. Ecker, R. Dias, R. Seeger, M. Braga, A. Boligon, I. Martins, D. Costa-Silva, N. Barbosa and A. Cañedo. 2016. Brazilian pampa biome honey protects against mortality, locomotor deficits and oxidative stress induced by hypoxia/reperfusion in adult Drosophila melanogaster. Neurochem. Res. 41: 116-129.
[https://doi.org/10.1007/s11064-015-1744-5]

-
Dalton, D. T., V. M. Walton, P. W. Shearer, D. B. Walsh, J. Caprile and R. Isaacs. 2011. Laboratory survival of Drosophila suzukii under simulated winter conditions of the Pacific Northwest and seasonal field trapping in five primary regions of small and stone fruit production in the United States. Pest Manag. Sci. 67: 1368-1374.
[https://doi.org/10.1002/ps.2280]

-
De Almeida, E. and H. Menezes. 2002. Anti-inflammatory activity of propolis extracts: a review. J. Venom. Anim. Toxins Incl. Trop. Dis. 8: 191-212.
[https://doi.org/10.1590/S0104-79302002000200002]

- El-Wahab, A., T. Huda, H. Elbehery and N. Farag. 2016. Evaluation of some honey bee products as artificial diets for rearing the parasitoid Bracon hebetor Say (Hymenoptera: Braconidae). Egypt. J. Biol. Pest Control 26: 309.
-
Ghisalberti, E. 1979. Propolis: a review. Bee World 60: 59-84.
[https://doi.org/10.1080/0005772X.1979.11097738]

-
Gressler, L. T., A. S. Da Silva, G. Machado, L. Dalla Rosa, F. Dorneles, L. T. Gressler, M. S. Oliveira, R. A. Zanette, A. C. de Vargas and S. G. Monteiro. 2012. Susceptibility of Trypanosoma evansi to propolis extract in vitro and in experimentally infected rats. Res. Vet. Sci. 93: 1314-1317.
[https://doi.org/10.1016/j.rvsc.2012.02.007]

-
Harborne, J. B. and C. A. Williams. 2000. Advances in flavonoid research since 1992. Phytochem. Lett. 55: 481-504.
[https://doi.org/10.1016/S0031-9422(00)00235-1]

-
Hashem, N. M., A. Gonzalez-Bulnes and J. Simal-Gandara. 2020. Polyphenols in farm animals: source of reproductive gain or waste? Antioxidants 9: 1023.
[https://doi.org/10.3390/antiox9101023]

-
Havsteen, B. H. 2002. The biochemistry and medical significance of the flavonoids. Pharmacol. Ther. 96: 67-202.
[https://doi.org/10.1016/S0163-7258(02)00298-X]

- Hegazi, A., R. Al Tahtawy, F. Abd Allah and A. M. Abdou. 2014. Antitumor and antioxidant activity of honey in mice bearing Ehrlich ascites carcinoma. Cancer Res. 7: 208-214.
-
Huang, S., C.-P. Zhang, K. Wang, G. Q. Li and F.-L. Hu. 2014. Recent advances in the chemical composition of propolis. Molecules 19: 19610-19632.
[https://doi.org/10.3390/molecules191219610]

-
Jennings, B. H. 2011. Drosophila-a versatile model in biology & medicine. Mater. Today Commun. 14: 190-195.
[https://doi.org/10.1016/S1369-7021(11)70113-4]

-
Kanbur, M., G. Eraslan and S. Silici. 2009. Antioxidant effect of propolis against exposure to propetamphos in rats. Ecotoxicol. Environ. Saf. 72: 909-915.
[https://doi.org/10.1016/j.ecoenv.2007.12.018]

-
Kaškonienė, V. and P. R. Venskutonis. 2010. Floral markers in honey of various botanical and geographic origins: a review. Compr. Rev. Food Sci. Food Saf. 9: 620-634.
[https://doi.org/10.1111/j.1541-4337.2010.00130.x]

- Kędzia, B. and E. Hołderna-Kędzia. 1991. Chemical composition of propolis in nowadays researches. Herba Pol. 38: 95-107.
-
Kim, Y., G. Goh and Y. H. Kim. 2022. Expression of antimicrobial peptides associated with different susceptibilities to environmental chemicals in Drosophila suzukii and Drosophila melanogaster. Pestic. Biochem. Phys. 187: 105210.
[https://doi.org/10.1016/j.pestbp.2022.105210]

-
Kim, Y., S. Lee, Y. H. Kim and Y. H. Kim. 2018. Comparative analyses of susceptibility to chemicals associated with fermentation between Drosophila melanogaster and Drosophila suzukii. Entomol. Res. 48: 514-521.
[https://doi.org/10.1111/1748-5967.12326]

-
Kim, Y. H., D. H. Kwon, H. M. Ahn, Y. H. Koh and S. H. Lee. 2014. Induction of soluble AChE expression via alternative splicing by chemical stress in Drosophila melanogaster. Insect Biochem. Mol. Biol. 48: 75-82.
[https://doi.org/10.1016/j.ibmb.2014.03.001]

-
Kurek-Górecka, A., A. Rzepecka-Stojko, M. Górecki, J. Stojko, M. Sosada and G. Świerczek-Zięba. 2013. Structure and antioxidant activity of polyphenols derived from propolis. Molecules 19: 78-101.
[https://doi.org/10.3390/molecules19010078]

- Lindenfelser, A. 1967. Antimicrobial activity of propolis. Am. Bee J. 107: 90-92.
-
Lopez, T. E., H. M. Pham, J. Barbour, P. Tran, B. Van Nguyen, S. P. Hogan, R. L. Homo, V. Coskun, S. E. Schriner and M. Jafari. 2016. The impact of green tea polyphenols on development and reproduction in Drosophila melanogaster. J. Funct. Foods 20: 556-566.
[https://doi.org/10.1016/j.jff.2015.11.002]

-
Mair, W., P. Goymer, S. D. Pletcher and L. Partridge. 2003. Demography of dietary restriction and death in Drosophila. Science 301: 1731-1733.
[https://doi.org/10.1126/science.1086016]

-
Marcucci, M. C. 1995. Propolis: chemical composition, biological properties and therapeutic activity. Apidologie 26: 83-99.
[https://doi.org/10.1051/apido:19950202]

-
Miguel, M., M. D. Antunes and M. L. Faleiro. 2017. Honey as a complementary medicine. Integr. Med. Insights 12: 1178633717702869.
[https://doi.org/10.1177/1178633717702869]

-
Mirzoyan, Z., M. Sollazzo, M. Allocca, A. M. Valenza, D. Grifoni and P. Bellosta. 2019. Drosophila melanogaster: A model organism to study cancer. Front. Genet. 10: 51.
[https://doi.org/10.3389/fgene.2019.00051]

-
Monti, M., E. Bertt, G. Carminati and M. Cusini. 1983. Occupational and cosmetic dermatitis from propolis. Contact Derm. 9: 163-163.
[https://doi.org/10.1111/j.1600-0536.1983.tb04341.x]

-
Mujica, V., R. Orrego, J. Pérez, P. Romero, P. Ovalle, J. Zúñiga-Hernández, M. Arredondo and E. Leiva. 2017. The role of propolis in oxidative stress and lipid metabolism: a randomized controlled trial. Evid.-Based Complementary Altern. Med. 2017.
[https://doi.org/10.1155/2017/4272940]

-
Omotayo, E. O., S. Gurtu, S. A. Sulaiman, M. S. Ab Wahab, S. KNS and M. S. M. Salleh. 2010. Hypoglycemic and antioxidant effects of honey supplementation in streptozotocin-induced diabetic rats. Int. J. Vitam. Nutr. Res. 80: 74-82.
[https://doi.org/10.1024/0300-9831/a000008]

-
Ong, C., L.-Y. L. Yung, Y. Cai, B.-H. Bay and G.-H. Baeg. 2015. Drosophila melanogaster as a model organism to study nanotoxicity. Nanotoxicology 9: 396-403.
[https://doi.org/10.3109/17435390.2014.940405]

-
Ristivojević, P., J. Trifković, F. Andrić and D. Milojković-Opsenica. 2015. Poplar-type propolis: Chemical composition, botanical origin and biological activity. Nat. Prod. Commun. 10: 1934578X1501001117.
[https://doi.org/10.1177/1934578X1501001117]

-
Rovenko, B. M., O. I. Kubrak, D. V. Gospodaryov, N. V. Perkhulyn, I. S. Yurkevych, A. Sanz, V. Lushchak and V. I. Lushchak. 2015. High sucrose consumption promotes obesity whereas its low consumption induces oxidative stress in Drosophila melanogaster. J. Insect Physiol. 79: 42-54.
[https://doi.org/10.1016/j.jinsphys.2015.05.007]

-
Rush, B., S. Sandver, J. Bruer, R. Roche, M. Wells and J. Giebultowicz. 2007. Mating increases starvation resistance and decreases oxidative stress resistance in Drosophila melanogaster females. Aging Cell 6: 723-726.
[https://doi.org/10.1111/j.1474-9726.2007.00322.x]

-
Salatino, A., É. W. Teixeira and G. Negri. 2005. Origin and chemical variation of Brazilian propolis. Evid. Based Complementary Altern. Med. 2: 33-38.
[https://doi.org/10.1093/ecam/neh060]

-
Santos-Buelga, C. and A. M. González-Paramás. 2017. Bee products-chemical and biological properties. pp. 43-82. Springer, Cham. New York City.
[https://doi.org/10.1007/978-3-319-59689-1_3]

-
Seong, K. M., Y. Kim, D. Kim, B. R. Pittendrigh and Y. H. Kim. 2020. Identification of transcriptional responsive genes to acetic acid, ethanol, and 2-phenylethanol exposure in Drosophila melanogaster. Pestic. Biochem. Phys. 165: 104552.
[https://doi.org/10.1016/j.pestbp.2020.02.018]

-
Silva, T. R. F. B., A. C. d. S. Almeida, T. d. L. Moura, A. R. d. Silva, S. d. S. Freitas and F. G. Jesus. 2016. Effect of the flavonoid rutin on the biology of Spodoptera frugiperda (Lepidoptera: Noctuidae). Acta Sci. 38: 165-170.
[https://doi.org/10.4025/actasciagron.v38i2.27956]

-
Simmonds, M. S. 2003. Flavonoid-insect interactions: recent advances in our knowledge. Phytochem. Lett. 64: 21-30.
[https://doi.org/10.1016/S0031-9422(03)00293-0]

-
Soh, J.-W., N. Marowsky, T. J. Nichols, A. M. Rahman, T. Miah, P. Sarao, R. Khasawneh, A. Unnikrishnan, A. R. Heydari and R. B. Silver. 2013. Curcumin is an early-acting stage-specific inducer of extended functional longevity in Drosophila. Exp. Gerontol. 48: 229-239.
[https://doi.org/10.1016/j.exger.2012.09.007]

-
Taira, N., B. C. Q. Nguyen, P. T. Be Tu and S. Tawata. 2016. Effect of Okinawa propolis on PAK1 activity, Caenorhabditis elegans longevity, melanogenesis, and growth of cancer cells. J. Agric. Food Chem. 64: 5484-5489.
[https://doi.org/10.1021/acs.jafc.6b01785]

-
Tayal, M., P. Somavat, I. Rodriguez, L. Martinez and R. Kariyat. 2020. Cascading effects of polyphenol-rich purple corn pericarp extract on pupal, adult, and offspring of tobacco hornworm (Manduca sexta L.). Commun. Integr. Biol. 13: 43-53.
[https://doi.org/10.1080/19420889.2020.1735223]

-
Toreti, V. C., H. H. Sato, G. M. Pastore and Y. K. Park. 2013. Recent progress of propolis for its biological and chemical compositions and its botanical origin. Evid. Based Complementary Altern. Med. 2013.
[https://doi.org/10.1155/2013/697390]

-
Vallianou, N. G., P. Gounari, A. Skourtis, J. Panagos and C. Kazazis. 2014. Honey and its anti-inflammatory, anti-bacterial and anti-oxidant properties. Gen. Med. 2: 1-5.
[https://doi.org/10.4172/2327-5146.1000132]

-
Wang, Y., A. B. Salmon and L. G. Harshman. 2001. A cost of reproduction: oxidative stress susceptibility is associated with increased egg production in Drosophila melanogaster. Exp. Gerontol. 36: 1349-1359.
[https://doi.org/10.1016/S0531-5565(01)00095-X]

- Wibowo, I., F. R. Nasution, I. Taufik, R. S. Zain, N. Marlinda, N. Utami, P. Y. Wardiny, R. E. Putra, M. I. Tan and S. H. Sumarsono. 2020. Anti-inflammatory activity of Indonesian propolis in Zebrafish (Danio rerio) larvae. Food Nutr. Res. 8: 225-230.
-
Zhao, H. W., D. Zhou and G. G. Haddad. 2011. Antimicrobial peptides increase tolerance to oxidant stress in Drosophila melanogaster. J. Biol. Chem. 286: 6211-6218.
[https://doi.org/10.1074/jbc.M110.181206]

-
Zhu, J., K.-C. Park and T. C. Baker. 2003. Identification of odors from overripe mango that attract vinegar flies, Drosophila melanogaster. J. Chem. Ecol. 29: 899-909.
[https://doi.org/10.1023/A:1022931816351]

-
Zirin, J. and N. Perrimon. 2010. Drosophila as a model system to study autophagy. Semin Immunopathol. 32: 363-372.
[https://doi.org/10.1007/s00281-010-0223-y]

-
Zwaan, B., R. Bijlsma and R. Hoekstra. 1991. On the developmental theory of ageing. I. Starvation resistance and longevity in Drosophila melanogaster in relation to pre-adult breeding conditions. Heredity (Edinb). 66: 29-39.
[https://doi.org/10.1038/hdy.1991.4]