스마트양봉 시스템을 활용한 가온판 이용이 월동중 양봉꿀벌 (Apis mellifera) 봉군에 미치는 영향: 일벌의 활동성
Abstract
The issue of honeybee winter mortality has become a global concern, with South Korea reporting high rates of winter die-offs over the past three years. This study investigated the optimal temperature and effectiveness of heating panels using a smart beekeeping system to mitigate winter mortality. The impact of heating pad use on colony internal temperature, worker bee movement distance and speed, and body weight during hibernation was evaluated. The experiment was conducted in three groups: a control group with natural hive temperatures, and two experimental groups with internal hive temperatures maintained at 10°C and 12°C, respectively. All colonies were monitored via smart sensors recording temperature, humidity, and CO2 at 30-minute intervals throughout the experiment. From December to March, worker bee movement distance and average speed were measured monthly. The results showed that the 12°C heating group maintained the most stable internal colony temperature during January and February. This group also exhibited the highest activity levels throughout the winter, particularly in March. Weight measurements in January revealed that the 12°C heating group had a higher average weight compared to the natural temperature group and the 10°C heating group, although it recorded the lowest weight in February. These findings indicate that the use of heating panels can significantly affect the activity levels of worker bees during and after the wintering period.
Keywords:
Honeybee, Wintering, Winter loss, Electric heating panels, Heating pads, Activity, Vitality서 론
전 세계적으로 꿀벌의 월동 폐사 문제가 대두되었다. 2018~2019년 유럽 31개국의 겨울철 평균 월동봉군 손실률은 평균 16.7%를 기록하였고, 국가마다 5.8~32%까지 큰 차이를 보여주었다 (Gray et al., 2020). 최근 2021년부터 2023년까지 국내 양봉농가에서 월동 중인 꿀벌 봉군이 사라지거나 폐사하는 문제가 증가하고 있다 (Kim, 2022; 한두봉, 2023). 2024년의 경우 한국양봉협회 자체 조사에 따르면 전국 53%의 봉군이 피해를 보았다고 보고하였다 (김신지, 2024). 꿀벌 봉군의 월동 폐사로 인해 과일이나 채소류의 수분에 사용될 화분매개 꿀벌 부족, 양봉농가의 꿀 수확을 위한 수확용 꿀벌이 부족해 양봉농가에 금전적 손실이 발생하는 상황이다 (Kim, 2022). 꿀벌의 월동 폐사의 원인으로는 기후변화, 빈번한 이상기온, 꿀벌응애류 감염, 꿀벌 질병 감염, 농약 노출 등이 지목되고 있다 (Ravoet et al., 2013; Chauzat et al., 2016; Pohorecka et al., 2017; Switanek et al., 2017). 국내에서 발생하는 월동꿀벌 폐사 현상의 정확한 원인을 규명하기 위해 기관 및 대학에서 연구가 진행 중이나 아직 명확한 해결 방법을 제시하지 못하는 상황이다.
꿀벌에게 온도는 매우 중요한 생존 요소 중 하나이다. 양봉꿀벌 (Apis mellifera)은 애벌레 양육을 위해 양육권의 온도를 33~36°C로 유지해야 한다 (Heinrich, 1993; Kleinhenz et al., 2003; Seeley, 2014). 적정 온도를 벗어나면 애벌레의 발육에 문제가 생기고 (Tautz et al., 2003, Wang et al., 2016), 번데기에서 성충이 되지 못하고 폐사한다 (Basile et al., 2008). 이러한 문제를 해결하기 위하여 꿀벌은 자체적으로 온도 조절 시스템을 갖추고 있다 (Basile et al., 2008). 꿀벌은 다른 변온성 (poikilothermy) 곤충과는 다르게 직접 체온을 증가시킬 수 있는 이온성 (heterothermic) 곤충이다 (Willmer and Stone, 2004). 꿀벌은 봉군 내부 및 육아권의 온도 유지를 위해 적정 온도보다 낮은 온도에서 일벌들은 날개근육을 진동하여 열을 발생시는 ‘떨림열 발생’ (shivering thermogenesis)으로 온도를 상승시킨다 (Heinrich, 1996; Stabentheiner et al., 2003b). 난방 역할을 하는 일벌들은 번데기방 주변의 빈 소방에 들어가 발열을 하여 온도 유지를 하기도 한다 (Kleinhenz et al., 2003). 재래꿀벌 (Apis cerana)은 말벌과 같은 천적곤충에 대한 방어 활동에도 날개근육에서 발생한 열을 사용한다. 말벌이 봉군으로 침입하면 일벌들은 말벌을 감싸 공 (heat ball)을 만들고 흉부의 온도를 올려 열로 공격한다 (Ono et al., 1987). 봉군 내부가 높은 온도일 경우, 외부에서 물을 수집해 벌집 내부에 묻혀 기화열을 통해 온도를 낮추거나 (Jarimi et al., 2020), 봉군 입구에서 날개짓을 하는 환풍 활동 (fanning)을 하여 공기를 순환시켜 벌통 내부의 온도를 낮춘다 (Cook et al., 2016a, 2016b). 꿀벌의 자체 온도 유지 시스템은 봉군 내부의 온도를 유지하는 데 일벌들이 많은 에너지를 사용하게 한다 (Southwick et al., 1990; Basile et al., 2008).
양봉가들은 꿀벌 봉군의 에너지 사용을 줄이고, 벌통 내부를 적정온도로 유지하는 데 도움을 주기 위하여 벌통 내부와 외부에 단열재 등을 사용하여 보온한다 (Szabo, 1985; St. Clair et al., 2022). 한국의 경우 아까시 꿀 수확 전 봄철에 채집벌 수 증가를 위한 보온은 매우 중요하며, 겨울철 월동 중인 봉군의 추위에 대한 보호에 중요한 역할을 한다. 벌통 보온법으로 단열재, 스티로폼 (styrofoam) 벌통, 벌집 덮개 사용, 실내로의 이동, 전기 가온 등 다양한 방법이 사용되며 (Currie et al., 2015; Alburaki and Corona, 2021; St. Clair et al., 2022), 외부 기온이 내부 온도에 미치는 영향을 최소화한다 (Lima et al., 2019).
전기 가온의 경우 발열하는 가온판을 사용하여 보온이 아닌 봉군 내부에서 직접적으로 열을 발생시켜 온도를 유지하는 방법이다. 월동봉구를 형성한 꿀벌들은 현재 위치의 저장된 꿀을 모두 소비하면 조금씩 이동하여 꿀을 소비하게 되는데 (Crailsheim et al., 1993), 이때 낮은 온도는 꿀벌의 이동을 방해한다 (Morse, 1966). 전기 가온은 이상기후로 인한 평균보다 낮은 외부 기온에서도 꿀벌들이 안정적으로 겨울철 먹이 활동을 할 수 있게 하고, 외부 기온과 내부 온도의 차이를 줄여 주어 꿀벌들이 안정적으로 월동봉구를 유지할 수 있게 한다 (Corkins, 1932; Oskin and Ovsyannikov, 2020). 장점이 존재함과 동시에 단점들도 존재한다. 따뜻한 온도에 의해 벌들의 대사가 가속되고 여왕벌이 겨울에 산란 자극을 받을 수 있으며, 내부의 일벌들이 활동하여 저장된 꿀 소비량이 증가될 수 있다 (Southwick, 1983). 먹이저장량이 부족한 봉군들은 먹이부족으로 인한 폐사 발생의 원인이 되기도 하고, 전기 에너지 사용으로 양봉가에게 추가적인 비용을 발생시킬 수 있다 (Oskin and Kudryavtseva, 2021). 이러한 단점을 극복하기 위해 스마트 시스템을 이용하여 벌통 내부의 온도를 확인하며 적정온도로 유지하는 방법이 있다 (Ohashi et al., 2009; Zacepins and Stalidzans, 2012). 하지만 스마트 양봉 시스템을 활용하기 위한 한국의 환경에 맞는 기초 데이터가 부족하여 효과적인 적용이 어려운 실정이다. 국내 겨울철 환경에 대한 전기가온 적정 온도와 사용시기, 사용방법 등을 표준화하는 추가적인 연구가 필요하다.
본 연구는 스마트 양봉 시스템을 활용해 겨울철 월동 봉군 내부 환경 (온도)을 최적 월동 조건으로 유지하는 데 필요한 기초 데이터를 얻기 위하여 실시하였다. 스마트 양봉 시스템과 연계된 전기 가온판 (electric heating panel 또는 hive heater)의 온도 유지가 월동봉군의 일벌들에게 어떠한 영향을 미치는지 행동학적인 접근법으로 일벌의 활동성을 비교하였고, 개체 무게, 봉군 온도를 측정하여 확인하였다.
재료 및 방법
1. 공시충
국립농업과학원 실험양봉장에서 사양 관리하는 12개의 양봉꿀벌 (Apis mellifera) 봉군을 대상으로 실험을 진행하였다. 각 봉군은 동일 시기에 여왕벌이 생성되었다. 사용된 봉군의 PCR을 통한 질병검사 결과 (Bakonyi et al., 2003), 봉군의 생존에 영향을 줄 수 있는 미국부저병 (AFB: American foulbrood) 및 유럽부저병 (EFB: European foulblood)이 검출되지 않았고, 다른 병증은 육안으로 확인되지 않았다.
2. 실험 그룹
겨울철 가온판의 사용이 벌통 내부의 온도, 꿀벌의 활동성 및 무게에 어떤 영향을 미치는지 알아보기 위하여 가온판을 사용하지 않은 그룹 (대조군; 자연온도), 가온판을 사용하여 벌통 내부의 온도가 10°C 이하로 떨어지지 않게 유지한 그룹 (실험군; 10°C 가온), 벌통 내부 온도가 12°C 이하로 떨어지지 않게 유지한 그룹 (실험군; 12°C 가온)을 설정하여 총 3가지 그룹으로 진행하였다. 온도 설정은 겨울철 일벌의 월동 봉구가 형성되기 시작하는 온도인 14°C보다 낮게 설정하여 (Johansson and Johansson, 1979), 일벌이 벌통 내부에서 활동할 수 있는 온도인 10°C와 봉구가 풀리지 않을 정도의 온도 설정인 12°C로 설정하였다 (Stabentheiner et al., 2003a).
3. 봉군 세력
실험 시작 전 봉군 간 벌 수를 표준화하기 위하여 일벌 수를 측정하였다. 측정 방법은 소비 한 면을 5 cm2인 정사각형으로 가로 4칸, 세로 8칸 총 32칸으로 나누어 양면 합을 64칸으로 설정하고 벌이 착봉된 칸 수를 측정하였다. 측정한 칸 수는 소비 양면에 100% 꿀벌이 붙어있는 상태를 2,500마리로 설정하여 칸수를 비율로 바꾸어 일벌 수를 계산하였다 (Delaplane et al., 2013). 3가지 실험 그룹에 각 4개의 벌통으로 4반복 실험을 진행하였다. 실험 시작 일벌 수는 실험군별 자연온도 그룹 9,487±435.3 (mean±SD)마리, 10°C 가온 그룹 8,970±419.9마리, 12°C 가온 그룹 9,430±419.9마리로 그룹 간 유의한 차이가 없었다 (one-way ANOVA, F(2,9)=1.780, p=0.223). 모든 벌통의 소비 (벌집)는 5매로 통일하였다.
4. 스마트 센서 및 가온판 설치
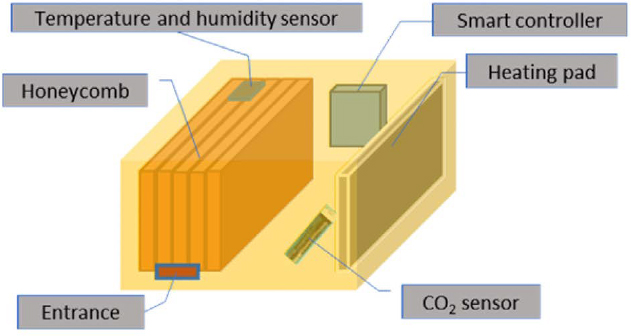
실험에 사용된 전체 봉군에 스마트 양봉 시스템이 포함된 온·습도 센서 ((주)비온팜, 전북 완주, 한국)를 설치하여 벌통 내부 온·습도를 기록하였다. 벌통은 일반적인 나무 단상 벌통을 사용하였다 ((주)야생, 광주, 한국). 스마트양봉 시스템은 벌통 내부의 온도, 습도, CO2 데이터를 30분 단위로 수집하여, 온라인으로 스마트폰 앱을 통하여 실시간 벌통 내부 정보를 확인할 수 있으며, 설정온도를 조절할 수 있는 시스템이다. 앱을 통해 기록된 데이터를 바로 받을 수 있다. 스마트 양봉 시스템에 연결된 전기 가온판 (BO-100, (주)비온팜, 전북 완주, 한국)은 온도 센서 (AM-2320, (주)비온팜, 전북 완주, 한국)에서 측정된 온도를 확인하여 설정 온도 (본 실험에서 10°C, 12°C) 이하로 떨어지면 가온하여 벌통의 온도를 유지한다. 이러한 시스템은 전기 가온으로 인해 봉군 내부 온도가 너무 높아져 꿀벌의 신진대사를 가속시켜 여왕벌의 산란을 유도하는 부작용을 줄일 수 있을 것이다 (Southwick, 1983).
센서의 위치는 입구의 반대쪽의 2번과 3번 소비 사이의 상단에 벽으로부터 10 cm, 아래로 10 cm 위치에 설치하였다. CO2 센서 (MH-z16, (주)비온팜, 전북 완주, 한국)는 소비와 가온판 사이의 바닥부분에 설치하였다. 자연온도 그룹의 4봉군을 제외하고, 8봉군에 가온판을 설치하였다. 가온판 설치 위치는 소비 반대편 끝 벽 쪽에 위치시켰다. 가온판은 설정 온도가 될 때까지 발열하기 때문에 소비와 가까이 있으면 소비의 밀납이 녹을 수 있어 소비와 거리를 약 20 cm 떨어뜨려 두었다 (Fig. 1). 가온판은 12월 2일부터 작동을 시작하였다. 각 봉군들은 동일한 보온포장으로 월동하였다.
5. 일벌 활동성 및 무게 측정
본 실험은 ‘월동봉군에 가온판을 사용하여 봉군내 온도를 유지해 준다면 월동 중 일벌들의 활동성 보존에 긍정적인 영향을 미칠 것이다’로 가설을 설정하였다. 일벌의 활동성은 30분 동안 총 이동거리와 평균속도를 측정하여 그룹별로 비교하여 확인하였다.
행동 측정은 12~3월에 걸쳐 총 4회 측정하였다 (1차-12월 23일, 2차-1월 4일, 3차-2월 18일, 4차-3월 21일). 각 실험 차수마다 3 그룹의 총 12개 벌통의 상단에서 14마리의 일벌을 무작위로 샘플링하여 온도 25±1°C, 상대습도 25±5%로 설정된 실험실로 이동하였다. 실험실로 이동시킨 일벌들은 CO2에 10초간 노출시켜 기절시킨 후 개체별로 petri dish (지름 10 cm, 높이 1.5 cm)로 옮겨주었다. petri dish로 이동시킨 일벌은 기절 상태에서 깨어나게 하기 위하여 25±1°C 온도에서 30분 대기시켰다. 그 후 수직 각도로 캠코더를 설치하여 30분 동안 일벌 개체의 움직임을 영상 촬영하였다. 영상 촬영이 종료된 일벌들은 저온저장고 (4°C)로 이동시켜 활동성을 낮춘 후 실험 그룹별로 4개의 봉군에서 각각 14마리씩 총 56마리의 개체 무게를 측정하였다. 3개의 실험그룹에서 1회 무게 측정 시 총 168마리의 일벌의 무게를 측정하였다.
6. 일벌 행동 및 데이터 분석
일벌들의 30분간 총 이동거리 (cm) 및 평균속력 (cm/s)은 행동분석 프로그램인 Ethovision XT v8.5 (Noldus Information Technology Inc., Wageningen, Netherlands)를 사용하여 정량화해 분석하였다 (Ingram et al., 2015). 데이터 간 통계분석은 통계분석 프로그램인 SigmaPlot 12.5 (Sysstat Software Inc)를 사용하였다. 그룹 간 통계적 비교에는 정규분포하고 등분산성을 만족할 경우 Oneway ANOVA를 사용하였고, 사후검정으로 Tuke’y HSD를 사용하여 두 그룹 간 비교를 진행하였다. 정규분포를 만족하지 않거나 등분산성을 만족하지 않을시 Kruskal-Wallis test를 사용하여 통계분석을 하였으며, 사후검정으로 Dunn’s test를 사용하였다.
결 과
1. 월동봉군 내부 온도
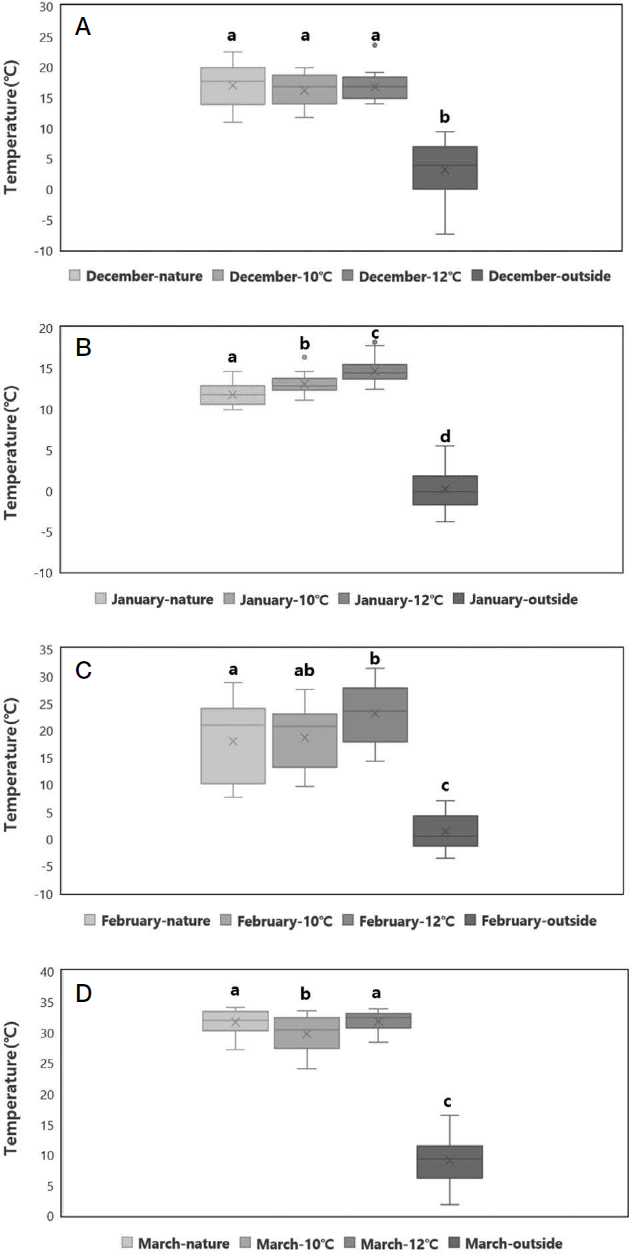
실험그룹 간 벌통 내부의 일 평균온도를 월별로 묶어 비교하였다. 오류로 측정이 안된 일 (day) 데이터는 제외되었다. 실험의 시작 달인 12월 (N=29)의 그룹별 평균 일일 온도는 자연온도 그룹 16.9±3.5°C, 10°C 가온 그룹 16.1±2.6°C, 12°C 가온 그룹 16.7±2.1°C로 각 실험그룹 간 유의한 차이를 보이지 않았다. 1월 (N=31)은 자연온도 그룹 11.7±1.3°C, 10°C 가온 그룹 13.0±1.1°C, 12°C 가온 그룹 14.6±1.3°C로 가온 그룹과 자연온도 그룹 간 유의한 차이를 보였다 (Kruskal-Wallis test, H(2)=47.692, p≤0.001). 이후 Dunn’s 사후검정을 사용하여 각 그룹 간 비교를 수행하였다. 사후검정 결과 전체 그룹에서 모두 그룹 간 유의한 차이를 보였다 (p<0.05). 2월 (N=23)은 자연온도 그룹 17.9±7.4°C, 10°C 가온 그룹 18.6±5.6°C, 12°C 가온 그룹 23.0±5.5°C로 유의한 차이를 보였다 (Kruskal-Wallis test, H(2)=7.669, p=0.022). 사후검정 결과 자연온도 그룹과 12°C 그룹 사이에서 유의한 차이를 보였다 (p<0.05). 3월 (N=25)은 자연온도 그룹 31.6±2.0°C, 10°C 가온 그룹 29.7±3.0°C, 12°C 가온 그룹 31.7±1.6°C로 유의한 차이를 보였다 (Kruskal-Wallis test, H(2)=8.408, p=0.015). 사후검정 결과 10°C 가온 그룹과 12°C 가온 그룹 사이에서 유의한 차이를 보였고 (p<0.05), 자연온도 그룹과 10°C 가온 그룹 사이에서 유의한 차이를 보였다 (p<0.05). 일일 외부 온도 평균은 12월 3.1±4.4°C, 1월 0.1±-2.6°C, 2월 1.2±3.2°C, 3월 9.0±3.8°C로 측정되었다 (Fig. 2).
2. 일벌 개체의 이동거리 비교
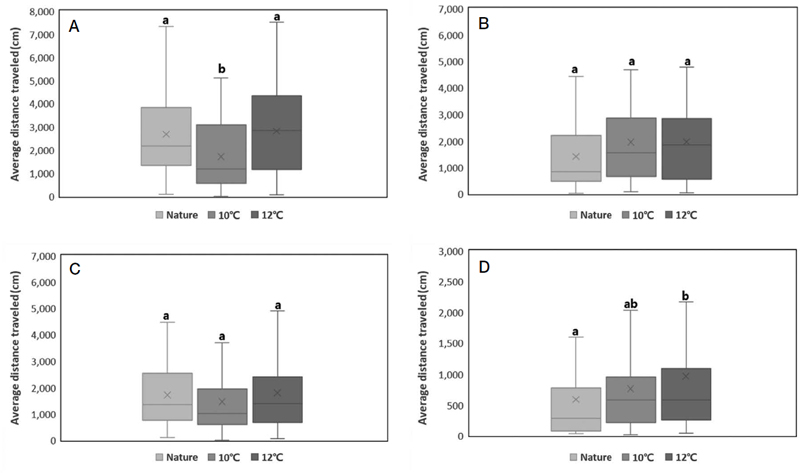
그룹별 일벌 개체의 이동거리 (그룹별 N=56)는 1차 (12월) 비교에서 자연온도, 10°C 가온, 12°C 가온 순으로 2,677.2±1854.3, 1,707.0±1,432.3, 2,813.4±1,877.5 cm (mean±SD)로 측정되었고, 그룹 간 유의한 차이가 있었다 (Kruskal-Wallis test, H(2)=12.929, p=0.002). 사후검정 결과 12°C 가온 그룹-10°C 가온 그룹, 자연온도 그룹-10°C 가온 그룹 사이에서 유의한 차이를 보이며 (p<0.05), 10°C 가온 그룹에 비해 자연온도 그룹과 12°C 가온 그룹의 일벌들이 더 높은 총 이동거리를 보여주었다. 2차 (1월) 비교는 1,411.0±1,199.1, 1,959.3±1,652.8, 1,969.9±1,664.7 cm로 그룹 사이에서 유의한 차이가 없었다. 3차 (2월) 비교는 1,715.8±1,106.4, 1,460.6±1,372.6, 1,798.6±1,547.7 cm로 그룹 사이에서 유의한 차이가 없었다. 4차 (3월) 비교는 586.0±781.0, 761.7±821.2, 967.1±1,266.3 cm로 그룹 간 유의한 차이가 있었다 (Kruskal-Wallis test, H(2)=7.367, p=0.025). 사후검정 결과 12°C 가온 그룹-자연온도에서 유의한 차이를 보이며 (p<0.05), 12°C 가온 그룹의 총 이동거리가 높았다 (Fig. 3).
3. 일벌 개체의 이동속도 비교
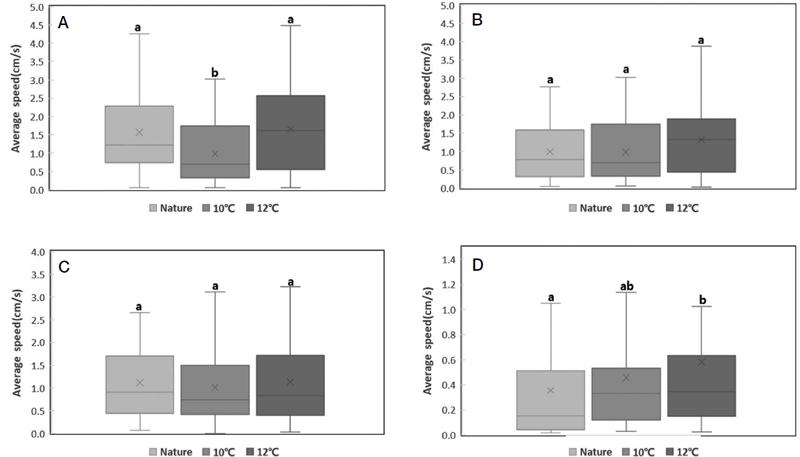
그룹별 일벌 개체의 이동속도 (그룹별 N=56)는 1차 (12월) 비교에서 자연온도, 10°C 가온, 12°C 가온 순으로 1.57±1.10, 0.99±0.83, 1.65±1.10 m/s (mean±SD)로 측정된 그룹 간 유의한 차이가 있었다 (Kruskal-Wallis test, H(2)=13.862, p≤0.001). 사후검정 결과 12°C 가온 그룹-10°C 가온 그룹, 자연온도 그룹-10°C 가온 그룹에서 유의한 차이를 보이며 (p<0.05), 10°C 가온 그룹에 비해 자연온도 그룹과 12°C 가온 그룹이 높은 평균속도를 보였다. 2차 (1월) 비교에서 1.00±0.86, 1.12±0.93, 1.32±1.02 m/s으로 그룹 간 유의한 차이가 없었다. 3차 (2월) 비교에서 1.12±0.72, 1.10±0.87, 1.13±0.90 m/s으로 그룹 간 유의한 차이가 없었다. 4차 (3월) 비교에서 0.36±0.46, 0.46±0.53, 0.58±0.78 m/s으로 그룹 간 유의한 차이가 있었다 (Kruskal-Wallis test, H(2)=6.708, p=0.035). 사후검정 결과 12°C 가온 그룹-자연온도 그룹에서 유의한 차이를 보이며 (p<0.05), 12°C 가온 그룹의 평균속도가 높았다 (Fig. 4).
4. 월동 중 가온 여부에 따른 일벌의 무게
영상촬영이 끝난 일벌들을 대상으로 개체 무게를 측정하였다. 12월의 그룹별 무게의 평균은 자연온도 그룹, 10°C 가온 그룹, 12°C 가온 그룹 순으로 97.9±12.3, 100.1±15.4, 99.6±17.1 mg으로 그룹 간 평균 비교에서 유의한 차이를 보이지 않았다. 1월은 96.1±10.1, 97.1±10.2, 104.7±16.6 mg으로 그룹 간 유의한 차이를 보였다 (Kruskal-Wallis test, H(2)=9.594, p=0.008). 사후검정 결과 12°C 그룹-자연온도 그룹에서 유의한 차이를 보였고 (p<0.05), 12°C 가온 그룹-10°C 가온 그룹 사이에서 유의한 차이를 보였다 (p<0.05). 2월은 115.1±16.4, 118.8±14.0, 111±12.5 mg으로 그룹 간 유의한 차이를 보였다 (Kruskal-Wallis test, H(2)=7.214, p=0.027). 사후검정 결과 12°C 가온 그룹-10°C 가온 그룹 사이에서 유의한 차이를 보였다 (p<0.05). 3월은 114.9±13.2, 114.3±15.5, 116.9±14.6 mg으로 그룹 간 유의한 차이를 보이지 않았다 (Table 1).

The average weight of individual bees in each experimental group by month (N=56). There were significant differences between groups in January and February. Dunn’s test: January (12℃-nature, p<0.05, 12℃~10℃, p<0.05), February (12℃~10℃, p<0.05). The same alphabet indicates that there is no significant difference between groups
고 찰
겨울철 월동 꿀벌 봉군에서 스마트 양봉 시스템을 이용한 전기 가온판의 사용이 벌통 온도, 일벌의 활력, 일벌의 무게에 미치는 영향을 평가하였다. 월동봉군의 내부 온도는 실험을 시작한 12월의 경우 3개의 실험 그룹 사이에서 유의한 차이를 보이지 않았다. 외부 평균기온은 약 3°C로 떨어졌지만, 봉군 내부 온도가 가온판 작동 설정 온도까지 낮아지지 않아서 가온판이 작동하지 않았기 때문에 실험군 간 유의한 차이가 발생하지 않았다. 이런 결과는 12월의 경우 가온판의 사용이 필요 없을 수 있다는 것을 보여준다. 1월의 경우 외부 일일 평균기온이 영하권으로 떨어지는 기간이 전체 기간 중 51% 이상 지속되어 가온판의 효과가 명확하게 드러났다. 내부 온도가 자연온도 그룹보다 가온판을 사용한 그룹들이 유의하게 높게 측정되었다. 이는 꿀벌들이 월동하기 좋은 안정적인 환경을 제공하여 꿀벌의 에너지 소모를 줄이고 생존율을 높일 수 있음을 시사한다 (Oskin and Kudryavtseva, 2021). 2월의 경우 1월에 비해 영하권 일일 평균기온인 날이 전체 일수 중 39%로 낮았지만, 12월 24%보다 많은 날이 영하권 일일 평균기온을 기록하였다. 2월에는 자연온도 그룹과 12°C 가온 그룹 사이에서 봉군 내부 온도의 유의한 차이가 발생하였다. 가온 그룹들의 온도 변동성이 더 적었으며, 자연온도 그룹, 10°C 가온 그룹, 12°C 가온 그룹 순서로 평균 일일 내부 온도가 높게 측정되어 가온판이 봉군 내부의 온도 유지에 효과가 있음을 보여주었다. 3월의 경우 외부 일일 평균 기온이 영하권으로 떨어지는 날은 없었다. 10°C 가온 그룹이 다른 두 그룹보다 유의하게 낮은 일일 평균 내부 온도를 보였지만, 가온판은 작동하지 않아 다른 요인에 의한 온도 차이로 보여진다. 낮은 외부 기온에서도 가온판을 사용한 그룹의 봉군들의 온도는 가온판을 사용하지 않은 그룹의 봉군들보다 높은 내부 온도를 유지하였다. 이러한 결과는 겨울철 전기 가온판으로 인한 가온이 봉군 내부 온도에 영향을 미친다는 사실을 보여준다. 가온판으로 인한 겨울철 봉군의 온도 유지 효과가 꿀벌 봉군에 미치는 영향에 대한 검증은 추가적인 연구를 진행해야 할 요소이다. 겨울철의 낮은 온도에서 꿀벌들은 네오니코티노이드계 살충제에 대한 더 높은 독성을 보여준다는 연구 결과는 가온판을 사용해 살충제에 대한 꿀벌 독성에 영향을 줄 수 있을 것으로 생각되나 추후 추가적인 연구가 필요해 보인다 (Saleem et al., 2020).
일벌의 행동력 측정결과 가온판을 사용한 그룹의 이동거리와 평균속도가 높게 측정되었다. 30분간 일벌들의 이동거리의 경우 12월 (1차) 측정에서는 가온판이 작동하지 않았기 때문에 3그룹 모두 온도가 조절되지 않는 조건에서 행동력이 측정되었다. 동일한 외부 온도 조건에서 자연온도 그룹과 12°C 가온 그룹은 비슷한 이동거리를 보여주었고, 10°C 가온 그룹만 앞의 두 그룹보다 낮은 이동거리를 기록하였다. 10°C 가온 그룹과 다른 그룹 사이에서 발생한 차이의 원인은 명확하지 않다. 꿀벌들의 활동에 영향을 주는 요인은 온도 이외에도 습도, 바람, 빛의 강도, 기생충, 화학물질, 질병 등 다양하기 때문에 온도 이외의 요인으로 인한 행동 변화는 어떠한 요인이 원인인지 확인하지 못하였다 (Butler and Finney, 1942; Szabo, 1980; Fairbrother et al., 2014). 1월 (2차), 2월 (3차) 측정 시 그룹 간 이동거리는 유의한 차이를 보이지 않았다. 1월과 2월은 겨울 중 가장 온도가 낮은 기간이기 때문에 일벌들의 활동성이 저하되어 있어 가온판 사용으로 인한 온도 차이에도 그룹 간 큰 차이를 보이지 않은 것으로 예상된다. 3월 (4차) 측정 시 12°C 가온 그룹이 자연온도 그룹에 비해 유의한 차이를 보이며 높은 이동거리가 측정되었고, 10°C 가온 그룹의 이동거리는 유의한 차이를 보이지는 않았지만 자연온도 그룹과 12°C 가온 그룹 사이의 이동거리 값이 측정되었다. 평균 이동속도 측정에서도 이동거리 데이터와 동일한 결과를 보여주었다. 이러한 결과는 월동을 종료할 시기에 가온판을 사용하여 봉군의 온도를 일정하게 유지해 준 봉군들이 자연온도 그룹보다 더 높은 활동성을 보여준다는 것을 의미한다. 이러한 높은 활동성의 원인을 추측한다면, 꿀벌들은 저온스트레스 환경에서 날개근육을 진동시켜 열을 발생시키는데, 저온 스트레스가 줄어들면 열을 발생시키는 빈도가 줄어들어 일벌들의 에너지 소모가 감소될 것이라고 판단할 수 있기 때문이다 (Stabenthiner et al., 2010). 12, 1, 2월에 비하여 전체적인 이동거리와 평균속도는 낮아졌지만, 3월 측정에서의 차이는 오랜 기간 겨울을 겪은 일벌의 에너지가 가온판 사용으로 조금 더 적게 소모될 수 있음을 시사한다. Oskin과 Ovsyannikov (2020)의 시뮬레이션을 통한 연구에 의하면 저온에서 난방된 벌집에서 일벌의 에너지 출력이 3,600 W/m3에서 1,900 W/m3으로 감소하였고 꿀 소비를 줄일 수 있다는 것을 확인하였다. 가온판으로 인한 일벌의 에너지 절약은 월동 이후 새로운 세대를 생산해야 할 봉군에 긍정적인 영향을 미칠 것으로 생각된다.
월동에 들어가기 전 12월에 일벌들의 무게는 각 그룹 간 유의한 차이가 없었다. 가온판이 작동되고, 1월부터 그룹 간 무게에 차이가 발생하였다. 1월 12°C 가온 그룹의 일벌들이 다른 그룹에 비하여 무거운 것으로 측정되었으나, 2월에는 가장 가벼운 무게를 기록하였다. 월동이 끝나는 시기인 3월에는 다시 그룹 간 일벌들의 무게 차이가 없었다. 1월에 12°C 가온 그룹의 일벌들의 무게가 더 무겁게 측정된 것은 비교적 따뜻한 봉군 내부 온도 유지로 인해 가장 추운 시기인 1월에도 일벌들이 먹이가 있는 곳으로 이동하여 먹이 섭취에 의한 것으로 사료된다. 일벌들의 샘플링 시 월동봉구의 손상을 최소화하기 위하여 소초광의 가장 위에 있는 개체들을 샘플링하였다. 샘플링한 외각 개체들은 봉군 내부에서 가장 낮은 온도에 노출된다. 이러한 외각의 일벌들은 외부 온도가 급격히 떨어지면 월동 봉구 외각의 온도가 낮아지기 때문에 먹이활동이 어려워질 수 있다 (Doeke et al., 2015). 본 실험에서는 가온판으로 외각의 온도를 높여주었기 때문에 일벌들의 먹이 섭취가 더 원활하게 이루어져 12°C 가온 그룹의 일벌들의 무게가 더 높았을 것이라 생각된다. 2월의 경우 1월보다 높은 온도를 기록하였기 때문에 다른 모든 그룹의 일벌들이 먹이섭취를 할 수 있었기 때문에 전체적으로 무거워진 결과를 보여주었다. 3월의 경우 일벌들이 월동을 종료하고, 봉군 내부의 온도가 먹이활동을 저해할 온도가 아니기에 다시 일벌들의 무게가 각 그룹 간 차이가 없게 측정된 것으로 생각된다.
본 연구는 겨울철 꿀벌의 월동 기간 동안 가온판 사용이 꿀벌의 벌통 내부 온도, 일벌의 이동거리, 평균속도, 개체의 무게에 미치는 영향을 평가함으로써, 꿀벌의 생존과 활동성 증진에 기여할 수 있는 적정 온도를 확인하고자 하였다. 연구 결과 12°C의 온도는 벌들의 활동량을 상대적으로 높게 유지시켰으며, 이는 꿀벌이 더 활발한 신체 활동을 유지할 수 있음을 시사한다. 한국에서 발생하고 있는 월동봉군의 높은 폐사율 문제를 고려할 때, 이 연구 결과는 꿀벌의 월동관리에 있어 스마트 양봉 시스템을 사용하여 온도를 조절하는 가온판의 사용이 월동봉군 내부의 온도 조절에 효과적일 수 있음을 말해준다. 하지만 이러한 실험 결과는 다르게 해석될 수 있으며, 다양한 봉군 크기, 외부환경 조건 및 내부조건, 양봉가의 월동방법 등에 의해 다른 결과가 발생할 수 있다. 가온판을 잘못 사용하게 된다면 난방시스템 사용으로 인한 에너지 소비 증가, 과한 가열로 인한 꿀벌의 생리 변화, 자연적인 체온조절 기능 방해, 꿀 소비량 증가 등의 문제로 봉군이 폐사할 수 있다 (Oskin and Kudryavtseva, 2021). 겨울철 가온판을 사용하는 것은 매우 신중해야 하며, 더 다양한 환경과 다양한 봉군 세력에서의 실험 결과가 뒷받침되어야 할 것으로 생각된다. 추가적인 연구가 이루어진다면 미래의 양봉 관리 방법과 정책 수립에 중요한 기초 자료로 사용할 수 있을 것이고, 꿀벌의 월동 폐사 감소에 영향을 줄 수 있을 것으로 생각된다.
적 요
이 연구는 국립농업과학원 실험양봉장에서 사육되는 양봉꿀벌 (Apis mellifera) 봉군을 대상으로 겨울철 가온판의 사용이 봉군 내부의 온도, 일벌의 활동성 및 무게에 미치는 영향을 조사하였다. 12개의 봉군을 세 그룹으로 나누어 자연온도 그룹, 10°C 가온 그룹, 그리고 12°C 가온 그룹으로 실험을 진행하였으며, 각 그룹은 동일한 조건에서 월동을 진행하였다. 스마트 온습도 센서와 가온판을 통해 봉군 내부의 환경을 조절하였고, 일벌의 이동거리, 평균속도, 그리고 무게를 정기적으로 측정하였다. 실험 결과, 가온판을 사용한 그룹들이 자연온도 그룹보다 일관적으로 높은 내부 온도를 유지하였으며, 특히 12°C 가온 그룹에서 가장 높은 일벌 활동성과 무게를 기록하였다. 이러한 결과는 가온판이 꿀벌의 월동 중 생존율과 활동성을 향상할 수 있음을 시사한다. 그러나 가온판 사용으로 인한 온도 조절이 벌의 에너지 소모에 미치는 영향을 더 자세히 이해하기 위해서는 추가적인 연구가 필요해 보인다. 겨울철 꿀벌 봉군의 월동 관리에 있어 스마트 양봉 시스템과 가온판의 적절한 사용이 중요할 수 있음을 보여주며, 다양한 환경과 조건에서의 추가 실험을 진행한다면, 겨울철 월동 폐사 방지 방법 및 정책 수립에 기여할 수 있는 기초 자료를 제공할 수 있을 것으로 생각된다.
Acknowledgments
본 연구는 농촌진흥청 연구과제 (PJ01418005)의 지원으로 수행되었다.
References
- 김신지. 2024. 꿀벌 월동 피해 심각...양봉산업 위기 직면. https://www.aflnews.co.kr/news/articleView.html?idxno=267976, )
- 한두봉. 2023. 꿀벌 피해 조사 방법 및 정책 해외사례 조사 분석. 한국농촌경제연구원.
-
Alburaki, M. and M. Corona. 2021. Polyurethane honey bee hives provide better winter insulation than wooden hives. J. Apic. Res. 61(2): 190-196.
[https://doi.org/10.1080/00218839.2021.1999578]

-
Bakonyi, T., I. Derakhshifar, E. Grabensteiner and N. Nowotny. 2003. Development and evaluation of PCR assays for the detection of Paenibacillus larvae in honey samples: comparison with isolation and biochemical characterization. Appl. Environ. Microbiol. 69(3): 1504-1510.
[https://doi.org/10.1128/AEM.69.3.1504-1510.2003]

-
Basile, R., C. W. Pirk and J. Tautz. 2008. Trophallactic activities in the honeybee brood nest-heaters get supplied with high performance fuel. Zoology 111(6): 433-441.
[https://doi.org/10.1016/j.zool.2007.11.002]

-
Butler, C. G. and D. J. Finney. 1942. The influence of various physical and biological factors of the environment on honeybee activity. An examination of the relationship between activity and solar radiation. J. Exp. Biol. 18(3): 206-212.
[https://doi.org/10.1242/jeb.18.3.206]

-
Chauzat, M. P., A. Jacques, M. Laurent, S. Bougeard, P. Hendrikx and M. Ribière-Chabert. 2016. Risk indicators affecting honeybee colony survival in Europe: one year of surveillance. Apidologie 47: 348-378.
[https://doi.org/10.1007/s13592-016-0440-z]

-
Cook, C. N., R. E. Kaspar, S. M. Flaxman and M. D. Breed. 2016a. Rapidly changing environment modulates the thermoregulatory fanning response in honeybee groups. Anim. Behav. 115: 237-243.
[https://doi.org/10.1016/j.anbehav.2016.03.014]

-
Cook, C. N., S. Durzi, K. J. Scheckel and M. D. Breed. 2016b. Larvae influence thermoregulatory fanning behavior in honeybees (Apis mellifera L.). Insect. Soc. 63: 271-278.
[https://doi.org/10.1007/s00040-016-0463-5]

-
Corkins, C. L. 1932. The temperature relationships of the honeybee cluster under controlled external temperature conditions. J. Econ. Entomol. 25(4): 820-825.
[https://doi.org/10.1093/jee/25.4.820]

-
Crailsheim, K., N. Hrassnigg, R. Gmeinbauer, M. J. Szolderits, L. H. W. Schneider and U. Brosch. 1993. Pollen utilization in non-breeding honeybees in winter. J. Insect Physiol. 39(5): 369-373.
[https://doi.org/10.1016/0022-1910(93)90024-L]

- Currie, R. W., M. Spivak, G. S. Reuter and J. M. Graham. 2015. Wintering management of honey bee colonies. The hive and the honey bee.
-
Delaplane, K. S., J. Van Der Steen and E. Guzman-Novoa. 2013. Standard methods for estimating strength parameters of Apis mellifera colonies. J. Apic. Res. 52(1): 1-12.
[https://doi.org/10.3896/IBRA/1.52.1.03]

-
Doeke, M. A., M. Frazier and C. M. Grozinger. 2015. Overwintering honey bees: biology and management. Curr. Opin. Insect Sci. 10: 185-193.
[https://doi.org/10.1016/j.cois.2015.05.014]

-
Fairbrother, A., J. Purdy, T. Anderson and R. Fell. 2014. Risks of neonicotinoid insecticides to honeybees. Environ. Toxicol. Chem. 33(4): 719-731.
[https://doi.org/10.1002/etc.2527]

-
Gray, A., N. Adjlane, A. Arab, A. Ballis, V. Brusbardis, J. D. Charrière and R. Brodschneider. 2020. Honey bee colony winter loss rates for 35 countries participating in the COLOSS survey for winter 2018-2019, and the effects of a new queen on the risk of colony winter loss. J. Apic. Res. 59(5): 744-751.
[https://doi.org/10.1080/00218839.2020.1797272]

-
Heinrich, B. 1993. The hot-blooded insects: strategies and mechanisms of thermoregulation. Harvard University Press.
[https://doi.org/10.4159/harvard.9780674418516]

-
Heinrich, B. 1996. How the honey bee regulates its body temperature. Bee World 77(3): 130-137.
[https://doi.org/10.1080/0005772X.1996.11099304]

-
Ingram, E. M., J. Augustin, M. D. Ellis and B. D. Siegfried. 2015. Evaluating sub-lethal effects of orchard-applied pyrethroids using video-tracking software to quantify honey bee behaviors. Chemosphere 135: 272-277.
[https://doi.org/10.1016/j.chemosphere.2015.04.022]

-
Jarimi, H., E. Tapia-Brito and S. Riffat. 2020. A review on thermoregulation techniques in honey bees’ (Apis mellifera) beehive microclimate and its similarities to the heating and cooling management in buildings. Futur. Cities Environ. 6: 7-7.
[https://doi.org/10.5334/fce.81]

-
Johansson, T. S. K. and M. P. Johansson. 1979. The honeybee colony in winter. Bee World 60(4): 155-170.
[https://doi.org/10.1080/0005772X.1979.11097754]

-
Kim, H. K. 2022. The effect of honey bee mites on the winter colony losses. J. Apic. 37(3): 291-299.
[https://doi.org/10.17519/apiculture.2022.09.37.3.291]

-
Kleinhenz, M., B. Bujok, S. Fuchs and J. Tautz. 2003. Hot bees in empty broodnest cells: heating from within. J. Exp. Biol. 206(23): 4217-4231.
[https://doi.org/10.1242/jeb.00680]

-
Lima, M. V., L. A. F. Pascoal, E. P. Saraiva, K. O. Soares, J. P. A. F. de Queiroz and A. Evangelista-Rodrigues. 2019. Individual Acclimatization of Apis mellifera L. to the Thermal Homeostasis of the Colony. Sociobiology 66(1): 81-87.
[https://doi.org/10.13102/sociobiology.v66i1.3378]

-
Morse, R. A. 1966. Honey bee colony defense at low temperatures. J. Econ. Entomol. 59(5): 1091-1093.
[https://doi.org/10.1093/jee/59.5.1091]

-
Ohashi, M., R. Okada, T. Kimura and H. Ikeno. 2009. Observation system for the control of the hive environment by the honeybee (Apis mellifera). Behav. Res. Methods 41(3): 782-786.
[https://doi.org/10.3758/BRM.41.3.782]

-
Ono, M., I. Okada and M. Sasaki. 1987. Heat production by balling in the Japanese honeybee, Apis cerana japonica as a defensive behavior against the hornet, Vespa simillima xanthoptera (Hymenoptera: Vespidae). Experientia 43: 1031-1034.
[https://doi.org/10.1007/BF01952231]

-
Oskin, S. V. and A. A. Kudryavtseva. 2021. Models of the Thermal Condition of Winter Aggregation of Bees with Electric Heaters Installed in the Hive. In IOP Conference Series: Earth and Environmental Science. IOP Publishing 666(3): 032091
[https://doi.org/10.1088/1755-1315/666/3/032091]

-
Oskin, S. V. and D. A. Ovsyannikov. 2020. Modeling of thermophysical processes in electrically heated hives. Biophysics 65: 331-337.
[https://doi.org/10.1134/S0006350920020165]

-
Pohorecka, K., T. Szczęsna, M. Witek, A. Miszczak and P. Sikorski. 2017. The exposure of honey bees to pesticide residues in the hive environment with regard to winter colony losses. J. Apic. Sci. 61(1): 105-125.
[https://doi.org/10.1515/jas-2017-0013]

-
Ravoet, J., J. Maharramov, I. Meeus, L. De Smet, T. Wenseleers, G. Smagghe and D. C. De Graaf. 2013. Comprehensive bee pathogen screening in Belgium reveals Crithidia mellificae as a new contributory factor to winter mortality. PLoS One 8(8): e72443.
[https://doi.org/10.1371/journal.pone.0072443]

-
Saleem, M. S., Z. Y. Huang and M. O. Milbrath. 2020. Neonicotinoid pesticides are more toxic to honey bees at lower temperatures: implications for overwintering bees. Front. Ecol. Evol. 8: 556856.
[https://doi.org/10.3389/fevo.2020.556856]

- Seeley, T. D. 2014. Honeybee ecology: a study of adaptation in social life. Princeton University Press, Vol. 44.
-
Southwick, E. E. 1983. The honey bee cluster as a homeothermic superorganism. pp. 641-645
[https://doi.org/10.1016/0300-9629(83)90434-6]

-
Southwick, E. E., D. W. Roubik and J. M. Williams. 1990. Comparative energy balance in groups of Africanized and European honey bees: ecological implications. Comp. Biochem. Physiol. A. 97(1): 1-7.
[https://doi.org/10.1016/0300-9629(90)90713-3]

-
St. Clair, A. L., N. J. Beach and A. G. Dolezal. 2022. Honey bee hive covers reduce food consumption and colony mortality during overwintering. PLoS One 17(4): e0266219.
[https://doi.org/10.1371/journal.pone.0266219]

-
Stabentheiner, A., H. Kovac and R. Brodschneider. 2010. Honeybee colony thermoregulation-regulatory mechanisms and contribution of individuals in dependence on age, location and thermal stress. PLoS One 5(1): e8967.
[https://doi.org/10.1371/journal.pone.0008967]

-
Stabentheiner, A., H. Pressl, T. Papst, N. Hrassnigg and K. Crailsheim. 2003a. Endothermic heat production in honeybee winter clusters. J. Exp. Biol. 206(2): 353-358.
[https://doi.org/10.1242/jeb.00082]

-
Stabentheiner, A., J. Vollmann, H. Kovac and K. Crailsheim. 2003b. Oxygen consumption and body temperature of active and resting honeybees. J. Insect Physiol. 49(9): 881-889.
[https://doi.org/10.1016/S0022-1910(03)00148-3]

-
Switanek, M., K. Crailsheim, H. Truhetz and R. Brodschneider. 2017. Modelling seasonal effects of temperature and precipitation on honey bee winter mortality in a temperate climate. Sci. Total Environ. 579: 1581-1587.
[https://doi.org/10.1016/j.scitotenv.2016.11.178]

-
Szabo, T. I. 1980. Effect of weather factors on honeybee flight activity and colony weight gain. J. Apic. Res. 19(3): 164-171.
[https://doi.org/10.1080/00218839.1980.11100017]

-
Szabo, T. I. 1985. The thermology of wintering honeybee colonies in 4-colony packs as affected by various hive entrances. J. Apic. Res. 24(1): 27-37.
[https://doi.org/10.1080/00218839.1985.11100645]

-
Tautz, J., S. Maier, C. Groh, W. Rössler and A. Brockmann. 2003. Behavioral performance in adult honey bees is influenced by the temperature experienced during their pupal development. Proc. Natl. Acad. Sci. U.S.A. 100(12): 7343-7347.
[https://doi.org/10.1073/pnas.1232346100]

-
Wang, Q., X. Xu, X. Zhu, L. Chen, S. Zhou, Z. Y. Huang and B. Zhou. 2016. Low-temperature stress during capped brood stage increases pupal mortality, misorientation and adult mortality in honey bees. PLoS One 11(5): e0154547.
[https://doi.org/10.1371/journal.pone.0154547]

-
Willmer, P. G. and G. N. Stone. 2004. Behavioral, ecological, and physiological determinants of the activity patterns of bees. Adv. Study Behav. 34(34): 347-466.
[https://doi.org/10.1016/S0065-3454(04)34009-X]

-
Zacepins, A. and E. Stalidzans. 2012. Architecture of automatized control system for honey bee indoor wintering process monitoring and control. In Proceedings of the 13th International Carpathian Control Conference (ICCC). IEEE. pp. 772-775.
[https://doi.org/10.1109/CarpathianCC.2012.6228751]