필터링 조건에 따른 꿀 혼합 프로폴리스의 성분 변화 및 Wnt 신호 조절과 암세포 성장 억제 효과
Abstract
Among the various signal transduction processes in cells against cancer, the activated Wnt signal is activated through the initiation of an intracellular “disheveled” signal, and it is induced cancer through overexpression of intracellular TCF/LEF genes through GSK-3β and binding inhibition of β-catenin. GSK-3β and β-catenin were overexpressed which correspond to Wnt signaling pathway in PANC-1 cells as a pancreatic cancer cells. We prepared a mixed formulation called “honeypolis” that honey and propolis mixture. Through inhibition of PCNA expression and Akt phosphorylation, and increasing of ERK phosphorylation, honeypolis inhibited PANC-1 cell proliferation. However, honeypolis dose not exhibit apoptosis of PANC-1. This effect is caused by specific functional components in propolis and it was confirmed according to the mixing and filtering order of the honeypolis. Cytotoxicity evaluation showed that specific components had an effect on cell death, Western blotting confirmed that the reducing expression of GSK-3β, β-catenin and mTOR protein corresponding to activated Wnt signaling pathway in PANC-1. In addition, this effect has been shown to be enhanced by a mixture of honey and propolis more than honey and propolis only. This result means that honey and propolis mixture has synergistic effects and it can be regulates Wnt signal cascade on PANC-1. Therefore, we suggested that the honeybee products regulates cell functionality about molecular level and it can be used to possibility against cancer.
Keywords:
Propolis extracts, Acacia honey, Honeypolis, Wnt signaling, β-catenin서 론
암은 전 세계적으로 두 번째로 높은 사망률을 가진 난치성 질환이며, 인구의 노령화 및 생활 방식의 변화에 따라 암 발병률이 증가되어왔다 (Siegel et al., 2013). 암은 모든 인류 사회에서 심각한 질병이기 때문에 암에 대한 정확한 진단과 치료는 주요 과제로 남아 있다 (Fisher et al., 2013; Meacham and Morrison, 2013). 성별에 있어서도 남성의 경우에는 전립선, 폐 및 기관지에서 높은 비율로 암이 발병하고, 여성의 경우 유방암, 폐암, 기관지암, 자궁암, 갑상선암의 발병률이 높게 나타난다 (Siegel et al., 2016). 어린이는 혈액암이나 림프절 관련 암이 높은 비율을 차지한다 (Schottenfeld and Fraumeni, 2006). 암은 가족력과 같은 선천적 요인 또는 환경 및 유해 물질에 의한 후천적 요인으로 인한 유전자에 연속적인 돌연변이가 발생하여 세포 기능을 변화시킴으로써 발생된다. 특히 후천적 요인 중에서도 여러 가지 발암성 화학물질은 암 발생에 대한 직접적인 원인이 된다 (Aizawa et al., 2016). 이러한 발암성 화학물질은 세포질과 핵에 직접 또는 간접적으로 영향을 미치게 되고, 유전 질환과 유전자 돌연변이를 유발한다 (Poon et al., 2014; Trafialek and Kolanowski, 2014). 또한 바이러스, 박테리아 및 방사선과 같은 요인도 암 발생에 있어 주요 요인으로 작용하며 전체 암 중 7%를 차지한다 (Parkin, 2006). 일반적으로 암은 세포에 존재하는 세포 소기관, 세포 기능성 유지에 필수적인 유전자의 기능 장애를 초래하고, 세포와 세포 사이에서 발생하는 “Cell communication”에 교란을 일으킨다. 이는 결과적으로 세포 주기에 영향을 끼쳐, 세포의 비정상적인 증식을 초래한다 (Cigudosa et al., 1999; Seto et al., 2010). 본래 암 발병과 관련된 원발암유전자의 경우 세포 내에서 세포 분열과 성장에 관련된 핵심적인 기능을 수행하고 있는데, 유전적 돌연변이로 인해 세포 생존에 위험한 영향을 끼치게 되고 (Shtivelman et al., 1985), p53과 같은 종양 억제유전자의 돌연변이는 세포 분열을 통제하지 못하게 되어 무한정의 세포 분열을 초래한다 (Matlashewski et al., 1984). 또한 자외선에 의해 유발되는 유전자 돌연변이를 교정하는 유전자 복구 기능의 교란 역시 암 발생에 있어 주된 요인으로 작용한다 (Wood et al., 2001).
Wnt 신호 경로는 배아 발생에 있어 주요 조절자임이 확인되어졌고 (Nüsslein-Volhard and Wieschaus, 1980), 이후 연구를 통해 Wnt1 유전자 영역에 바이러스 삽입 또는 유전자 과발현이 발생할 경우 종양이 발생한다는 것이 알려졌다 (Nusse and Varmus, 1982; Tsukamoto et al., 1988). 1991년에 유전성 선종성 다형증 (familiar adenomatous polyposis)이라 불리는 원인이 adenomatous polyposis coli (APC) 유전자의 돌연변이임이 밝혀졌는데 (Nishisho et al., 1991), APC는 β-catenin과 상호작용하고 (Rubinfeld et al., 1993; Su et al., 1993) T-cell factor (TCF)4/β-catenin 신호의 과활성화로 인해 APC의 기능 상실을 일으키는 것으로 밝혀졌다 (Korinek et al., 1997). 이 결과로 인해 신호 전달과 인간 대장암 사이의 직접적인 연관성이 밝혀졌다. Wnt 신호는 frizzled 유전자에 의해 암호화된 막횡단 수용체에 결합하는 wnt 단백질에 의해 개시된다 (Bhanot et al., 1996; Yang-Snyder et al., 1996; He et al., 1997). Wnt 결합에 의해 활성화된 수용체는 세포 내부의 glycogen synthase kinase-3β (GSK-3β)의 활성화를 유도하여 세포 내 신호 경로에 포함되어 있는 단백질의 인산화를 유도한다 (Itoh et al., 1998; Yost et al., 1998). GSK-3β 기질에는 axin과 APC 뿐만 아니라 β-catenin이 포함되는데 (Rubinfeld et al., 1996; Yamamoto et al., 1999), 인산화되지 않은 β-catenin은 β-transducin repeat-containing protein (TRCP)에 의해 인식되지 않고 핵으로 이동하여 T-cell factor/lymphoid enhancer factor (TCF/LEF) 등의 전사 인자와 결합하여 표적 유전자의 발현을 촉진하며, Wnt 신호 경로를 조절한다 (Behrens et al., 1996; Molenaar et al., 1996). 그러나 Wnt 신호 조절과 관련된 인자와 관련된 단백질의 구명과 기능 연구는 현재까지 지속되고 있고, 최근 들어 Wnt 신호 경로를 조절할 수 있는 물질과 인산화 효소 (kinase) 사이의 기전 구명을 통해 암 발생 신호를 조절하는 연구가 시도되고 있다.
꿀벌에 의해 생산되는 프로폴리스는 수많은 식물에서 유래되는 삼출물을 기반으로 밀랍과 꿀벌이 타액이 혼합되어 만들어진 다기능성 물질이다. 꿀벌은 프로폴리스를 외부의 곤충 또는 미생물과 같은 침입자로부터 벌집을 보호하고 손상된 부분을 수리하는 용도로 활용한다 (Burdock, 1998). 인류 역시 고대부터 상처 회복과 같은 용도로 프로폴리스를 활용했는데, 최근 프로폴리스 내의 성분에 대한 연구와 활용이 증가함에 따라 매우 다양한 분야에 프로폴리스를 활용하고 있다 (Fernandes Junior et al., 2005; Sforcin, 2007). 프로폴리스는 풍부하고도 다양한 플라보노이드 및 폴리페놀 성분을 함유하고 있는데, 이전에는 항균, 항산화와 같은 분야에 프로폴리스의 기능성을 보고하였다. 최근 들어 다양한 분야에 대한 프로폴리스의 기능성이 입증되었는데, 대표적으로 Yeh 등에 의해 플라보노이드 섭취에 따른 인지기능 개선 효과가 밝혀졌고 (Yeh et al., 2021), Kim 등은 프로폴리스에 의한 tau 과인산화 억제를 보고함으로써 알츠하이머 개선에 대한 프로폴리스 활용 가능성을 보고하였다 (Kim et al., 2021). 또한 2022년도에 프로폴리스가 파킨슨을 유발하는 MPTP의 독성을 저해하며, 파킨슨 유발 억제에 대한 가능성을 보고하였다 (Kim et al., 2022, 2023).
이에 본 연구에서는 프로폴리스를 활용한 세포 기능성 효과를 보다 더 구체적으로 밝히고자 프로폴리스를 꿀과 혼합하여 기능성 효과를 증진시키고 섭취가 용이하도록 제작한 제형 (허니폴리스)을 활용하여 췌장암세포에 적용함으로써 암세포의 사멸 증진 효과 및 세포 기전을 확인하였다. 특히, in vitro에서 허니폴리스의 필터링 순서에 따라 프로폴리스의 성분의 변화로 인한 암세포 사멸에 대한 성분을 특정하고자 하며, 허니폴리스에 의한 Wnt 신호 경로 단백질의 발현 변화를 통해 암세포에 대한 프로폴리스의 신호 조절 기전을 구명하고자 한다.
재료 및 방법
1. 허니폴리스 제작
본 실험에 사용된 꿀과 프로폴리스는 국내 양봉농협에서 판매되는 아까시꿀과 프로폴리스 추출액을 사용하였으며, 제형은 두 가지 방법으로 구분하여 제작하였다. 먼저 꿀 2.5 g을 80% 에탄올과 1 : 1의 비율로 완전히 혼합하고, 동량의 3차 증류수를 첨가하였다. 이후 프로폴리스 250 μL를 첨가하여 혼합한 다음 0.45 μm의 syringe filter로 필터링하였다 (MF). 두 번째 제작 방법은 프로폴리스를 혼합하기 전 단계에서 꿀과 프로폴리스 추출액을 0.45 μm의 syringe Àlter로 각각 필터링한 다음, 꿀에 250 μL의 프로폴리스를 첨가하여 완전히 혼합하였다 (FM). 두 제형의 꿀과 프로폴리스 혼합비는 10 : 1이며, 제작된 시료는 세포에 처리하기 전 냉장 보관하였다.
2. Media & Reagents
세포 배양에 사용된 배지는 Gibco (U.S.A.)사의 Dulbecco’s modified eagles medium (DMEM) 배지를 사용하였으며, 세균 성장 억제를 위해 첨가된 penicillin-streptomycin 역시 Gibco사에서 구입하였다. 세포 배양에 필수적인 fetal bovine serum (FBS)은 GenDEPOT (Korea)사에서 구입하여 첨가하였는데, 첨가하기 전 FBS를 56°C에서 50분간 불활성화한 뒤 사용하였다. 세포 독성 평가에 사용한 WST 시약은 DoGenbio (Korea)의 EZ-Cytox plus solution을 사용하였고, Western blotting에 사용된 1차 항체 중 Phospho-Akt, Akt, Phospho-ERK, ERK, Bak, Bax, Bcl-2, Cytochrome C 그리고 mTOR 항체는 Cell Signaling Technology (U.S.A.)에서 구입하였고, PCNA, AIF, β-catenin, GSK-3β 그리고 GAPDH는 Santacruz Biotechnology (U.S.A.)에서 구입하였다. 허니폴리스 특이 성분 분석을 위한 acetonitrile은 Fisher Brand (PA, U.S.A.)와 trifluoroacetic acid (TFA)는 Sigma (U.S.A.)에서 각각 구입하였다.
3. 세포주 배양
실험에 사용된 암세포주는 pancreas duct 세포주인 PANC-1으로서 한국한의학연구원에서 분양받아 계대배양하며 실험에 사용하였다. 대표적인 신경세포주인 SH-SY5Y 신경아세포종 세포주로서 한국세포주은행에서 구입하여 계대배양하며 실험에 사용하였다. 세포 배양용 배지는 DMEM 기본 배지에 100 unit/mL의 penicillin-streptomycin, 10%의 FBS를 첨가하여 사용하였으며, 세포는 37°C로 유지되고 5%의 CO2가 공급되는 배양기에서 배양하였다.
4. 허니폴리스 제형의 ultra-performance liquid chromatography (UPLC) 분석
혼합 방법이 다른 두 제형에 대한 특이 성분의 분석은 photodiode array (PDA)가 장착된 UPLC로서 Waters (Minneapolis, MN, USA)사의 ACQUITY UPLC I-Class를 사용하였다. 분리는 Halo C18 (2.1×100 mm, 2 μm)을 이용하여 30°C에서 분석하였다. 기울기 농도는 용매 A (0.2% TFA in water)와 용매 B (0.2% TFA in acetonitrile)를 사용하여 조절하였으며, 0.4 mL/min의 용리 속도로 0~2 min (5% B), 2~30 min (50% B)의 조건으로 254 nm에서 분석하였다. 허니폴리스 시료에 대한 대조군으로 같은 필터링 조건으로 준비한 꿀 단독 시료와 프로폴리스 단독 시료를 비교하였다. 대조 시료 역시 용매의 최종 농도를 20% 에탄올로 설정하고 혼합 시에는 3차 증류수를 혼합하여 제작하였다.
5. PANC-1 세포에 대한 허니폴리스 제형의 세포 독성 평가
췌장암세포주인 PANC-1 세포에 대한 두 가지 제형의 허니폴리스의 lethal dose 50 (LD50)를 확인하기 위해 처리 농도에 따른 세포 독성 효과를 평가하였다. PANC-1 세포주를 96-well plate에 2×104 cells/well이 되도록 접종한 뒤, 24시간 동안 세포를 안정화시켰다. 배양된 세포에 두 가지 제형의 허니폴리스를 처리하였는데, 프로폴리스 농도를 기준으로 0.03%, 0.15%의 농도로 처리하였다. 대조구로서 꿀과 프로폴리스가 혼합되지 않은 프로폴리스 단독 시료와 꿀 단독 시료를 처리하여 비교하였으며, 용매 대조군으로는 20% 에탄올 처리군을 설정하였다. 필터링 순서에 따른 세포 독성 평가를 위해 위의 같은 조건하에서 서로 다른 제형을 비교하여 세포 독성을 평가하였다. 허니폴리스를 처리하고 24시간 후에 EZ-cytox 용액을 배지 부피의 1/10로 처리하여 2시간 동안 배양기에서 반응시키고 450 nm 파장의 SpectraMax M2 microplate reader (Molecular Devices, San Jose, U.S.A.)에서 흡광도를 측정하였다.
6. Western blotting
세포 독성 평가의 조건에 따라 처리된 세포에서 단백질을 추출하여 Western blotting을 실시하였다. 각 제형의 허니폴리스가 24시간 동안 처리된 세포를 1× phosphate buffered saline (PBS) (Invitrogen, U.S.A.)으로 1회 수세한 후, 200 μL의 nonidet P-40 (NP-40) lysis buffer (Invitrogen, U.S.A.)을 첨가하고 cell scraper로 세포를 파쇄하여 추출하였다. 추출된 단백질은 17,000 rpm에서 20분간 원심분리하여 상층액을 회수하고, bicinchronic acid (BCA) 단백질 정량법으로 정량하였다. 정량된 단백질에 5× SDS sample buffer (250 mM Tris-HCl (pH 6.8), 5% 2-Mercaptoethanol, 10% SDS, 0.5% Bromophenol blue, 50% Glycerol)를 1×의 농도가 되도록 첨가하고 100°C에서 10분간 끓여 단백질을 변성시켰다. 20 μg의 단백질 시료를 Bio-Rad (U.S.A.)사의 4~15% TGX gradient gel에 loading하고 100 voltage에서 1시간 동안 전개한 후, transblot (Bio-Rad, U.S.A.) 장치를 이용하여 12 voltage에서 7분간 polyvinylidene fluoride (PVDF) membrane에 transfer하였다. Western blotting 항체의 비특이적 반응을 차단하기 위해 1× tris-buffered saline-tween 20 (TBS-T)에 2% non-fat dry milk (with 0.02% sodium azide)를 첨가한 용액으로 실온에서 1시간 반응시켰으며, 이후 1차 항체를 실온에서 16시간 동안 반응시켰다. 1차 항체 중 phospho-ERK와 phospho-Akt 항체는 1 : 500의 비율로 희석하고, GAPDH는 1 : 5,000으로 희석하였으며, 나머지 항체는 모두 1 : 1,000 비율로 희석하여 반응에 사용하였다. 1차 항체 반응 후, 1× TBS-T로 membrane을 washing하고, 2차 항체 goat anti-mouse-HRP 또는 goat anti-rabbit-HRP를 sodium azide를 첨가하지 않은 5% non-fat dry milk에 1 : 2,000으로 희석하여 실온에서 1시간 동안 반응하였다. 이후, 1× TBS-T로 membrane을 wash하고 ECL pico detection system (GenDEPOT, Korea)으로 발색 후, ChemiDOC (Bio-Rad, U.S.A.)으로 검출하였다.
결과 및 고찰
1. 필터링에 의한 허니폴리스 제형의 성분 변화
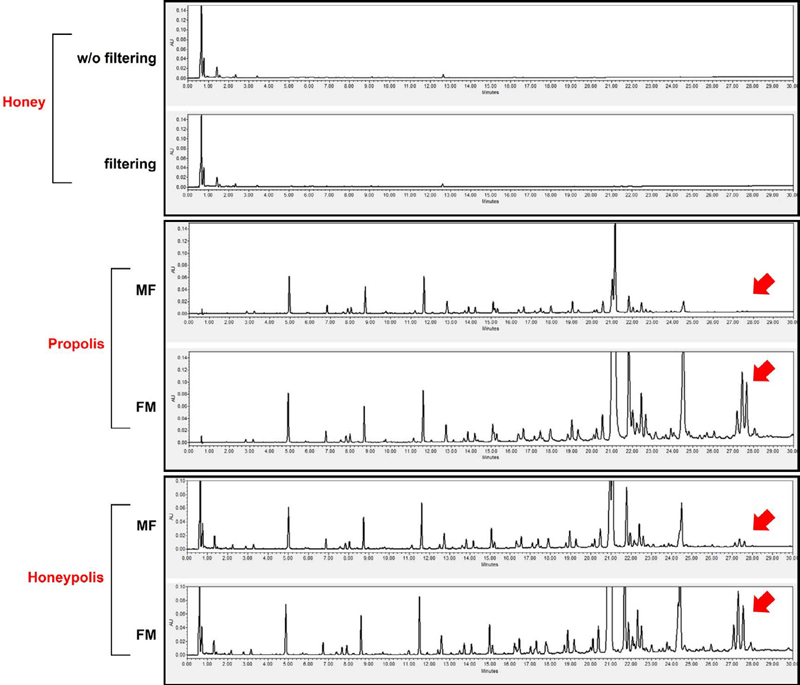
Fig. 1에는 제작된 허니폴리스 제형의 UPLC 결과를 나타내고 있다. 필터링 순서에 따라 나타나는 결과를 보면, 전체적인 peak는 두 가지 시료에서 비교적 동일하게 나타났으나 27분에서 나타나는 peak에서 차이가 발생했다. 꿀과 프로폴리스를 먼저 혼합하고 필터링한 시료는 27분대에서 peak가 크게 감소한 반면, 각 시료를 먼저 필터링하고 혼합한 시료는 동일 시간대의 peak가 감소하지 않았다. 대조군으로 분석한 꿀 단독 시료는 필터링을 하지 않은 시료와 필터링한 시료를 비교하였는데, 두 시료 모두 차이가 발생하지 않았다. 그러나 프로폴리스 단독 시료는 허니폴리스와 마찬가지로 MF 시료에서는 동일 시간대에서 peak가 나타나지 않았으나, FM 시료에서는 peak가 강하게 나타났다. 이는 LC 분석 상에서 나타난 peak가 프로폴리스에서 유래된 성분이며, 제형을 제작하는 과정에서 프로폴리스의 성분이 용매와 혼합되며 aggregation되어 필터를 통과하지 못한 것으로 보여진다. 또한 다른 성분의 양적 차이도 미세하게 혼합 후 필터링한 시료가 감소한 것으로 나타났다. 추가적으로 본 성분에 대한 동정을 수행하여 어떤 성분인지 밝혀야 할 것이다.
2. 허니폴리스의 세포 독성 평가
췌장암세포주인 PANC-1 세포에 대한 허니폴리스 시료의 세포 독성을 확인하였다. 허니폴리스 MF와 FM 시료를 세포에 처리하고 24시간 후에 WST법을 응용한 EZ-cytox solution으로 세포의 생존을 평가했다. 각 시료의 처리 농도는 프로폴리스의 플라보노이드 농도를 기준으로 0.03%와 0.15%로 처리하였으며, 실험에 사용된 대조군은 아무것도 처리하지 않은 세포와 용매에 대한 대조군으로 20%의 에탄올을 처리한 세포로 비교하였다. 또한 허니폴리스는 꿀과 프로폴리스를 혼합하여 제작한 제형이기 때문에 두 가지를 혼합하지 않은 프로폴리스와 꿀을 각각 세포에 처리하여 비교하였다. Fig. 2의 결과를 보면, MF를 처리한 세포는 처리 농도 및 시료에 상관없이 세포에 대한 독성을 나타내지 않았다. 그러나 FM 시료에서는 0.15% 농도 조건에서 꿀을 제외한 시료에서 세포 독성이 나타났는데, 프로폴리스 단독 시료보다 꿀을 혼합한 시료에서 더 강한 세포 독성을 나타냈다. 이는 앞선 LC 분석 데이터에서 나타난 MF와 FM 시료 간 성분 변화에 의한 것과 꿀과 프로폴리스의 혼합에 의한 암세포 사멸 기능의 상승을 의미한다.
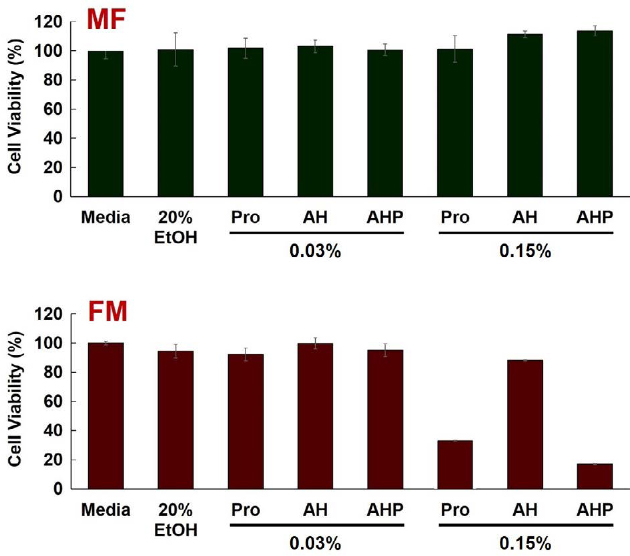
Comparison of cytotoxic effect of MF honeypolis and FM honeypolis 2×104 cells/well of PANC-1 seeded to 96-well plate. After 24 hrs, honey, propolis or honeypolis were treated and incubated for 24 hrs. Cell viability were measured by microplate reader at 450 nm. MF: honey and propolis mixing before filtering. FM: honey and propolis filtering before mixing.
3. 허니폴리스 시료 처리에 따른 PANC-1 내 세포 내 단백질 변화
세포 독성 평가 결과를 바탕으로 세포에 0.15%의 허니폴리스와 프로폴리스 및 동량의 꿀, 20% 에탄올을 처리한 후 단백질을 추출하고 Western blotting으로 세포 분열 매개 단백질 및 세포 사멸 단백질의 변화를 확인했다. Fig. 3A의 결과를 보면 대조군에 비해 프로폴리스와 허니폴리스를 처리했을 때, Akt의 인산화를 감소시켰다. FM과 MF의 프로폴리스 시료는 Akt의 인산화를 감소시켰으나 시료 간에서는 프로폴리스 단독 처리가 Akt의 인산화 감소에 더 효과적이었다. 그러나 Akt의 발현에 있어서는 허니폴리스가 더 효과적이었다. ERK의 인산화는 FM 허니폴리스 시료를 처리했을 때 강하게 증가되었는데, 프로폴리스 단독으로 처리한 그룹에서 더욱 강한 인산화가 나타났고, 전체 ERK의 양 변화에 있어서도 FM 허니폴리스 시료가 더 효과적이었으며, 더 많은 ERK 발현양 감소를 나타냈다. 특히, 세포 분열에 대한 마커 중의 하나로 알려진 PCNA의 경우 FM 허니폴리스가 뚜렷한 발현 감소를 나타냈다. GAPDH는 시료 간의 loading 양에 대한 대조군이며, Western 결과 중에서 phospho-Akt, phospho-ERK 그리고 PCNA 단백질의 발현양을 Fig. 3B에 나타내었다.
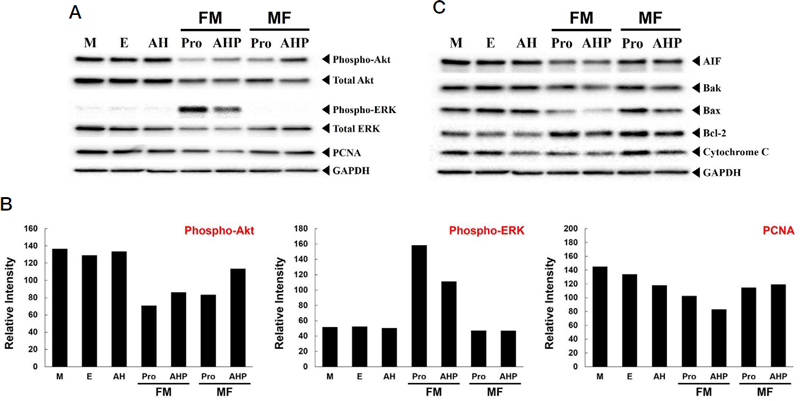
Honeypolis decreases the expression of cell proliferation-related protein, but it was does not influence apoptosis-related protein. 20 μg of proteins were seperated 4~15 gradient gel. (A) All of phospho-antibodies were diluted at 1:500. Dilution factor of total Akt, ERK and PCNA were 1 : 1,000. (B) Relative intensity of essential protein level. (C) All of antibodies were diluted at 1 : 1,000 except GAPDH (1 : 5,000). Primary antibody incubation for 16 hrs at R.T. This result repeat 3-times.
Fig. 3C에서는 세포 내에서 세포 사멸을 유도하는 단백질에 대한 발현을 확인한 것이다. Apoptosis 발생에 대한 주된 마커로 알려진 AIF, cytochrome C, Bak, Bax 그리고 Bcl-2를 검증했는데, 필터링 방법에 상관없이 프로폴리스 및 허니폴리스를 처리한 세포에서 AIF, Bak, Bax Cytochrome C의 발현 증가는 나타나지 않았다. 그러나 Bcl-2의 경우에는 단백질 발현이 증가되는 것으로 나타났으며, 이는 또 다른 apoptosis에 대한 세포 내 신호를 확인해야 할 것이다.
4. 허니폴리스에 의한 Wnt 신호 경로 단백질 조절
췌장암세포주인 PANC-1 세포주에서 허니폴리스에 의한 암 신호 조절에 대해 확인하였다. 암에 대한 다양한 세포 신호 전달 과정 중에 Wnt/β-catenin 신호 경로에 연관되어 있는 단백질의 발현을 확인한 결과를 Fig. 4A에서 확인할 수 있다. 허니폴리스 시료 중에서 FM 시료는 Wnt의 신호 개시로 이루어지는 β-catenin 단백질의 발현 감소를 유도했는데, 이 신호와 관련된 mTOR 및 GSK-3β의 발현 감소를 함께 유발하고 있었다. 그러나 MF 시료의 경우 이 경로에 있는 단백질의 발현 감소에 영향을 미치지 못했다. 또한 FM 시료 중에서도 프로폴리스 단독 시료보다 허니폴리스 시료가 더 많은 단백질 발현 감소를 나타내고 있었다. 이는 허니폴리스 제형이 Wnt에 연관된 암 조절 신호에 효과적으로 작용할 수 있음을 나타내며, 꿀과 프로폴리스를 혼합함으로써 암 조절에 대한 기능적 상승 효과를 나타낼 수 있음을 의미하는 것이다. Fig. 4B는 각 단백질의 발현양을 그래프로 나타낸 것이다.
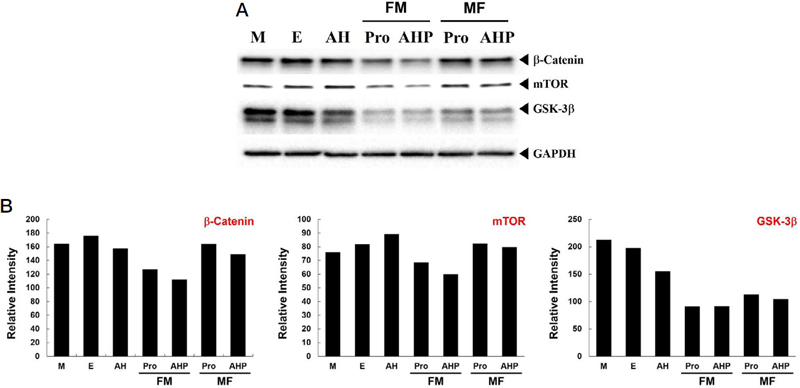
Honeypolis (FM) decreases the expression level of β-catenin, mTOR and GSK-3β according to Wnt singaling pathway. (A) 20 μg of protein lysates were used in this experiments. Primary antibody were diluted at 1 : 1,000 except GAPDH (1 : 5,000) and incubated for 16 hrs at R.T. All primary antibodies were diluted in 2% non-fat dry milk. This result repeat 3-times. (B) Relative intensity of essential protein expression level.
고 찰
암은 유전자의 돌연변이로 인해 세포의 증식이 통제되지 못해 발병되며, 치료가 어려운 난치성 질병이다. 암세포는 여러 세포 내의 신호 전달 기전이 활성화되어 세포의 분열이 지속되며, apoptosis가 억제되기 때문에 현재 사용되는 항암제는 세포 내 특정 신호 기전의 지속을 억제함으로써 암의 진행 억제 및 세포 사멸을 유도하게 된다. 여러 가지 세포 신호 전달 기전 중에서 Wnt 신호 전달 역시 암 발생 및 진행과 연관되어 있으며, 본 연구에서는 꿀벌의 주된 생산물인 아까시꿀과 프로폴리스를 혼합하여 손쉽게 섭취할 수 있는 제형을 개발하고, 췌장암세포주인 PANC-1 세포주를 이용하여 Wnt 신호 기전을 억제할 수 있는 세포 기전을 확인했다. 특히 허니폴리스 제형 제조에 있어 필터링의 순서에 따라 암세포의 사멸에 영향을 미치는 프로폴리스의 주된 성분을 확인했고, 세포 내의 단백질 분자의 발현을 확인하여 암세포 성장 억제에 효과가 있음을 구명했다. 허니폴리스는 apoptosis와 관련된 세포 사멸 단백질의 발현에는 영향을 끼치지 않았지만, 세포 증식에 주된 영향을 미치는 Akt의 인산화 및 발현, mitogen-activating protein kinases (MAPK)에 속하는 단백질 중 ERK의 인산화와 발현 조절에 영향을 끼친다. 또한 필터링 순서에 따른 특이 성분의 존재 유무에 따라 Wnt 신호 기전의 활성화 억제에 영향을 끼친다. 허니폴리스 제형을 제작함에 있어 적절히 희석된 꿀과 프로폴리스 원액을 먼저 필터링하고 혼합하는 것이 암세포 생장 억제에 대한 프로폴리스의 기능성을 그대로 유지할 수 있게 되고, 이 성분에 의해 암세포의 활성화 신호 경로 중 Wnt 신호 경로에 해당하는 단백질의 발현을 억제할 수 있다. 본래 활성화된 Wnt 신호는 세포 내의 GSK-3β, mTOR 그리고 β-catenin의 발현 증가를 유도하여, 세포에서 지속적인 세포 분열 촉진 신호를 활성화시킨다. 그러나 허니폴리스에 의해 GSK-3β, mTOR 그리고 β-catenin의 발현 억제를 유도하여 세포 내로 전달되는 세포 분열 신호를 차단하게 된다. 그러나 각 시료를 먼저 혼합하고 필터링을 한 경우에는 프로폴리스에 존재하는 성분의 소실을 일으키고, Wnt 신호를 억제할 수 없게 된다. 위의 결과를 종합해 볼 때, UPLC 분석 그래프 상의 27분에서 나타나는 peak가 암세포 억제에서 핵심적인 역할을 수행하며, 그 중에서도 Wnt 신호 억제에 효과적임을 나타내고 있다. 본 연구를 바탕으로 해당 peak에 해당하는 프로폴리스의 성분을 동정하고 순수분리된 성분의 암 억제 기능에 대해 연구해야 할 것이다. 또한 본 연구 결과에서 나타난 결과에서 프로폴리스 단독으로 나타난 기능보다 꿀과 혼합하여 프로폴리스를 활용하는 것이 기능성 상승에 있어 더 효과적임을 알 수 있다. 본 연구 결과를 바탕으로 앞으로 프로폴리스의 약리적 효과와 산물 혼합에 대한 기능성 상승 효과에 대한 추가 연구를 통해 국산 양봉산물의 소비 증진을 꾀할 수 있을 것이다.
Acknowledgments
본 연구는 농촌진흥청 어젠다연구사업 (과제번호: PJ01745701)에 의해 수행되었습니다.
References
-
Aizawa, K., C. Liu, S. Tang, S. Veeramachaneni, K. Q. Hu, D. E. Smith and X. D. Wang. 2016. Tobacco carcinogen induces both lung cancer and non-alcoholic steatohepatitis and hepatocellular carcinomas in ferrets which can be attenuated by lycopene supplementation. Int. J. Cancer 139: 1171-1181.
[https://doi.org/10.1002/ijc.30161]

-
Behrens, J., J. P. von Kries, M. Kühl, L. Bruhn, D. Wedlich, R. Grosschedl and W. Birchmeier. 1996. Functional interaction of beta-catenin with the transcription factor LEF-1. Nature 382: 638-642.
[https://doi.org/10.1038/382638a0]

-
Bhanot, P., M. Brink, C. H. Samos, J. C. Hsieh, Y. Wang, J. P. Macke, D. Andrew, J. Nathans and R. Nusse. 1996. A new member of the frizzled family from Drosophila functions as a Wingless receptor. Nature 382: 225-230.
[https://doi.org/10.1038/382225a0]

-
Burdock, G. A. 1998. Review of the biological properties and toxicity of bee propolis (propolis). Food Chem. Toxicol. 36: 347-363.
[https://doi.org/10.1016/S0278-6915(97)00145-2]

-
Cigudosa, J. C., N. Z. Parsa, D. C. Louie, D. A. Filippa, S. C. Jhanwar, B. Johansson, F. Mitelman and R. S. Chaganti. 1999. Cytogenetic analysis of 363 consecutively ascertained diffuse large B-cell lymphomas. Genes Chromosomes Cancer 25: 123-133.
[https://doi.org/10.1002/(SICI)1098-2264(199906)25:2<123::AID-GCC8>3.0.CO;2-4]

-
Fernandes Junior, A., E. C. Balestrin, J. E. Betoni, O. Orsi Rde, L. da Cunha Mde and A. C. Montelli. 2005. Propolis: anti-Staphylococcus aureus activity and synergism with antimicrobial drugs. Mem. Inst. Oswaldo Cruz. 100: 563-566.
[https://doi.org/10.1590/S0074-02762005000500018]

-
Fisher, R., L. Pusztai and C. Swanton. 2013. Cancer heterogeneity: implications for targeted therapeutics. Br. J. Cancer 108: 479-485.
[https://doi.org/10.1038/bjc.2012.581]

-
He, X., J. P. Saint-Jeannet, Y. Wang, J. Nathans, I. Dawid and H. Varmus. 1997. A member of the Frizzled protein family mediating axis induction by Wnt-5A. Science 275: 1652-1654.
[https://doi.org/10.1126/science.275.5306.1652]

-
Itoh, K., V. E. Krupnik and S. Y. Sokol. 1998. Axis determination in Xenopus involves biochemical interactions of axin, glycogen synthase kinase 3 and beta-catenin. Curr. Biol. 8: 591-594.
[https://doi.org/10.1016/S0960-9822(98)70229-5]

-
Kim, S.-K., H. Y. Kim, H. M. Choi, S. G. Kim, S. M. Kim, H. J. Lee, H. J. Moon, Y. S. Lee, S. Ryu, S. M. Han and S. O. Woo. 2023. The protection effect of Parkinson’s disease by Korean propolis. J. Apic. 38: 83-92.
[https://doi.org/10.17519/apiculture.2023.04.38.1.83]

-
Kim, S.-K., H. Y. Kim, S. G. Kim, S. M. Han, S. Ryu and S. O. Woo. 2022. The effect of Korean propolis for apoptosis by MPTP-mediated Parkinson’s disease and its molecular mechanism in SH-SY5Y neuroblastoma cells. J. Apic. 37: 83-90.
[https://doi.org/10.17519/apiculture.2022.04.37.1.83]

-
Kim, S.-K., S. M. Han, S. G. Kim, H. Y. Kim, S. Ryu and S. O. Woo. 2021. Inhibition of tau hyperphosphorylation and its molecular mechanism by Korean propolis extracts. J. Apic. 36: 169-176.
[https://doi.org/10.17519/apiculture.2021.09.36.3.169]

-
Korinek, V., N. Barker, P. J. Morin, D. van Wichen, R. de Weger, K. W. Kinzler, B. Vogelstein and H. Clevers. 1997. Constitutive transcriptional activation by a beta-catenin-Tcf complex in APC-/- colon carcinoma. Science 275: 1784-1787.
[https://doi.org/10.1126/science.275.5307.1784]

-
Matlashewski, G., P. Lamb, D. Pim, J. Peacock, L. Crawford and S. Benchimol. 1984. Isolation and characterization of a human p53 cDNA clone: expression of the human p53 gene. EMBO J. 3: 3257-3262.
[https://doi.org/10.1002/j.1460-2075.1984.tb02287.x]

-
Meacham, C. E. and S. J. Morrison. 2013. Tumour heterogeneity and cancer cell plasticity. Nature 501: 328-337.
[https://doi.org/10.1038/nature12624]

-
Molenaar, M., M. van de Wetering, M. Oosterwegel, J. Peterson-Maduro, S. Godsave, V. Korinek, J. Roose, O. Destrée and H. Clevers. 1996. XTcf-3 transcription factor mediates beta-catenin-induced axis formation in Xenopus embryos. Cell 86: 391-399.
[https://doi.org/10.1016/S0092-8674(00)80112-9]

-
Nishisho, I., Y. Nakamura, Y. Miyoshi, Y. Miki, H. Ando, A. Horii, K. Koyama, J. Utsunomiya, S. Baba, P. Hedge, A. Markham, A. J. Krush, G. Petersen, S. R. Hamilton, M. C. Nilbert, D. B. Levy, T. M. Bryan, A. C. Preisinger, K. J. Smith, L.-K. Su, K. W. Kinzler and B. Vogelstein. 1991. Mutations of chromosome 5q21 genes in FAP and colorectal cancer patients. Science 253: 665-669.
[https://doi.org/10.1126/science.1651563]

-
Nusse, R. and H. E. Varmus. 1982. Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome. Cell 31: 99-109.
[https://doi.org/10.1016/0092-8674(82)90409-3]

-
Nüsslein-Volhard, C. and E. Wieschaus. 1980. Mutations affecting segment number and polarity in Drosophila. Nature 287: 795-801.
[https://doi.org/10.1038/287795a0]

-
Parkin, D. M. 2006. The global health burden of infection-associated cancers in the year. Int. J. Cancer 118: 3030-3044.
[https://doi.org/10.1002/ijc.21731]

-
Poon, S. L., J. R. McPherson, P. Tan, B. T. The and S. G. Rozen. 2014. Mutation signatures of carcinogen exposure: genome-wide detection and new opportunities for cancer prevention. Genome Med. 6: 24.
[https://doi.org/10.1186/gm541]

-
Rubinfeld, B., I. Albert, E. Porfiri, C. Fiol, S. Munemitsu and P. Polakis. 1996. Binding of GSK3beta to the APC-beta-catenin complex and regulation of complex assembly. Science 272: 1023-1026.
[https://doi.org/10.1126/science.272.5264.1023]

-
Rubinfeld, B., B. Souza, I. Albert, O. Müller, S. H. Chamberlain, F. R. Masiarz, S. Munemitsu and P. Polakis. 1993. Association of the APC gene product with beta-catenin. Science 262: 1731-1734.
[https://doi.org/10.1126/science.8259518]

-
Schottenfeld, D. and J. F. Fraumeni Jr. 2006. Cancer epidermiology and prevention. Oxford University Press 2006.
[https://doi.org/10.1093/acprof:oso/9780195149616.001.0001]

-
Seto, M., K. Honma and M. Nakagawa. 2010. Diversity of genome profiles in malignant lymphoma. Cancer Sci. 101: 573-578.
[https://doi.org/10.1111/j.1349-7006.2009.01452.x]

-
Shtivelman, E., B. Lifshitz, R. P. Gale and E. Canaani. 1985. Fused transcript of abl and bcr genes in chronic myelogenous leukaemia. Nature 315: 550-554.
[https://doi.org/10.1038/315550a0]

-
Sforcin, J. M. 2007. Propolis and the immune system: a review. J. Ethnopharmacol. 113: 1-14.
[https://doi.org/10.1016/j.jep.2007.05.012]

-
Siegel, R. L., K. D. Miller and A. Jemal. 2016. Cancer statistics. CA Cancer J. Clin. 66: 7-30.
[https://doi.org/10.3322/caac.21332]

-
Siegel, R. D., Naishadham and A. Jemal. 2013. Cancer statistics. CA Cancer J. Clin. 63: 11-30.
[https://doi.org/10.3322/caac.21166]

-
Su, L. K., B. Vogelstein and K. W. Kinzler. 1993. Association of the APC tumor suppressor protein with catenins. Science 262: 1734-1737.
[https://doi.org/10.1126/science.8259519]

-
Trafialek, J. and W. Kolanowski. 2014. Dietary exposure to meat-related carcinogenic substances: is there a way to estimate the risk? Int. J. Food Sci. Nutr. 65: 774-780.
[https://doi.org/10.3109/09637486.2014.917146]

-
Tsukamoto, A. S., R. Grosschedl, R. C. Guzman, T. Parslow and H. E. Varmus. 1988. Expression of the int-1 gene in transgenic mice is associated with mammary gland hyperplasia and adenocarcinomas in male and female mice. Cell 55: 619-625.
[https://doi.org/10.1016/0092-8674(88)90220-6]

-
Wood, R. D., M. Mitchell, J. Sgouros and T. Lindahl. 2001. Human DNA repair genes. Science 291: 1284-1289.
[https://doi.org/10.1126/science.1056154]

-
Yamamoto, H., S. Kishida, M. Kishida, S. Ikeda, S. Takada and A. Kikuchi. 1999. Phosphorylation of axin, a Wnt signal negative regulator, by glycogen synthase kinase-3beta regulates its stability. J. Biol. Chem. 274: 10681-10684.
[https://doi.org/10.1074/jbc.274.16.10681]

-
Yang-Snyder, J., J. R. Miller, J. D. Brown, C. J. Lai and R. T. Moon. 1996. A frizzled homolog functions in a vertebrate Wnt signaling pathway. Curr. Biol. 6: 1302-1306.
[https://doi.org/10.1016/S0960-9822(02)70716-1]

-
Yeh, T.-S., C. Yuan, A. Ascherio, B. Rosner, W. Willett and D. Blacker. 2021. Long-term dietary flavonoid intake and subjective congnitive decline in US men and women. Neurology, Online ahead of print.
[https://doi.org/10.1212/wnl.0000000000012454]

-
Yost, C., G. H. 3rd Farr, S. B. Pierce, D. M. Ferkey, M. M. Chen and D. Kimelman. 1998. GBP, an inhibitor of GSK-3, is implicated in Xenopus development and oncogenesis. Cell 93: 1031-1041.
[https://doi.org/10.1016/S0092-8674(00)81208-8]