대식세포에서 다래 벌화분에 의한 염증 저해 효과 및 면역 단백질 발현
Abstract
In this study, we proposed the functional effect of the anti-inflammation effect of the Actinidia arguta (A.a.) bee pollen and the molecular mechanism of its anti-inflammation. Two A.a. bee pollen samples commercially available in Korea were extracted in 70% ethanol, and finally dissolved in 35% ethanol to prepare a 100 mg/mL. The A.a. bee pollen extracts was treated with LPS, an inflammatory factor, to Raw264.7 macrophages. The A.a. bee pollen extracts reduced the NO production induced by LPS by approximately 60%, indicating that the A.a. bee pollen extracts had an anti-inflammatory effect. In addition, the intracellular molecular mechanism of the anti-inflammatory effect of the A.a. bee pollen was confirmed by Western blotting, and the expression of inflammation-related proteins such as iNOS, COX-2, NF-κB, and IL-1β induced by LPS was reduced by the A.a. bee pollen. In addition, the expression of intracellular antioxidant molecules such as SOD2 was also decreased. However, it did not affect the phosphorylation and expression of MAPKs that related intracellular division and apoptosis. The results of this study showed that the molecular mechanism of the inhibitory effect of the A.a. bee pollen extract on hyperimmunity caused by inflammatory factors, thereby providing a basis for the immune function of the Korean A.a. bee pollen and the increased utilization of the pollen.
Keywords:
Bee pollen, Actinidia arguta, Anti-inflammation, Lipopolysaccharide (LPS), Raw264.7서 론
염증은 특정 부상에 따른 미생물의 감염으로부터 신체 내의 세포를 방어하는 데 필요한 중심적인 과정이다 (Isailovic et al., 2015; Todd et al., 2015). 염증 반응은 두 가지로 구분할 수가 있는데, 하나는 급성 염증성 질환 (Serhan et al., 2015)이고, 다른 하나는 만성 염증성 질환 (Isailovic et al., 2015)이다. 두 가지 중 만성 염증성 질환은 신경퇴행성 질환, 암 그리고 심혈관 질환 등을 포함하는 다양한 질병의 원인이 된다 (Uttara et al., 2009). 염증의 기전은 신체 내에 존재하는 조직에서 일련의 반응을 통해 발생하며, 이 과정에서 면역 관련 세포의 수치가 급격히 증가된다 (Huether and McCance, 2015). 이러한 세포에서는 면역에 관련된 각종 분자들이 분비 및 활성화되어 체내의 면역 반응을 조절한다 (Anwikar and Bhitre, 2010). 이 중 염증 반응에 있어 히스타민, 단백질 종류 그리고 에이코사노이드는 염증 반응에 핵심이 되는 중요한 매개체로서 히스타민의 경우 염증 반응 동안 급성 반응 유지를 위해 방출되고 (GilÀllan and Metcalfe, 2011), 에이코사노이드는 염증의 생물학적 활성 매개체 합성에 있어 중요한 역할을 수행하는 기질 중의 하나이다 (Mak et al., 2013). 염증 반응 내에서의 단백질 중 cyclooxygenase (COX)는 COX-1과 COX-2의 두 가지 형으로 존재하는데 (Bailey, 2013), COX-1과 COX-2의 동시 작용에 따라 염증이 개시된다 (Engelhardt, 2014). 또한 세포 내에 존재하는 단백질 중 염증성 사이토카인은 많은 세포 유형에서 방출되어 작용하는데, 이들은 특히 면역 체계 조절에서 중요하다 (Guo et al., 2013). 박테리아 감염이나 lipopolysaccharide (LPS)에 의해 염증성 질환이 개시되면 세포 내에서 사이토카인의 기능과 양이 증가되었다 (Horadagoda et al., 2002; Moreland, 2004; Opriessnig et al., 2011; Marza et al., 2015). 특히, 많은 사이토카인 중에서 interleukin (IL)-1β, IL-8, IL-6, IL-12 그리고 tumor necrosis factor (TNF)-α는 면역 반응에서 가장 주된 요소이며 (Rubin and Reisner, 2009), LPS 노출 동물 모델에서 IL 분자 및 TNF-α의 분비가 증가되었고, 이는 염증 유발로 이어졌다 (Shivachandra et al., 2011). 이처럼 박테리아 또는 LPS 노출에 의한 염증성 반응은 선천성 및 적응 면역 세포의 활성화 및 작용을 포함하는 신체 방어에 필수적인 요소로 작용하며, 조직 복구나 재생과 관련된 신체 항상성 유지에 있어 중요한 역할을 담당한다 (Medzhitov, 2008). 특히, 최근에는 면역 체계와 염증으로 인한 암 발병, 진행 및 치료에 대한 상호 연관성 연구가 진행되면서 ‘암 세포 중심’의 관점에서 염증이 연구되고 있다 (Balkwill and Mantovani, 2001).
양봉산물 (벌꿀, 프로폴리스, 로열젤리, 밀랍, 화분 등)은 고대부터 그리스, 중국 그리고 이집트 등에서 의학적으로 널리 사용되었다 (Abdelnour, 2019). 현재에도 양봉산물은 기능성 식품 또는 대체 의학에 적용되고 있다 (Richardson et al., 2000; Bogdanov, 2004; Žižić et al., 2013). 최근 벌화분이 잠재적 치료 가치를 지닌 것으로 보고 많은 생물학적 활성이 연구되고 활용되고 있으며, 특히 항암에 대한 연구가 지속적으로 이루어지고 있다 (Aliyazicioglu et al., 2005; Cocan et al., 2005; Campos et al., 2010). 벌화분은 꽃가루와 꿀 그리고 꿀벌의 효소가 혼합되어 형성된 과립 형태를 이루고 있다 (Campos et al., 2008). 벌화분은 단백질, 지질, 비타민, 미네랄, 탄수화물과 같은 필수 영양소와 미량원소, 플라보노이드 그리고 폴리페놀과 같은 기능성 성분을 포함하고 있기 때문에 인간에 대한 기능성 영양 식품으로 활용된다 (Li et al., 2018). 벌화분은 생물지리적 (지역적) 요소, 벌의 생태 서식지, 계절 및 꿀벌의 행동 양식에 따라 구성 성분 및 화학적 조성이 달라지게 된다 (Roulston and Cane, 2000; Szczęsna, 2006a; Liolios et al., 2019; Mayda et al., 2020). 벌화분 단백질을 구성하는 아미노산은 트립토판, 페닐알라닌, 메티오닌, 류신, 라이신, 트레오닌, 히스티딘, 이소류신 및 발린과 같은 필수 아미노산을 포함하여 전체 중 약 22.7%를 차지한다 (Hou et al., 2015). 또한 에너지원으로서 포도당과 과당 등의 환원당을 포함한 탄수화물이 약 30.8%를 차지하며 (Almeida-Muradian et al., 2005), 벌화분의 지질은 약 5.1%를 차지하는데, 리놀레산, γ-리놀레산, 인지질, β-시토스테롤과 같은 필수 지방산으로 나타났으며 (Szczęsna, 2006b), 폴리페놀 및 플라보노이드 등은 평균 1.6%를 차지한다 (Komosinska-Vassev et al., 2015). 기타 비타민 등의 생물학적 요소와 관련된 필수 물질은 약 0.7%를 차지하고, 그 외에도 거대 원소 및 미량 원소들도 벌화분은 함께 포함하고 있기 때문에 (Thakur and Nanda, 2020) 기능성 측면에서 높은 활용도를 가질 수 있다. 위와 같은 다양한 대사산물 및 생물학적 활성을 바탕으로 벌화분은 항산화 (Morais et al., 2011), 항염증 (Maruyama et al., 2010), 항암 (Furusawa et al., 1995), 항균 (Basim et al., 2006; Pascoal et al., 2014), 간 보호 (Eraslan et al., 2009) 그리고 항동맥경화 활성 (Wójcicki, 1987; Aliyazicioglu et al., 2005) 등을 나타낸다는 연구 보고가 있다. 그러나 위와 같은 벌화분의 생물학적 기능성에 있어 각 기능의 주된 분자 기전은 명확하게 제시되지 않고 있으며, 현재 벌화분은 다른 양봉산물에 비해 활용도가 높지 않고, 기능 식품으로서의 인식 역시 크지 않다.
이에 본 연구에서는 꿀벌에 의해 만들어지는 벌화분 중에서 다래에서 유래된 벌화분을 대식세포인 Raw264.7 세포에 적용하여 세포 내에서 일어나는 면역 반응 중 염증 반응에 관련된 주요 분자 기전에 대한 과학적 근거를 마련하고, 그에 따라 벌화분 이용에 대한 생물학적 활성을 알아보고자 한다. 또한 기능 식품으로서 현재 제한적으로 생산되고 이용되고 있는 벌화분의 이용 가치를 높이고, 양봉산물 활용에 대한 활용 소재 범위를 넓히고자 한다.
재료 및 방법
1. 다래 벌화분 추출물의 제작
다래 벌화분은 국내 농가에서 수확되어 판매되고 있는 벌화분 2점 (I-C, II-C)을 구입하여 재료로 사용하였다. 각 벌화분 내 성분 추출을 위해 10 g을 100 mL의 70% 에탄올에 정량하여 넣고, stirring plate에서 12시간 이상 교반하였다. 교반 후 Whatman No. 2 필터를 이용하여 필터링하고, 감압농축기에서 완전히 농축시켰다. 농축된 시료를 200 mg/mL의 농도가 되도록 70% 에탄올을 첨가하고, 동량의 distilled water를 첨가하여 최종 에탄올 농도를 35%가 되도록 제작하였다. 세포 실험을 위해 추출물을 0.45 μm의 syringe Àlter로 필터링하고 다음 실험에 사용할 때까지 4℃에서 보관하였다.
2. 배지 및 시약
Raw264.7 세포 배양을 위해 Dulbecco’s Modified Eagles Medium (DMEM), penicillin-streptomycin은 Gibco (U.S.A.)사에서 구입하였으며, fetal bovine serum (FBS)은 GenDEPOT (Korea)사에서 구입하여 사용하였다. 구입한 FBS는 56℃에서 50분간 inactivation한 후, 50 mL conical tube에 분주하여 보관하고 필요시에 녹여서 사용하였다. 대식세포에 염증 자극을 주기 위한 LPS는 Sigma (U.S.A.)사에서 구입한 것을 사용하였고, 세포 생존율 측정을 위한 EZ-Cytox Plus solution은 DoGenBio (Korea)에서 구입하였다. Nitric oxide (NO) 평가를 위한 NO assay kit는 iNtRON biotechnology (Korea)에서 구입하였다. 세포에서 단백질 추출을 위한 완충액은 Invitrogen (U.S.A.)에서 판매하는 nonidet P-40 (NP-40)를 사용하였으며, 단백질 발현 및 인산화 검증을 위해 Western blotting에 사용된 extracellular signal regulated kinase (ERK) (4695), stress-activated protein kinase/c-Jun N-terminal kinase (SAPK/JNK) (9252), p38 (8690), phospho-ERK (4377), phospho-SAPK/JNK (9251), phospho-p38 (4511), inducible nitric oxide synthase (iNOS) (13120) 그리고 IL-1β (31202)는 Cell Signaling Technology (U.S.A.)에서 구입하였고, COX-2 (sc-166475), nuclear factor kappa-light chain-enhancer of activated B cells (NF-κB) (sc-166588), superoxide dismutase (SOD)1 (sc-101523), SOD2 (sc-137254) 그리고 glyceraldehyde-3-phosphate dehydrogenase (GAPDH) (sc-32233)는 Santacruz Biotechnology (U.S.A.)에서 구입하였다. Western blotting에서 2차 항체로 사용된 goat anti-mouse-HRP (SA001-500)와 goat anti-rabbit-HRP (SA002-500)는 GenDEPOT 제품을 구입하였고, 단백질 검출에 사용된 ECL pico solution은 GenDEPOT의 제품을 사용하 였다.
3. 실험 세포주
다래 벌화분의 기능성 효과 실험에 사용한 쥐 대식세포주인 Raw264.7 세포는 한국세포주은행에서 구입하였다. 세포 배양은 DMEM 배지에 100 units/mL의 penicillin-streptomycin과 10%의 FBS가 첨가된 배지에서 배양하였으며, 세포 배양은 37℃의 온도 유지와 함께 5% CO2가 공급되는 배양기에서 배양하였으며, 계대배양 시에는 trypsin을 처리하지 않고, cell scraper (SPL, Korea)를 사용하였다.
4. 다래 벌화분 추출물의 세포 독성 평가
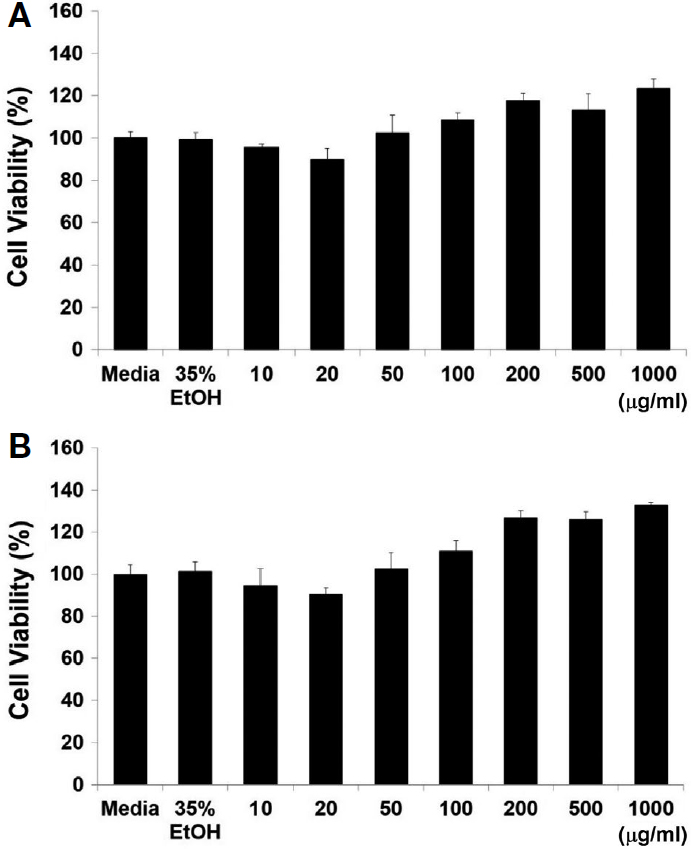
다래 벌화분 추출물 I-C와 II-C가 가진 Raw264.7 대식세포에 대한 세포 독성 영향과 실험 농도에 대한 설정을 위해 lethal dose (LD)50를 확인하고자 하였다. 각 다래 벌화분 추출물은 0, 10, 20, 50, 100, 200, 500 그리고 1,000 μg/mL의 농도 의존적으로 설정하였으며, 먼저 Raw264.7 세포는 96-well plate에 2×104 cell/well의 수로 계수하여 분주하고 24시간 동안 배양시켰다. 다래 벌화분의 효과에 대한 대조군으로서 아무것도 처리하지 않고 배양액만을 넣은 것과 다래 벌화분 용매인 35% 에탄올 처리군을 설정하였다. 세포 접종 24시간 후, 농도 의존적으로 다래 벌화분 I-C와 II-C가 각각 첨가된 배지로 교체하고 다시 24시간 동안 배양하여 Raw264.7 세포주에 대한 다래 벌화분의 세포 독성 영향을 평가하였다. 세포 독성 평가는 water-soluble tetrazolium (WST)법을 응용한 EZ-Cytox plus solution을 전체 부피의 1/10로 처리하고, 37℃ 세포 배양기에서 2시간 동안 반응시킨 후 450 nm의 파장의 SpectraMax M2 microplate reader (Molecular Devices, San Jose, U.S.A.)에서 흡광도를 측정하였다.
5. 다래 벌화분 추출물의 NO 생성 평가
앞선 세포 독성 평가에서 결정된 농도로 1 μg/mL 농도의 LPS와 함께 Raw264.7 세포주에 처리하여 다래 벌화분 추출물 I-C와 II-C에 대한 NO 생성 억제 효과를 평가하였다. 각 다래 벌화분 추출물 I-C와 II-C 농도는 500 μg/mL와 1,000 μg/mL의 두 농도로 처리하고 LPS는 1 μg/mL의 농도로 세포에 처리하였다. 음성 대조군으로서 배양액만을 넣은 세포군과 35% 에탄올만을 처리한 세포군을 설정하고, NO 생성에 대한 양성 대조군으로서 1 μg/mL의 LPS를 처리한 세포군을 설정하였다. 다래 벌화분은 LPS를 첨가하지 않고 다래 벌화분 단독으로만 처리한 실험군과 LPS와 함께 다래 벌화분을 처리한 실험군을 설정하였다. 12-well plate에 Raw264.7 세포를 2×105 cell/well의 수로 접종하고 24시간 배양 후, 실험 조건에 따라 세포에 LPS와 다래 벌화분 추출물이 첨가된 배양액을 교환하였다. 24시간 후, 세포 배양액을 수거하여 9,000 rpm에서 10분간 원심분리하여 상층액을 회수하고 iNtRON사의 NO assay kit protocol에 따라 실험을 진행하고 540 nm의 파장에서 흡광도를 측정함으로써 생성된 NO 양을 측정하였다.
6. Western blotting
다래 벌화분의 염증 저해에 대한 세포 내 단백질 변화를 확인하기 위해 Western blotting을 실시하였다. 100 mm dish에 1×107 cell/dish로 세포를 접종하고 NO 평가와 같은 실험 조건으로 LPS와 다래 벌화분 추출물 I-C와 II-C를 처리하였다. 처리 24시간 후, 세포 배양액을 제거하고 1× phosphate buffered saline (PBS)로 2회 수세한 후, 200 μL의 NP-40 lysis buffer를 첨가하고 세포를 용해한 뒤, 단백질을 회수하였다. 회수된 단백질을 강하게 vortex한 후, 15,000 rpm에서 20분간 원심분리하여 깨끗한 상층액을 회수하였다. 회수된 단백질은 BCA 정량법으로 정량하였고, 5× SDS sample buffer (250 mM Tris-HCl (pH 6.8), 5% 2-Mercaptoethanol, 10% SDS, 0.5% Bromophenol blue, 50% Glycerol)를 1×가 되도록 첨가한 후, 100℃에서 10분간 끓여 시료를 준비하였다. 30 μg의 단백질을 100 voltage에서 4~15% TGX gradient gel에 전개한 후, transblot (Bio-Rad, U.S.A.)에서 12 voltage/7분 조건으로 polyvinylidene Áuoride (PVDF) membrane에 transfer하였다. 항체의 비특이적 반응 억제를 위해 1× tris-buffered saline-tween 20 (TBS-T)에 2% non-fat dry milk를 첨가한 blocking solution으로 실온에서 2시간 반응시켰고, 단백질 발현 검증을 위한 항체를 1 : 1,000으로 blocking solution에 희석하여 실온에서 overnight 반응시켰다. GAPDH는 1 : 5,000으로 희석하여 사용하였다. 1차 항체 반응 후, 1× TBS-T 용액으로 membrane을 4회 수세하고, 1차 항체의 host에 따라 2차 항체인 goat anti-mouse-HRP 또는 goat anti-rabbit-HRP를 5% non-fat dry milk (in 1× TBS-T)에 1 : 2,000으로 희석하여 실온에서 2시간 동안 반응시켰다. 반응 후, 1× TBS-T로 membrane을 4회 wash한 후, ECL pico detection system으로 발색한 후, ChemiDOC (Bio-Rad, U.S.A.) 장치에서 단백질 띠를 검출하였다.
결과 및 고찰
1. 다래 벌화분 추출물의 세포 독성
Fig. 1에서는 Raw264.7 대식세포에 대한 다래 벌화분 I-C (Fig. 1A)와 II-C (Fig. 1B)의 세포 독성 결과를 나타내었다. 다래 벌화분 I-C, II-2는 모두 Raw264.7에 대해 가장 높은 농도인 1,000 μg/mL에서도 세포 독성이 나타나지 않았으며, 오히려 세포 분열을 촉진하는 것으로 나타났다. 이는 고농도의 다래 벌화분을 처리해도 세포에 대해 독성을 띠지 않기 때문에 세포에 대한 안전성을 나타내는 것이며, 이는 농도에 상관없이 벌화분 섭취가 가능함을 의미한다.
2. LPS로 유발되는 염증에 대한 다래 벌화분의 저해 효과
Raw264.7 대식세포주는 LPS 처리에 따라 염증 반응이 유발된다. 염증 반응에 따른 지표 중의 하나는 세포에서의 NO 생성량을 확인하는 것이므로, Raw264.7 세포에서 LPS 자극으로 유도된 NO 생성 증가에 대한 다래 벌화분 추출물 I-C와 II-C의 효과를 확인하였다. Fig. 2A에서 LPS와 함께 다래 벌화분 추출물 I-C를 500 μg/mL 처리한 실험군에서는 LPS 단독 처리군에 비해 30%의 NO 생성 저해를 나타냈고, 1,000 μg/mL의 농도를 처리했을 경우 약 60%의 NO 생성 저해를 나타냈다. 다래 벌화분 추출물 II-C를 500 μg/mL 농도로 LPS와 함께 처리할 경우, LPS 단독 처리군보다 50%의 NO 생성 감소를 나타냈고, 1,000 μg/mL의 농도를 처리했을 때는 60% 이상의 NO 생성 감소 효과를 나타냈다. LPS를 처리하지 않고 다래 벌화분 추출물만을 처리한 실험군에서의 NO 생성량은 대조군과 차이를 나타내지 않았다. 이는 LPS에 의해 유도되는 염증 반응을 다래 벌화분 추출물이 저해하는 것을 보여주고 있다. 또한 NO 생성 억제 효과는 다래 벌화분 추출물의 농도 의존적으로 나타났으며, 다래 벌화분 추출물의 종류에 관계없이 염증 저해 효과를 가지고 있음이 확인되었다. 이는 꿀벌이 수집하는 다래 벌화분이 염증 저해에 효과가 있음을 제시하고 있다.
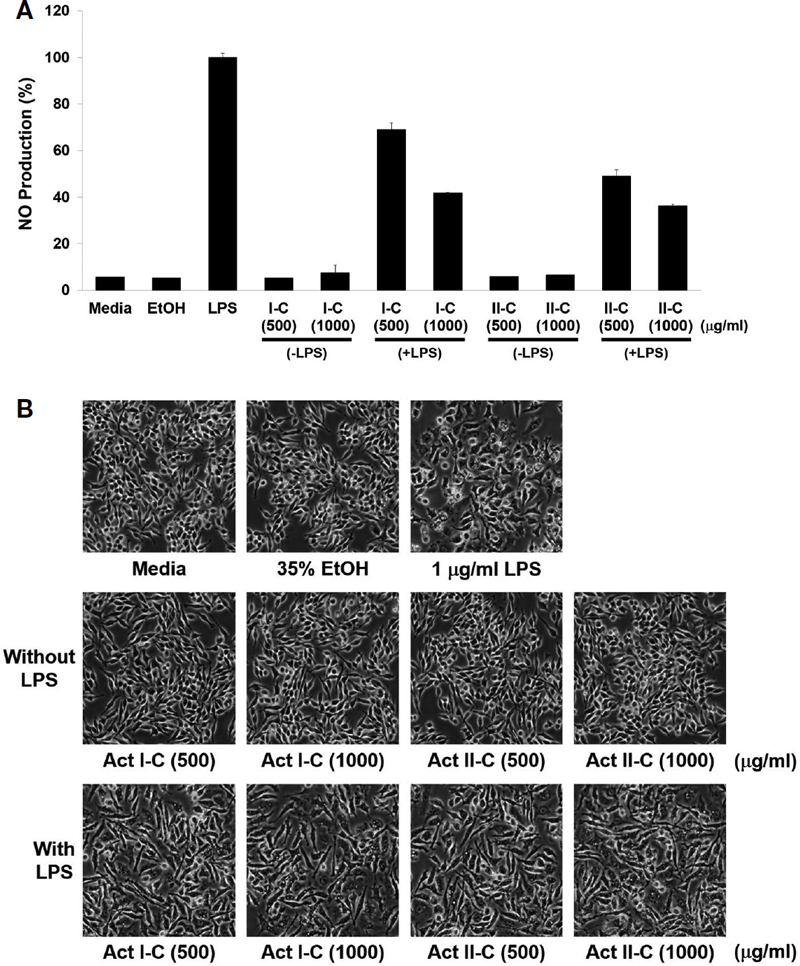
A.a. bee pollen extracts inhibit LPS-mediated NO production. (A) Determination of NO production were carried out through NO Assay kit of iNtRON biotechnology. 1 μg/mL of LPS and 500 μg/mL and 1,000 μg/mL of A.a. bee pollen I-C and II-C were simultaneously treatment and incubated for 24 hrs. (B) Microscope image of differentiated Raw264.7 cells by LPS and A.a. bee pollen I-C and II-C.
Fig. 2B에서는 NO 생성 평가에서 나타난 세포 형태를 EVOS XL-core microscope (ThermoFisher ScientiÀc, U.S.A.) 현미경으로 확인한 것이다. LPS 자극을 받지 않은 대조군과 다래 벌화분 추출물 I-C, II-C 처리군의 Raw264.7 세포는 면역 반응이 발생하지 않아 세포가 분화되지 않은 형태로 남아있다. 그러나 LPS 단독 처리군의 경우 염증 자극에 의해 세포가 분화된 형태를 보이고 있으며, 다래 벌화분 I-C, II-C를 LPS와 함께 처리한 세포 역시 LPS 단독 자극에서 나타난 세포 형태와 큰 차이를 나타내지는 않았다. 이는 다래 벌화분이 염증성 자극에 대해서 세포 내부의 염증 분자의 발현은 저해하지만, 염증 반응을 대조군 세포처럼 완전히 억제하지 못하기 때문에 나타나는 것을 의미한다.
3. 다래 벌화분 추출물의 염증 저해 작용에 대한 세포 분자 기전
다래 벌화분 추출물에 의한 염증 저해 반응에 관한 세포 내 단백질 분자들의 발현 변화 및 신호 전달 분자의 기전을 확인하였다. 각 실험군에 해당하는 단백질 시료의 Western blotting을 통해 항산화 단백질, 염증 관련 단백질 그리고 세포 내 중요한 신호 전달에 해당하는 mitogen-activated protein kinases (MAPKs)의 발현 또는 인산화를 확인하였다. Fig. 3A에서는 염증에 의해 세포 내에서 과발현되는 reactive oxygen species (ROS) 제거에 관련하는 항산화 단백질의 발현을 검증하였다. LPS 단독으로 처리한 실험군에서는 항산화에 관련된 SOD2의 발현이 강하게 나타났지만 다래 벌화분 추출물 I-C, II-C를 처리한 실험군에서는 SOD2의 발현이 감소되는 것으로 나타났다. 이는 LPS에 의해 증가된 ROS를 제거하기 위해 세포 내에서 SOD2의 발현이 증가하는데, 다래 벌화분 추출물이 염증을 경감시키면서 SOD2 분자의 발현이 감소되는 것을 나타낸다. SOD의 또 다른 isotype인 SOD1은 본 작용에서는 영향을 미치지 않는 것으로 나타났다.
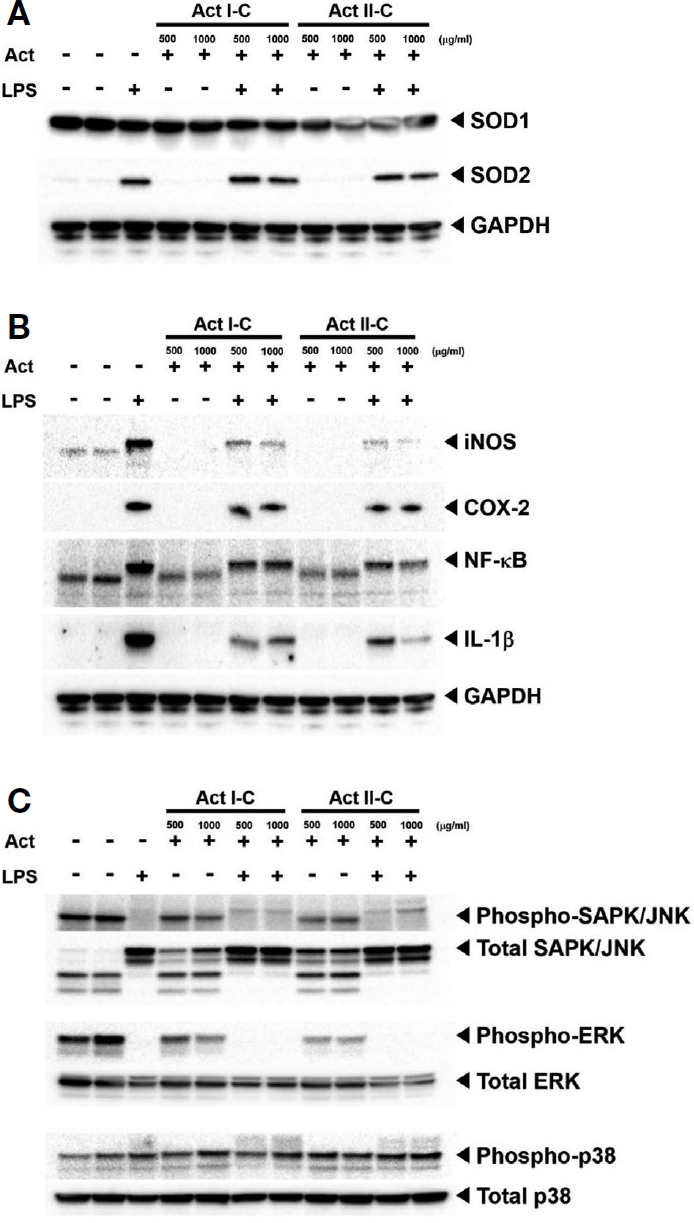
A.a. bee pollen regulated LPS-mediated antioxidant-, inflammatory response-protein expression level. 30 μg of protein resolved 4~15% gredient gel. (A)~(C) All antibodies diluted in 2% non-fat dry milk at 1 : 1,000 except GAPDH (1 : 5,000) and incubated for 16 hr at room temperature.
Fig. 3B에서는 염증과 관련된 단백질의 발현을 검증하였다. 먼저 iNOS는 염증 반응 발생 시 세포 내에서 발현이 증가하여 NO의 생성을 증가시키는데, LPS 처리군에서는 대조군에 비해 iNOS의 발현이 강하게 나타났다. LPS와 다래 벌화분 추출물을 처리한 실험군에서는 I-C, II-C 모두 농도 의존적으로 LPS에 의해 유도된 iNOS의 발현을 억제시켰다. 염증과 관련된 주요 단백질인 COX-2 역시 LPS에 의해 발현이 증가되었지만, 다래 벌화분 추출물에 의해 감소되었으며, 2차 염증 매개 효소를 활성화시키는 NF-κB는 LPS에 의해 발현이 증가되었지만 다래 벌화분 추출물에 의해 감소되었으며, 염증과 관련된 핵심 사이토카인 중의 하나인 활성화된 IL-1β 역시 LPS 자극에 의해 발현이 증가되었지만 다래 벌화분 추출물을 처리함으로써 발현이 감소하였다. 즉, Raw264.7 대식세포는 LPS 자극에 의해 염증 반응이 생성되고, 이 과정에서 iNOS, COX-2, NF-κB 그리고 IL-1β 등의 염증 관련 인자들의 발현이 세포 내에서 증가하게 된다. 이로 인해 신체에서는 발열이나 통증 등이 수반되는데, 다래 벌화분 추출물을 처리하여 염증 관련 단백질들의 발현을 감소시키고, 이는 신체에서 발생되는 이차 반응을 경감시킬 수 있다는 것을 의미한다.
Fig. 3C에서는 세포 내 주요 신호 전달 분자인 MAPKs의 인산화와 발현을 확인하였다. 세포 내 대표적인 MAPKs에 속하는 분자는 ERK, SAPK/JNK 그리고 p38인데, 이들은 세포 분열 또는 사멸이 진행되는 과정에서 인산화의 증가 혹은 감소를 통해 세포 주기를 조절한다. 또한 이들 단백질들은 인산화뿐만이 아니라 단백질 양의 발현 조절을 통해서 세포 내 신호를 전달하여 항상성을 유지하도록 조절한다. Fig. 3C에서 LPS와 다래 벌화분 추출물을 처리한 후, ERK, SAPK/JNK 그리고 p38의 인산화 및 발현을 확인하였는데, LPS에 의해서 감소된 ERK와 SAPK/JNK의 인산화는 다래 벌화분 추출물을 처리해도 대조군 수준으로 회복되지 않았으며, 전체 단백질 양은 SAPK의 경우 스트레스에 의해서 매개되기 때문에 LPS 자극에 의해 발현이 증가되었으나 다래 벌화분 추출물이 이에 대한 발현 감소 효과를 나타내지 못했다. 또한 ERK 단백질의 인산화 역시 LPS에 의해 감소되었고, p38의 인산화는 LPS 자극에 의해 대조군보다 증가했으나 다래 벌화분 추출물을 처리해도 대조군 수준으로 회복시키지 못하였다. 두 단백질 모두 발현 양에 있어서는 큰 차이를 나타내지 못했다. 이는 LPS에 의해 변화되는 MAPKs의 신호 또는 발현 양을 다래 벌화분 추출물이 조절하지 못함을 의미하며, 이는 다래 벌화분 추출물이 관여하는 신호 경로가 MAPKs 경로가 아님을 나타낸다. 그러나 LPS 처리와는 별개로 다래 벌화분 추출물만을 처리했을 때, Fig. 1의 세포 생존율이 증가되는 것으로 나타났다. 이는 Fig. 3C에서 SAPK/JNK 그리고 p38의 발현 양이 증가된 것에 따라 세포 분열이 증가된 것이다. 특히, 이 과정에는 SAPK/JNK의 발현 양 증가가 중요한 역할을 하고 있음을 나타낸다. 따라서 Fig. 3에 해당하는 Western blotting 결과를 종합했을 때, LPS 자극에 대해서 다래 벌화분 추출물은 항산화와 염증 조절에는 관여하지만 MAPKs 경로에 해당하는 단백질에는 영향을 끼치지 못하지만, LPS가 존재하지 않을 때에는 SAPK/JNK의 발현에 영향을 끼쳐 세포 분열을 촉진함을 나타낸다.
지금까지 수많은 연구를 통해 꿀, 프로폴리스, 로열젤리와 같은 양봉산물의 생물학적 기능성이 입증되어왔다. 그러나 벌화분에 대해서는 현상학적인 기능은 알려져 있지만 명확한 분자 기전은 제시되지 않았고, 특히 수집되는 시기 및 주변 식물상의 조성에 따라 벌화분의 기능성은 다양해질 수 있기 때문에 아직 많은 연구가 미비한 실정이다. 본 연구에서는 벌화분 중 다래 벌화분을 특정하여 추출물을 준비하고 염증 저해에 관한 기능성 및 해당 기능성에 대한 분자 기전을 제시했으며, 이 결과를 통해 다래 벌화분이 앞으로 더 많은 생물학적 효과를 나타낼 수 있음을 의미하고 있다. 그러나 본 연구에서는 시중에서 판매되고 있는 다래 벌화분을 구입하여 사용하였는데 이는 다래 벌화분 내에 존재하는 수많은 구성 성분 중에서 명확한 기준 물질이 정립되지 않았으므로 앞으로 염증에 대해 기능성을 가지는 다래 벌화분 내 기준 물질을 선정해야 할 것이며, 이는 염증 기능성뿐만이 아니라 다래 벌화분이 가지는 다른 생물학적 기능성을 검증할 때도 마찬가지로 고려해야 할 점이다. 또한 시판되는 다래 벌화분 내 실제 다래에서 유래된 벌화분의 양을 확인해야 할 것이다. 다른 식물에서 유래한 벌화분에서 유래한 기능성 효과 여부의 검증이 중요하므로, 실험에 사용된 시료의 분류를 통한 유전적 동정을 통해 전체 중 다래 벌화분이 포함되어 있는 양을 확인하고 순수 분리된 다래 벌화분의 기능성 효과도 검증해야 한다. 그럼에도 불구하고 다래 벌화분의 염증 저하 효과에 대해 본 연구에서 입증함으로써 앞으로 양봉산물 중 벌화분을 식품 또는 건강기능식품으로 응용할 수 있는 근거가 제시되었다. 또한 다른 식물에서 유래되는 벌화분 종류와 비교하여 각각의 벌화분이 가지는 생물학적 기능성에 대한 특징을 비교·연구해야 할 것이다. 이 결과를 기초로 다래 벌화분 내의 표준 지표 물질을 선정하고 세포 실험뿐만이 아닌 동물실험에 적용하여 생물학적 효과를 명확히 해야 할 것이고, 또 다른 기능성 효과 및 기전을 구명해 나갈 것이며, 인류 건강 증진을 위해 다양한 양봉산물이 활용될 것으로 기대한다.
Acknowledgments
본 연구는 농촌진흥청 어젠다연구사업 (과제번호: RS-2024-00332514)에 의해 수행되었습니다.
References
-
Abdelnour, S. A., M. E. Abd El-Hack, M. Alagawany, M. R. Farag and S. S. Elnesr. 2019. Beneficial impacts of bee pollen in animal production, reproduction and health. J. Anim. Physiol. Anim. Nutr. 103: 477-484.
[https://doi.org/10.1111/jpn.13049]

-
Aliyazicioglu, Y., O. Deger, E. Ovali, Y. Barlak, I. Hosver, Y. Tekelioglu and S. C. Karahan. 2005. Effects of Turkish pollen and propolis extracts on respiratory burst for K-562 cell lines. Int. Immunopharmacol. 5: 1652-1657.
[https://doi.org/10.1016/j.intimp.2005.04.005]

-
Almeida-Muradian, L. B., L. C. Pamplona, S. Coimbra and O. M. Barth. 2005. Chemical composition and botanical evaluation of dried bee pollen pellets. J. Food Compos. Anal. 18: 105-111.
[https://doi.org/10.1016/j.jfca.2003.10.008]

-
Anwikar, S. and M. Bhitre. 2010. Study of the synergistic anti-inflammatory activity of Solanum xanthocarpum Schrader and Wendl and Cassia fistula Linn. Int. J. Ayurveda Res. 1: 167-171.
[https://doi.org/10.4103/0974-7788.72489]

- Baily, J. M. 2013. Prostaglandins, Leukotrienes, Lipoxins, and PAF: mechanism of action, molecular biology, and clinical applications. Springer Science and Business Media.
-
Balkwill, F. and A. Mantovani. 2001. Inflammation and cancer: back to Virchow? Lancet 357: 539-545.
[https://doi.org/10.1016/S0140-6736(00)04046-0]

-
Basim, E., H. Basim and M. Özcan. 2006. Antibacterial activities of Turkish pollen and propolis extracts against plant bacterial pathogens. J. Food Eng. 77: 992-996.
[https://doi.org/10.1016/j.jfoodeng.2005.08.027]

- Bogdanov, S. 2004. Quality and standards of pollen and beeswax. Apiacta 38: 334-341.
-
Campos, M. G. R., C. Frigerioc, J. Lopes and S. Bogdanov. 2010. What is the future of bee-pollen? J. ApiProd. ApiMed. Sci. 2: 131-144.
[https://doi.org/10.3896/IBRA.4.02.4.01]

-
Campos, M. G. R., S. Bogdanov, L. Bicudo de Almeida-Muradian, T. Szczesna, Y. Mancebo, C. Frigerio and F. Ferreira 2008. Pollen composition and standardisation of analytical methods. J. Apic. Res. 47: 154-161.
[https://doi.org/10.3896/IBRA.1.47.2.12]

- Cocan, O., L. A. Marghitas, D. Dezmirean and L. Laslo. 2005 Composition and biological activities of bee pollen: review. Bull. Univ. Agric. Sci. Vet. Med. 61: 221-226.
- Engelhardt, N. 2014. Synthese und charakterisierung von Oberflachen-funktionalisierten polymeren nanopartikeln auf Poly (2-oxazolin)-basis (Doctoral Dissertation).
-
Eraslan, G., M. Kanbur and S. Silici. 2009. Effect of carbaryl on some biochemical changes in rats: The ameliorative effect of bee pollen. Food Chem. Toxicol. 47: 86-91.
[https://doi.org/10.1016/j.fct.2008.10.013]

-
Furusawa, E., S. C. Chou, A. Hirazumi and A. Melera. 1995. Antitumour potential of pollen extract on lewis lung carcinoma implanted intraperitoneally in syngeneic mice. Phytother. Res. 9: 255-259.
[https://doi.org/10.1002/ptr.2650090405]

-
Gilfillan, A. M. and D. D. Metcalfe 2011. Mast cell biology: Contemporary and emerging topics. Adv. Exp. Med. Biol. 716.
[https://doi.org/10.1007/978-1-4419-9533-9]

-
Guo, B., K. M. Lager, J. N. Henningson, L. C. Miller, S. N. Schlink, M. A. Kappes, M. E. Kehrli Jr, S. L. Brockmeier, T. L. Nicholson, H. C. Yang and K. S. Faaberg. 2013. Experimental infection of united states swine with a Chinese highly pathogenic strain of porcine reproductive and respiratory syndrome virus. Virology 435: 372-384.
[https://doi.org/10.1016/j.virol.2012.09.013]

-
Horadagoda, N. U., J. C. Hodgson, G. M. Moon, T. G. Wijewardana and P. D. Eckersall. 2002. Development of a clinical syndrome resembling haemorrhagic septicaemia in the buffalo following intravenous inoculation of Pasteurella multocida serotype B: 2 endotoxin and the role of tumour necrosis factor-α. Res. Vet. Sci. 72: 194-200.
[https://doi.org/10.1053/rvsc.2001.0538]

-
Hou, Y., Y. Yin and G. Wu. 2015 Dietary essentiality of “nutritionally non-essential amino acids” for animals and humans. Exp. Biol. Med. 240: 997-1007.
[https://doi.org/10.1177/1535370215587913]

- Huether, S. E. and K. L. McCance. 2015. Understanding pathophysiology. Elsevier Health Sciences.
-
Isailovic, N., K. Daigo, A. Mantovani and C. Selmi. 2015. Interleukin-17 and innate immunity in infections and chronic inflammation. J. Autoimmun. 60: 1-11.
[https://doi.org/10.1016/j.jaut.2015.04.006]

-
Komosinska-Vassev, K., P. Olczyk, J. Kaźmierczak, L. Mencner and K. Olczyk. 2015. Bee pollen: Chemical composition and therapeutic application. Evid. Based Complement. Alternat. Med. 2015: 297425.
[https://doi.org/10.1155/2015/297425]

-
Li, Q. Q., K. Wang, M. C. Marcucci, A. C. H. F. Sawaya, L. Hu, X. F. Xue, L. M. Wu and F. L Hu. 2018. Nutrient-rich bee pollen: A treasure trove of active natural metabolites. J. Funct. Foods 49: 472-484.
[https://doi.org/10.1016/j.jff.2018.09.008]

-
Liolios, V., C. Tananaki, A. Papaioannou, D. Kanelis, M. A. Rodopoulou and N. Argena. 2019. Mineral content in monofloral bee pollen: Investigation of the effect of the botanical and geographical origin. J. Food Meas. Charact. 13: 1674-1682.
[https://doi.org/10.1007/s11694-019-00084-w]

- Mak, T. W., M. E. Saunders and B. D. Jett. 2013. Primer to the immune response. Newnes.
-
Maruyama, H., T. Sakamoto, Y. Araki and H. Hara. 2010. Anti-inflammatory effect of bee pollen ethanol extract from Cistus sp. of Spanish on carrageenan-induced rat hind paw edema. BMC Complement. Altern. Med. 10: 30.
[https://doi.org/10.1186/1472-6882-10-30]

-
Marza, A. D., F. F. J. Abdullah, I. M. Ahmed, E. L. T. Chung, H. H. Ibrahim, M. Zamri-Saad, A. R. Omar, M. Z. A. Bakar, A. A. Saharee, A. W. Haron and M. A. M Lila. 2015. Involvement of nervous system in cattle and buffaloes due to Pasteurella multocida B: 2 infection: A review of clini-copathological and pathophysiological changes. J. Adv. Vet. Anim. Res. 2: 252-262.
[https://doi.org/10.5455/javar.2015.b99]

-
Mayda, N., A. Özkök, N. E. Bayram, Y. C. Gercek and K. Sorkun. 2020. Bee bread and bee pollen of different plant sources: Determination of phenolic content, antioxidant activity, fatty acid and element profiles. J. Food Meas. Charact. 14: 1795-1809.
[https://doi.org/10.1007/s11694-020-00427-y]

-
Medzhitov, R. 2008. Origin and physiological roles of inflammation. Nature 454: 428-435.
[https://doi.org/10.1038/nature07201]

-
Morais, M., L. Moreira, X. Feás and L. M. Estevinho. 2011. Honeybee-collected pollen from five Portuguese natural parks: Palynological origin, phenolic content, antioxidant properties and anti-microbial activity. Food Chem. Toxicol. 49: 1096-1101.
[https://doi.org/10.1016/j.fct.2011.01.020]

-
Moreland, L. W. 2004. Rheumatology and immunology therapy: A to Z essentials. Springer Science and Business Media.
[https://doi.org/10.1007/3-540-29662-X]

-
Opriessnig, T., L. G. Giménez-Lirola and P. G. Halbur. 2011 Polymicrobial respiratory disease in pigs. Anim. Health Res. Rev. 12: 133-148.
[https://doi.org/10.1017/S1466252311000120]

-
Pascoal, A., S. Rodrigues, A. Teixeira, X. Feás and L. M. Estevinho. 2014. Biological activities of commercial bee pollens: antimicrobial, antimutagenic, antioxidant and anti-inflammatory. Food Chem. Toxicol. 63: 233-239.
[https://doi.org/10.1016/j.fct.2013.11.010]

-
Richardson, M. A., T. Sanders, J. L. Palmer, A. Greisinger and S. E. Singletary. 2000. Complementary alternative medicine use in a comprehensive cancer center and the implications for oncology. J. Clin. Oncol. 18: 2505-2514.
[https://doi.org/10.1200/JCO.2000.18.13.2505]

-
Roulston, T. H. and J. H. Cane. 2000. Pollen nutritional content and digestibility for animals. Plant. Syst. Evol. 222: 187-209.
[https://doi.org/10.1007/978-3-7091-6306-1_10]

- Rubin, E. and H. M. Reisner. 2009. Essentials of Rubin’s Pathology. Lippincott Williams & Wilkins.
-
Serhan, C. N., J. Dalli, R. A. Colas, J. W. Winkler and N. Chiang. 2015. Protectins and maresins: New pro-re-solving families of mediators in acute inflammation and resolution bioactive metabolome. Biochim. Biophys. Acta Mol. Cell Biol. Lipids 1851: 397-413.
[https://doi.org/10.1016/j.bbalip.2014.08.006]

-
Shivachandra, S. B., K. N. Viswas and A. A. Kumar. 2011. A review of hemorrhagic septicemia in cattle and buffalo. Anim. Health Res. Rev. 12: 67-82.
[https://doi.org/10.1017/S146625231100003X]

- Szczęsna, T. 2006a. Protein content and amino acid composition of bee-collected pollen from selected botanical origins. J. Apic. Sci. 50: 81-90.
- Szczęsna, T. 2006b. Long-chain fatty acids composition of honeybee-collected pollen. J. Apic. Sci. 50: 65-79.
-
Thakur, M. and V. Nanda. 2020. Composition and functionality of bee pollen: A review. Trends Food Sci. Technol. 98: 82-106.
[https://doi.org/10.1016/j.tifs.2020.02.001]

- Todd, I., G. P. Spickett and L. Fairclough. 2015. Lecture notes: Immunology. John Wiley & Sons.
-
Uttara, B., A. V. Singh, P. Zamboni and R. T. Mahajan. 2009. Oxidative stress and neurodegenerative diseases: A review of upstream and downstream antioxidant therapeutic options. Curr. Neuropharmacol. 7: 65-74.
[https://doi.org/10.2174/157015909787602823]

- Wójcicki, J. 1987. Experimental and clinical analyses of bee pollen extracts. Herba Polonica 33: 49-54.
-
Žižić, J. B., N. L. Vuković, M. B. Jadranin, B. D. Anđelković, V. V. Tešević, M. M. Kacaniova, S. B. Sukdolak and S. D. Marković. 2013. Chemical composition, cytotoxic and antioxidative activities of ethanolic extracts of propolis on HCT-116 cell line. J. Sci. Food Agric. 93: 3001-3009.
[https://doi.org/10.1002/jsfa.6132]