산지별 아까시꿀 비교 분석을 위한 전처리법의 확립
Abstract
This study aims to obtain fundamental data for identifying the geographical origin of false acacia honey through spectroscopic methods. Initially, the Korean honey was extracted with four different solvents, and the components were compared using ultra-performance liquid chromatography (UPLC) and assessed for total antioxidant capacity with total phenol and flavonoid content. Based on these experiments, the pretreatment of false acacia honey was optimized by extracting with ethyl acetate, evaporating, redissolving in methanol, and filtering for UPLC analysis. The chromatograms revealed subtle differences in peak at 254 nm. Further studies should be conducted to identify specific compounds in false acacia honey.
Keywords:
False acacia honey, Robinia pseudoacasia, Spectroscopic analysis서 론
벌꿀은 꿀벌이 다양한 밀원으로부터 화밀 (nectar), 수액 등을 수집하고 효소를 포함하는 타액과 함께 벌집에 저장하여 생성되는 주요 양봉 산물이다 (식품의약품안전처, 2020). 그중 우리나라 전역에 분포하여 유용 밀원수종인 아까시나무 (Robinia pseudoacacia)의 화밀에서 유래된 아까시꿀은 독특한 맛과 향미에서 국내 소비자 선호도가 높아 국내 벌꿀 생산량의 70% 이상을 차지한다 (이, 1998; Lee et al., 2004; Lee et al., 2019). 아까시꿀에는 다량의 탄수화물 (포도당, 과당 등)과 수분 이외에도 무기질 (칼륨, 마그네슘, 인 등) 및 아미노산 (프롤린, 세린 등)을 함유하고 있어 영양학적 가치가 있다 (Kim et al., 2017a; 정 등, 2019). 또한, 아까시꿀은 아까시나무 유래 주요 대사물로 알려진 robinin과 같은 Áavonoid류의 페놀성 화합물을 함유하고 있어 항산화 등의 다양한 생리활성 효과를 가진다 (Gismondi et al., 2017; Kim et al., 2020).
아까시꿀은 우리나라 뿐만 아니라 중국, 헝가리 등 세계적으로 생산이 이루어지고 있다. 국산 아까시꿀의 안정적인 생산과 경쟁력을 갖추기 위해 특이성분 연구가 활발히 이루어지고 있다 (Truchado et al., 2008; Wang et al., 2014). 예를 들어, 위질환 발병인자 중 하나인 헬리코박터 파일로리 (Helicobacter pylori)균을 억제하는 아브시스산 (abscisic acid)의 평균 함량이 국산 아까시꿀에 평균 24 mg/kg으로, 해외에서 생산되는 아까시꿀 평균 함량의 3배 높게 함유하여 국산 아까시꿀의 지표성분으로 활용할 수 있다는 연구가 보고된 바 있다 (Can et al., 2015; Kim et al., 2017b, 2018).
한편, 한국과 베트남 간의 FTA 체결 이후 점차 관세가 낮아져 2029년에는 무관세가 적용된다. 이는 중국산 아까시꿀을 베트남산 아까시꿀로 둔갑하여 우회 수출하게 되면 국내 양봉산업과 국산 아까시꿀의 보호에 큰 타격을 입을 우려가 있다. 따라서, 산지별 아까시꿀이 특이적으로 가지는 성분에 대한 연구를 바탕으로 원산지를 판별할 수 있는 기준이 마련되어야 한다. 본 연구에서는 국산 아까시꿀을 표준시료로 하여 용매 극성별 추출물의 성분패턴 비교 및 항산화 활성 평가를 통해 최적 전처리법을 확립하였다. 이를 바탕으로 국산과 중국산 아까시꿀 내에 포함된 구성 화합물의 차이를 확인하고자 UPLC를 이용하여 크로마토그램에 나타나는 peak를 비교하였다.
재료 및 방법
1. 실험재료
본 실험에서는 한국양봉농협에서 수매한 아까시꿀 (국산 1종, 중국산 4종)을 사용하였다. 꿀 추출에 사용한 용매로는 물, 메탄올, 에틸아세테이트 (ethyl acetate, EA), 클로로포름으로써 SK chemicals (Seongnam, Korea)에서 구입하였다. 또한, Ultra performance liquid chromatography (UPLC)에 사용된 유기용매 및 탈이온수는 Fisher Brand (PA, USA)에서 구입하여 trifluoroacetic acid (Sigma-aldrich, Mo, USA)를 0.2%가 되도록 첨가하여 사용하였다.
2. 용매 극성별 아까시꿀 추출
국산 및 중국산 아까시꿀의 성분 패턴 비교에 앞서, 극성에 따른 4종의 용매를 선정하여 아까시꿀 내 특이성분을 추출하였다. 먼저, 아까시꿀 5 g에 각 용매 10 mL를 넣어 30°C에서 1시간 초음파 추출하고, rotary evaporator로 감압 농축한 것을 메탄올로 10 mg/mL이 되도록 조제하였다. 각 용액을 0.2 μm PTFE (Adventec, Dublin, OH, USA) 필터로 여과한 다음 분석에 사용하였다.
3. UPLC 분석 조건
산지별 아까시꿀 분석 기기는 UPLC로 Waters (Minneapolis, MN, USA)사의 ACQUITY UPLC I-Class 모델을 사용하였다. 분석에 사용한 컬럼은 Halo C18 (2.1×100 mm, 2 μm, Advanced Materials Technology, Wilmington, DE, USA)을 이용하여 분리하였고, UPLC 분석 조건은 Table 1에 나타내었다.
4. 총 폴리페놀 및 플라보노이드 함량과 항산화력 측정
총 페놀 및 플라보노이드는 Kim et al. (2022)의 방법을 참고하여 흡광값 측정을 통해 함량을 구하였다. 표준물질로 gallic acid와 quercetin을 각각 메탄올로 녹인 후 0~250 μg/mL의 구간에서 5개 농도를 설정하고 검량선을 작성하였다. 이를 바탕으로 총 페놀 함량은 mg GAE/kg으로, 총 플라보노이드 함량은 μg QE/kg으로 나타내었다. 항산화 활성은 TAC (Total antioxidant capacity)를 측정하였다. TAC assay는 OxiTecTM colorimetric detection kit (BIOMAX, Guri, Korea)를 사용하여 시료, copper reagent, reaction buffer를 각각 50 μL씩 넣고 30분 동안 암실에서 방치한 후 450 nm에서 흡광 측정하였다. Trolox를 표준물질로 0~250 μg/mL 구간에서 검량선을 작성한 것을 바탕으로 평가하였다. 흡광 측정을 위한 분광광도계는 Spectramax M2 (Molecular Devices, San Jose, CA, USA)를 사용하였고, 실험에 사용한 모든 시약은 Sigma Co. (St. Louis, Mo, USA)에서 구매하였다.
결과 및 고찰
1. UPLC를 통한 용매별 국산 아까시꿀 추출물 성분패턴 비교
아까시나무 (Robinia pseudoacacia)는 콩과 (Leguminosae) 여러해살이 낙엽교목으로 세계적으로 분포하고 있는 수종이다 (이, 2003). 특히, 우리나라 전역에 분포하는 주요 밀원식물로 아까시나무에서 유래한 아까시꿀은 국내 양봉농가의 주요 소득원으로 자리매김하였다. 본 연구에서는 아까시꿀의 원산지에 따른 성분패턴 비교에 앞서, 양봉농협에서 수매한 국산 아까시꿀을 표준시료로 하여 추출 방법에 따른 꿀 내 성분패턴 비교를 통해 전처리법을 최적화하고자 하였다.
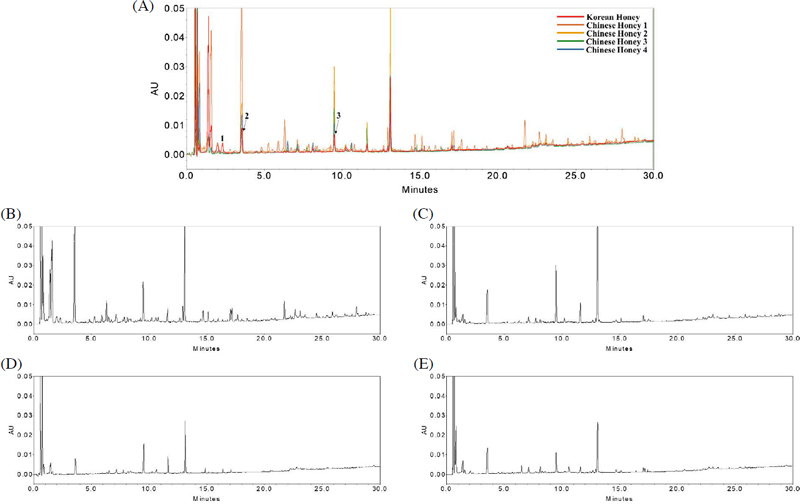
이를 위해 국산 아까시꿀을 유기용매 극성에 따라 선정한 4종의 용매 (물, 메탄올, EA, 그리고 클로로포름)로 추출한 후 UPLC로 분석 및 비교하였다. 꿀 내 뛰어난 생리활성을 나타낸다고 알려진 폴리페놀 및 플라보노이드류와 같은 유효성분을 비교하기 위해 이들의 감응도가 좋은 254 nm 환경에서 결과를 해석하였고, Fig. 1에 제시하였다 (Jibril et al., 2019; Nyarko et al., 2023). 그 결과 EA 추출물에서 상대적인 peak의 수가 많아 추출효율이 높음을 확인했다. 반면, 물과 메탄올 추출물은 추출물질이 거의 검출되지 않았다. 이는 물과 메탄올이 극성용매로서 다량의 당 성분이 함유되어 있는 꿀과 잘 섞이지만, 당 성분은 UV에 감응하지 않기 때문에 미량 성분들의 검출이 어려웠을 것으로 추정된다 (Ana et al., 2021). 클로로포름 추출물은 EA 추출물과 유사한 성분패턴을 나타냈으나 감응도가 상대적으로 낮았다 (추출수율: 물, 메탄올 수율계산 불가, EA 6.4 mg; 0.13%, 클로로포름 4.8 mg; 0.09%).
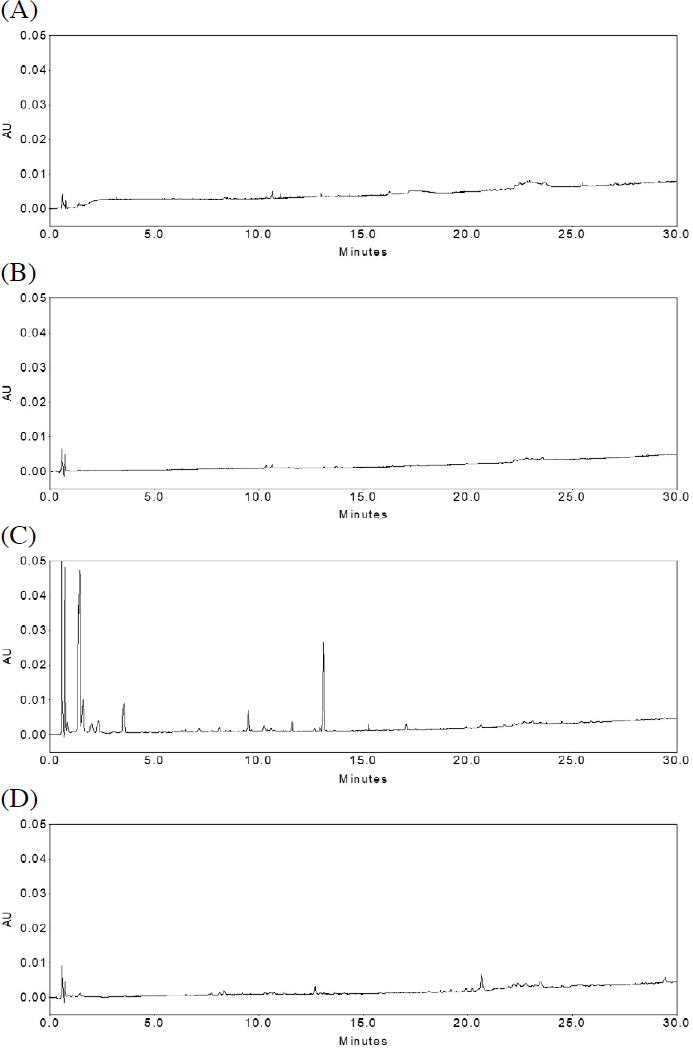
UPLC chromatograms of Korean false acacia honey with different solvent extraction method at 254 nm. (A) water, (B) methanol, (C) ethyl acetate, and (D) chloroform.
이와 같이 극성에 따른 4가지 추출 용매를 사용하여 아까시꿀 추출물의 화학적 패턴을 비교한 결과, EA로 추출한 것이 꿀 내 다량의 당을 제거하여 유효성분을 효율적으로 추출함을 알 수 있었다.
2. 용매별 국산 아까시꿀 추출물 내 총 폴리페놀 및 플라보노이드 함량과 항산화 활성
밀원식물이나 벌 내 대사과정 등에서 유래하여 꿀에 존재하는 폴리페놀과 플라보노이드 계열 화합물은 항산화 등의 생리활성에 크게 기여하는 것으로 알려져 있다 (Rostislav et al., 2016; Boutoub et al., 2021). 본 연구에서는 국산 아까시꿀을 EA와 클로로포름 (CHCl3)으로 추출하여 총 페놀과 플라보노이드 함량을 비교하고자 하였다 (Table 2). 국산 아까시꿀 EA 추출물의 총 폴리페놀 함량 (TPC)은 9.32 mg GAE/g으로 나타났으며 총 플라보노이드 함량 (TFC)은 88.87 μg QE/g으로 나타났다. CHCl3 추출물의 경우 EA보다 3배가량 낮은 3.65 mg GAE/g와 36.62 μg QE/g으로 나타났다. 두 시료 모두 페놀 함량에 비해 플라보노이드 함량이 낮게 나타났다. 이는 아까시꿀 내 비플라보노이드 성분이 많은 것으로 판단된다. 문헌에 따르면, 국산 아까시꿀의 물 추출물에 대한 TPC는 47 μg GAE/g이며 TFC는 30 μg QE/g으로, EA 추출물에 비해 폴리페놀 및 플라보노이드의 추출효율이 낮은 것으로 나타났다 (Kim et al., 2010).

Total polyphenol and flavonoid contents of Korean false acacia honey with different solvent extraction method
상기 두 실험적 근거를 바탕으로, 꿀 시료 전처리법 최적화를 위해 주요 대사물의 추출효율이 높게 나타난 EA 용매를 최종 선정하였다.
추가로, TAC assay를 통해 총 페놀과 플라보노이드 함량이 비교적 높았던 EA 꿀 추출물의 항산화 활성 평가를 하였다. TAC assay는 꿀 시료가 Cu2+를 Cu+로 환원하는 능력을 측정하는 원리로 이를 통해 시료의 총 항산화 능력을 측정할 수 있다 (Al Qahtani et al., 2022). 4구간 (1,000~10,000 μg/mL)의 농도로 국산 아까시꿀 EA 추출물을 처리한 결과, 농도 의존적으로 높아지는 경향을 보였고 가장 높은 농도에서 295.3 μM으로 나타났다 (Fig. 2).
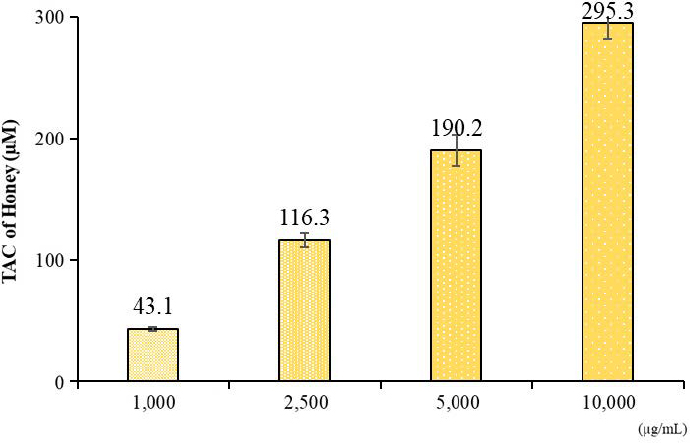
Total antioxidant capacity assay of ethyl acetate extract of Korean false acacia honey. Error bars represent the standard deviation of the mean.
이로써, 아까시꿀이 항산화 소재로 활용될 수 있음을 확인하였다.
3. UPLC를 통한 산지별 아까시꿀 성분패턴 비교
추출효율이 높았던 EA 용매를 이용해 국산 1종과 중국산 4종 아까시꿀 시료를 동일한 방식으로 전처리 후 UPLC로 분석하여 크로마토그램에 나타나는 peak를 비교하였다 (Fig. 3). 그 결과, peak 1 (2.3 min)에서 국산 시료가 중국산 시료보다 상대적으로 높은 함량을 나타냈다. Peak 2 (3.8 min)와 peak 3 (9.5 min)은 중국산 시료에서 높게 검출되었다. 또한 14분대와 16분대에서 국산 시료와 검출되지 않은 peak가 중국산 시료에 나타났다. 이로써 동일한 아까시나무 수종임에도 지리적 위치에 따라 벌꿀 내 성분에 차이가 있음을 확인하였고, 아까시꿀의 원산지 판별 분석에 기초자료로서 활용될 수 있을 것으로 판단된다. 하지만 이와 같은 지리적 위치의 차이가 동일 원산지에서도 발생할 수 있어 더 많은 시료를 확보한 후 국산 아까시꿀 만의 특이적인 성분을 선정 및 동정하는 연구가 수행되어야 한다.
적 요
본 연구는 국산 아까시꿀을 용매별로 추출하여 꿀 내 성분패턴과 항산화 활성을 분석하고 전처리법을 확립한 후, 산지별 아까시꿀을 UPLC 분석하여 원산지 판별을 위한 기초자료를 확보하고자 하였다. 국산 아까시꿀의 용매별 추출 수율은 에틸아세테이트, 클로로포름, 물, 메탄올 순으로 높게 나타났다. 용매별 추출 수율이 높은 에틸아세테이트와 클로로포름 추출물의 총 폴리페놀과 총 플라보노이드 함량 분석 결과, 에틸아세테이트 추출물의 총 폴리페놀 함량은 9.32 mg GAE/g, 총 플라보노이드 함량은 88.87 μg QE/g으로 확인되었고, 클로로포름 추출물은 각각 3.65 mg GAE/g, 36.62 μg QE/g으로 나타났다. 에틸아세이트 추출물의 항산화 활성 (TAC) 분석 결과 농도 의존적으로 활성이 증가했으며, 10,000 μg/mL 농도에서 295.3 μM로 나타났다. 이 두 결과를 근거로, 아까시꿀 시료의 전처리법 최적화를 위해 에틸아세테이트 용매를 선택하였고, 꿀 5 g에 EA 10 mL를 넣어 초음파 추출 후 농축하여 10 mg/mL의 농도로 맞춘 후 메탄올에 녹인 뒤 필터링하는 전처리 방법을 거쳐 분석에 사용하였다. 산지별 아까시꿀 에틸아세테이트 추출물을 UPLC 분석한 결과, peak 1에서 국산 시료가 중국산 시료보다 상대적으로 높은 함량을 보였고, peak 2, 3은 중국산 시료에서 높게 확인되었다. 이상의 결과을 종합하면, 동일한 아까시나무 수종이지만 원산지에 따라 아까시꿀의 성분 차이가 존재하며, 원산지 판별을 위한 명확한 근거를 마련하기 위해 추후 지역별 국산 아까시꿀 시료를 수집하여 동일한 방식으로 성분패턴을 비교하고 특이성분을 탐색하는 연구가 진행되어야 할 것이다.
Acknowledgments
본 연구는 농촌진흥청 어젠다연구사업 (과제번호: PJ01745702)에 의하여 수행된 것으로 이에 감사드립니다.
References
- 식품의약품안전처. 2020. 식품공전. 식품의약품안전처. 청주, 대한민국. p. 263.
- 이경준. 1998. 한국 목본류 주요 및 보조밀원수종과 화분원수종의 분류와 개화기별 자원분포 현황. 서울대학교수목원연구보고 18: 57-71.
- 이창복. 2003. 원색 대한식물도감 (상, 하). 서울: 향문사.
- 정민국, 허 덕, 이용건, 이정민, 김태련. 2019. 양봉산업 실태조사 연구. 한국농촌경제연구원. pp. 9-13.
-
Al Qahtani, H. W. S., S. Yagi, M. A. Yilmaz, O. Cakir, A. Tarhan, A. A. Mustafa and G. Zengin. 2022. Chemical profile, antioxidant and enzyme inhibition acitivites of natural Saudi Sidr and Talh honeys. Chem. Biodivers. 19: e202200227.
[https://doi.org/10.1002/cbdv.202200227]

-
Ana, L. B., B. Q. Salazar, O. D. Garcia and H. B. E. Buendia. 2021. Phenolic compounds in honey and their relationship with antioxidant activity, botanical origin, and color. Antioxidants 10: 1700.
[https://doi.org/10.3390/antiox10111700]

-
Boutoub, O., S. El-Guendouz, A. Manhita, C. B. Dias, L. M. Estevinho, V. B. Paula, J. Carlier, M. C. Costa, B. Rodrigues, S. Raposo, S. Aazza, L. El Ghadraoui and M. G. Miguel. 2021. Comparative study of the antioxidant and enzyme inhibitory activites of two types of Moroccan euphorbia entire honey and their phenolic extracts. Foods 10: 1909.
[https://doi.org/10.3390/foods10081909]

-
Can, Z., O. Yildiz, H. Sahin, E. Akyuz Turumtay, S. Silici and S. Kolayli. 2015. An investigation of Turkish honeys: Their physico-chemical properties, antioxidant capacities and phenolic profiles. Food Chem. 180: 133-141.
[https://doi.org/10.1016/j.foodchem.2015.02.024]

-
Gismondi, A., S. D. Rossi, L. Canuti, S. Novelli, G. D. Macro, L. Fattorini and A. Canini. 2017. From Robinia pseudoacacia L. nectar to Acacia monofloral honey: biochemical changes and variation of biological properties. J. Sci. Food Agric. 98: 4312-4322.
[https://doi.org/10.1002/jsfa.8957]

-
Jibril, F. I., A. B. M. Hilmi and L. Manivannan. 2019. Isolation and characterization of polyphenols in natural honey for the treatment of human diseases. Bull. Natl. Res. Cent. 43.
[https://doi.org/10.1186/s42269-019-0044-7]

- Kim, H. K., M. Y. Lee, I. P. Hong, Y. S. Choi, N. S. Kim, M. L. Lee and S. C. Lee. 2010. Antioxidant and antimicrobial capacity of several monofloral honey correlation with phenolic and flavonoid contents. Korean J. Apic. 25: 275-282.
-
Kim, S. G., I. P. Hong, S. O. Woo, H. R. Jang, J. S. Jang and S. M. Han. 2017a. Chemical composition of Korean natural honeys and sugar fed honeys. Korean J. Food Nutr. 30: 112-119.
[https://doi.org/10.9799/ksfan.2017.30.1.112]

-
Kim, S. G., I. P. Hong, S. O. Woo, H. R. Jang, S. C. Pak and S. M. Han. 2017b. Isolation of abscisic acid from Korean acacia honey with anti-Helicobacter pylori activity. Pharmacogn. Mag. 13: S170-S173.
[https://doi.org/10.4103/0973-1296.210166]

-
Kim, S. G., S. O. Woo, H. R. Jang, H. M. Choi, H. J. Moon and S. M. Han. 2018. Development of quantitative analysis for abscisic acid in Korean acacia honey by UPLC. J. Apic. 33: 195-200.
[https://doi.org/10.17519/apiculture.2018.09.33.3.195]

-
Kim, S. G., S. O. Woo, H. Y. Kim, H. M. Choi, H. J. Moon and S. M. Han. 2020. Development of UPLC method for robinin isolated from Korean Robinia honey. J. Apic. 35: 189-194.
[https://doi.org/10.17519/apiculture.2020.09.35.3.189]

- Kim, S. G., H. Y. Kim, H. M. Choi, H. J. Lee and S. M. Han. 2022. Antioxidant activity of honeydew honey produced by Apis mellifera L. Korean J. Appl. Entomol. 61: 669-673.
-
Lee, C. S., H. J. Cho and H. Yi. 2004. Stand dynamics of introduced black locust (Robinia pseudocacacia L.) planation under different disturibance regimes in Korea. For. Ecol. Manage. 189: 281-293.
[https://doi.org/10.1016/j.foreco.2003.08.012]

-
Lee, S. J., Y. G. Kim, G. R. Noh, H. S. Lee, M. S. Kim, S. H. Kim and H. W. Kwon. 2019. Comparative study of floral volatile components in the different species of Robinia spp. J. Apic. 34: 189-195.
[https://doi.org/10.17519/apiculture.2019.09.34.3.189]

-
Nyarko, K., K. Boozer and C. M. Greenlief. 2023. Profiling of the polyphenol content of honey from different geographical origins in the United States. Molecules 28: 5011.
[https://doi.org/10.3390/molecules28135011]

-
Rostislav, H., T. Petr and Z. S. Cavar. 2016. Characterisation of phenolics and other quality parameters of different types of honey. Czech J. Food Sci. 34: 244-253.
[https://doi.org/10.17221/321/2015-CJFS]

-
Truchado, P., F. Ferreres, L. Bortolotti, A. G. Sabatini and F. A. Tomás-Barberán. 2008. Nectar flavonol rhamnosides are floral markers of acacia (Robinia pseudacacia) honey. J. Agric. Food Chem. 56: 8815-8824.
[https://doi.org/10.1021/jf801625t]

-
Wang, J., X. Xue, X. Du, N. Cheng, L. Chen, J. Zhao, J. Zheng and W. Cao. 2014. Identification of acacia honey adulteration with rape honey using liquid Chromatography-electrochemical detection and chemometrics. Food Anal. Methods 7: 2003-2012.
[https://doi.org/10.1007/s12161-014-9833-7]