
겨울철 노지 월동 중인 꿀벌과 온실 화분매개 활동 중인 꿀벌의 지방체 및 비텔로제닌 발현량 비교 분석
Abstract
Honey bees can be classified as summer bees with a short lifespan and winter bees with a lifespan of over 5 months based on their physiological and ecological characteristics. This compared the physiological characteristics of fat body content and vitellogenin expression levels from the honey bees overwintering in the field and pollinating inside the greenhouse during December 2024. Honey bee workers were randomly collected from 3 colonies for each environment, and their fat body ratio in the abdomen was quantified by ethyl ether extraction method, while vitellogenin expression levels were analyzed using qPCR. The fat body ratio in the abdomen showed significant difference between overwintering and pollinating honey bees. However, although there were statistically significant differences in fat body ratios among colonies, no clear trend was observed. Vitellogenin expression levels, both group-level and colony-level comparisons showed that overwintering colonies had significantly higher expression than pollinating colonies. Based on these findings, vitellogenin expression levels appear to be a more suitable indicator of honey bee overwintering status than the fat body contents. This study provides insight into the physiological transition of honeybees from overwintering to foraging during winter.
Keywords:
Apis mellifera, Pollination, Winter bee, Physiology, qPCR analysis서 론
꿀벌 (Apis mellifera)은 전 세계적으로 다양한 기후 조건에서 넓은 지리적 범위에 분포하고 있다 (Ruttner, 1988). 꿀벌은 다양한 야생 식물 및 작물에 화분매개를 통해 번식에 기여하고 있으며 이는 생태계 보전과 식량 생산으로 이어진다 (Jung, 2008; Aryal et al., 2020; Papa et al., 2022; Jung and Shin, 2022). 이러한 이유로 꿀벌은 화분매개를 위해 전 세계에서 사육 관리되고 있으며, 양봉 산물을 통해 양봉농가에 경제적 이익을 제공하고 있다 (Jung, 2008; Garibaldi et al., 2017; Minaud et al., 2024). 하지만, 주요 화분매개자인 꿀벌은 지난 30여 년간 북미 (Bruckner et al., 2023), 남미 (Requier et al., 2024) 및 유럽 (Gray et al., 2023) 등 전 세계적으로 여러 지역에서 월동 실패가 보고되고 있다 (Minaud et al., 2024). 국내에서도 월동 중인 꿀벌의 실종 및 폐사가 보고되었다 (Jung and Bae, 2022; Kim, 2022; Kim and Lee, 2022; Lee et al., 2022). 2011~2013년의 국내 월동 실패율은 평균 17.4% (8.5~24.9%)로 조사되었으나, 2022년 월동 실패율은 평균 36% (22.6~67.7%)로 증가한 것으로 조사되었다 (Jeong et al., 2016; Jung and Bae, 2022, Kang et al., 2024). 꿀벌의 폐사는 직접적으로 봉군의 손실에 의한 직접적인 피해와 봉산물 및 식량의 생산 감소로 연쇄적인 피해로 이어질 수 있다 (Conte and Navajas, 2008; Laurino et al., 2020; Kim, 2022). 월동 봉군 폐사는 다양한 스트레스 요인으로 인해 봉군의 세력이 약해져서 발생할 수 있다 (Potts et al., 2010; Goulson et al., 2015; Henry et al., 2017; Steinhauer et al., 2018). 그 요인들로는 말벌과 같은 포식자 (Laurino et al., 2019; Requier et al., 2019; Hong and Jung, 2024), 농약 (Van Der Zee et al., 2015; Ulziibayar and Jung, 2019; Insolia et al., 2022; Kang et al., 2023), 영양부족 (Clermont et al., 2015; Requier et al., 2017; Kuchling et al., 2018), 병해충 (van Dooremalen et al., 2012; Desai and Currie, 2015; Oh et al., 2024) 및 기후변화 (Switanek et al., 2017; Insolia et al., 2022; Overturf et al., 2022) 등이 있으며 이들이 복합적으로 작용하여 봉군의 세력이 저하되고 폐사로 이어질 수 있다. 따라서 월동 폐사를 막기 위해서는 이러한 다양한 요인들로부터 꿀벌을 보호하고 외부 온도에 대응할 수 있는 충분한 세력이 필요하다.
꿀벌은 사회성 동물로 초개체 집단을 이루며 추운 겨울 환경에 월동 봉구 (winter cluster)를 형성한다 (Jung and Bae, 2022). 꿀벌은 생리 및 생태적으로 여름벌과 겨울벌로 구분할 수 있다 (Doke et al., 2015; Jung and Bae, 2022). 월동 봉구 형성기에 여름벌과 겨울벌의 구성비는 월동 성공에 큰 영향을 미친다 (Doke et al., 2015; Jung and bae, 2022). 여름벌은 연령에 따라 노동의 분화가 이루어져 각 연령에 따라 다른 작업을 수행하며 수명은 15~45일로 짧다. 겨울벌은 모든 연령의 꿀벌들이 월동 봉구를 형성하여 저장되어 있는 먹이를 기반으로 봉군 내 온도 조절을 수행하며 수명은 5개월 이상으로 길다. 생리학적 측면에서도 내역봉과 겨울벌의 유충호르몬은 낮고 외역봉은 높은 반면에, 하인두샘과 비텔로제닌은 외역봉보다 내역봉과 겨울벌이 높고 혈림프 내 단백질은 겨울벌이 가장 높게 나타난다 (Fluri et al., 1982; Huang and Robinson, 1995). 여름벌에 비해 겨울벌의 몸무게가 약 20~30%가 무겁고 에너지를 저장하고 공급하는 지방체 함량 또한 증가한다 (Fluri et al., 1982). 지방체는 곤충의 주요 대사 기관으로 에너지 저장 및 공급, 면역 반응 조절, 단백질 합성 그리고 호르몬 대사와 성장 조절에 중요한 역할을 한다 (Arrese and Soulages, 2010; Martins et al., 2011). 이러한 기능을 하는 지방체는 여름벌의 복부보다 겨울벌의 복부에 더 많은 것으로 보고되었다 (Keller, 2005). 난황단백질 전구체로 알려져 있는 비텔로제닌은 생식기능뿐만 아니라 행동 및 사회성 역할 조절, 면역 기능 강화, 영양 운반 및 저장, 그리고 수명 연장 등의 역할을 한다 (Seehuus et al., 2006; Corona et al., 2007).
우리나라에서는 양봉농가들이 대체로 2~5매의 봉세로 월동군을 형성하지만 그 봉군을 구성하고 있는 겨울벌의 비율이 더 중요할 수 있다는 의견이 제기되고 있다 (Jung and Bae, 2022). 만약 겨울벌의 구성비가 낮다면 월동 중 수명이 다해 죽는 꿀벌의 수가 많아져 월동 봉구의 크기가 작아지기 때문에 봉군 내 온도 유지가 힘들고 월동 폐사로 이어질 수 있다. 겨울벌의 수를 늘리기 위해서는 겨울벌이 생산되는 시기에 집중적으로 산란을 유도해야 한다. 선행연구에서 겨울벌은 10월 중순부터 태어나는 일벌들로 수명이 150일 이상 되는 것으로 보고되어 있다 (Mattila et al., 2001). 하지만, 가을의 온도가 지속적으로 높게 유지되어 꿀벌들의 산란이 지속적으로 발생하는 경우, 겨울벌로 전환이 느려지거나 겨울벌들이 다시 여름벌로 생리적 전환이 이루어질 수 있어 그 시기는 가변적일 수 있을 것이다. 겨울벌들은 봉군 내 산란이 발생하게 되는 경우 여름벌의 생리적 상태로 전환하여 내역봉과 외역봉 등으로 다시 구분된다 (Doke et al., 2015). 겨울벌을 월동시키지 않고 딸기 온실과 같은 따뜻한 환경에 배치하는 경우, 여왕벌은 산란을 개시하고 외역 활동이 이루어져 작물에 화분매개를 하게 된다. 뿐만 아니라 겨울 이상 고온으로 인해 외부 온도가 3일 이상 12℃가 넘게 지속되는 경우 월동 봉구 내 산란이 일어날 수 있다 (Winston, 1987; Lee et al., 2022). 겨울벌의 생리적 변화와 노동의 증가는 월동 봉군 생존에 부정적이기 때문에 봉군 내부의 생리적 변화를 추적할 필요가 있다.
따라서, 본 연구에서는 겨울철 노지에서 월동 중인 꿀벌과 딸기 온실에서 화분매개 활동 중인 꿀벌의 생리적 특성 (지방체, 비텔로제닌)을 비교하였다. 선행연구들을 기반으로 월동 중인 꿀벌의 지방체와 비텔로제닌 발현량이 모두 높을 것으로 가정하였다.
재료 및 방법
1. 양봉꿀벌
실험에 사용된 양봉꿀벌 (Apis mellifera)은 2024년 12월 15일 경북 안동시 송천동 안동대학교 부속 실험 양봉장에서 월동 봉구를 형성 중인 봉군과 경북 의성군 안계면 딸기 온실에서 화분매개 활동 중인 봉군을 대상으로 하였다. 각 봉군의 세력은 4매로 유사하였으나, 월동 중인 봉군은 봉구를 형성하고 산란이 없었고, 화분매개에 사용 중인 꿀벌 봉군은 화분떡을 제공하여 산란권을 형성한 상태였다. 월동 중인 꿀벌과 화분매개 활동 중인 꿀벌은 각각 3개 봉군에서 각각 30마리씩, 연령 구분 없이 성충을 채집하였다.
2. 복부 내 지방체 비율
꿀벌 지방체는 에테르 추출법 (Wilson-Rich et al., 2008)을 통해 정량화하였다. 각 봉군당 10마리의 꿀벌 복부를 상온에서 3일간 건조 후 정밀 저울 (AX324, Ohaus, New Jersey, United States; 0.1 mg 단위)로 무게를 측정하였다. 이후, 지방체를 녹이기 위해 에틸 에테르가 담긴 튜브에 꿀벌 복부를 24시간 침지하였다. 그리고 꿀벌 복부를 상온에서 다시 3일간 건조한 뒤 정밀 저울로 무게를 측정하였다. 복부 내 지방체 비율은 ((지방체 용해 전 무게-지방체 용해 후 무게))/(3일 건조 복부 무게)*100을 통해 추정하였다.
3. 비텔로제닌 발현량 분석
동일한 시기에 채집된 월동 중인 꿀벌과 화분매개 중인 꿀벌의 복부에서 RNA를 추출하여 비텔로제닌 발현 수준을 비교하였다. RNA 추출은 트리졸 (TRIzol) 시약 (Invitrogen, Carlsbad, CA, USA)을 사용하였으며 제조업체의 지침에 따라 수행하였다. 꿀벌 복부를 트리졸 1 mL에 넣고 균질화하고 실온에서 5분간 보관하여 핵단백질 복합체를 분리하였다. 클로로포름 (Chloroform) 200 μL를 혼합해준 뒤 4℃에서 15분간 13,000 g으로 원심분리를 하였다. 상층액을 새로운 RNase-free 튜브로 옮기고 이소프로판올 (Isopropanol, Merck, Darmstadt, Germany) 200 μL를 추가하고 10분간 RNA를 침전시켰다. 이후, 4℃에서 10분간 13,000 g으로 원심분리하여 생성된 RNA 팰릿을 75% 에탄올 (Ethanol, Merck, Darmstadt, Germany) 1 mL로 세척하고 4℃에서 5분간 7,500 g으로 원심분리하였다. 세척된 RNA 팰릿을 5분 동안 실온에서 공기 건조하고 RNase-free water 50 μL를 추가하였다. RNA 농도와 순도는 NanoDrop 분광기 (Thermo Fisher Scientific, Waltham, MA, USA)를 사용하여 평가하였다. cDNA는 각 샘플당 RNA 100 ng을 RT-premix (Intron Biotechnology, Seoul, Korea)로 합성하였다. qPCR은 SYBR Green Real-Time PCR master mix (Toyobo, Osaka, Japan)를 StepOnePlus Real-Time PCR System (Applied Biosystems, Singapore)으로 수행하였다. 각 샘플은 10 pmol의 비텔로제닌 특이적 프라이머 (Vg-Forward: GCAGAATACATGGACGGTGT, Vg-Reverse: GAACAGTCTTCGGAAGCTTG)와 100 ng의 cDNA 템플릿을 추가하여 총 20 μL로 구성하였다. PCR 과정은 enzyme activation: 94℃, 5분; denaturation: 94℃, 20초; annealing: 52℃, 20초; extension: 72℃, 20초로 구성하여 35회 반복하였다. 유전자 발현량을 비교하기 위해 Am-actin을 기준으로 하여 비텔로제닌 유전자를 정규화하였다 (Livak and Schmittgen, 2001).
4. 자료의 통계 분석
월동 중인 봉군들과 화분매개 중인 봉군들 각 그룹 간의 복부 내 지방체 비율과 비텔로제닌 발현량은 정규성과 등분산성을 충족하지 않아 Wilcoxon rank sum test를 통해 비교하였다. 각 처리 내 봉군 간에 나타나는 복부 내 지방체 비율 및 비텔로제닌 발현량의 차이는 정규성 검정 후 (Shapiro-Wilk test) 일원분산분석 (one-way ANOVA)을 통해 95% 유의 수준에서 분석하였다. 사후검정은 Duncan’s multiple range test를 통해 봉군 간 비교하였다. 모든 통계분석은 R studio 소프트웨어 (Version 4. 3. 2)를 사용 하였다.
결 과
1. 복부 내 지방체 비율 비교
월동 봉군에서 채집한 꿀벌의 복부 내 지방체 비율은 65±15.0%, 화분매개 봉군에서 채집한 꿀벌의 복부 내 지방체 비율은 55±13.6%로 그룹 간의 차이가 있는 것으로 나타났다 (Wilcoxon rank sum test, w=242, p<0.05).
각 봉군의 꿀벌 복부 내 지방체 비율은 W1번 봉군이 77±7.2%로 가장 높은 것으로 나타났으며, W3번 봉군 (63±15.9%), P1번 봉군 (57±4.8%) 순으로 봉군 간의 차이가 있는 것으로 나타났다 (one-way ANOVA, F=4.313, p<0.05).
2. 비텔로제닌 발현량 비교
월동 중인 꿀벌 봉군과 화분매개 중인 꿀벌 봉군에서 꿀벌을 채집하여 꿀벌의 건강과 수명의 지표인 비텔로제닌 발현량을 비교하였다. 월동 중인 꿀벌 그룹의 비텔로제닌 발현량은 화분매개 중인 꿀벌 그룹보다 통계적으로 유의미하게 높은 것으로 나타났다 (Wilcoxon rank sum test, w=1, p<0.05).
각 봉군들 간의 비텔로제닌 발현량은 월동 중인 봉군인 W1이 가장 높은 것으로 나타났고, W2와 W3 순으로 나타나 월동 중인 봉군들이 화분매개 중인 봉군들보다 통계적으로 유의미하게 높은 것으로 나타났다 (One-way ANOVA, F=18.36, p<0.05). 화분매개 중인 봉군들 (P1, P2, P3)은 유의미한 차이 없이 모두 낮은 발현 수준을 보였다.
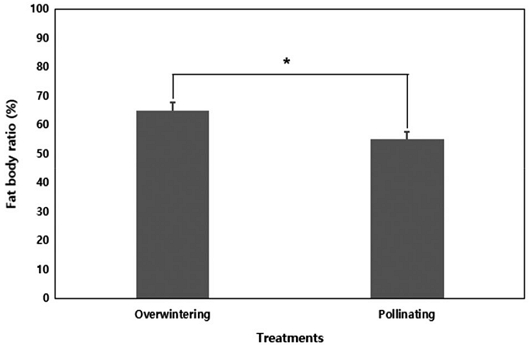
Comparison of abdomen fat body ratio (%, mean±SE)) of overwintering and pollinating honey bees in winter. Fat body ratio was measured from 3 colonies each (n = 3) with 10 individual bees dissected per colony. * indicates a significant difference between groups by Wilcoxon rank sum test with p = 0.05.
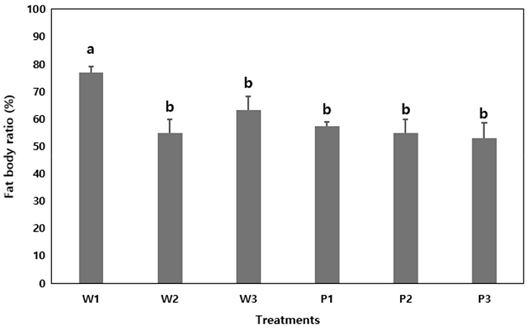
Abdomen fat body ratio (%, mean±SE) of overwintering (W1, W2, W3) and pollinating (P1, P2, P3) honey bees in winter. From each colony, 10 individual bees dissected. Different letters above the bars indicate statistically significant differences (p<0.05) based on Duncan’s multiple range test.
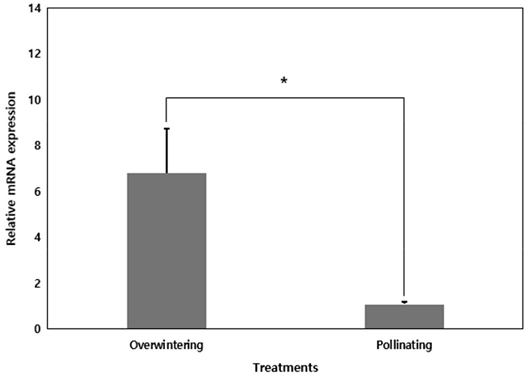
Relative vitellogenin (Vg) mRNA expression level (mean±SE) of overwintering and pollinating honey bees in winter. Fat body ratio was measured from 3 colonies each (n = 3) with 10 individual bees dissected per colony. * indicates a significant difference between groups by Wilcoxon rank sum test with p = 0.05.
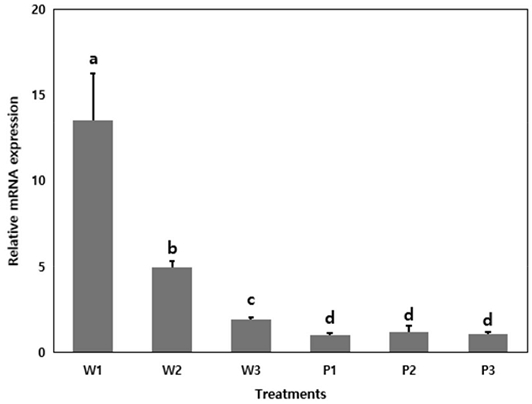
Relative vitellogenin (Vg) mRNA expression (mean±SE) of overwintering (W1, W2, W3) and pollinating (P1, P2, P3) honey bees in winter. From each colony, 10 individual bees dissected. Different letters above the bars indicate statistically significant differences (p<0.05) based on Duncan’s multiple range test.
고 찰
본 연구에서는 봉구를 형성하고 산란이 없이 월동 중인 봉군 내 꿀벌과 화분떡을 제공하여 산란권을 형성한 화분매개 중인 꿀벌의 생리적 지표 (지방체, 비텔로제닌)를 비교하였다. 복부 내 지방체 비율은 월동 중인 꿀벌에서 화분매개 중인 꿀벌보다 더 높게 나타났다. 비텔로제닌 발현량 역시 월동 중인 꿀벌에서 높게 나타났으며, 화분매개 집단과는 뚜렷한 차이를 보였다.
본 연구에서 추정한 각 봉군의 꿀벌 복부 내 지방체 비율은 53~77%로 상이하게 나타났다. 지방체의 비율 및 함량은 분석 시료의 연령, 봉군의 응애 감염 정도, 분석 시료의 채집 시기 및 먹이의 품질 등 다양한 요인에 의해 다르게 나타날 수 있다 (Wilson-Rich et al., 2008; Ramsey et al., 2019; Ricigliano and Simone-Finstrom, 2020; Jang et al., 2022; Knoll et al., 2024). 2022년 2월부터 2023년 1월까지 내역봉과 외역봉의 복부 내 지방체 비율 및 함량을 조사한 결과, 내역봉은 42±13% (13.2±6.7 mg), 외역봉은 29±20% (7.7±7.6 mg)으로 외역봉보다 내역봉에서 더 높게 나타났으며 11월에 가장 높은 것으로 나타났다 (Wilson-Rich et al., 2008; Knoll et al., 2024). 본 연구에서 수행된 채집 방법은 연령에 구분을 하지 않고 무작위 표본 추출법을 수행하였으므로 차이가 발생할 수 있다. 꿀벌응애 (Varroa destructor)는 꿀벌의 유충 및 성충을 직접 가해하고 혈림프가 아닌 지방체를 흡즙하기 때문에 꿀벌의 지방체가 적어져 면역, 해독 및 월동 생존에 부정적인 영향을 미칠 수 있다고 보고되었다 (Ramsey et al., 2019). 화분의 품질에 따라 12일령 꿀벌의 복부 내 지방체 비율이 다르게 나타나는 것으로 나타났다 (Jang et al., 2022). 따라서, 지방체는 다양한 요인에 의해 영향을 받을 수 있으며, 봉군 간 지방체를 비교하기 위해서는 다양한 요인에 대한 충분한 통제가 필요하다.
비텔로제닌 발현량은 월동 중인 꿀벌이 온실에서 화분매개 중인 꿀벌보다 더 높게 나타났다. 이는 여름벌보다 겨울벌의 비텔로제닌 발현량이 높다고 보고된 선행연구와 일치하는 결과이다 (Doke et al., 2015). 화분매개 꿀벌은 월동벌과 비슷한 시기에 생산되었더라도, 온실 조건에서 육아와 외역활동 등 여름벌로의 생리 전환이 이루어졌고, 그로 인해 비텔로제닌 발현량이 상대적으로 낮은 것으로 사료된다 (Jung and Bae, 2022). 월동 중인 모든 봉군들이 화분매개 중인 봉군보다 통계적으로 유의미하게 높은 것으로 나타났지만, 월동 중인 봉군들 간에 차이가 있는 것으로 나타났다. 꿀벌응애 감염이 높은 꿀벌의 난황단백질과 혈림프 단백질 양은 감염이 낮은 꿀벌보다 낮은 것으로 보고되어 있다 (Amdam et al., 2004). 화분의 품질에 따라 5일령된 꿀벌의 비텔로제닌의 발현량이 상이한 것으로 나타났다 (Jang et al., 2022). 네오니코티노이드 계열의 클로티아니딘 3 ng에 노출된 꿀벌의 비텔로제닌 발현량은 3배 증가하는 것으로 나타났다 (Christen et al., 2019). 비텔로제닌 또한 지방체와 마찬가지로 다양한 요인에 의해 발현 수준이 달라질 수 있으므로 실험에 주의가 필요하다.
두 결과를 종합해 보면, 꿀벌 복부 내 지방체 비율보다는 비텔로제닌 발현량이 월동벌과 육아와 먹이활동을 하는 벌의 생리적 상태를 파악하는 데 더 적합한 것으로 사료된다. 즉, 겨울철 월동 중인 꿀벌집단이라 하더라도 비텔로제닌 발현량을 통해 벌통 내부의 육아 등의 활동에 대한 생리적 변화의 추적뿐 아니라 겨울철 봉군 관리 전략을 마련하는 수단으로 사용될 수 있겠다. 추가적으로 어떤 꿀벌을 채집하여 표본집단으로 하였을 경우 이러한 생리지표와 생태적 반응의 관계를 적절하게 파악할 수 있은지 등에 관한 연구개발이 이루어진다면 겨울벌 관리 및 월동 폐사나 소멸 등의 위함을 관리하는 데 도움이 될 것이다.
적 요
꿀벌은 생리적·생태적 특성에 따라 수명이 짧은 여름벌과 수명이 5개월 이상인 겨울벌로 구분된다. 본 연구는 2024년 12월 야외에서 월동 중인 꿀벌과 딸기 온실 내에서 화분매개 활동을 하는 꿀벌의 복부 내 지방체 비율 및 비텔로제닌 발현 수준을 비교하였다. 각 환경에서 3개 봉군의 일벌을 무작위로 채집하여, 복부 내 지방체 비율은 Ethyl ether 추출법을 이용해 정량화하였고, 비텔로제닌 발현 수준은 qPCR을 통해 분석하였다. 복부 내 지방체 비율은 월동 중인 봉군과 화분매개 중인 봉군 간 유의미한 차이를 보였으나, 각 봉군 간 비교에서는 뚜렷한 경향을 확인할 수 없었다. 하지만, 비텔로제닌 발현 수준은 그룹 간 및 봉군 간 비교 모두 월동 중인 꿀벌이 화분매개 중인 꿀벌보다 유의미하게 높은 수준으로 나타났다. 이러한 결과를 바탕으로, 비텔로제닌 발현 수준은 꿀벌의 월동 상태를 판단하는 데 복부 내 지방체 비율보다 더 적절한 생리학적 지표로 판단된다. 본 연구는 겨울철 꿀벌의 월동 상태에서 채집 및 활동 상태로의 생리적 전환에 대한 통찰력을 제공한다
Acknowledgments
본 연구는 농촌진흥청 농업정책지원기술개발 사업 꿀벌 강건성 연구 과제 (이상기온 대응 꿀벌 스마트 관리 기술개발, RS-2023-00232847)의 지원으로 수행되었습니다.
References
-
Amdam, G. V., K. Hartfelder, K. Norberg, A. Hagen and S. W. Omholt. 2004. Altered physiology in worker honey bees (Hymenoptera: Apidae) infested with the mite Varroa destructor (Acari: Varroidae): a factor in colony loss during overwintering. J. Econ. Entomol. 97: 741-747.
[https://doi.org/10.1093/jee/97.3.741]

-
Arrese, E. L. and J. L. Soulages. 2010. Insect fat body: energy, metabolism, and regulation. Annu. Rev. Entomol. 55: 207-225.
[https://doi.org/10.1146/annurev-ento-112408-085356]

-
Aryal, S., S. Ghosh and C. Jung. 2020. Ecosystem services of honey bees; regulating, provisioning and cultural functions. J. Apic. 35(2): 119-128.
[https://doi.org/10.17519/apiculture.2020.06.35.2.119]

-
Bruckner, S., M. Wilson, D. Aurell, K. Rennich, D. vanEngelsdorp, N. Steinhauer and G. R. Williams. 2023. A national survey of managed honey bee colony losses in the USA: results from the Bee Informed Partnership for 2017-18, 2018-19, and 2019-20. J. Apic. Res. 62: 429-443.
[https://doi.org/10.1080/00218839.2022.2158586]

-
Christen, V., M. S. Vogel, T. Hettich and K. Fent. 2019. A vitellogenin antibody in honey bees (Apis mellifera): characterization and application as potential biomarker for insecticide exposure. Environ. Toxicol. Chem. 38(5): 1074-1083.
[https://doi.org/10.1002/etc.4383]

-
Clermont, A., M. Eickermann, F. Kraus, L. Hoffmann and M. Beyer. 2015. Correlations between land covers and honey bee colony losses in a country with industrialized and rural regions. Sci. Total Environ. 532: 1-13.
[https://doi.org/10.1016/j.scitotenv.2015.05.128]

-
Conte, Y. L. and M. Navajas. 2008. Climate change: impact on honey bee populations and diseases. Rev. Sci. Tech. 27(2): 499-510.
[https://doi.org/10.20506/rst.27.2.1819]

-
Corona, M., R. A. Velarde, S. Remolina, A. Moran-Lauter, Y. Wang, K. A. Hughes and G. E. Robinson. 2007. Vitellogenin, juvenile hormone, insulin signaling, and queen honey bee longevity. Proc. Natl. Acad. Sci. USA 104: 7128-7133.
[https://doi.org/10.1073/pnas.0701909104]

-
Desai, S. D. and R. W. Currie. 2015. Genetic diversity within honey bee colonies affects pathogen load and relative virus levels in honey bees, Apis mellifera L. Behav. Ecol. Sociobiol. 69: 1527-1541.
[https://doi.org/10.1007/s00265-015-1965-2]

-
Doke, M. A., M. Frazier and C. M. Grozinger. 2015. Overwintering honey bees biology and management. Curr. Opin. Insect Sci. 10: 185-193.
[https://doi.org/10.1016/j.cois.2015.05.014]

-
Fluri, P., M. Lüscher, H. Wille and L. Gerig. 1982. Changes in weight of the pharyngeal gland and haemolymph titres of juvenile hormone, protein and vitellogenin in worker honey bees. J. Insect Physiol. 28: 61-68.
[https://doi.org/10.1016/0022-1910(82)90023-3]

-
Garibaldi, L. A., F. Requier, O. Rollin and G. K. Andersson. 2017. Towards an integrated species and habitat management of crop pollination. Curr. Opin. Insect Sci. 21: 105-114.
[https://doi.org/10.1016/j.cois.2017.05.016]

-
Goulson, D., E. Nicholls, C. Botías and E. L. Rotheray. 2015. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science 347: 1255957.
[https://doi.org/10.1126/science.1255957]

-
Gray, A., N. Adjlane, A. Arab, A. Ballis, V. Brusbardis, A. Bugeja Douglas, L. Cadahía, J.-D. Charriere, R. Chlebo, M. F. Coffey, B. Cornelissen, C. A. D. Costa, E. Danneels, J. Danihlík, C. Dobrescu, G. Evans, M. Fedoriak, I. Forsythe, A. Gregorc, I. Ilieva Arakelyan, J. Johannesen, L. Kauko, P. Kristiansen, M. Martikkala, R. Martín-Hernández, E. Mazur, C. A. Medina-Flores, F. Mutinelli, E. M. Omar, S. Patalano, A. Raudmets, G. San Martin, V. Soroker, P. Stahlmann-Brown, J. Stevanovic, A. Uzunov, F. Vejsnaes, A. Williams and R. Brodschneider. 2023. Honey bee colony loss rates in 37 countries using the COLOSS survey for winter 2019-2020: the combined effects of operation size, migration and queen replacement. J. Apic. Res. 62: 204-210.
[https://doi.org/10.1080/00218839.2022.2113329]

-
Henry, M., M. A. Becher, J. L. Osborne, P. J. Kennedy, P. Aupinel, V. Bretagnolle, F. Brun, V. Grimm, J. Horn and F. Requier. 2017. Predictive systems models can help elucidate bee declines driven by multiple combined stressors. Apidologie 48: 328-339.
[https://doi.org/10.1007/s13592-016-0476-0]

- Hong, D. and C. Jung. 2024. Evaluation of The Susceptibility of Several Insecticides to Honey Bee Pest, Vespa velutina nigrithorax (Hymenoptera: Vespidae). Korean J. Appl. Entomol. 63(1), 13-23.
-
Huang, Z. Y. and G. E. Robinson. 1995. Seasonal changes in juvenile hormone titers and rates of biosynthesis in honey bees. J. Comp. Physiol. B 165: 18-28.
[https://doi.org/10.1007/BF00264682]

-
Insolia, L., R. Molinari, S. R. Rogers, G. R. Williams, F. Chiaromonte and M. Calovi. 2022. Honey bee colony loss linked to parasites, pesticides and extreme weather across the United States. Sci. Rep. 12: 20787.
[https://doi.org/10.1038/s41598-022-24946-4]

-
Jang, H., S. Ghosh, S. Sun, K. J. Cheon, S. Mohamadzade Namin and C. Jung. 2022. Chlorella-supplemented diet improves the health of honey bee (Apis mellifera). Front. Ecol. Evol. 10: 922741.
[https://doi.org/10.3389/fevo.2022.922741]

-
Jeong, S., C. Lee, D. Kim and C. Jung. 2016. Questionnaire study on the overwintering success and pest management of honeybee and damage assessment of Vespa hornets in Korea. Korean J. Apic. 31(3).
[https://doi.org/10.17519/apiculture.2016.09.31.3.201]

- Jung, C. 2008. Economic value of honeybee pollination on major fruit and vegetable crops in Korea. Korean J. Apic. 23(2): 147-152.
- Jung, C. and J. H. Shin. 2022. Evaluation of crop production increase through Insect Pollination Service in Korean Agriculture. Korean J. Appl. Entomol. 61(1): 229-238.
-
Jung, C. and Y. H. Bae. 2022. Production and characteristics of winter generation honey bees, Apis mellifera: Discussion with overwintering failure. Korean J. Apic. 37(3): 265-274.
[https://doi.org/10.17519/apiculture.2022.09.37.3.265]

-
Kang, Y., S. H. Kwon and C. Jung. 2024. Correlation Analysis between Honeybee Pest Occurrences and Winter Failure Based on the Questionnaire from Beekeepers in Korea. Korean J. Apic. 39(3): 185-193.
[https://doi.org/10.17519/apiculture.2024.09.39.3.185]

-
Kang, Y., T. Begna, D. H. Lee, M. J. Kim, J. Kim and C. Jung. 2023. Risk Assessment for Honeybees in Pesticide Spraying by Multicopter Assuming Aerial Application. Korean J. Apic. 38(3): 233-241.
[https://doi.org/10.17519/apiculture.2023.09.38.3.233]

-
Keller, I., P. Fluri and P. A. Imdorf. 2005. Pollen nutrition and colony development in honey bees: part I. Bee World 86: 3-10.
[https://doi.org/10.1080/0005772X.2005.11099641]

-
Kim, H. K. 2022. The effect of honey bee mites on the winter colony losses. Korean J. Apic. 37(3): 291-299.
[https://doi.org/10.17519/apiculture.2022.09.37.3.291]

-
Kim, Y. H. and S. K. Lee. 2022. Current status of fluvalinate resistance in Varroa destructor in Korea and suggestion for possible solution. Korean J. Apic. 37(3): 301-313.
[https://doi.org/10.17519/apiculture.2022.09.37.3.301]

-
Knoll, S., V. Fadda, F. Ahmed and M. G. Cappai. 2024. The nutritional year-cycle of Italian honey bees (Apis mellifera ligustica) in a southern temperate climate. Agric. 14(5): 730.
[https://doi.org/10.3390/agriculture14050730]

-
Kuchling, S., I. Kopacka, E. Kalcher-Sommersguter, M. Schwarz, K. Crailsheim and R. Brodschneider. 2018. Investigating the role of landscape composition on honey bee colony winter mortality: a long-term analysis. Sci. Rep. 8: 12263.
[https://doi.org/10.1038/s41598-018-30891-y]

-
Laurino, D., S. Lioy, L. Carisio, A. Manino and M. Porporato. 2020. Vespa velutina: an alien driver of honey bee colony losses. Diversity 12: 5.
[https://doi.org/10.3390/d12010005]

-
Lee, S. J., S. H. Kim, J. Y. Lee, J. H. Kang, S. M. Lee, H. J. Park and C. Jung. 2022. Impact of ambient temperature variability on the overwintering failure of honeybees in South Korea. Korean J. Apic. 37 (3): 331-347.
[https://doi.org/10.17519/apiculture.2022.09.37.3.331]

-
Livak, K. J. and T. D. Schmittgen. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods 25(4): 402-408.
[https://doi.org/10.1006/meth.2001.1262]

-
Martins, G. F., J. E. Serrão, J. M. Ramalho-Ortigão and P. F. P. Pimenta. 2011. A comparative study of fat body morphology in five mosquito species. Mem. Inst. Oswaldo Cruz 106: 742-747.
[https://doi.org/10.1590/S0074-02762011000600015]

-
Mattila, H. R., J. L. Harris and G. W. Otis. 2001. Timing of production of winter bees in honey bee (Apis mellifera) colonies. Insectes Soc. 48: 88-93.
[https://doi.org/10.1007/PL00001764]

-
Minaud, E., F. Rebaudo, G. Mainardi, P. Vardakas, F. Hatjina, I. Steffan-Dewenter and F. Requier. 2024. Temperature in overwintering honey bee colonies reveals brood status and predicts colony mortality. Ecol. Indic. 169: 112961.
[https://doi.org/10.1016/j.ecolind.2024.112961]

-
Oh, H., T. Begna and C. Jung. 2024. Evaluating the Efficacy of Registered Acaricides on Varroa destructor and Tropilaelaps mercedesae, in Apis mellifera Colonies. Korean J. Apic. 39(1): 21-30.
[https://doi.org/10.17519/apiculture.2024.04.39.1.21]

-
Overturf, K. A., N. Steinhauer, R. Molinari, M. E. Wilson, A. C. Watt, R. M. Cross, D. vanEngelsdorp, G. R. Williams and S. R. Rogers. 2022. Winter weather predicts honey bee colony loss at the national scale. Ecol. Indic. 145: 109709.
[https://doi.org/10.1016/j.ecolind.2022.109709]

-
Papa, G., R. Maier, A. Durazzo, M. Lucarini, I. K. Karabagias, M. Plutino, E. Bianchetto, R. Aromolo, G. Pignatti, A. Ambrogio, M. Pellecchia and I. Negri. 2022. The honey bee Apis mellifera: An insect at the interface between human and ecosystem health. Biology 11(2): 233.
[https://doi.org/10.3390/biology11020233]

-
Potts, S. G., J. C. Biesmeijer, C. Kremen, P. Neumann, O. Schweiger and W. E. Kunin. 2010. Global pollinator declines: trends, impacts and drivers. Trends Ecol. Evol. 25: 345-353.
[https://doi.org/10.1016/j.tree.2010.01.007]

-
Ramsey, S.D., R. Ochoa, G. Bauchan, C. Gulbronson, J.D. Mowery, A. Cohen and et al. 2019. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proc. Natl. Acad. Sci. U.S.A. 116 (5): 1792-1801.
[https://doi.org/10.1073/pnas.1818371116]

-
Requier, F., J.-F. Odoux, M. Henry and V. Bretagnolle. 2017. The carry-over effects of pollen shortage decrease the survival of honeybee colonies in farmlands. J. Appl. Ecol. 54: 1161-1170.
[https://doi.org/10.1111/1365-2664.12836]

-
Requier, F., Q. Rome, G. Chiron, D. Decante, S. Marion, M. Menard, F. Muller, C. Villemant and M. Henry. 2019. Predation of the invasive Asian hornet affects foraging activity and survival probability of honey bees in Western Europe. J. Pest Sci. 92: 567-578.
[https://doi.org/10.1007/s10340-018-1063-0]

-
Requier, F., M. S. Leyton, C. L. Morales, L. A. Garibaldi, A. Giacobino, M. P. Porrini, J. M. Rosso-Londono, R. A. Velarde, A. Aignasse, P. Aldea-Sanchez, M. L. Allasino, D. Arredondo, C. Audisio, N. B. Cagnolo, M. Basualdo, B. Branchiccela, R. A. Calderon, L. Castelli, D. Castilhos, F. C. Escareno, A. Correa-Benítez, F. O. D. Silva, D. S. Garnica, G. De Groot, A. Delgado-Canedo, H. Fernandez-Marín, B. M. Freitas, A. G. Cardona, N. Garcia, P. M. Garrido, T. Giray, L. S. Gonçalves, L. Landi, D. M. Gonçalves, S. Martinez, P. J. Moja, A. Molineri, P. F. Müller, E. Nogueira, A. Pacini, M. A. Palacio, G. N. Parra, A. Parra-H, K. P. Gramacho, E. Pérez, C. S. S. Pires, F. J. Reynaldi, A. R. Luis, C. Rossini, M. S. Armijos, E. Santos, A. Scannapieco, Y. M. Spina, J. M. T. González, A. M. V. Fernandez, C. A. Y. García, B. F. Viana, L. Vieli and K. Antúnez. 2024. First large-scale study reveals important losses of honey bee and stingless bee colonies in Latin America. Sci. Rep. 14: 1-15.
[https://doi.org/10.1038/s41598-024-59513-6]

-
Ricigliano, V. A. and M. Simone-Finstrom. 2020. Nutritional and prebiotic efficacy of the microalga Arthrospira platensis (spirulina) in honey bees. Apidologie 51(5): 898-910.
[https://doi.org/10.1007/s13592-020-00770-5]

-
Ruttner, F. 1988. Biogeography and taxonomy of honeybees. Springer-Verlag Berlin Heidelberg GmbH. 288.
[https://doi.org/10.1007/978-3-642-72649-1]

-
Seehuus, S. C., K. Norberg, U. Gimsa, T. Krekling and G. V. Amdam. 2006. Reproductive protein protects functionally sterile honey bee workers from oxidative stress. Proceedings of the National Academy of Sciences 103(4): 962-967.
[https://doi.org/10.1073/pnas.0502681103]

-
Steinhauer, N., K. Kulhanek, K. Antúnez, H. Human, P. Chantawannakul, M.-P. Chauzat and D. vanEngelsdorp. 2018. Drivers of colony losses. Curr. Opin. Insect Sci. 26: 142-148.
[https://doi.org/10.1016/j.cois.2018.02.004]

-
Switanek, M., K. Crailsheim, H. Truhetz and R. Brodschneider. 2017. Modelling seasonal effects of temperature and precipitation on honey bee winter mortality in a temperate climate. Sci. Total Environ. 579: 1581-1587.
[https://doi.org/10.1016/j.scitotenv.2016.11.178]

-
Ulziibayar, D. and C. Jung. 2019. Comparison of acute toxicity of different groups of pesticides to honey bee workers (Apis mellifera L.). Korea J. Apic. 34(4), 305-313.
[https://doi.org/10.17519/apiculture.2019.11.34.4.305]

-
Van Der Zee, R., A. Gray, L. Pisa and T. De Rijk. 2015. An observational study of honey bee colony winter losses and their association with Varroa destructor, neonicotinoids and other risk factors. PLoS ONE 10: e0131611.
[https://doi.org/10.1371/journal.pone.0131611]

-
van Dooremalen, C., L. Gerritsen, B. Cornelissen, J. J. M. van der Steen, F. van Langevelde and T. Blacquiere. 2012. Winter survival of individual honey bees and honey bee colonies depends on level of Varroa destructor infestation. PLoS ONE 7: e36285.
[https://doi.org/10.1371/journal.pone.0036285]

-
Wilson-Rich, N., S. T. Dres and P. T. Starks 2008. The ontogeny of immunity: Development of innate immune strength in the honey bee (Apis mellifera). J. Insect Physiol. 54: 1392-1399.
[https://doi.org/10.1016/j.jinsphys.2008.07.016]

- Winston, M. L. 1987. The biology of the honey bee. Harvard University Press, Cambridge, Mass.