아까시꿀 내 혼입 화분과 국내 지역별 양봉장 주변의 밀원식물 간의 화분 형태 비교
Abstract
This study aimed to analyze the morphological characteristics of pollen grains mixed into Robinia honey collected from 17 regions across South Korea, and to compare them with pollen collected from nearby nectar plants. The number of pollen types identified in the honey samples ranged from 12 to 31 depending on the region, with several regions showing the presence of specific pollen morphotypes. Most samples included commonly observed rounded, triangular, or elongated pollen shapes, while saccate and irregular-surfaced types appeared only in limited areas. Although some morphological similarities were observed between the pollen found in honey and those collected from surrounding nectar plants, perfect correspondence was not confirmed. These results suggest that the mixed pollen composition may reflect not only local floral sources but also the wide foraging range of honeybees and the influence of migratory beekeeping practices. This study presents a morphology-based comparison of mixed and local floral pollen, providing a reference for understanding regional patterns in the pollen composition of Korean Robinia honey.
Keywords:
Robinia honey, Mixed pollen, Pollen morphology, Nectar plant comparison서 론
벌꿀은 전 세계적으로 천연 감미료로 활용되며, 다양한 생리활성 기능이 있어 건강기능 식품으로 널리 소비되고 있다 (El Sohaimy et al., 2015; Miguel et al., 2017). 꿀의 화학적 조성은 밀원식물의 종류와 지역적 특성에 따라 달라지며, 이는 꿀의 맛, 향, 영양 성분 등에 영향을 미친다 (정, 1979; Jiang et al., 2024). 이와 관련하여 화분 분석 (Melissopalynology)은 꿀에 포함된 화분의 형태와 분포 특성을 관찰하여 밀원 식물 구성의 경향을 이해하는 데 유용한 방법으로 활용되고 있다 (Von Der Ohe et al., 2004; Louveaux et al., 2015; Shakoori et al., 2023). 여러 국가에서는 꿀 내에 혼입되어있는 화분을 분석함으로써 특정 식물 화분의 특징을 정리하고 꿀의 특성과의 연관성을 규명하고자 하였다. 예를 들어, 뉴질랜드에서는 마누카 화분 함량을 기준으로 단일꿀을 정의하였으며 (Moar, 1985), 호주, 에티오피아, 이집트 등에서도 화분 형태에 기반한 다양한 꿀 연구가 수행되었다 (Kale Sniderman et al., 2018; El-Sofany et al., 2020; Hussein and Ail., 2024).
반면 국내에서는 꿀에 혼입된 화분의 형태적 특성을 관찰하고, 주변 밀원식물 화분과의 형태를 비교한 연구는 제한적이다. 꿀벌은 채집 반경 내 다양한 밀원식물을 방문하기 때문에 단일 꿀이라도 여러 식물의 화분이 혼입될 수 있다. 특히, 국내 양봉 형태가 이동 양봉이 다수임을 고려할 때 벌꿀에는 다양한 밀원식물의 화분이 포함될 수 있지만, 이에 관한 연구는 한정적이다. 이에 본 연구에서는 국내 17개 지역의 양봉장에서 수집한 아까시꿀을 대상으로 혼입된 화분의 형태를 관찰하고, 양봉장 밀원식물 화분과 비교함으로써, 지역 간 화분 구성과 형태적 유사성을 비교하고자 하였다.
재료 및 방법
1. 시료 수집
본 연구는 국내 17개 지역의 45개 양봉장에서 해당 지역에서만 생산된 아까시꿀을 수집하였으며, 실험은 45개의 아까시꿀 중에서 같은 지역에서 생산된 꿀은 동일한 비율로 혼합하여 전처리 후 사용했다. 또한 해당 농가 주변 밀원식물을 조사하고 초본류만을 대상으로 38종을 채집하여 화분의 형태 분석에 사용했다.
2. 아까시꿀 내 혼입 화분 전처리법
꿀 내에 존재하는 화분을 분리하고 화분의 형태를 명확하게 관찰하기 위하여 전처리 과정을 진행했다. 아까시꿀 100 g에 증류수 (D.W.) 400 mL를 첨가하여 혼합한 뒤, 냉장 대용량 원심분리기 (Combi-514R, Hanil, Gangwon, Korea)를 이용하여 3,500 rpm에서 원심분리하였다. 이후 상층액을 제거하고, 침전된 펠릿 (화분)을 시료로 사용하였다. 전처리 방법은 가라앉은 펠릿을 화학적 처리 없이 그대로 사용한 방법과, 아세트산 (Sigma-Aldrich, MO, USA) 0.5 mL를 넣고 볼텍싱 (vortexing)으로 처리한 뒤 원심분리 (Minispin® Plus, Eppendorf, Hamm, Germany)하여 상층액 제거 후 증류수로 3회 세척한 방법 두 가지를 비교했다 (Kale Sniderman et al., 2012).
3. 아까시꿀 내 혼입 화분 광학현미경 분석
전처리된 펠릿에서 상층액을 제거한 후, 70% 글리세롤 (GenDEPOT, TX, USA)을 첨가하여 혼합하였다. 이후 해당 시료를 IN CYTO C-Chip (Chungnam, Korea)에 샘플링하여 광학현미경 (EVOSTM XL Core, Thermo Fisher Scientific, WA, USA)으로 40배 배율로 화분 형태를 관찰하였다.
4. 밀원별 화분 형태 분석
양봉장 주변에서 채집한 밀원식물의 수술 및 암술을 5 mL Micro tube에 소분한 뒤, 증류수 1 mL를 첨가하여 볼텍싱하였다. 이를 통해 식물체에 부착된 화분을 부유시킨 후, 식물 조직을 제거하였다. 부유액을 원심분리하여 상층액을 제거하고, 증류수로 3회 세척하였다. 이후 70% 글리세롤을 첨가하고 IN CYTO C-Chip에 샘플링하여 광학현미경 (40배 배율)으로 화분 형태를 관찰하였다.
채집한 밀원식물은 동결건조기 (LYOPH-PRODE LP20, Ilshinbiobase, Gyeonggi, Korea)를 사용하여 48시간 동안 건조시켰다. 건조된 시료는 실체현미경 (Nikon SMZ645, Nikon Instruments Inc., Tokyo, Japan)을 이용하여 화분이 부착된 부위를 선별하였고, 이를 주사전자현미경용 시료대의 카본 테이프에 부착하였다. 이후 스퍼터 코터 (Quorum SC7620, Quorum, East Sussex, England)를 사용하여 15초간 3회에 걸쳐 백금 코팅한 후, 주사전자현미경 (Carl Zeiss Geminisem 300, Zeiss, Jena, Germany)을 이용해 화분 형태를 관찰하였다.
주사전자현미경과 광학현미경으로 관찰한 화분의 형태는 기존 연구 문헌 (박 등, 2015; Koen et al., 2020; Kostryco et al., 2020; Raine et al., 2022)을 참고하여 분석하였다.
결과 및 고찰
1. 아까시꿀 채밀 지역 양봉장 생태조사
해당 지역에서 아까시꿀을 채밀하는 양봉장에서 아까시꿀을 수집하고, 각 양봉장 인근에서 자생하는 밀원식물의 목록을 조사하였다 (Fig. 1, Table 1). 각 지역에서는 6종 내외의 식물이 조사되었으며, 일부 지역에서는 10종 이상이 확인되었다. 반복적으로 양봉장에서 발견된 식물로는 C. majus (애기똥풀), R. multiflora (찔레), H. lyrata (지칭개), V. sativa (살갈퀴) 등 이었으며, 이들은 다수 지역에서 공통적으로 확인되었다.
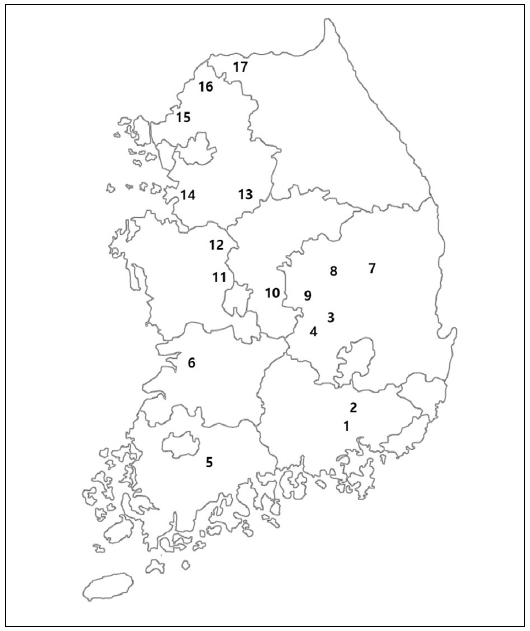
Geographic locations of Robinia honey collection sites across 17 regions in Korea; 1. Haman; 2. Changnyeong; 3. Gumi; 4. Gimcheon; 5. Hwasun; 6. Gimje; 7. Andong; 8. Yecheon; 9. Sangju; 10. Boeun; 11. Sejong; 12. Cheonan; 13. Icheon; 14. Hwaseong; 15. Paju; 16. Yeoncheon; 17. Cheorwon.
2. 아까시꿀 내 혼입 화분 전처리
수집된 아까시꿀 시료는 거름망을 거치지 않은 상태로 채밀되어, 화분 외에도 밀랍, 벌 사체 등의 다양한 입자성 불순물을 포함하고 있었다. 이에 따라 광학현미경을 이용해 관찰하기 전, 시료 내 불순물 제거를 위한 전처리 과정을 실시하였다. 전처리는 증류수 희석 및 원심분리 과정을 기반으로 하였으며, 일부 시료에는 0.5 mL의 아세트산을 추가하여 볼텍싱 (Vortexing) 처리한 뒤 동일한 조건으로 세척하였다. 두 가지 조건의 시료를 비교한 결과, 아세트산을 처리한 시료에서 불순물이 제거되어 화분의 형태가 잘 관찰되었다 (Fig. 2).
3. 밀원 식물별 화분 유형
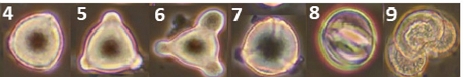
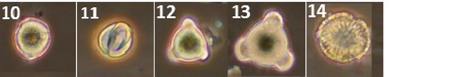
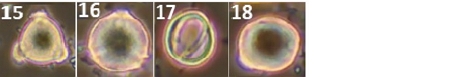
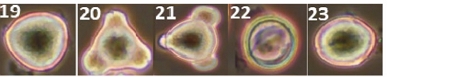
양봉장 주변에서 채집한 밀원식물 중 총 38종에서 화분 형태를 관찰할 수 있었다 (Figs. 3, 1~38). 화분 형태 분석 결과, 대부분의 화분이 단립형 (Monad)이었으며, 철쭉의 경우 유일하게 사립형 (Tetrad) 화분 형태 (Figs. 3, 25)를 보였다. 삼구형 (Tricolpate) 화분은 개불알풀, 꽃양귀비, 냉이, 돌양지꽃, 멍석딸기, 물별이끼, 분홍바늘꽃, 뻐꾹채, 산괴불주머니, 산딸기, 살갈퀴, 수리딸기, 신나무, 아까시, 애기똥풀, 유럽전호, 족제비싸리, 지느러미엉겅퀴, 찔레, 콩다닥냉이, 토끼풀 등에서 관찰되었다. 이들 화분은 적도면과 극축면에 따라 다양한 형태로 관찰되었으나, 대부분 긴구형 (Colpate)의 발아구가 세 개 있는 삼구형 구조를 가지고 있었다. 산공형 (Pantoporate) 화분은 개꽃마리와 패랭이꽃에서 확인되었으며, 이들 화분은 둥근 공형 (Porate)의 발아구가 꽃가루 전체에 균일하게 분포하는 특징을 보였다. 로페이트형 (Lophate) 화분은 고들빼기, 민들레, 방가지똥, 서양민들레, 씀바귀에서 관찰되었으며, 이들 화분은 뾰족한 돌기 사이에 함몰된 발아구가 무작위로 분포하는 형태를 나타냈다. 그 외에 금계국, 데이지, 불란서국화, 지칭개는 표면이 뾰족한 돌기 형태로 둘러싸여 있었으며, 붉은병꽃나무의 경우 매우 작은 가시 형태의 돌기를 포함하고 있었다. 이 화분들은 발아구가 광학현미경상으로 명확히 관찰되지는 않았으나, 불란서국화처럼 단공형 (Uniporate)이거나 발아구가 없는 무공형 (Aporate) 화분일 가능성이 있다.

Pollen morphology of collected nectar plants observed via SEM and light microscopy. 1~38. Scanning electron microscopy; (1)~(38), Light microscopy; 1. Acer ginnala (신나무); 2. Amorpha fruticosa (족제비싸리); 3. Anthriscus caucalis (유럽전호); 4. Bellis perennis (데이지); 5. Callitriche palustris (물별이끼); 6. Capsella bursa-pastoris (냉이); 7. Carduus crispus (지느러미엉겅퀴); 8. Chelidonium majus (애기똥풀); 9. Chrysanthemum leucanthemum (불란서국화); 10. Coreopsis basalis (금계국); 11. Corydalis speciosa (산괴불주머니); 12. Crepidiastrum sonchifolium (고들빼기); 13. Dianthus chinensis (패랭이꽃); 14. Erigeron philadelphicus (봄망초); 15. Hemistepta lyrata (지칭개); 16. Indigofera kirilowii (땅비싸리); 17. Ixeridium dentatum (씀바귀); 18. Lepidium virginicum (콩다닥냉이); 19. Mazus pumilus (주름잎꽃); 20. Myosotis laxa (개꽃마리); 21. Myosoton aquaticum (쇠별꽃); 22. Papaver nudicaule (꽃양귀비); 23. Potentilla dickinsii (돌양지꽃); 24. Rhaponticum uniflorum (뻐꾹채); 25. Rhododendron schlippenbachii (철쭉); 26. Robinia pseudoacacia (아까시); 27. Rosa multiflora (찔레); 28. Rubus corchorifolius (수리딸기); 29. Rubus crataegifolius (산딸기); 30. Rubus parvifolius (멍석딸기); 31. Sonchus oleraceus (방가지똥); 32. Strobilanthes oliganthus (분홍방울꽃); 33. Taraxacum mongolicum (민들레); 34. Taraxacum officinale (서양민들 레); 35. Trifolium repens (토끼풀); 36. Veronica polita (개불알풀); 37. Vicia sativa (살갈퀴); 38. Weigela florida (붉은병꽃나무).
4. 아까시꿀내 혼입 화분 유형 분석
국내 17개 지역에서 수집한 아까시꿀 시료의 혼입 화분을 분석한 결과, 지역별로 관찰된 식물 종의 수는 12종에서 31종까지 다양하게 나타났다 (Fig. 4).

Morphological comparision of pollen from C. majus and R. pseudoacacia in Robinia honey (SEM; Scanning electron microscope, LM; Light microscope).
구체적으로는 구미 (31종), 상주 (29종), 함안 (24종), 화순 (22종), 김천 (20종), 이천·파주 (20종), 세종 (21종), 김제·보은·천안 (17종), 안동·연천 (14종), 화성 (13종), 창녕 (12종) 순으로 확인되었다 (Table 2; Number of pollen type). 모든 시료에서 삼구형 (tricolpate) 화분이 공통적으로 관찰되었으며, 이 중 일부는 극축면에서 발아구가 덜 발달된 둥근 형태 (Table 2, Common pollen; 1, 4, 7, 10, 16, 19, 27, 28, 29, 32), 혹은 삼각형 형태로 발아구가 선명히 드러나는 구조 (Table 2, Common pollen; 5, 6, 12, 13, 15, 20, 21, 24, 29, 33), 또는 적도면 관찰되어 긴구형의 발아구가 나타나는 형태 (Table 2, Common pollen; 3, 8, 11, 17, 22, 25, 30, 34)로 세분화되었다. 같은 삼구형 구조 내에서도 관찰면과 발아구 형태에 따라 세부적인 차이를 보였다. 또한 특정 화분이 지역 특이적으로만 출현하는 것이 일부 관찰되었다. 예를 들어, 공기주머니가 부착된 타원형 화분 (Table 2, Common pollen; 9)은 구미와 김천에서만 관찰되었고, 표면이 울퉁불퉁한 삼구형 화분 (Table 2, Common pollen; 14)은 화순과 김제에서 확인되었다.
5. 아까시꿀 내 혼입 화분과 밀원식물 화분의 형태 비교 분석
아까시꿀 내 혼입 화분과 양봉장 주변에서 채집한 밀원식물 화분 간의 형태를 비교한 결과, 일부 시료에서는 형태적 유사성이 관찰되었다. 특히 C. majus (애기똥풀) 및 R. pseudoacacia (아까시)로 추정되는 화분은 꿀 시료와 밀원 시료 모두에서 반복적으로 확인되었으며 (Fig. 4), 이는 밀원 식생이 혼입 화분 구성에 일정 부분 영향을 미쳤음을 보여준다.
반면, 여러 지역 시료에서는 밀원 시료와 일치하지 않는 혼입 화분이 관찰되었으며, 공통적으로 출현한 화분 중 일부는 주변 식생에서 확인되지 않았다. 명확히 특정 지역 고유로 분류되는 형태는 제한적이었다. 이러한 경향은 꿀벌의 넓은 채집 반경, 채밀 시기, 지역 식생 구성 등의 복합적인 요인에 의해 영향을 받은 것으로 보인다 (Steffan-Dewenter and Kuhn, 2003).
실제로 꿀벌은 반경 1.5~1.7 km 이상의 채집 범위 내에서 다양한 자원을 수집하며, 이러한 특성은 시료 간 화분 구성의 차이에 영향을 줄 수 있다. 또한 국내 아까시꿀 생산은 개화 시기에 맞춘 이동 양봉 방식으로 이루어지는 경우가 많아, 동일한 채밀 경로를 따라 채집된 시료 간에는 특정 화분 형태가 반복적으로 혼입되는 경향도 확인되었다 (Kang et al., 2017).
이와 같은 결과는 일부 시료에서 지역 식생이 혼입 화분 구성에 반영되었음을 보여주는 동시에, 이동 양봉 구조와 꿀벌의 채집 행동이 혼입 화분 구성에 영향을 미친다는 점을 시사한다. 특히, 반복 출현하는 특정 화분은 주요 밀원 자원을 간접적으로 추정할 수 있는 단서가 될 수 있으며, 이러한 분석은 지역 간 채밀 환경의 특성을 파악하는 기초 자료로 활용될 수 있다 (Beekman and Ratnieks, 2000).
적 요
본 연구는 국내 17개 지역에서 수집된 아까시꿀을 대상으로 혼입 화분의 형태를 분석하고, 지역 간 구성의 차이와 밀원식물과의 형태 유사성을 비교하였다. 분석 결과, 혼입 화분의 수는 지역별로 12종에서 31종까지 다양하게 나타났으며, 삼구형 화분이 모든 시료에서 공통적으로 관찰되었다.
삼구형 화분은 관찰 방향과 발아구의 형태에 따라 아형으로 분류되었으며, 각 아형의 비율은 지역 간에 상이하였다. 본 연구를 통하여 혼입 화분을 순수 형태학적 기준으로 관찰하여 지역 간 경향성을 비교한 분석으로, 아까시꿀의 특성에 대한 기초 자료를 제공하였다. 다만 형태학적 관찰만으로는 화분의 기원을 정확히 특정하는 데 한계가 있으므로, 향후에는 분자 마커 기반의 유전자 분석 기법을 병행 (Kress et al., 2005)하여 더 정밀한 화분 동정과 기원 확인이 이루어질 수 있도록 보완 연구가 필요 하다.
Acknowledgments
본 연구는 농촌진흥청사업 (과제번호: PJ01745701)에 의하여 수행된 것으로 이에 감사드립니다.
References
- 박찬호, 정은희, 김선유, 홍석표, 문혜경, 송준호, 공민정. 2015. 한반도 알레르기 유발 꽃가루 가이드북. 4-167. 환경부 국립생물자원관. 인천광역시.
- 정동효. 1979. 벌꿀의 특성과 그 이용. Food Industry 50: 34-38.
-
Beekman, M. and F. L. W. Ratnieks. 2000. Long-range foraging by the honey-bee, Apis mellifera L. Funct. Ecol. 14: 490-496.
[https://doi.org/10.1046/j.1365-2435.2000.00443.x]

-
El-Sohaimy, S. A., S. H. D. Masry and M. G. Shehata. 2015. Physicochemical characteristics of honey from different origins. Ann. Agric. Sci. 60: 279-287.
[https://doi.org/10.1016/j.aoas.2015.10.015]

-
El-Sofany, A., Y. A. Naggear, E. Naiem, J. P. Giesy and A. Sief. 2020. Authentication of the botanical and geographic origin of Egyptian honey using pollen analysis methods. J. Apic. Res. 59: 946-955.
[https://doi.org/10.1080/00218839.2020.1720950]

-
Hussein, O. and S. Ail. 2024. Botanical origins of honeys from pollen analysis during the main honey flow across agro-ecologies in kelala district, South Wollo, Ethiopia. Heliyon 10: e40101.
[https://doi.org/10.1016/j.heliyon.2024.e40101]

-
Jiang, W., M. Battesti, Y. Yang, É. Jean-Marie, J. Costa, D. Béreau, J. Paolini and J. Robinson. 2024. Melissopalynological analysis of honey from French Guiana. Foods 13: 1073.
[https://doi.org/10.3390/foods13071073]

-
Kale Sniderman, J. M., K. A. Matley, S. G. Haberle and D. J. Cantrill. 2018. Pollen analysis of Australian honey. PLoS One 15: e0197545.
[https://doi.org/10.1371/journal.pone.0197545]

-
Kang, D. Y., A. Seol, J. C. Oh, Y. K. Jung, H. Han and J. S. Chung. 2017. Analyzing the management characteristics of beekeeping households according to their beekeeping types. J. Apic. 32: 1-9.
[https://doi.org/10.17519/apiculture.2017.04.32.1.1]

-
Koen, J., M. M. Slabbert, M. Booyse and C. Bester. 2020. Honeybush (Cyclopia spp.) pollen viability and surface morphology. S. Afr. J. Bot. 128: 167-173.
[https://doi.org/10.1016/j.sajb.2019.11.004]

-
Kostryco, M., M. Chwil and R. Matraszek-Gawron. 2020. Comparison of the micromorphology and ultrastructure of pollen grains of selected Rubus idaeus L. cultivars grown in commercial plantation. Plants 9: 1194.
[https://doi.org/10.3390/plants9091194]

-
Kress, W. J., K. J. Wurdack, E. A. Zimmer, L. A. Weigt and D. H. Janzen. 2005. Use of DNA barcodes to identify flowering plants. Proc. Natl. Acad. Sci. U S A 102: 8369-8374
[https://doi.org/10.1073/pnas.0503123102]

-
Louveaux, J., A. Maurizio and G. Vorwohl. 2015. Methods of melissopalynology. Bee World 59: 139-157.
[https://doi.org/10.1080/0005772X.1978.11097714]

-
Miguel, M. G., M. D. Antunes and M. L. Faleiro. 2017. Honey as a Complementary Medicine. Integr. Med. Insights. 12: 1178633717702869.
[https://doi.org/10.1177/1178633717702869]

-
Moar, N. T. 1985. Pollen anaysis of New Zealand honey. N. Z. J. Agric. Res. 25: 39-70.
[https://doi.org/10.1080/00288233.1985.10426997]

- Raine, J. I., X. Li and L. Newstrom-Lloyd. 2022. New Zealand bee pollen data base. GNS Science https://keys.landcareresearch.co.nz/nzbeepollen/key/nzbeepollen/media/NZBPkey.htm#linkintro
-
Shakoori, Z., A. Mehrabian, D. Minai, F. Salmanpour and F. Khajoei Nasab. 2023. Assessing the quality of bee honey on the basis of melissopalynology as well as chemical analysis. PLos One 18: e0289702.
[https://doi.org/10.1371/journal.pone.0289702]

-
Staffan-Dewenter, I. and A. Kuhn. 2003. Honeybee foraging in differentially structured landscapes. Proc. Biol. Sci. 270: 567-575.
[https://doi.org/10.1098/rspb.2002.2292]

-
Von Der Ohe, W., L. P. Oddo, M. L. Piana, M. Morlot and P. Martin. 2004. Harmonized methods of melissopalynology. Apidologie 35: 18-25.
[https://doi.org/10.1051/apido:2004050]