
아까시꿀의 원산지 판별을 위한 벌꿀 내 단백질의 탄소 안정동위원소 비 활용 연구
Abstract
The geographic origin and authenticity of honey are critical for consumer trust and product value. Traditional stable carbon isotope ratio (δ13C) analysis of whole honey has limitations in distinguishing between honeys from different countries, especially when the primary sugar source derives from C3 plants. In this study, we explored a novel approach by analyzing the δ13C values of proteins isolated from Robinia honey, hypothesizing that protein fractions better reflect both bee metabolism and the regional ecological characteristics. Although δ13C values of whole honey and protein fractions alone did not show statistically significant differences between Korean, Chinese, and European samples, multivariate statistical analysis using PLS-DA revealed meaningful separation among these groups. Notably, Component 1 explained 74.2% of the total variance, while Component 2 accounted for 25.8%, allowing clear differentiation between domestic and imported honey samples. These findings suggest that δ13C values in honey proteins may serve as a more precise and biologically meaningful marker for identifying the origin of honey. This dataset serves as a preliminary baseline for origin discrimination, and future studies should aim to expand the number and diversity of samples to develop a more robust and reliable authentication technique.
Keywords:
Stable isotope ratios, Geographic origin discrimination, Robinia honey서 론
벌꿀 (honey)은 전통적으로 식품 및 약용 자원으로 활용되어 온 천연물로, 그 품질과 진위 여부에 대한 소비자의 신뢰는 제품의 부가가치를 결정짓는 핵심 요소 중 하나이다 (Bogdanov et al., 2008). 최근 국제 교역량이 급증함에 따라 다양한 국가에서 생산된 벌꿀이 국내로 수입되고 있으며, 이에 따른 원산지 오표기 및 사양벌꿀 (설탕급이벌꿀) 문제가 심화되고 있다 (Dong et al., 2020). 특히, 수입산 벌꿀을 국내산으로 둔갑시켜 판매하거나, 값싼 전분 시럽이나 설탕을 혼합한 꿀을 자연산 벌꿀로 유통하는 사례는 식품 안전성과 소비자 신뢰를 동시에 위협하고 있다 (Anklam, 1998). 이러한 상황에서 벌꿀의 진위를 과학적으로 판별하고, 원산지를 명확히 식별할 수 있는 정량적 분석 기술의 개발은 매우 시급하다.
현재까지 벌꿀 진위 판별을 위한 주요 분석법 중 하나는 탄소 안정동위원소 (δ13C, delta carbon-13) 분석이다. 이 기법은 벌꿀의 유기 성분에 존재하는 탄소 안정동위원소의 비율을 측정하여, 벌이 섭취한 식물의 광합성 경로 (C3 또는 C4 식물군) 차이를 반영함으로써 꿀의 조성 및 원산지를 추적하는 데 활용된다 (Padovan et al., 2003). 특히, C4 식물 (예: 옥수수, 사탕수수 등)을 원료로 한 당류 혼합물은 상대적으로 δ13C 값이 높은 경향이 있어, 이를 통해 인위적 혼합 여부를 감별할 수 있다. 그러나 이러한 기존의 접근은 주로 벌꿀 내 당 성분 또는 전체 성분에 대한 분석에 국한되어 있어, C3 식물인 사탕무가 혼입될 경우 δ13C 값이 평균화되거나 희석되어 진위 판별에 한계가 존재한다 (Jamali et al., 2024). 또한, 당 성분은 꿀벌 외부 환경이나 사양 방식에 따라 쉽게 변화되며, 지역적 특성이나 생태적 신호를 충분히 반영하지 못하는 한계가 있다.
이에 반해, 벌꿀 내 존재하는 단백질은 꿀벌의 대사 과정에서 유래된 내생성 효소 (invertase, glucose oxidase 등)와 꿀벌이 방문한 밀원식물에서 채집된 화분 (pollen)에 포함된 외생성 단백질로 구성된다 (Lewkowski et al., 2019; Stanković et al., 2020). 일반적인 당류보다는 벌의 생리적 특성뿐 아니라 지역 생태계의 식물 다양성까지 통합적으로 반영하기 때문에, 원산지 판별에 있어 훨씬 더 정밀하고 생물학적으로 의미 있는 마커가 될 수 있다. 특히, 단백질은 위·변조에 영향을 덜 받으며, 꿀벌의 대사와 주변 식생의 복합적인 신호를 보존하므로, 그 안에 함유된 탄소 안정동위원소 비는 지역적 특성과 생태적 이력을 반영하는 강력한 추적 지표로 기능할 수 있다 (Cotte et al., 2007). 본 연구는 이러한 단백질의 특성에 주목하여, 벌꿀 시료로부터 단백질을 응집·침전시켜 분리한 뒤 해당 단백질의 δ13C 값을 분석함으로써 국가별 원산지 간의 차이를 비교하고자 하였다.
재료 및 방법
1. 실험재료
본 실험에 사용된 아까시꿀은 2024년 전국 각지에서 생산된 아까시꿀 농가를 직접 방문하여 거름망을 통한 1차 필터만을 마친 시료를 사용하였으며, 권역별로 5개의 지역 전남 화순 (HS), 경기 화성 (HSG), 경북 안동 (AD), 강원 철원 (CW), 경남 함안 (HA)에서 생산된 아까시꿀과 국산 아까시꿀의 대표성을 위해 농협 (NH)에서 생산된 꿀을 포함하여 6개의 시료를 분석시료로 사용하였다. 외국산 아까시꿀의 경우, 유럽산 아까시꿀은 이탈리아 현지에서 직접 구매한 시료 5개를 사용하였으며, 중국산 아까시꿀은 한국양봉농협으로부터 제공받은 중국산 아까시꿀 5개를 사용하여 분석하였다.
2. 아까시꿀 내 단백질 응집
아까시꿀 안에 존재하는 단백질을 응집시키기 위해 꿀 10 g에 증류수 4 mL를 넣어 꿀이 충분히 녹도록 잘 혼합한 후 10% NaWO4와 0.355 M H2SO4를 혼합한 용액 4 mL를 첨가하여 80℃에서 2시간 동안 반응시켰다. 단백질의 응집이 육안으로 확인되면 원심분리기 (Hnail Science, Gimpo, Korea)를 이용하여 15,000 rpm에서 5분간 원심분리 후 상층액을 제거하고 침전된 펠렛만을 회수하였다. 증류수 4 mL를 첨가하여 잘 섞은 후 동일한 조건에서 원심분리 후 상등액을 제거하는 과정을 5회 반복하여 펠렛에 남아 있는 산을 제거하였다. 산이 충분히 제거된 단백질을 모아 75℃의 드라이 오븐 (JSR, Gongju, Korea)에서 1시간 건조하였으며, 45℃ 감압 오븐 (SH scientific, Sejong, Korea)에서 2시간 이상 건조하여 남은 수분을 완전히 제거하였다.
3. 탄소 안정동위원소 비 분석
탄소 안정동위원소 분석은 원소분석기 (EA, vario Pyro Cube, Elementar, Germany)와 연결된 안정동위원소 질량분석기 (Isotope ratio mass spectrometer, IRMS, visION, Elementar, UK)를 이용하였다. 100∼200 μg의 꿀과 꿀의 단백질 시료의 무게를 측정하여 주석용기 (tin capsule, 3.5 mm×1.5 mm, Elemental Microanalysis, UK)에 쌓아서 준비하였다. 준비된 시료는 원소 분석기의 오토샘플러 (autosampler)에 로딩하였다. 시료는 1,150℃로 유지되는 산화관 (combustion tube)에 주입되어 60초간 주입된 산소가스와 함께 산화된 후 환원관 (reduction tube, 850℃)에서 여분의 산소가 제거되었다. 생성된 CO2 가스는 흡착컬럼 (adsorption tube)에서 분리되어 안정동위원소 질량분석기로 도입된 후 탄소 동위원소 비가 측정되었다. 탄소 동위원소 값 보정을 위해 IAEA-CH-6 (sucrose, IAEA, Austria, δ13C=-10.449‰), IAEA-600 (caffeine, IAEA, Austria, δ13C=-27.771‰), urea working standard (urea, Elemental Microanalysis, UK, δ13C=-36.54‰)를 사용하였다.
4. 다변량 통계 분석을 통한 상관성 분석
아까시꿀의 전체 탄소 안정동위원소 비 (δ13Choney)와 아까시꿀 내 단백질의 탄소 안정동위원소 비 (δ13Cprotein) 간의 상관성을 시각적으로 평가하기 위해 MetaboAnalyst 6.0 (https://www.metaboanalyst.ca)을 활용하여 PLS-DA 분석을 수행하였다. 측정된 동위원소 비의 데이터는 샘플별로 그룹화하여 CSV 형식으로 정리하여 분석하였으며, 추출된 두 개의 주요 성분 (Component 1, Component 2)을 기반으로 그룹 간 분포를 시각화한 Scores plot을 그려 변수 간 상관 구조를 직관적으로 분석하였다.
결과 및 고찰
1. 아까시꿀 내 탄소 안정동위원소 비 분석
일반적으로 탄소 안정동위원소 비 분석은 벌꿀의 진위 여부 및 원산지 판별을 위한 대표적인 과학적 기법으로 활용되고 있다. 설탕을 먹인 사양벌꿀의 가짜꿀 진위 여부에서 주로 사용되었으며, 특히 IRMS를 이용한 동위원소비 질량분석법은 C3 식물 기반의 천연꿀과 C4 식물에서 유래되는 시럽, 설탕 등의 혼입 여부를 효과적으로 구분하는 데 사용되었다 (Lao et al., 2021). 양봉에서 사양벌꿀의 진위 판별 외에도 육류, 생선, 올리브유, 와인, 유제품 등 최근 다양한 식품에서 탄소 안정동위원소 분석법을 활용하여 국가별, 지역별, 생산방식별 원산지 판별을 시도하였다 (Kim et al., 2013; Carrera and Gallardo, 2017; Gumus et al., 2017; Bostic et al., 2018). 본 연구에서도 수입산 아까시꿀의 원산지 판별을 위해 국내에서 생산되는 아까시꿀, 외국산 (중국산, 유럽산) 아까시꿀에 대한 탄소 안정동위원소 비 분석을 수행하였다.
농협을 비롯한 권역별로 5개 지역 (전남 화순, 경기 화성, 경북 안동, 강원 철원, 경남 함안)에서 생산된 국산 아까시꿀의 탄소 안정동위원소 비는 전체적으로 -22.5‰ 이하로 벌꿀 규격 관리 기준에는 모두 적합하였으며, 평균적으로 -25.2‰로 지역별로 생산된 꿀 간에도 큰 차이를 나타내지는 않았다 (Table 1). 최근 베트남과의 관세 철폐로 인해 베트남산으로 둔갑한 중국산 꿀의 유입이 문제가 되고 있다. 이에 중국산 아까시꿀의 원산지 판별을 위해 탄소 안정동위원소 비를 분석한 결과, 평균적으로 -25.6‰로 국산 아까시꿀과 유의적인 차이를 보이지는 않았다. 마찬가지로 유럽산 아까시꿀 또한 -24.7‰의 평균값을 나타냈으며, 국산 아까시꿀과는 유의적인 차이를 나타내지는 않았다 (Table 1).
2. 단백질 내 탄소 안정동위원소 비 분석
기존의 아까시꿀 내 전체 탄소 안정동위원소 비를 이용한 방법에서는 원산지 판별이 제대로 이루어지지 않았으며, 국산 아까시꿀과 외국산 아까시꿀의 탄소 안정동위원소 비는 비슷하게 나타났다. 실제 꿀의 주성분인 당 성분은 꿀벌 외부 환경이나 사양 방식에 따라 쉽게 변화되며, 지역적 특성이나 생태적 신호를 충분히 반영하지 못하는 한계가 있기 때문에 새로운 방법에 대한 접근이 필요하다 (Siddiqui et al., 2017; Panasyuk et al., 2023). 꿀에 존재하는 탄소원으로는 크게 당을 구성하고 있는 탄소, 화분에서 유래되는 단백질, 꿀벌이 내뱉는 효소 등으로 구분할 수 있다. 그래서 본 연구에서는 당을 구성하는 탄소 외에 나머지 단백질에서 유래되는 탄소에 집중하여 안정동위원소 비 분석을 수행하였다.
그 결과, 국산 아까시꿀은 지역별로 일부 그룹 간의 차이를 나타내는 듯 보였지만 유의적인 차이를 나타내지 는 않았으며, 평균적으로 -24.9‰의 값을 나타내었다 (Table 2). 마찬가지로 중국산 아까시꿀과 유럽산 아까시꿀을 분석한 결과, 시료 간에 큰 차이를 보이지 않았으며, 평균적으로 각각 -24.6‰와 -25.3‰의 값을 나타내었다 (Table 2).

Comparative analysis of stable carbon isotope ratio in protein fractions of robinia honey (δ13Cprotein) from Korea
아까시꿀 내 단백질의 탄소 안정동위원소 비 또한 그룹 간에 유의적인 차이를 보이지는 않았으며, 국가별 아까시꿀의 그룹 간 차별성을 확인하기 위한 새로운 접근이 필요하였다. Lewkowski et al. (2019)의 문헌에서는 꿀 속 단백질 대부분은 꿀벌의 분비샘에서 유래된 효소나 펩타이드이며, 이는 벌이 수집한 당원 (fructose, glucose 등)과 외부 요인인 화분 등에 따라 일부 조절된다고 알려져 있다. 그래서 본 연구에서는 아까시꿀 전체의 탄소 안정동위원소 비와 아까시꿀 내 단백질 간의 상관성을 분석해 보고자 하였다.
3. 아까시꿀과 단백질 간의 상관성 분석
우선 아까시꿀 전체의 탄소 안정동위원소 비를 X축으로 하고 아까시꿀 내 단백질의 탄소 안정동위원소 비를 Y축으로 설정하여 그룹 간에 산포도를 비교하여 어떤 연관성이 있는지를 확인해 보았다. 그 결과 Fig. 1A에서 보시는 바와 같이 국가별 그룹 간에 차이를 나타내었다. 국산 아까시꿀의 경우에는 X축과 Y축을 기준으로 주로 대각선에 분포하여 집단을 형성하는 것을 확인하였으며, 국산 아까시꿀을 기준으로 중국산 아까시꿀은 대부분 위쪽에 집단을 형성하며 분포하였고, 유럽산 아까시꿀은 아래쪽에 집단을 형성하며 분포하는 것을 확인할 수 있었다 (Fig. 1A). 보다 신뢰성 있는 상관관계 분석을 위해 PLS-DA 분석을 통해 다변량 통계 분석을 진행하였다. PLS-DA 분석을 통해 세 그룹 (Korea, China, Europe) 간의 분포를 시각적으로 평가하였다. Component 1은 전체 분산의 74.2%를 설명하였으며, Component 2는 25.8%를 설명하였다. 특히 Component 1 축에서 국산 아까시꿀 그룹과 두 그룹 (중국, 유럽) 간의 뚜렷한 분리가 관찰되었으며, 이는 각 그룹 간에 유의한 차이가 있음을 의미한다 (Fig. 1B).
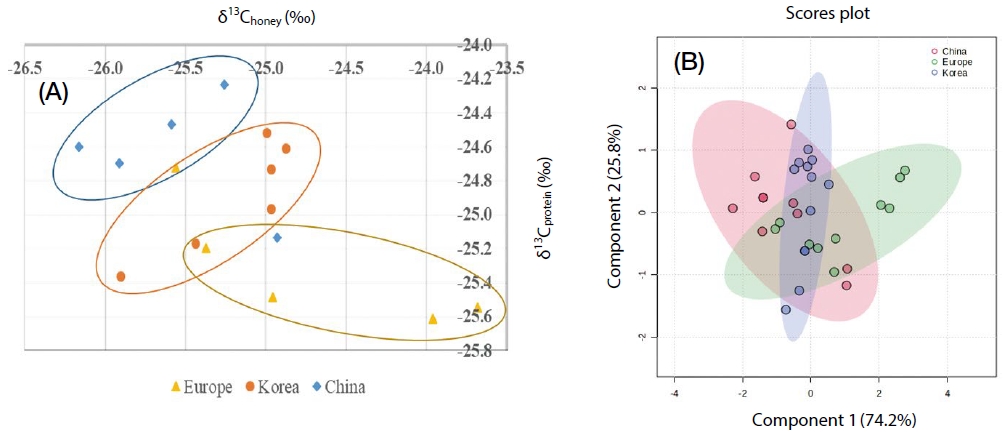
Correlation analysis between δ13C values of robinia honey and its protein fractions. The correlation was initially examined using a scatter plot (A) and futher validated through PLS-DA analysis (B).
여러 가지 안정동위원소 비를 이용한 원산지 판별은 다양한 식품군에서 이용되어 왔으며, 본 연구에서는 국내 및 외국에서 생산되는 아까시꿀 내에서 꿀 자체와 꿀에 존재하는 단백질 응집에 따른 단백질의 탄소 안정동위원소 비를 비교 분석하여 그룹 간의 차이를 통해 국가별 원산지 판별의 기초 데이터로 활용 가능할 것으로 생각되며, 정확한 결과 도출을 통해 시료의 개수를 늘려 경향치를 확인할 필요가 있을것으로 사료된다.
적 요
기존의 탄소 안정동위원소 비 (δ13Choney) 분석은 벌꿀 전체에 존재하는 탄소에 대한 분석으로 대부분 탄수화물 (당) 유래 탄소원에 해당되었으며, 이러한 분석만으로는 국산과 수입산 아까시꿀을 명확히 구분하기 어려웠다. 이에 따라 벌꿀 내에 존재하는 단백질 분획에서의 δ13C 값 (δ13Cprotein)을 추가로 분석한 결과, 개별 δ13C 값에서는 국가 간 유의미한 차이가 나타나지 않았으나, 전체 벌꿀과 단백질 간 δ13C 상관성을 이용한 다변량 통계 분석 (PLS-DA)에서는 의미 있는 구분이 가능하였다. 특히 Component 1이 전체 분산의 74.2%, Component 2가 25.8%를 설명하였으며, 국산 아까시꿀과 수입산 (중국, 유럽) 꿀 간에 뚜렷한 그룹 분리가 관찰되었다. 이러한 결과는 꿀의 단백질에 포함된 탄소 동위원소 정보가 꿀벌의 생리적 대사와 지역 생태계를 반영하므로, 벌꿀의 원산지 판별에 있어 더 정밀하고 신뢰도 높은 지표로 활용될 수 있음을 시사한다. 본 연구에서의 데이터값은 기초 연구 수준의 경향성을 제시하는 결과로 해석되어지며, 보다 정밀하고 재현성 있는 원산지 판별 기술을 개발하기 위해서는 다양한 지역과 국가의 꿀을 포함한 충분한 시료 수의 확보와 추가 연구가 필수적이다.
Acknowledgments
본 연구는 농촌진흥청 농업과학기반기술연구 (과제번호: PJ01745704)에 의하여 수행되었습니다.
References
-
Anklam, E. 1998. A review of the analytical methods to determine the geographical and botanical origin of honey. Food Chem. 63(4): 549-562.
[https://doi.org/10.1016/S0308-8146(98)00057-0]

-
Bogdanov, S., T. Jurendic, R. Sieber and P. Gallmann. 2008. Honey for Nutrition and Health: A Review. J. Am. Coll. Nutr. 27(6): 677-689.
[https://doi.org/10.1080/07315724.2008.10719745]

-
Bostic, J. N., W. M. Hagopian and A. Jahren. 2018. Carbon and nitrogen stable isotopes in U.S. milk: Insight into production process. Rapid Commun. Mass Spectrom. 32(7): 561-566.
[https://doi.org/10.1002/rcm.8069]

-
Carrera, M. and J. M. Gallardo. 2017. Determination of the Geographical Origin of All Commercial Hake Species by Stable Isotope Ratio (SIR) Analysis. J. Agric. Food Chem. 65(5): 1070-1077.
[https://doi.org/10.1021/acs.jafc.6b04972]

-
Cotte, J., H. Casabianca, J. Lhéritier, C. Perrucchietti, C. Sanglar, H. Waton and M. Grenier-Loustalot. 2007. Study and Validity of 13C Stable Carbon Isotopic Ratio Analysis by Mass Spectrometry and 2H Site-Specific Natural Isotopic Fractionation by Nuclear Magnetic Resonance Isotopic Measurements to Characterize and Control the Authenticity of Honey. Anal. Chim. Acta. 582(1): 125-136.
[https://doi.org/10.1016/j.aca.2006.08.039]

- Dong, H., W. Luo, X. Zhang and L. Wang. 2020. Detection of honey adulteration using stable isotope ratio and trace elements. Food Chem. 340: 127933.
-
Gumus, Z. P., V. U. Celenk, S. Tekin, O. Yurdakul and H. Ertaş. 2017. Determination of trace elements and stable carbon isotope ratios in virgin olive oils from Western Turkey to authenticate geographical origin with a chemometric approach. Eur. Food Res. Technol. 243: 1719-1727.
[https://doi.org/10.1007/s00217-017-2876-4]

-
Jamali, V., A. Emamifar, H. Beiginejad, M. Moradi and M. Rasouli. 2024. Detection of adulteration in Iranian grape molasses added glucose/fructose/sugar beet syrups with 13C/12C isotope ratio analysis method. Food Sci. Nutr. 12(10): 8432-8440.
[https://doi.org/10.1002/fsn3.4259]

-
Kim, K., J. S. Kim, I. Hwang, I. Jeong, N. Khan, S. I. Lee, D. Jeon, Y. Song and K. S. Kim. 2013. Application of Stable Isotope Ratio Analysis for Origin Authentication of Pork. Korean J. Food Sci. Anim. Resour. 33(1): 39-44.
[https://doi.org/10.5851/kosfa.2013.33.1.39]

-
Lao, M., A. T. Bautista VII, N. Mendoza and C. Cervancia. 2021. Stable carbon isotope ratio analysis of Philippine honeys for the determination of adulteration with C4 sugars. Food Anal. Methods 14(6): 1443-1455.
[https://doi.org/10.1007/s12161-021-01968-8]

-
Lewkowski, O., C. Mureşan, D. Dobritzsch, M. Fuszard and S. Erler. 2019. The Effect of Diet on the Composition and Stability of Proteins Secreted by Honey Bees in Honey. Insects 10(9): 282.
[https://doi.org/10.3390/insects10090282]

-
Oganesyants, L., A. Panasyuk, D. Sviridov, M. Ganin, A. Schilkin and O. Serebryakova. 2024. Light Stable Isotopes and Their Ratios in Honey Components. Food Process.: Tech. Technol. 54(3): 522-531.
[https://doi.org/10.21603/2074-9414-2024-3-2523]

-
Padovan, G. J., D. de Jong, L. P. Rodrigues and J. S. Marchini. 2003. Detection of adulteration of commercial honey samples by the 13C/12C isotope ratio. Food Chem. 82(4): 633-636.
[https://doi.org/10.1016/S0308-8146(02)00504-6]

-
Panasyuk, A., E. Kuzmina, D. Sviridov and M. Ganin. 2023. Individual integrated approach to honey identification using instrumental methods of analysis and statistical processing of results. Food Systems 6(2): 211-223.
[https://doi.org/10.21323/2618-9771-2023-6-2-211-223]

-
Siddiqui, A., S. Musharraf, M. Choudhary and A. U. Rahman. 2017. Application of analytical methods in authentication and adulteration of honey. Food Chem. 217: 687-698.
[https://doi.org/10.1016/j.foodchem.2016.09.001]

-
Stanković, M., M. Nikčević and K. Radotić. 2020. Annual Variation of Proteins and Phenols in Honey of a Bee Society Using Fluorescence Spectroscopy. Eur. Food Res. Technol. 246: 1515-1518.
[https://doi.org/10.1007/s00217-020-03507-x]
